Дыхание природы: как возник галитоз
26 января 2018
Дыхание природы: как возник галитоз
- 10031
- 1
- 9
Бактерии, живущие во рту, выделяют множество пахучих веществ.
сайт wikimedia.org, рисунок адаптирован
-
Автор
-
Редакторы
Темы
Галитоз — медицинский термин, обозначающий дурной запах изо рта. Хотя сам термин вошел в обиход лишь в ХХ веке вместе с увеличением продаж товаров по уходу за полостью рта, проблема несвежего дыхания стара как мир. Этот обзор расскажет, как ее решали древние римляне, какой процент людей не догадывается о несвежести своего дыхания и как надо питаться и ухаживать за ротовой полостью, чтобы избавиться от галитоза.
Биология, медицина и косметология ротовой полости

Партнер цикла — компания SPLAT: ведущий разработчик и производитель профессиональных средств ухода за полостью рта.
О необходимости ухода за ротовой полостью знает каждый с детства, и, казалось бы, это не та область науки, где читатель ждет захватывающих новостей. Однако ошибочно думать, что исследования по здоровью зубов и десен не ведутся. Как выяснила «Биомолекула», дела обстоят совсем по-другому. Ведется переклассификация некоторых заболеваний. Болезни ротовой полости оказываются связаны с такими «раскрученными» темами как диабет, сердечно-сосудистые заболевания и даже рак. Ведутся споры о том, какие компоненты должны входить в состав зубных паст. Разрабатываются пре- и пробиотики для нормализации состава микробиоты ротовой полости. Наконец, даже в обычной жизни пользователь сталкивается с огромным арсеналом средств по уходу за ротовой полостью: это специализированные ополаскиватели, пенки, ершики, нити и огромное разнообразие зубных щеток и паст.
Для того чтобы разобраться, какие темы касательно здоровья и косметологии зубов и десен сейчас наиболее активно изучаются, что изменилось с исторической точки зрения в гигиене ротовой полости и на что в средствах ухода стоит обращать внимание, «Биомолекула» объединила усилия с одним из ведущих производителей и разработчиков в этой области — компанией SPLAT. Результатом сотрудничества стали четыре статьи, которые и представлены в этом спецпроекте.
Вы не против, если я отодвинусь? Просто у вас изо рта гадко пахнет. Правда.
Дональд Трамп в интервью с Ларри Кингом, 1987 г.
Новое название старой болезни
Неприятный запах изо рта зачастую незаметно портит жизнь, особенно при общении. Люди издавна очень серьезно относились к этой проблеме и изобрели множество способов освежить дыхание. Еще в Вавилоне (2500–1800 годы до н.э.) население использовало хворостинки (рис. 1) для чистки зубов, со временем превратившиеся в зубные щетки. Тем не менее хворостинки всё еще популярны в Индии и Западной Африке — их делают из деревьев, сок которых обладает антисептическими свойствами [1].

Рисунок 1. Мисвак — хворостинка для чистки зубов, распространенная в исламских культурах. Мисвак получают из ветвей сальвадоры персидской, чей сок токсичен для бактерий полости рта, ответственных за появление запаха.
сайт dudeiwantthat.com
Во времена Древнего Рима Овидий (43 год до н.э. — 18 год н.э.) в «Науке любви» рекомендовал дамам: «Не говори натощак, если дух изо рта нехороший», указывая на голодание как на основную причину плохого запаха. Хотя еще Гиппократ (IV век до н.э) давал более практичный совет — ополаскивать рот вином, настоями семян укропа и аниса. Однако ни сам Гиппократ, ни многие поколения врачей после него не могли найти и устранить причину запаха изо рта [2].
Жевательная резинка, ставшая популярной в конце XIX века, тоже гораздо древнее, чем кажется. Так, римский врач Гален еще во II веке описал «иерусалимский бальзам» — смолу мастиковой фисташки, основной компонент первых жвачек. Средиземноморские народы использовали его после еды для ухода за зубами. Мастика за счет своих противовоспалительных свойств и приятного вкуса мгновенно стала продуктом массового потребления в Америке, но позже, в XIX веке, желая поспеть за растущим спросом, производители жевательной резинки заменили мастику на латекс, а затем на парафин, и начали добавлять в продукт ароматизаторы [3].
В Средние века по-прежнему использовали «народные рецепты» для борьбы с несвежим дыханием. Например, в «Рассказе мельника» Джеффри Чосера (1343–1400) псаломщик Абсалон жует лакричный корень и кардамон для услащения дыхания перед свиданием.
В XIX веке, во времена расцвета микробиологической науки, была обнаружена причина запаха изо рта — продукты жизнедеятельности бактерий, а само несвежее дыхание получило научное название — галитоз (лат. halitus — дыхание). Сегодня это очевидно, но полтора века назад про необходимость уничтожения болезнетворных бактерий знали единицы. Выдающийся британский хирург Джозеф Листер всю жизнь вел борьбу с предрассудками и патогенами, призывая коллег мыть руки и стерилизовать оборудование. В его честь американский предприниматель Джозеф Лоренс назвал многофункциональный антисептический раствор, в состав которого входили спирт и экстракты мяты, тмина, эвкалипта и гаультерии.
Вплоть до 1920-х средство не пользовалось особой популярностью, но это изменила одна из самых успешных маркетинговых кампаний в истории человечества (рис. 2). Производитель сделал ставку на одно из множества показаний к применению раствора — на борьбу с неприятным запахом изо рта — и не прогадал. Если до попадания на рекламные плакаты термин «галитоз» почти не встречался в медицинских статьях, то после его знал уже каждый американец. В рекламной продукции подробно описывалось, как легко «волшебный раствор» справится с микробами, которые стоят на пути новых знакомств, семейного счастья и успешной карьеры.
Реклама раствора оказалась настолько успешной, что борьба с галитозом стала общественной манией и распространилась на весь цивилизованный мир. Сегодня свежее дыхание всё так же востребовано, но уже без фанатизма первой трети XX века. Более того, сейчас уже ясно, что временно замаскировать неприятный запах или уничтожить все бактерии, обитающие во рту, — не лучшие решения.
Распространенность галитоза
Описано несколько типов галитоза. Чаще всего неприятное для окружающих дыхание появляется после употребления определенных пищевых продуктов — например, чеснока или алкогольных напитков. Такой галитоз — временное явление, проходящее в течение суток: за это время из организма выводятся пахучие соединения.
Но есть и стойкая, хроническая форма галитоза. Ее распространенность значительно варьирует между разными странами и возрастными группами: например, галитоз значительно чаще встречается у пожилых людей; в Швеции его отмечают только у 2% населения, в Китае — у 28% [5], а в Германии и Франции — примерно у 80% взрослых. Однако попытки объединить все разрозненные статистические данные и определить, сколько же на Земле страдающих от галитоза людей, выдают малоинформативный интервал в 2–87% [6].
Одна из главных проблем эпидемиологии галитоза — способ его диагностики. В одних исследованиях испытуемые сами о нём сообщают, в других диагноз ставят врачи, а в третьих галитоз оценивают количественно с помощью газоанализаторов, измеряющих содержание пахучих веществ в выдохе. Такие приборы сложны, доступны не всем клиникам и не регистрируют весь спектр соединений, способных вызывать запах, воспринимаемый человеком как неприятный. Поэтому общая проблема подобных исследований — субъективность их результатов [7], [8].
Сравнение результатов клинического обследования с мнением самих испытуемых показывает, что рекламщики из 1920-х не лгали: только 47% «жертв» галитоза знают о своем состоянии. Еще интереснее то, что более 40% людей со свежим дыханием уверены, что у них пахнет изо рта: галитофобия стала неотъемлемой частью современного общества.
Причины галитоза
Несмотря на то, что галитоз удостоен собственного медицинского термина, это не самостоятельное заболевание с однозначной этиологией, а лишь симптом с разными причинами возникновения: в 90% случаев галитоз вызван продуктами жизнедеятельности микрофлоры полости рта, в 9% причина кроется в дыхательной, пищеварительной и мочевыделительной системах [5], [8], [9], и, наконец, оставшийся 1% приходится на серьезные нарушения метаболизма вследствие болезни или приема лекарств. К редким случаям галитоза относятся «ацетоновое дыхание» при кетоацидозе у диабетиков и «фруктовое дыхание» при диабете II типа. Соответственно, если у человека стойкий галитоз, от которого ничего не помогает избавиться, то необходимо обратиться к врачу за консультацией.
Но все же в подавляющем большинстве случаев несвежее дыхание — проблема диеты и гигиены рта. Нормальная микрофлора рта включает как аэробные, так и анаэробные виды бактерий, находящиеся в устойчивом равновесии между собой. Когда это равновесие нарушается, в сообществе начинают доминировать анаэробы — и возникает галитоз. Анаэробы выделяют множество пахучих веществ, которые и дают гнилостный запах: метантиол (запах гнилой капусты), сульфид (тухлых яиц), кадаверин (трупного гниения), бутират (прогорклого масла), скатол (фекалий) и прочие [10–12]. В целом же пахучие вещества анаэробов делятся на летучие серные соединения, полиамины, органические кислоты и гетероциклы. Бóльшая часть этих веществ образуется в ходе анаэробного метаболизма белковых остатков пищи во рту (рис. 3).
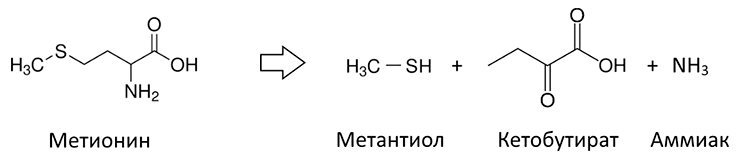
Рисунок 3. Летучие соединения серы с неприятным запахом синтезируют из серосодержащих аминокислот анаэробные бактерии. В частности, метилмеркаптан (метантиол), пахнущий гнилой капустой, получается из метионина.
Ключевой фактор, влияющий на скорость роста анаэробов во рту, — доступ кислорода. Так, утренний запах изо рта объясняется именно тем, что снижение уровня кислорода во рту спящего человека угнетает аэробов и помогает анаэробам занять их место [11].
Некоторые пищевые пристрастия также приводят к стойкому запаху изо рта. В норме растущие в слизистой ротовой полости бактерии и остатки пищи вымываются слюной. Вдобавок в слюне содержится фермент лизоцим, оказывающий бактерицидное действие на микрофлору ротовой полости [13]. Некоторые продукты же вызывают сухость во рту, и микроорганизмы успевают сформировать прочную биопленку (рис. 4), которая и становится источником галитоза.
Плотные сети, состоящие из внеклеточных белков, полисахаридов и ДНК, удерживающие бактерий на месте и защищающие их от химического воздействия.
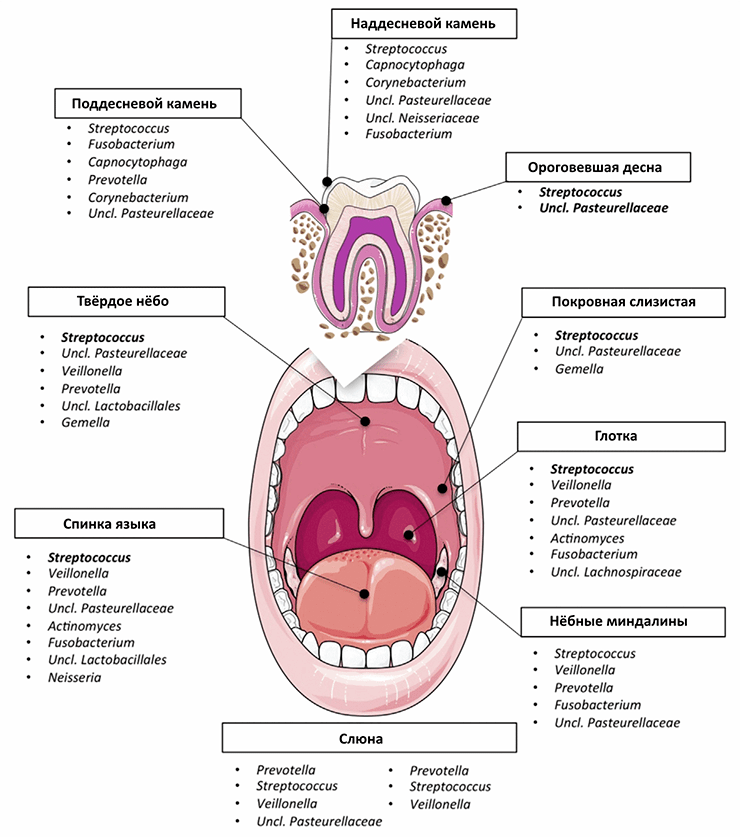
Рисунок 4. Состав ключевой микробиоты ротовой полости, установленный в рамках инициативы Human Microbiome Project, включает роды бактерий, встречающиеся у >80% людей. Жирным выделены те таксоны, которые распространены у >75% людей и составляют >10% всех бактерий сообщества.
Так, подсушивать слизистую ротовой полости могут, например, кофеин, алкоголь и табачный дым, попадающий в рот при курении. Помимо обезвоживания, алкоголь дополнительно метаболизируется в ацетон, выделяющийся через легкие. Табачный дым, в свою очередь, не только подавляет работу слюнных желез, но и содержит много пахучих веществ — производных пиридина, пиррола и пиразина, которые после оседания на слизистых долгое время источают характерный запах [14–16]. Табачный дым помимо этого вызывает хроническое воспаление десен — гингивит (о нем подробно рассказано в первой статье этого цикла: «Дареному коню в дёсны не смотрят» [17]), на фоне которого баланс микрофлоры изменяется, и начинается активное заселение бактериями, способствующими появлению неприятного запаха [18].
Но самый важный фактор, влияющий на развитие галитоза, — это гигиена, поскольку при ее отсутствии ротовая полость превращается в настоящий инкубатор для бактерий (рис. 5). Вопреки широко распространенному заблуждению, для устранения несвежего дыхания регулярной чистки зубов не всегда достаточно. Основной источник неприятного запаха — это язык [19]: в здоровой ротовой полости бóльшая часть бактерий скапливается на его задней части (рис. 4), и этот налет можно увидеть невооруженным глазом. Для безболезненного снятия налета с языка стоматологи рекомендуют пользоваться специальными щетками-скребками, однако эффективность такого способа в большинстве случаев сомнительна, как отмечается в публикациях ведущих медицинских сообществ [20–23].
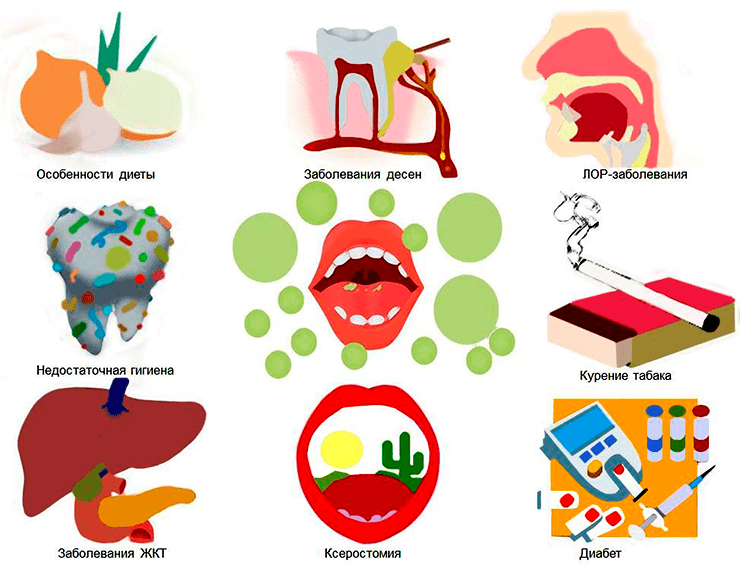
Рисунок 5. Самые распространенные (90%) причины неприятного запаха изо рта (галитоза): особенности диеты и неправильное питание, неправильный уход за полостью рта, ксеростомия — сухость во рту (в том числе из-за кофе, алкоголя или курения). В 9% случаев галитоз вызван проблемами с желудком (гастроэзофагеальный рефлюкс) или дыхательными путями (заболевания легких, синусит). И только в 1% случаев с галитозом нельзя справиться за счет корректировки диеты или гигиены рта, например при диабете.
Хотя использование ополаскивателей и пенок в целом предотвращает накопление налета, для эффективного удаления бактерий с зубной поверхности необходимо комбинировать несколько способов очищения (подробнее о различных средствах см. таблицу 1). Для разрушения биопленки можно сначала счистить верхний слой налета щеткой, а затем воспользоваться ополаскивателем: иначе биопленка защитит живущих в ее глубине бактерий, и действующие вещества ополаскивателя не смогут до них достать. Ополаскиватели также не проникают в узкие межзубные промежутки, и для вычищения зубного налета на этих участках рекомендуется использовать зубные нити и ершики. В противном случае межзубный налет может спровоцировать гингивит (воспаление десен) и сопутствующий галитоз.
| Средство по уходу | Плюсы | Минусы |
|---|---|---|
| Зубные щетки и щетки для языка | Механически устраняют бактериальный налет и остатки пищи с поверхностей. | Не действуют на состав микрофлоры рта, могут травмировать язык и десны. |
| Ополаскиватели и пенки | В состав входят растительные масла и ферменты, обладающие дезинфицирующими, увлажняющими и заживляющими эффектами. Нормализуют кислотный баланс ротовой полости. Компактны и могут применяться без доступа к воде. | Удаляют бактериальный налет менее эффективно, чем зубная щетка. Необходимо чередовать с механической очисткой. |
| Зубные нити и ершики | Проникают в труднодоступные для ополаскивателей и зубных щеток места. За счет присадок могут также уничтожать бактерии в зубных промежутках. | Точечное действие. Риск травмирования десен. Сложно пользоваться при плотном расположении зубов. |
| Жевательная резинка | Социально приемлемое средство для ухода за полостью рта в общественных местах.
Удаляет остатки пищи их межзубных щелей. За счет таких добавок, как лактат кальция, может предотвращать разрушение зубной эмали. |
Поверхностность и краткосрочность действия. |
| Пробиотики и пребиотики | Нормализуют микрофлору полости рта напрямую. Длительный эффект. Не требуют времени. | Необходим прием курсом. Находятся на стадии фундаментальных исследований. Могут неспецифично способствовать размножению патогенной флоры. |
| Фтор | Используется в виде фторидов, фторофосфатов и гексафторосиликатов. Предотвращает разрушение зубной эмали, поскольку осаждается на ней в виде фтороапатитов [26]. Фтороапатиты хуже растворяются в кислотах, выделяемых бактериями при метаболизме сахаров, и тем самым предотвращают развитие кариеса [27]. |
| Нитрат калия, аргинин | Снижают чувствительность зубов. Нитрат калия используют еще с 1980-х годов. Проникая через поры в эмали, он снижает чувствительность одонтобластов — зубных рецепторов. Эффект становится максимальным через 2–4 недели использования калийсодержащих средств [28], [29]. Аргинин вместе с карбонатом кальция минерализуется в порах эмали, предотвращая проникновение болевых стимулов к одонтобластам [30]. |
| Цитрат цинка | Ионы цинка неспецифично замедляют образование биопленок (но не разрушают уже готовые), а также способствуют реминерализации [31], [32]. |
| Папаин, актинидин, трипсин | Ферменты-протеазы, расщепляющие белки, формирующие биопленки [33]. |
| Прополис | Обладает мягким антибактериальным эффектом и не повреждает клетки десен. Также снижает чувствительность зубов по пока не выясненному механизму [34], [35]. |
| Ментол, тимол | Дают антибактериальный эффект, встраиваясь в клеточную мембрану микробов и повышая ее проницаемость. Возможно, взаимодействуют с мишенями внутри микробов [36]. |
| Коллоидное серебро | Антисептик. За счет реакции с тиоловой группой (преимущественно в цистеинах белков) увеличивает проницаемость бактериальной мембраны для K+, может проникать внутрь бактерий и связываться с фосфатными группами ДНК. Антисептическая эффективность сопоставима со спиртом [37], [38]. |
| CPC (хлорид цетилпиридина) | Антисептик. Повышает проницаемость клеточных мембран для К+ [39]. |
| Перекись карбамида | Используется в отбеливающих зубных пастах. При контакте с водой распадается на мочевину и перекись водорода, которая и отбеливает эмаль. |
Свежее дыхание навсегда
Использование современных методов ухода за полостью рта позволяет избавиться от галитоза. Но ученые все равно предпринимают попытки изобрести еще более совершенные средства для борьбы с ним.
До сих пор основными подходами к гигиене рта являются механическое и химическое очищение. Однако щетки, скребки и нити удаляют только избыток бактерий и не способны восстановить нарушенное равновесие в микробиоте полости рта. В то же время вещества, токсичные для нежелательных бактерий, также подавляют жизнедеятельность и нормальной микрофлоры. Подход будущего подразумевает создание устойчивой бактериальной экосистемы во рту человека, где баланс микробиоты будет оптимальным.
Больше всего пахучих веществ выделяют грамотрицательные бактерии родов Campylobacter, Fusobacterium, Prevotella, Porphyromonas и грамположительные родов Actinomyces, Eubacterium, Peptostreptococcus [44]. Некоторые из них встречаются только у людей, страдающих хроническим галитозом. Микробиота нормальной и галитозной ротовой полости различаются не только по видовому составу, но и по функциональному: в частности, микробное сообщество у человека с галитозом содержит больше генов, способствующих переводу цистеина в сульфид, обладающий неприятным запахом (рис. 6) [45].
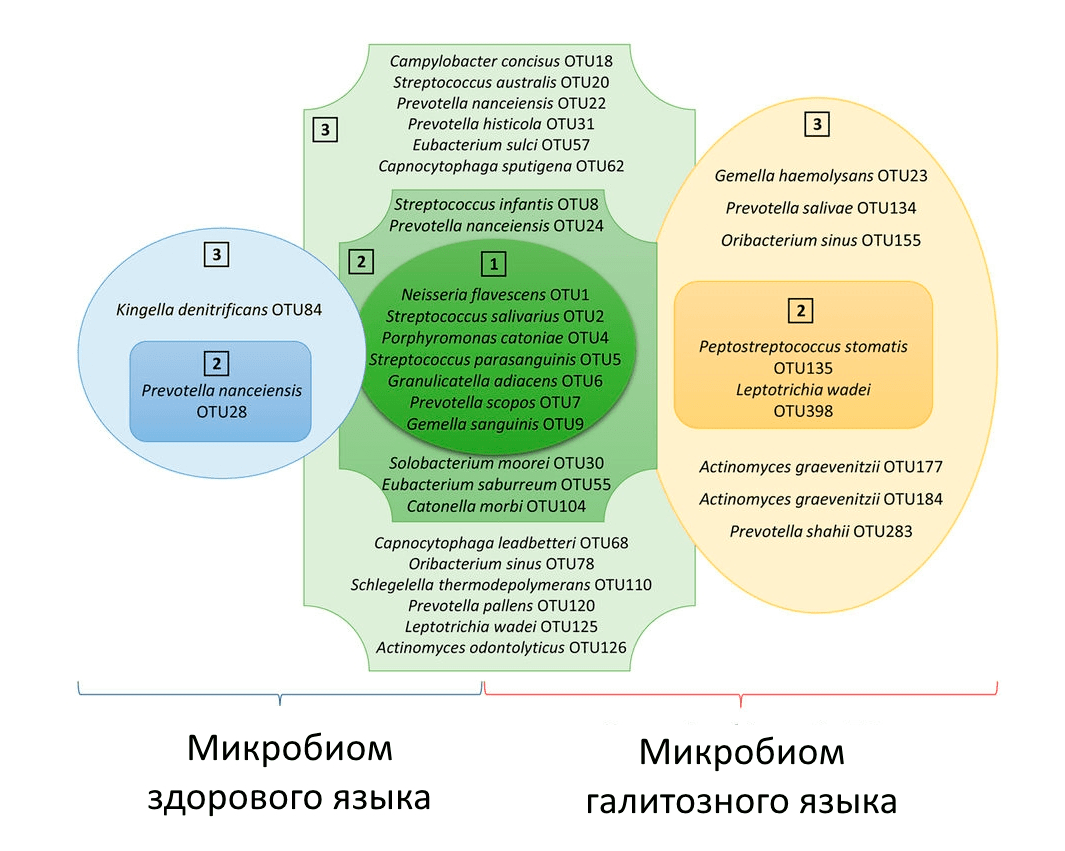
Рисунок 6. Микробиота биопленки языка при галитозе и в норме значительно различаются. Пробиотический подход к уходу за полостью рта подразумевает «подселение» в больной рот микроорганизмов из состава здоровой микрофлоры рта. Зона «1» включает бактерии, встречающиеся в биопленках всех испытуемых и занимающие >1% в сообществе. Зона «2» включает бактерии, встречающиеся у всех испытуемых из указанных групп и занимающие <1% в сообществе. Зона «3» — бактерии, встречающиеся у 75–99% испытуемых указанной группы и занимающие <1% в сообществе.
Один из предлагаемых способов повлиять на состав микрофлоры рта — это использование пробиотиков, живых культур полезных бактерий. Теоретически, пробиотики за счет искусственно созданного численного преимущества должны вытеснять другие виды, способствующие развитию заболеваний. Однако в реальности все оказывается сложнее: микробы, вызывающие галитоз, образуют взаимовыгодные метаболические связи, помогающие им выжить в ротовой полости. Подобные симбиозы могут формировать и полезные бактерии в пробиотиках.
Но, к сожалению, не все виды полезных бактерий можно культивировать и тем более превратить в лекарство, и поэтому ученым приходится выбирать пусть и менее эффективные, но более простые в производстве составы пробиотиков. Тем не менее пероральные пробиотики, содержащие всего один вид бактерий, тоже могут снижать скорость роста налета и интенсивность воспаления [46]. Механизм работы подобных пробиотиков все еще не раскрыт, но есть предположения, что бактерии из монопробиотиков эффективней потребляют лимитирующие ресурсы (например, витамины), выделяют антибиотики или же выигрывают за счет «диалога» «микроб—хозяин». Так, вредоносные бактерии, говоря метафорами, предпочитают существовать в оппозиции с организмом хозяина, тогда как полезные бактерии выбирают путь мирного сосуществования. Бактерии из пробиотиков имеют ряд приспособлений для успешного симбиоза: они хуже связываются с антителами и могут выделять вещества, снижающие интенсивность воспаления. Все это приводит к тому, что иммунитет человека относится к микробам из пробиотиков «дружелюбней», чем к остальным [47].
Иной подход к нормализации микробиоты полости рта — поддержание с помощью пребиотиков тех микроорганизмов, которые уже живут в ротовой полости, но находятся в угнетенном состоянии. Пребиотики содержат питательные и сигнальные вещества, способствующие росту отдельных групп микроорганизмов, и с их помощью можно увеличить численность бактерий в сообществе, не привнося их извне. Но составление пребиотика — процесс не менее трудоемкий (и порой интуитивный), чем составление пробиотика, поскольку необходимо знать, как работает метаболизм всех бактерий, входящих в микробные сообщества полости рта, чтобы найти вещества, которые бы способствовали оптимальному соотношению микроорганизмов.
Пока известно крайне мало об особенностях метаболизма микробиоты полости рта, и это затрудняет создание пребиотиков. C помощью компьютерного моделирования можно определить набор веществ, способствующих росту какого-либо конкретного микроорганизма. Но в то же время эффект отдельного веществ на композицию всего сообщества чаще всего не поддается анализу in silico и требует сложных и дорогостоящих клинических исследований. В результате науке известно множество соединений, которые в теории должны поспособствовать развитию представителей нормальной микрофлоры человека, но их суммарное действие на всю экосистему ротовой полости по-прежнему требует опытной проверки. Например, некоторые полагают, что пребиотики должны поддерживать часто встречаемые в здоровой ротовой полости бактерии родов Lactobacillus и Bifidobacterium. Однако эти же микроорганизмы ответственны за кариес, и поэтому трудно предугадать долгосрочные последствия их «подкармливания» [47], [48].
Короткий путь к получению пребиотика — использование разрушенных клеток бактерий (бактериальных лизатов). Их преимущество перед искусственными пребиотиками — многокомпонентность, за счет которой лизаты предоставляют одновременно и строительный материал для бактерий, и сигнальные молекулы, и даже естественные антибиотики.
Более того, бактериальные лизаты повышают реактивность иммунной системы и действуют как иммуномодуляторы, поскольку антигены микроорганизмов активируют одновременно системы врожденного и приобретенного иммунитетов. Хотя изначально бактериальные лизаты использовались в медицине для лечения и профилактики инфекций дыхательных путей, сегодня существует ряд исследований, в которых их применение улучшает состояние больных диабетом, артритом, астмой, колитом и даже пародонтитом [49], [50]. Бактерии стараются вытеснить «противников» также и выделением бактериоцинов: пероксидаз, пептидаз, хелаторов и перфораторов клеточных стенок и прочих веществ [51]. В составе механически приготовленного лизата эти вещества могут сохранять активность и использоваться для нормализации микрофлоры ротовой полости.
Некоторые компоненты бактериальных лизатов уже успешно интегрированы в пищевую промышленность [52]: например, выделяемый из Lactococcus lactis бактериоцин низин с 1960-х годов добавляют в консервы, сыры и прочие продукты для устранения образующих термоустойчивые споры бацилл и клостридий. Однако лизаты некоторых бактерий содержат антигены, вызывающие слишком интенсивный иммунный ответ, перерастающий в хроническое воспаление, и поэтому к препаратам на основе бактериальных лизатов необходимо относиться с осторожностью, как и к любым лекарствам [53].
Существует и еще один, пока исключительно гипотетический вариант борьбы с патогенами во рту, — вирусная терапия. Американское Управление по контролю качества продуктов питания и медикаментов (FDA) в 2006 году одобрило применение бактериофагов для обеззараживания мяса. Применение фагов, поражающих только бактерий, присутствие которых нежелательно, могло бы навсегда решить проблемы кариеса, галитоза, пародонтита и любых других заболеваний ротовой полости. В то же время жизнеспособность бактериофагов в медицинских препаратах еще ниже, чем бактерий, и из-за этого их эффективность на практике может оказаться значительно ниже, чем в теории, а в продуктах гигиены полости рта сохранить жизнеспособность фагов и вовсе невозможно.
Несмотря на то, что ученые придумывают все новые и новые способы поддержки здорового состояния полости рта, существующих средств гигиены уже вполне достаточно, чтобы избавиться от галитоза. А о том, как зубная паста помогает справиться не только с галитозом, но и прочими проблемами ротовой полости, читайте в следующей статье цикла — «Зубная крепость: как пасты делают наши зубы лучше?».Литература
- Mohammad Haque, Saeed Alsareii. (2015). A review of the therapeutic effects of using miswak (Salvadora Persica) on oral health. SMJ. 36, 530-543;
- Bosy A. (1997). Oral malodor: philosophical and practical aspects. J. Can. Dent. Assoc. 63, 196–201;
- Hacked G. (1978). It's flavored chewing gum: Taffy Tolu invention is remembered. Kentucky New Era;
- Waterhouse B.C. The land of enterprise: a business history of the United States. Simon & Schuster, 2017. — 288 p.;
- BahadirUgur Aylikci, Hakan Çolak. (2013). Halitosis: From diagnosis to management. J Nat Sc Biol Med. 4, 14;
- Soares L.G. and Tinoco E.M.B. (2014). Prevalence and related parameters of halitosis in general population and periodontal patients. OA Dent. 2, 4;
- Thuy A. V. Pham. (2013). Comparison between self-estimated and clinical oral malodor. Acta Odontologica Scandinavica. 71, 263-270;
- Curd ML Bollen, Thomas Beikler. (2012). Halitosis: the multidisciplinary approach. Int J Oral Sci. 4, 55-63;
- Dong-Hun Han, Sun-Mi Lee, Jung-Gyu Lee, Yun-Jin Kim, Jin-Bom Kim. (2014). Association between viral hepatitis B infection and halitosis. Acta Odontologica Scandinavica. 72, 274-282;
- S. Goldberg, A. Kozlovsky, D. Gordon, I. Gelernter, A. Sintov, M. Rosenberg. (1994). Cadaverine as a Putative Component of Oral Malodor. J Dent Res. 73, 1168-1172;
- Johannes Snel, Maurits Burgering, Bart Smit, Wouter Noordman, Albert Tangerman, et. al.. (2011). Volatile sulphur compounds in morning breath of human volunteers. Archives of Oral Biology. 56, 29-34;
- RV Subramanyam, AjayBenerji Kotti. (2015). Oral malodor: A review of etiology and pathogenesis. J NTR Univ Health Sci. 4, 1;
- Koshimune S., Awano S., Gohara K., Kurihara E., Ansai T., Takehara T. (2003). Low salivary flow and volatile sulfur compounds in mouth air. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 96, 38–41;
- Russell Bazemore, Charles Harrison, Michael Greenberg. (2006). Identification of Components Responsible for the Odor of Cigar Smoker's Breath. J. Agric. Food Chem.. 54, 497-501;
- Jiun I.L., Siddik S.N., Malik S.N., Tin-Oo M.M., Alam M.K., Khan M.M. (2015). Association between oral hygiene status and halitosis among smokers and nonsmokers. Oral Health Prev. Dent. 13, 395-405;
- Rad M., Kakoie S., Niliye Brojeni F., Pourdamghan N. (2010). Effect of long-term smoking on whole-mouth salivary flow rate and oral health. J. Dent. Res. Dent. Clin. Dent. Prospects. 4, 110–114;
- Дареному коню в дёсны не смотрят;
- Arif Şanlı. (2016). Relationship between smoking and otorhinolaryngological symptoms. Kulak Burun Bogaz Ihtis Derg. 26, 28-33;
- Ken Yaegaki, Kazuo Sanada. (1992). Biochemical and Clinical Factors Influencing Oral Malodor in Periodontal Patients. Journal of Periodontology. 63, 783-789;
- Tongue scrapers and cleaners. MouthHealthy;
- Salinas T.J. (2015). Bad breath: could a tongue scraper help? Mayo Clinic;
- Outhouse T.L., Fedorowicz Z., Keenan J.V., Al-Alawi R. (2006). A Cochrane systematic review finds tongue scrapers have short-term efficacy in controlling halitosis. Gen. Dent. 54, 352–359; 360, 367–368;
- Rainer Seemann. (2006). Tongue scrapers may reduce halitosis in adults. Evid Based Dent. 7, 78-78;
- Rachel David. (2012). Why zinc is bad for bacteria. Nat Rev Micro. 10, 4-4;
- Alix Young, Grazyna Jonski, Gunnar Rolla. (2002). The oral anti-volatile sulphur compound effects of zinc salts and their stability constants. Eur J Oral Sci. 110, 31-34;
- S.O. Griffin, E. Regnier, P.M. Griffin, V. Huntley. (2007). Effectiveness of Fluoride in Preventing Caries in Adults. J Dent Res. 86, 410-415;
- T. Aoba, O. Fejerskov. (2002). Dental Fluorosis: Chemistry and Biology. Critical Reviews in Oral Biology & Medicine. 13, 155-170;
- S. Sharma, NJ. Shetty, A. Uppoor. (2012). Evaluation of the clinical efficacy of potassium nitrate desensitizing mouthwash and a toothpaste in the treatment of dentinal hypersensitivity. J Clin Exp Dent. e28-e33;
- Robin Orchardson, David G. Gillam. (2006). Managing dentin hypersensitivity. The Journal of the American Dental Association. 137, 990-998;
- Petrou I., Heu R., Stranick M., Lavender S., Zaidel L., Cummins D. et al. (2009). A breakthrough therapy for dentin hypersensitivity: how dental products containing 8% arginine and calcium carbonate work to deliver effective relief of sensitive teeth. J. Clin. Dent. 20, 23–31;
- Richard J.M. Lynch. (2011). Zinc in the mouth, its interactions with dental enamel and possible effects on caries; a review of the literature. International Dental Journal. 61, 46-54;
- C. Wu, J. Labrie, Y.D.N. Tremblay, D. Haine, M. Mourez, M. Jacques. (2013). Zinc as an agent for the prevention of biofilm formation by pathogenic bacteria. J Appl Microbiol. 115, 30-40;
- Naho Mugita, Takayuki Nambu, Kazuya Takahashi, Pao-Li Wang, Yutaka Komasa. (2017). Proteases, actinidin, papain and trypsin reduce oral biofilm on the tongue in elderly subjects and in vitro. Archives of Oral Biology. 82, 233-240;
- AamirRashid Purra, Mubashir Mushtaq, ShashiRashmi Acharya, Vidya Saraswati. (2014). A comparative evaluation of propolis and 5.0% potassium nitrate as a dentine desensitizer: A clinical study. J Indian Soc Periodontol. 18, 466;
- Ozan F., Sümer Z., Polat Z.A., Er K., Ozan U., Deger O. (2007). Effect of mouthrinse containing propolis on oral microorganisms and human gingival fibroblasts. Eur. J. Dent. 1, 195–201;
- D. Trombetta, F. Castelli, M. G. Sarpietro, V. Venuti, M. Cristani, et. al.. (2005). Mechanisms of Antibacterial Action of Three Monoterpenes. Antimicrobial Agents and Chemotherapy. 49, 2474-2478;
- W. K. Jung, H. C. Koo, K. W. Kim, S. Shin, S. H. Kim, Y. H. Park. (2008). Antibacterial Activity and Mechanism of Action of the Silver Ion in Staphylococcus aureus and Escherichia coli. Applied and Environmental Microbiology. 74, 2171-2178;
- Abadi M.F., Mehrabian S., Asghari B., Namvar A.E., Ezzatifar F., Lari A.R. (2013). Silver nanoparticles as active ingredient used for alcohol-free mouthwash. GMS Hyg. Infect. Control. 8, Doc05;
- M. P. Edlind, W. L. Smith, T. D. Edlind. (2005). Effects of Cetylpyridinium Chloride Resistance and Treatment on Fluconazole Activity versus Candida albicans. Antimicrobial Agents and Chemotherapy. 49, 843-845;
- Mahesh R Khairnar. (2015). Mitigation of Fluorosis - A Review. JCDR;
- MJ McCullough, CS Farah. (2008). The role of alcohol in oral carcinogenesis with particular reference to alcohol-containing mouthwashes. Australian Dental Journal. 53, 302-305;
- Parth LODHIA, Ken YAEGAKI, Ali KHAKBAZNEJAD, Toshio IMAI, Tsutomu SATO, et. al.. (2008). Effect of Green Tea on Volatile Sulfur Compounds in Mouth Air. J Nutr Sci Vitaminol. 54, 89-94;
- Svante Twetman, Mette K. Keller. (2016). Fluoride Rinses, Gels and Foams: An Update of Controlled Clinical Trials. Caries Res. 50, 38-44;
- Kerin L Tyrrell, Diane M Citron, Yumi A Warren, Sushma Nachnani, Ellie J.C Goldstein. (2003). Anaerobic bacteria cultured from the tongue dorsum of subjects with oral malodor. Anaerobe. 9, 243-246;
- Wen Ren, Zhe Xun, Zicheng Wang, Qun Zhang, Xuenan Liu, et. al.. (2016). Tongue Coating and the Salivary Microbial Communities Vary in Children with Halitosis. Sci Rep. 6;
- M.R. Vivekananda, K.L. Vandana, K.G. Bhat. (2010). Effect of the probiotic Lactobacilli reuteri (Prodentis) in the management of periodontal disease: a preliminary randomized clinical trial. Journal of Oral Microbiology. 2, 5344;
- Deirdre A. Devine, Philip D. Marsh. (2009). Prospects for the development of probiotics and prebiotics for oral applications. Journal of Oral Microbiology. 1, 1949;
- Kenichi HOJO, Chinami MIZOGUCHI, Naoki TAKETOMO, Tomoko OHSHIMA, Kazuhiro GOMI, et. al.. (2007). Distribution of SalivaryLactobacillusandBifidobacteriumSpecies in Periodontal Health and Disease. Bioscience, Biotechnology, and Biochemistry. 71, 152-157;
- Neumann C., Zönnchen B., Willershausen-Zönnchen B. (1996). The efficacy of an oral immunostimulant in treating periodontitis — a pilot study. Eur. J. Med. Res. 1, 387–392;
- Elisa Villa, Valentina Garelli, Fulvio Braido, Giovanni Melioli, Giorgio Walter Canonica. (2010). May We Strengthen the Human Natural Defenses with Bacterial Lysates?. World Allergy Organization Journal. 3, S17-S23;
- Sven-Ulrik Gorr, Mahsa Abdolhosseini. (2011). Antimicrobial peptides and periodontal disease. Journal of Clinical Periodontology. 38, 126-141;
- José Luis Parada, Carolina Ricoy Caron, Adriane Bianchi P. Medeiros, Carlos Ricardo Soccol. (2007). Bacteriocins from lactic acid bacteria: purification, properties and use as biopreservatives. Braz. arch. biol. technol.. 50, 512-542;
- Sumita Jain, Richard P. Darveau. (2010). Contribution of Porphyromonas gingivalis lipopolysaccharide to periodontitis. Periodontology 2000. 54, 53-70;
- B. Sampaio-Maia, I.M. Caldas, M.L. Pereira, D. Pérez-Mongiovi, R. Araujo. (2016). The Oral Microbiome in Health and Its Implication in Oral and Systemic Diseases. Advances in Applied Microbiology. 171-210.