Дареному коню в дёсны не смотрят
14 января 2018
Дареному коню в дёсны не смотрят
- 6371
- 5
- 10
Основные виновники заболеваний дёсен — это бактерии Porphyromonas gingivalis, Treponema denticola, Tannerella forsythia.
рисунок предоставила компания SPLAT
-
Автор
-
Редакторы
Почти каждого родители приучали с детства: «Встал с утра — почисти зубы». Все слышали про кариес и знают, что гигиена полости рта может снизить частоту посещения стоматолога. Но недавно ученые с удивлением узнали, что благодаря этой гигиене можно защититься не только от кариеса, но и от куда более страшных, системных заболеваний. Мы решили разобраться, кто такие инфламмофилы, как возникает пародонтит и каким образом он связан с атеросклерозом, диабетом и другими страшными заболеваниями. Теперь мы можем рассказать вам самое интересное.
Биология, медицина и косметология ротовой полости

Партнер цикла — компания SPLAT: ведущий разработчик и производитель профессиональных средств ухода за полостью рта.
О необходимости ухода за ротовой полостью знает каждый с детства, и, казалось бы, это не та область науки, где читатель ждет захватывающих новостей. Однако ошибочно думать, что исследования по здоровью зубов и десен не ведутся. Как выяснила «Биомолекула», дела обстоят совсем по-другому. Ведется переклассификация некоторых заболеваний. Болезни ротовой полости оказываются связаны с такими «раскрученными» темами как диабет, сердечно-сосудистые заболевания и даже рак. Ведутся споры о том, какие компоненты должны входить в состав зубных паст. Разрабатываются пре- и пробиотики для нормализации состава микробиоты ротовой полости. Наконец, даже в обычной жизни пользователь сталкивается с огромным арсеналом средств по уходу за ротовой полостью: это специализированные ополаскиватели, пенки, ершики, нити и огромное разнообразие зубных щеток и паст.
Для того чтобы разобраться, какие темы касательно здоровья и косметологии зубов и десен сейчас наиболее активно изучаются, что изменилось с исторической точки зрения в гигиене ротовой полости и на что в средствах ухода стоит обращать внимание, «Биомолекула» объединила усилия с одним из ведущих производителей и разработчиков в этой области — компанией SPLAT. Результатом сотрудничества стали четыре статьи, которые и представлены в этом спецпроекте.
Каждый из нас, получив какой-то не совсем подходящий, по нашему мнению, подарок, слышал укоризненную фразу «дареному коню в зубы не смотрят». В детстве я заинтересовался ее происхождением и решил расспросить родителей. После непременных «ну, наверное...», «это просто выражение такое...» и эпохального «эээ...» мне таки объяснили, что, скорее всего, по внешнему виду лошади сложно определить ее возраст и здоровье, а потому перед покупкой ей заглядывают в рот. Если зубы сточены, значит лошадь старая. Если плохие — в дырках, желтые, отсутствуют, — значит, лошадь плохо кормили, и она скорее всего больна.
Тогда меня это удовлетворило. Здравый смысл подсказывал, что по такой тривиальной и маленькой части организма, как рот, ничего другого узнать и не выйдет. Но здравый смысл ошибался. Выяснилось, что не только заводчики лошадей, но и ученые — биологи и медики — давно заметили, что различные заболевания отражаются на состоянии полости рта, особенно на деснах. Это оказалось верно не только для лошадей, но и для людей, что, несомненно, куда интереснее.
Что удивительно, плохое состояние полости рта может не только показать, но и предсказать развитие тяжелых, подчас неизлечимых состояний, таких как диабет, ревматоидный артрит или атеросклероз. Как же это происходит? Какие заболевания можно выявить по состоянию зубов и дёсен? Есть ли тут причинно-следственная связь? Что можно предотвратить своевременным лечением и правильной гигиеной? Давайте разберемся.
Иммунный ответ в ротовой полости
Все слизистые оболочки нашего организма заселены комменсальной микробиотой (рис. 1). От нас эти микроорганизмы получают пищу и защиту. Но особенно хорошо живется комменсалу в ротовой полости, поскольку это совершенно особое место. Посудите сами: с наружной средой сообщается, основной поток материи — снаружи внутрь: легко заселиться, не нужно долго путешествовать по ЖКТ, преодолевать агрессивное пространство желудка. Еды вдоволь, поскольку вся пища хозяина тут проходит первичную обработку. Среда умеренно щелочная, почти нейтральная. Единственная проблема — надо совладать с иммунитетом.
Комменсалы — виды, которые получают пользу от сожительства с другими организмами, при этом своим сожителям они ни вредны, ни полезны. Термин в отношении человеческой микробиоты устарел: теперь мы знаем о множестве важных функций, выполняемых ею. Правильнее было бы называть эти микроорганизмы симбиотическими, но традиция есть традиция.
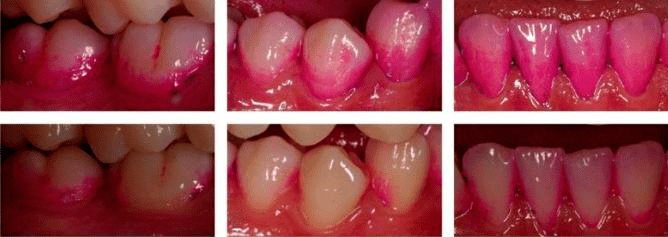
Рисунок 1. Сравнение нормальной биопленки на зубах и после чистки зубной щеткой. Пленка для наглядности окрашена фиолетовым красителем.
Иммунный надзор за состоянием ротовой полости — тоже что-то особенное [1]. Эпителий тут тонкий и активно обновляющийся. Слюнные железы создают слабощелочную среду и выделяют антибактериальные ферменты, такие как лизоцим, разрушающий клеточную стенку бактерий. Инфицирование ротовой полости приводит к повреждению эпителиальных клеток и быстрому возникновению воспаления, которое в этой области организма из-за маленькой толщины эпителия ведет к частым кровотечениям и сильному покраснению. Зараженная область атакуется иммунной системой сразу по всем фронтам. Клеточный компонент врожденного иммунитета представлен тучными клетками, нейтрофилами и макрофагами. Гуморальный — лизоцимом, системой комплемента и антителами: эти факторы разрушают мембраны клеток-мишеней или выступают в роли опсонинов .
Комплемент — важнейшая система врожденного гуморального иммунного ответа, своеобразный древний аналог защиты посредством антител. Она состоит из нескольких десятков белков, выделяемых в кровоток печенью или представляемых на своей поверхности клетками организма. Активация комплемента приводит к каскаду реакций, вызывающему воспаление, фагоцитоз или даже непосредственную гибель патогенов.
Опсонины — своеобразный «молекулярный кетчуп» для иммунных клеток, покрывающий поверхность бактерий при инфицировании. Без опсонизации патоген тоже может быть съеден фагоцитом, но это будет малоэффективный процесс. Опсонизация повышает эффективность фагоцитоза в том числе и за счет формирования на поверхности патогена белковых комплексов, производящих хемоаттрактанты для фагоцитов, которые сбегаются на них, как акулы на кровь. То есть благодаря опсонизации патоген не только становится «вкуснее» для фагоцита, но и сильнее «пахнет».
Видео. Нейтрофил в мазке крови преследует стафилококка среди эритроцитов. Плазма крови содержит белки системы комплемента (C1—С9), которые собираются на поверхности патогена в белковые «фабрики», производящие растворимые хемоаттрактанты (С3а и С5а) и фиксированные на клеточной стенке опсонины (С3b и C5b). Нейтрофил движется по градиенту хемоаттрактантов и «хватается» своими рецепторами за опсонины для осуществления фагоцитоза. (Заинтересованному читателю может пригодиться подробное описание происходящего на видео.)
Подробнее о том, как работает наш иммунитет, рассказано в статье «Иммунитет: борьба с чужими и... своими» [2] из цикла «Аутоиммунные заболевания».
Острое воспаление губительно для большинства бактериальных и грибковых клеток. Потому наша микробиота, живущая на поверхности слизистых, готова на многое, лишь бы его не вызвать. Наши симбиотические бактерии тратят драгоценную энергию и ресурсы на синтез противовоспалительных веществ [3] и отказываются от повреждения таких вкусных на вид клеток эпителия, потому что при их повреждении никакие противовоспалительные стратегии не спасут от активации иммунитета. Кроме того, они создают так называемую колонизационную резистентность — препятствуют заселению освоенного ими эпителия другими микроорганизмами (которые вполне могут вызвать воспаление и навредить комменсалам) [4]. В итоге пользы от них нашему организму больше, чем вреда. Все счастливы.
Гингивит и пародонтит — власть над хаосом
Хотя острый иммунный ответ способен уничтожить почти любую инфекцию в ее зачатке, некоторым возбудителям удается закрепиться в этих условиях на время, достаточное, чтобы вызвать хроническое воспаление дёсен и связанное с ним заболевание — хронический гингивит. Таких паразитов называют ключевыми патогенами, и найдено их не очень много, все на счету. Самый изученный из них — порфиромонада Porphyromonas gingivalis. В статье мы по большей части будем говорить именно о ней, хотя почти всё сказанное в той или иной мере можно отнести к любому другому ключевому патогену.
Ранее считалось, что такие возбудители тоже страдают от воспаления, но просто научились с ним справляться. Это своеобразные «робинзоны» в суровых условиях воспаленной ткани, старающиеся не быть съеденными и не умереть с голоду. Однако в последнее время появляется всё больше данных, указывающих на то, что эти бактерии на самом деле даже активно способствуют возникновению воспаления . Дело в том, что воспаление деструктивно в отношении не только патогенов, но и собственного организма. А поврежденные ткани для таких паразитов — отличный источник ресурсов.
Для таких бактерий даже придумали новый термин — инфламмофилы: от латинского inflammatio («воспаление») и греческого philía («любящий»). Но этот термин появился в литературе недавно, концепция пока не устоялась.
Как правило, такие бактерии располагаются на участках дёсен, непосредственно примыкающих к зубу. Они облигатно анаэробны — погибают в присутствии кислорода. По этой причине они формируют защитные биопленки, основой для которых служат устойчивые ткани зуба. Так образуется зубной налет. По мере развития заболевания острое воспаление переходит в хроническое. При этом вокруг зоны воспаления формируется особое дисбиотическое сообщество микроорганизмов, сильно отличающееся от нормального для ротовой полости. В нём можно выделить несколько классов микробионтов.
Дисбиоз — новое название для состояния, ранее звавшегося дисбактериозом. Это значит, что состав симбиотической микрофлоры отклонился от нормального, стал в определенной мере патогенным. Смена названия связана с тем, что не бактериями едиными сформирована наша микрофлора.
Первый — собственно инициатор процесса, ключевой патоген. Это бактерии, которые почти всегда обнаруживаются в воспаленной ткани и почти никогда — в здоровой полости рта. К ним относят упомянутую выше P. gingivalis, а также Treponema denticola, Tannerella forsythia и некоторые другие виды. В эксперименте с животными моделями заметили интересную деталь: принудительное заражение P. gingivalis не вызывало гингивита у гнотобиотических животных в отличие от обычных. Из этого ученые сделали вывод, что для успешной колонизации полости рта ключевому патогену нужна помощь нормальной микробиоты [5].
Гнотобиология — наука, изучающая физиологию гнотобионтов — животных, лишенных каких-либо кишечных, кожных и других микроорганизмов (то есть безмикробных животных) или заселенных небольшим числом известных видов (гнотофоров).
Второй класс включает как раз таких комменсалов-«помощников». Например, Streptococcus gordonii и Aggregatibacter actinomycetemcomitans [6]. S. gordonii вступает в контакт с P. gingivalis через поверхностные белки, и бактерии начинают взаимно стимулировать рост друг друга. Без помощи S. gordonii порфиромонада испытывает большие трудности с формированием устойчивой биопленки. A. actinomycetemcomitans, в свою очередь, обеспечивает колонии защиту от активных форм кислорода — как атмосферного, так и выделяемого нейтрофилами в попытках уничтожить источник воспаления. Это делает ответ врожденного иммунитета непродуктивным, а сообщество — способным выживать в губительных условиях.
Особняком стоят другие «помощники» — реактивированные вирусы из семейства Herpesviridae. Практически 100% человеческой популяции заражены каким-либо представителем этого семейства [7], и показано их участие в развитии многих заболеваний [8]. Однако в норме заражение носит латентный характер: вирус никак себя не проявляет. У пациентов с гингивитом в зоне воспаления часто обнаруживают активировавшийся вирус, а в крови — повышенный титр антител к нему [9]. Причем такая реактивация указывает на более тяжелое течение заболевания. Показано даже, что герпесвирусы способны индуцировать переход гингивита в пародонтит, то есть усугублять патологию. Однако пока не ясно, способны ли они выступать в роли ключевого патогена.
Третий класс микробионтов — страдающий и угнетенный. Это те представители микрофлоры, которые не способны выживать в условиях воспаления. По сути, это почти вся нормальная флора. Особенно крепко ей достается, когда гингивит начинают лечить. Стандартная терапия сейчас предполагает использование антисептиков вроде хлоргексидина, от которых патологические сообщества защищены лучше, чем нормальные. Это ведет к ослаблению их противовоспалительного действия и к нарушению колонизационной резистентности.
Ситуация, в которой иммунный ответ не способен справиться с паразитарной нагрузкой, ведет к переходу острого воспаления в хроническое. При этом начинает меняться сама композиция ткани: активируются фибробласты, макрофаги, моноциты. Если задача острого воспаления — уничтожить захватчиков, то хроническое воспаление стремится их локализовать путем ремоделирования ткани и окружения пораженной области соединительнотканной капсулой.
Ремоделирование ткани, сопровождающее хроническое воспаление, приводит к тому, что близлежащие связки и кости начинают растворяться. Гингивит превращается в пародонтит — состояние, при котором возникает неиллюзорный риск потери зубов. Десна при этом начинает отходить от зуба и постепенно, по мере растворения альвеолярной кости и связок «съезжать» вниз (рис. 2) [10].
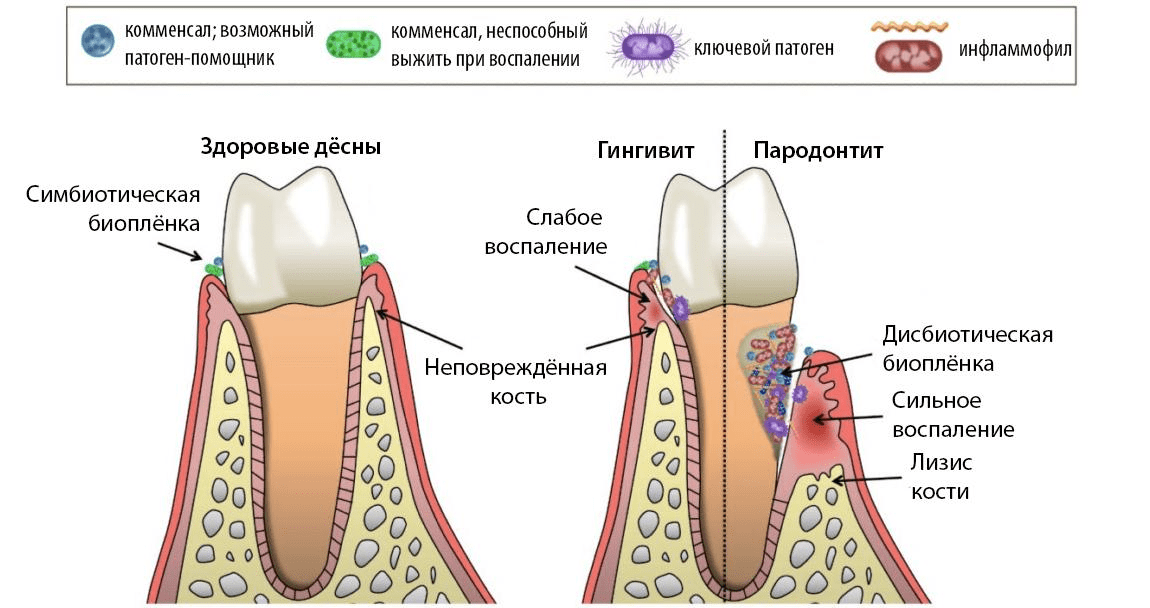
Рисунок 2. Сравнение анатомии и микробиологического статуса полости рта в норме, при гингивите и пародонтите.
Ранее медики выделяли пародонтоз как отдельное заболевание. Под этим термином подразумевалась деградация альвеолярных костей и потеря зубов без сопутствующего воспаления. Однако в последнее время такой диагноз уже не ставят, потому что пародонтоз невозможно достоверно отличить от пародонтита.
Разделяй и властвуй — контроль иммунитета при пародонтите
P. gingivalis и организмы-помощники (бактерии и вирусы) совместно создают условия, при которых сообщество способно существовать при постоянном воспалении и под ударами иммунитета. Механизмы этого процесса пока изучены не до конца, поскольку они многочисленны и разнообразны.
Нейтрофилы
Первой линией защиты от гингивита служат нейтрофилы [11]. Во многом благодаря им ключевые патогены, которые постоянно попадают в нашу ротовую полость, уничтожаются задолго до того, как вызывают первые симптомы воспаления. Нейтрофилы — клетки врожденного иммунитета, обладающие двоякой функцией. С одной стороны, они способны к фагоцитозу (поеданию чужеродных организмов), хоть и не такому массированному и эффективному, как макрофаги. С другой же — могут выбрасывать во внешнюю среду активные формы кислорода (АФК), целые сети из собственной ДНК, ферменты и другие белки, токсичные для патогенов.
Нейтрофилы — это клетки-камикадзе (рис. 3). Они очень эффективны в убийстве больших масс бактерий, но при этом погибают сами. Другие фагоциты съедают остатки и от них самих, и от сраженных ими бактерий. При нормальном ответе на заражение дёсен до 90% всех представленных в зоне поражения активных клеток — нейтрофилы.
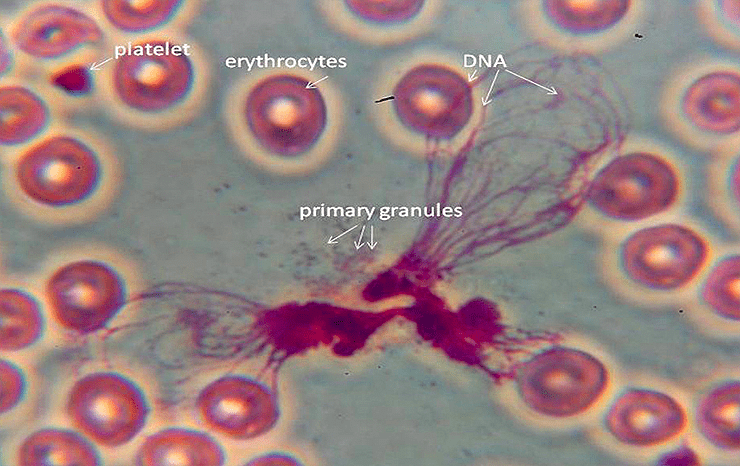
Рисунок 3. Нейтрофил осуществляет нетоз — клеточную смерть с выбросом «сетей из ДНК».
сайт regensci.org
Нейтрофильный ответ при пародонтите нарушается на нескольких уровнях. Во-первых, P. gingivalis нарушают синтез хемотаксического фактора IL-8 и молекулы адгезии Е-селектина в клетках эпителия дёсен. Без этих молекул проплывающие мимо зоны поражения нейтрофилы не смогут покинуть капилляр и выйти в ткань. Этот эффект продолжается недолго, но, как правило, его достаточно, чтобы патоген успел закрепиться и включить другие механизмы защиты. Во-вторых, как упоминалось ранее, «помощники» ключевого патогена из числа нормальной микрофлоры способны защищать дисбиотическое сообщество. Например, самое эффективное оружие против нейтрофилов — это выделение ферментов, расщепляющих АФК.
Интересно то, что нейтрофилы нужны патогенам! Вероятно, именно поэтому блокировка хемотаксиса имеет небольшую продолжительность во времени. Дело в том, что инфламмофильной флоре нужно воспаление тканей, чтобы нормально питаться, а никто не вызывает его лучше активированных нейтрофилов. Потому после выставления защиты новообразованной биопленки от повреждающих факторов контроль нейтрофилов практически прекращается. В результате, нейтрофилы оказываются одним из основных факторов, повреждающих десну и альвеолярную кость при пародонтите.
Комплемент
Система комплемента — древняя часть врожденного гуморального иммунитета. Комплемент представляет собой комплекс последовательно активирующихся белков плазмы (рис. 4). При активации они покрывают поверхность патогена, стимулируют хемотаксис фагоцитов и облегчают фагоцитоз. Некоторые патогены даже могут быть уничтожены только белками комплемента без привлечения других ветвей иммунитета.
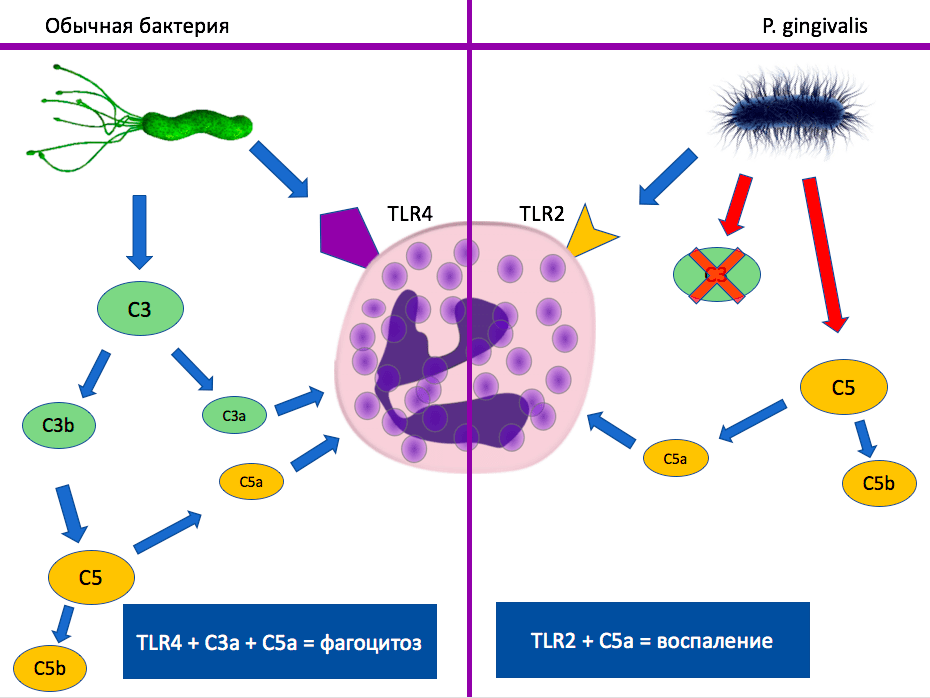
Рисунок 4. Различия в пути активации системы комплемента в норме и при гингивите и его воздействие на нейтрофилы. Синие стрелки — обычные для организма реакции. Красные стрелки — бактериальные ферменты.
рисунок автора статьи
Показано, что P. gingivalis способна расщеплять один из белков комплемента С5 на С5а и С5b без активации вышележащих путей (рис. 4). В результате в области воспаления оказывается большое количество С5а. Это привлекает в нее дополнительные нейтрофилы, но очень интересным образом на них действует. Дело в том, что ключевые патогены активируют на поверхности нейтрофилов рецепторы TLR2, которые узнают пептидогликан клеточной стенки. В сочетании с рецептором С5а это приводит к подавлению фагоцитоза и усилению провоспалительной и дегранулирующей активности [12]. В итоге вместо уничтожения бактерий, нейтрофилы разрушают ткани. Инфламмофилы торжествуют!
В свою очередь другой компонент системы комплемента (С3) уничтожается бактериями. Таким образом, комплемент переходит под практически полный бактериальный контроль и служит их целям вместо защиты организма.
Белки, контролирующие систему комплемента, обнаружены у всех ключевых патогенов гингивита, что указывает на важность нарушения этого слоя иммунной системы для успеха заражения [13].
Иные способы контроля иммунитета
Вышеприведенные пути контроля воспаления и иммунного ответа являются самыми изученными, но не единственными. Сегодня изучают различные межбактериальные связи в дисбиотическом сообществе, при которых оно защищает свои отдельные виды от видоспецифичной атаки. Также при гингивите нарушается активация хелперных лимфоцитов (с молекулами CD4 на поверхности) и преимущественная дифференцировка их в сторону провоспалительного 2-го типа, а не направленного против внутриклеточных бактерий 1-го. Это, в частности, приводит к незавершенному фагоцитозу бактерий во время процессов, описанных далее. Исследование механизмов контроля иммунитета продолжается.
Путь к сердцу лежит...
Как говорилось в предисловии, пародонтит и гингивит часто сопровождают, а порой и предсказывают риск развития определенных системных заболеваний. В этот список входят метаболические нарушения, атеросклероз, некоторые формы онкологических заболеваний, аутоиммунные болезни и многое другое. Ученые довольно сильно углубились в исследования механизмов этих процессов и нашли уже много чего интересного. Например, почти все эти процессы так или иначе связаны с ключевым патогеном, а наша микрофлора почти не принимает участия в этой ветви патогенеза гингивита. Частично мы уже разобрались, как именно это происходит. Рассмотрим все по порядку.
Сердечно-сосудистые заболевания
Наиболее сильная ассоциация в этой группе состояний выявлена между гингивитом и атеросклерозом [14]. Ученые обнаружили, что воспалительные заболевания полости рта — независимый фактор развития этого состояния. Важным вопросом в таких случаях является наличие причинно-следственных связей: сам ли гингивит — причина повышенного риска, или некий неизвестный пока фактор повышает риск и атеросклероза, и гингивита? Имеющиеся на сегодня данные указывают на первый вариант (то есть при прочих равных у человека с пародонтитом риск заболеть атеросклерозом выше, чем у здорового).
Ученые обнаружили несколько механизмов, посредством которых гингивит может влиять на состояние сосудов. Холестериновая бляшка — это не просто однородное нагромождение. Она имеет сложную структуру, частью которой являются так называемые «пенистые» клетки — макрофаги, наевшиеся холестериновых фрагментов и выглядящие под микроскопом как будто наполненные пеной (рис. 5). Важный фактор атеросклероза — воспаление интимы (внутреннего слоя стенки) сосуда, привлекающее макрофаги.
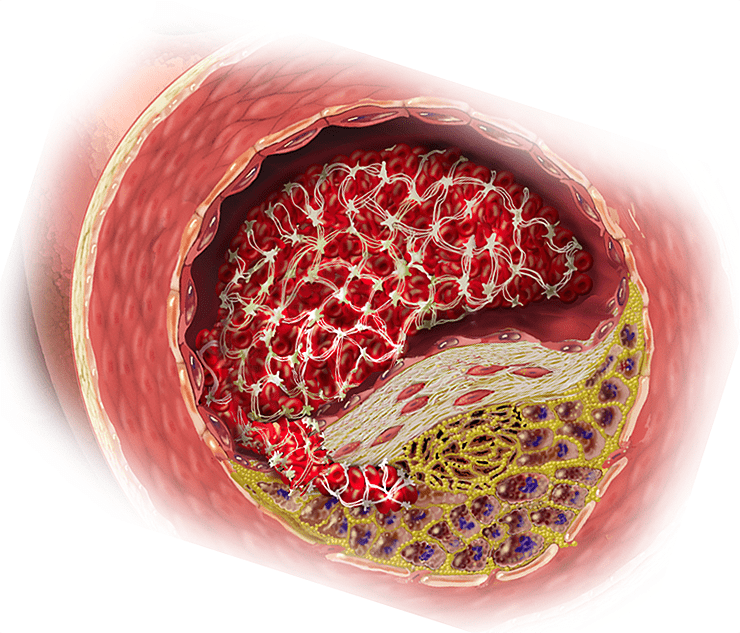
Рисунок 5. Атеросклеротическая бляшка в сосуде. В нижней части бляшки — пенистые клетки.
сайт medimagery.com
Показано, что у людей с гингивитом и атеросклерозом в бляшках можно обнаружить ключевых патогенов заболеваний полости рта. Как мы помним, они являются анаэробами и инфламмофилами, так что атеросклеротическая бляшка для них — более чем приемлемое место обитания. Более того, они вполне способны создать ее самостоятельно, вызвав воспаление в месте своего прикрепления после проникновения в кровь. Но как же они туда попадают? На это есть два возможных ответа.
Во-первых, если переусердствовать с чисткой зубов при гингивите и вызвать кровотечение, часть дисбиотической флоры попадает в кровь и вызывает слабую бактериемию [15]. Однако этот путь проникновения, предположительно, не может быть основной причиной повышенного риска атеросклероза при гингивите — бактерии не готовы выживать в токсичной для них крови. Куда более перспективным с точки зрения патогенов является их путешествие по организму внутри фагоцитов после незавершенного фагоцитоза [16].
Бактериемия — присутствие бактерий, живых или мертвых, в системном кровотоке.
Незавершенный фагоцитоз — состояние клеток-фагоцитов, при котором они проглотили бактерию, но слияние фагосомы с лизосомой не произошло. При этом бактерии продолжают жить внутри фагоцита и могут путешествовать в таком виде по организму.
Помимо бактериемии предложено еще несколько механизмов. Обнаружено, что выделение провоспалительных цитокинов в зоне пародонтита может спровоцировать системный воспалительный ответ в печени, тем самым создав предпосылки к развитию воспаления сосудов [17]. Также отмечено, что по неизвестному пока пути пародонтит сильно меняет состав кишечной микрофлоры, снижая ее противовоспалительные способности и вызывая системное воспаление [18]. Сами ключевые патогены в кишечнике при этом, однако, не обнаруживаются.
Помимо атеросклероза, на мышах показано, что воспаление ротовой полости ведет к снижению скорости восстановления миокарда после инфаркта. Имеются данные по связи пародонтита с риском развития коронарной недостаточности сердца [17]. Однако ассоциация пародонтита со всеми другими сердечно-сосудистыми заболеваниями куда более зыбкая, нежели с атеросклерозом.
Осложнения при беременности
Заболевания полости рта также плохо влияют на плод. Отмечено снижение массы новорожденного, повышение риска преждевременных родов, выкидыша и мертворождения. Ученые рассматривают два возможных механизма. В первом случае некоторые бактерии, вызывающие пародонтит, проникают через плаценту. Что интересно, в отличие от атеросклероза это не ключевые патогены, а бактерии-помощники — часть нормальной флоры ротовой полости, измененная под влиянием P. gingivalis или других индукторов. Второй механизм указывает на провоспалительный фон, который создает в организме матери пародонтит. При воспалении ресурсы организма распределяются по принципу «сначала мать, потом дитя» [10].
Аутоиммунные заболевания
Среди состояний, при которых иммунитет обращается против своего владельца, наиболее сильна и изучена связь пародонтита с ревматоидным артритом (рис. 6) [19]. Интересно, что если во всех предыдущих случаях излечение пародонтита ведет к улучшению состояния пациента (снижается количество новых бляшек, снижается вероятность выкидыша и т.д.), то в случае с артритом заболевание полости рта только повышает риск его возникновения. Излечение же дёсен никак не помогает заболевшим: далее артрит развивается независимо от наличия или отсутствия пародонтита.
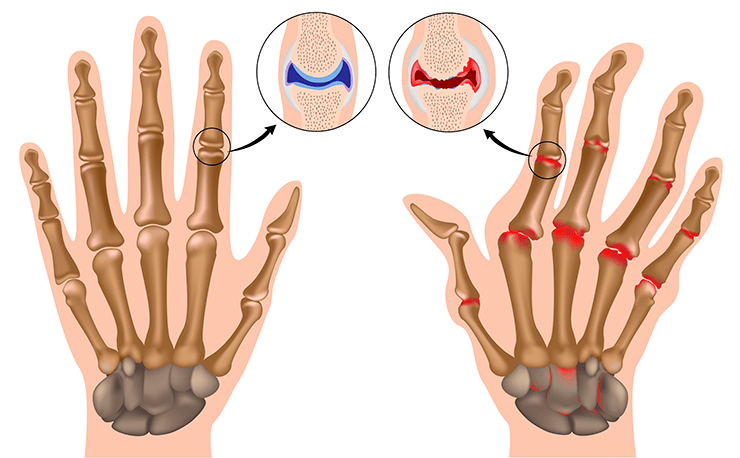
Рисунок 6. Суставы рук в норме (слева) и при ревматоидном артрите.
сайт shutterstock.com
Механизм, по которому повышается риск заболевания, довольно своеобразен. У самого частого патогена, вызывающего гингивит и пародонтит, P. gingivalis, есть фермент пептидил-аргинин-деиминаза, который бактерия выделяет во внешнюю среду. Его функция заключается в том, что он отыскивает в белках аминокислоту аргинин и превращает ее в цитруллин, не меняя сам белок. Такие цитруллинированные белки собственного организма способны вызвать иммунный ответ, прежде всего антительный. Интересно, что более чем в половине случаев ревматоидного артрита у пациентов обнаруживают антитела к цитруллинированным белкам. В первую очередь при пародонтите этому воздействию подвергаются факторы роста соединительной ткани.
Ответ на цитруллинированные белки лишь прокладывает путь к заболеванию. Далее начинается процесс, который в англоязычной литературе называется antigen spreading, дословно — антигенное расползание. Дело в том, что антигеном, то есть узнаваемой молекулой для адаптивного иммунитета, являются небольшие кусочки белков. Если сначала иммунный ответ возникает только к цитруллинированным фрагментам, то постепенно «расползается» на неизмененные пептиды, а оттуда — на другие белки, не встречающиеся в цитруллинированном виде. Общее провоспалительное состояние организма завершает дело — возникает аутоиммунное заболевание.
Диабет второго типа
Много исследований посвящено поиску связи между пародонтитом и диабетом второго типа, или «диабетом пожилых», как называют его патологи. Его стоит отличать от диабета первого типа, имеющего аутоиммунную природу [20]. В отличие от предыдущих заболеваний, однако, в этом случае ученые сконцентрировались скорее на изучении пародонтита, возникающего у больных диабетом, нежели на возникновении диабета у людей с воспалением дёсен. Впереди планеты всей в этих исследованиях страховые компании. Это неудивительно в свете старения популяции — они ищут способы повысить эффективность лечения и/или снизить его цену [21].
Отмечено, что пациенты-диабетики без пародонтита лучше поддаются лечению и, что немаловажно для страховщиков, дешевле обходятся, чем страдающие заболеваниями полости рта. Пародонтит у таких больных встречается чаще, чем в целом по популяции, а значит, его экономически эффективно выявлять и лечить.
Онкологические заболевания
Отдельные ключевые патогены оказались «замешаны» и в развитии некоторых онкологических заболеваний. Тут связь оказалась видоспецифична, что указывает на то, что именно патоген, а не вызываемый им пародонтит, является причиной повышения риска заболевания.
Подробно разобранная в статье Porphyromonas gingivalis оказалась связана с вероятностью заболеть плоскоклеточной орофарингеальной карциномой. Причиной этому является воздействие патогена на различные сигнальные пути в эпителиальных клетках ротоглотки, что приводит к блокаде апоптоза и стимуляции деления. Также P. gingivalis способствует выработке этими клетками протеазы MMP9, с помощью которой они могут разжижать матрикс и покидать место своего образования, создавая метастазы [22]. Отмечена связь этого микроба с развитием рака поджелудочной железы, но тут механизмы пока не разобраны.
Другой ключевой патоген, Fusobacterium nucleatum, в отличие от P. gingivalis, способен проходить желудок и достигать кишечника. Там он взаимодействует с эпителиальными клетками толстого кишечника и способствует их выживанию и делению. Таким образом он способен стимулировать развитие рака толстой кишки, что подтверждается и лабораторными исследованиями — раковые клетки лучше растут, если в среде присутствует Fusobacterium nucleatum [23].
Таким образом, даже если у человека не развивается гингивит в присутствии ключевых патогенов, они все равно могут быть опасны.
Другие заболевания
Вышеперечисленные состояния представляют собой отнюдь не исчерпывающий список того, что исследуется в связи с пародонтитом. Другие заболевания или менее значимы, или хуже изучены, причем вторая опция пока что встречается чаще. Ученые отмечают связь болезней полости рта с бронхиальной астмой и аспирационной пневмонией, хронической почечной недостаточностью и обструктивной болезнью легких. В ближайшие годы стоит ждать новых открытий в этих областях. Но даже с имеющимися данными ясно, что следить за полостью рта — важная со всех сторон задача. Так как же не заболеть гингивитом или вылечиться, если вы уже заболели? Об этом — в следующей главе.
Клиника пародонтита: как не заболеть и чем лечить
Факторы риска
Основной причиной возникновения пародонтита и гингивита является возникновение дисбиотического бактериального (иногда бактериально-герпесвирусного) сообщества, управляемого «ключевым патогеном», — как правило, Porphyromonas gingivalis или подобным ему анаэробом. Но для формирования сообщества нужно, чтобы потенциальный хозяин ключевого патогена был к этому готов [9].
Первый фактор риска — это генетическая предрасположенность. Гены-кандидаты пока достоверно не установлены, и предположение о генетическом вкладе делается на основе разной уязвимости к пародонтиту у людей с одинаковым набором факторов окружающей среды. Исследования по этой теме сейчас ведутся.
Следующим по значимости фактором можно считать «переходный» гормональный фон. Наиболее подвержены гингивиту юноши и девушки в период полового созревания, беременные женщины, женщины в менопаузе, диабетики, — то есть люди, чей гормональный фон нарушен или меняется. Как правило, такое состояние связано с ослаблением иммунитета в целом, что открывает окно для входа патогенов.
Заболевания, снижающие иммунную защиту, такие как СПИД или рак, а также прием иммуносупрессоров тоже могут являться причиной довольно серьезного пародонтита. Такие нарушения структуры полости рта, как хирургическое вмешательство, установка имплантов и т.д. также вносят свой вклад в развитие заболевания.
Недостаточная гигиена полости рта и курение завершают этот список.
Лечение пародонтита
Различные варианты монотерапии гингивита и пародонтита, применяющиеся последние 100 лет, оказались недостаточно эффективными. По отдельности ни хирургия, ни антибиотики, ни антисептические полоскания рта не могут справиться с образованной патогенами биопленкой.
В XX веке классическим лечением тяжелых форм пародонтита являлись различные хирургические вмешательства вроде раскрытия десневых карманов или удаления воспаленной части десны. Однако в конце века установили, что они неэффективны: воспаление сохраняется, а развитие пародонтита даже не замедляется [32].
Сейчас в клинике лечение пародонтита ведется комплексно, в две стадии. На первом этапе необходимо разрушить биопленку механически в кресле стоматолога. На втором применяют антимикробную терапию с использованием антисептиков, таких как хлоргексидин или раствор гипохлорита натрия. По отдельности эти методы работают плохо, но в комплексе дают сильный терапевтический эффект. При агрессивном течении заболевания могут также применять антибиотики широкого спектра — тетрациклины [33].
Также хорошие результаты показывает соблюдение гигиенических правил. Например, эффективна обычная регулярная чистка зубов. Ученые расходятся в оценках минимально необходимой частоты и делятся на два лагеря — «адепты 24-часового цикла» (один раз в день) и «адепты 12-часового цикла» (дважды в день).
Хорошо зарекомендовало себя и не очень частое использование некоторых антисептиков. Например, орошение полости рта 0,25-процентным раствором гипохлорита натрия не только эффективно предотвратило развитие пародонтита, но и улучшило многие другие косвенные параметры здоровья полости рта — например, кардинально снизило кровоточивость при зондировании десневых карманов. Другие антисептики, такие как хлоргексидин, не оказались успешны. Триклозан же, часто применяемый в зубных пастах, помимо отсутствия значимого эффекта, еще имеет и потенциальные побочные эффекты. Из-за этого с 2017 года его включение в антибактериальные средства для мытья рук и тела запрещено FDA [34].
Резюмируя, можно сказать, что исследования в области связи заболеваний полости рта с различными системными патологиями уже принесли массу неожиданных результатов. И отнюдь не зря в старину покупатель рассматривал зубы у лошади — наметанный глаз много чего мог сказать о будущей покупке.
В следующей статье нашего цикла мы перейдем к другому состоянию полости рта. Хоть оно и грозит меньшими проблемами со здоровьем, нежели пародонтит, но куда сильнее бьет по нашей социальной жизни. Речь пойдет о плохом запахе изо рта — галитозе.
Литература
- Małgorzata Nędzi-Góra, Jan Kowalski, Renata Górska. (2017). The Immune Response in Periodontal Tissues. Arch. Immunol. Ther. Exp.. 65, 421-429;
- Иммунитет: борьба с чужими и… своими;
- Graham A. W. Rook. (2012). Hygiene Hypothesis and Autoimmune Diseases. Clinic Rev Allerg Immunol. 42, 5-15;
- Andreas Schwiertz Microbiota of the Human Body — Springer International Publishing, 2016;
- Qian Yin, Su-Chang Lin, Betty Lamothe, Miao Lu, Yu-Chih Lo, et. al.. (2009). E2 interaction and dimerization in the crystal structure of TRAF6. Nat Struct Mol Biol. 16, 658-666;
- G. Hajishengallis, R.J. Lamont. (2012). Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Microbiol Oral Immunol. 27, 409-419;
- Bjørn Grinde. (2013). Herpesviruses: latency and reactivation – viral strategies and host response. Journal of Oral Microbiology. 5, 22766;
- От поцелуя до лимфомы один вирус;
- Jørgen Slots. (2017). Periodontitis: facts, fallacies and the future. Periodontol 2000. 75, 7-23;
- George Hajishengallis. (2014). Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 15, 30-44;
- E. Hajishengallis, G. Hajishengallis. (2014). Neutrophil Homeostasis and Periodontal Health in Children and Adults. J Dent Res. 93, 231-237;
- Tomoki Maekawa, Jennifer L. Krauss, Toshiharu Abe, Ravi Jotwani, Martha Triantafilou, et. al.. (2014). Porphyromonas gingivalis Manipulates Complement and TLR Signaling to Uncouple Bacterial Clearance from Inflammation and Promote Dysbiosis. Cell Host & Microbe. 15, 768-778;
- K. Popadiak, J. Potempa, K. Riesbeck, A. M. Blom. (2007). Biphasic Effect of Gingipains from Porphyromonas gingivalis on the Human Complement System. The Journal of Immunology. 178, 7242-7250;
- Amol Ashok Bahekar, Sarabjeet Singh, Sandeep Saha, Janos Molnar, Rohit Arora. (2007). The prevalence and incidence of coronary heart disease is significantly increased in periodontitis: A meta-analysis. American Heart Journal. 154, 830-837;
- P. B. Lockhart, M. T. Brennan, H. C. Sasser, P. C. Fox, B. J. Paster, F. K. Bahrani-Mougeot. (2008). Bacteremia Associated With Toothbrushing and Dental Extraction. Circulation. 117, 3118-3125;
- Michael T Certo, Kamila S Gwiazda, Ryan Kuhar, Blythe Sather, Gabrielle Curinga, et. al.. (2012). Coupling endonucleases with DNA end–processing enzymes to drive gene disruption. Nat Meth. 9, 973-975;
- Robert J. Genco, Thomas E. Van Dyke. (2010). Reducing the risk of CVD in patients with periodontitis. Nat Rev Cardiol. 7, 479-480;
- Kei Arimatsu, Hitomi Yamada, Haruna Miyazawa, Takayoshi Minagawa, Mayuka Nakajima, et. al.. (2015). Oral pathobiont induces systemic inflammation and metabolic changes associated with alteration of gut microbiota. Sci Rep. 4;
- Ревматоидный артрит: изменить состав суставов;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Marjorie K. Jeffcoat, Robert L. Jeffcoat, Patricia A. Gladowski, James B. Bramson, Jerome J. Blum. (2014). Impact of Periodontal Therapy on General Health. American Journal of Preventive Medicine. 47, 166-174;
- Joseph Katz, Mairelys D Onate, Kaleb M Pauley, Indraneel Bhattacharyya, Seunghee Cha. (2011). Presence of Porphyromonas gingivalis in gingival squamous cell carcinoma. Int J Oral Sci. 3, 209-215;
- Mara Roxana Rubinstein, Xiaowei Wang, Wendy Liu, Yujun Hao, Guifang Cai, Yiping W. Han. (2013). Fusobacterium nucleatum Promotes Colorectal Carcinogenesis by Modulating E-Cadherin/β-Catenin Signaling via its FadA Adhesin. Cell Host & Microbe. 14, 195-206;
- Liu G., He Y.H., Zhang F.F., Kong X.L., Wen Y.L., Ma Q.R. et al. (2010). Effects of glycyrrhizic acid on the growth and acid-producing of Streptococcus mutans in vitro. Sichuan Da Xue Xue Bao Yi Xue Ban. 41, 634–637;
- Azuma K., Ito H., Ippoushi K., Higashio H. (2003). In vitro antibacterial activity of extracts from four Labiatae herbs against Helicobacter pylori and Streptococcus mutans. Yasai Chagyou Kenkyuujo kenkyuu houkoku. 2, 83–91;
- Pompei R., Pani A., Flore O., Marcialis M.A., Loddo B. (1980). Antiviral activity of glycyrrhizic acid. Experientia. 36, 304;
- Жгучий перец облегчит боль;
- Presser A. (2009). Cayenne (Capsicum annuum; C. frutescens). Huntington College of Health Sciences;
- Atmaca S. (1998). The effect of zinc on microbial growth. Tr. J. of Medical Sciences. 28, 595–597;
- Xanthou M. (1998). Immune protection of human milk. Biol. Neonate. 74, 121–133;
- Hoogedoorn H. Activation of the salivary peroxidase system: clinical studies. In: The Lactoperoxidase system: chemistry and biological significance / ed. by Tenovuo J.O. and Pruitt K.M. NY: Dekker, 1985. P. 217–228;
- S. P. Ramfjord, R. G. Caffesse, E. C. Morrison, R. W. Hill, G. J. Kerry, et. al.. (1987). 4 modalities of periodontal treatment compared over 5 years*. J Clin Periodontol. 14, 445-452;
- Ranjitha Krishna, Jamie A. De Stefano. (2016). Ultrasonic vs. hand instrumentation in periodontal therapy: clinical outcomes. Periodontol 2000. 71, 113-127;
- FDA issues final rule on safety and effectiveness of antibacterial soaps. (2016). Сайт FDA;
- Tomas Lang, Sebastian Staufer, Barbara Jennes, Peter Gaengler. (2014). Clinical validation of robot simulation of toothbrushing - comparative plaque removal efficacy. BMC Oral Health. 14.