Экспансионная микроскопия, или Как увидеть новое сквозь старую линзу
24 января 2015
Экспансионная микроскопия, или Как увидеть новое сквозь старую линзу
- 760
- 0
- 0
Биологи широко используют микроскопию в своих целях: анализируют морфологию микроорганизмов, строение тканей и клеток животных, детали организации растений и т.д.
Рисунок в полном размере.
рисунок с сайта micromed.pro
-
Автор
-
Редактор
Темы
Микроскопия в биологии играет огромную роль, позволяя получить визуальную информацию об объекте изучения. В своем стремлении увидеть больше ученые в очередной раз достигли успеха. Был опубликован новый протокол приготовления препаратов для микроскопии, который позволяет улучшить разрешение.
Микроскопия — незаменимый метод для многих биологов, в том числе молекулярных. Но возможности ее не безграничны. Оптическая микроскопия наталкивается на дифракционный предел. Когда две точки находятся друг от друга на критически маленьком расстоянии, то микроскоп не позволяет разрешить эти две точки, и мы воспринимаем их, как одну.
Дифракционный предел научились обходить разными способами, и существует сразу несколько технологий, применяемых в молекулярной биологии. Среди них атомно-силовая микроскопия [1] или микроскопия сверхвысокого разрешения [2], [3]. То есть, когда мы хотим получить лучшее разрешение, первое, что может помочь — это новый микроскоп. Недавно ученые показали, что вторым (но явно не более сложным) подходом может стать физическое растяжение образца [4].
Принципиально подход очень прост. Если две точки находятся так близко, что становятся неотличимы от одной, то нужно их отодвинуть друг от друга на определенное расстояние. Тогда и разрешение станет возможным. В реальности мы имеем дело с целым изображением, но применить такой подход по-прежнему возможно. Ведь если раздвинуть все точки изображения на равные расстояния, то в целом картинка не поменяется.
Как происходит растяжение?
Для того чтобы физически увеличить образец, применили интересное свойство полиэлектролитных гелей [5]. Оно заключается в том, что при помещении такого геля в воду, он увеличивается в размере, растягиваясь во всех направлениях (рис. 1).
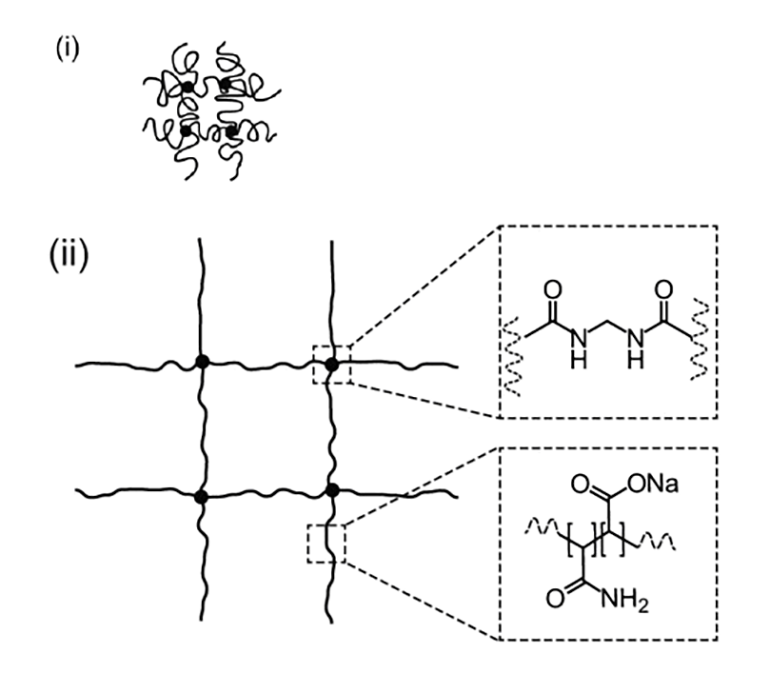
Рисунок 1. Cхема структуры полиэлектролитного геля. (i) Гель до помещения в воду и растяжения. (ii) Гель, помещенный в воду и увеличившийся в размере.
Данное свойство геля решили использовать в следующем опыте. Взяли тонкий срез мозга мыши и зафиксировали его. Затем залили этот биологический препарат гелем так, что гелевые волокна проникли внутрь среза. В образце пришлось удалить белки с помощью специальных ферментов. Это сделало препарат более однородным. Полученную конструкцию поместили в воду, гель растянулся во всех направлениях, что повлекло за собой растяжение среза мозга. Таким образом удалось увеличить биологический образец в 4,5 раза (рис. 2).

Рисунок 2. Изображение среза мозга мыши до растяжения (а) и после растяжения (б).
Белки сохранить нельзя, но узнать, где они были — можно
Очевидным недостатком такой микроскопии стала необходимость удаления белков. Дело в том, что для молекулярной биологии бывает очень важно охарактеризовать локализацию в клетке именно белков. Но ученые придумали, как можно обойти это препятствие.
Перед тем как удалить все белки, с некоторыми из них связывали антитела. К антителам прикрепляли олигонуклеотид. Комплементарный ему олигонуклеотид был флуоресцентно мечен. А флуоресцентная метка, в свою очередь, несла химическое вещество, способное связывать волокна геля. Олигонуклеотиды объединялись так же, как две цепи ДНК объединяются, будучи комплементарными друг другу (рис. 3). Таким образом, когда белки удаляли, метка оставалась связанной с гелем в том месте, где ранее была белковая молекула. А по флуоресцентному следу можно характеризовать локализацию молекул даже после того, как их убрали.
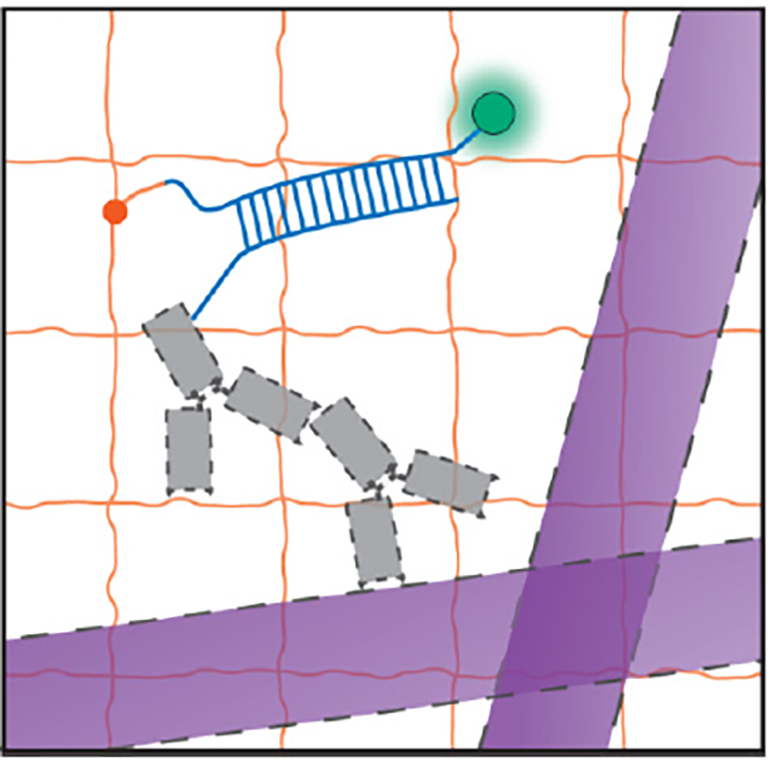
Рисунок 3. Схема локализации белка с помощью флуоресцентной метки. Фиолетовые ленты символизируют цепи белка. Серым показаны антитела, которые узнают этот белок. Синим цветом обозначены взаимодействующие олигонуклеотиды. Один из них несет зеленый флуорофор и оранжевую молекулу, связывающую гель. Волокна геля показаны в виде оранжевой сетки.
Такой новый протокол приготовления препаратов назвали экспансионной микроскопией (ExM). Авторы показали, что ошибка метода не превышает 1%. В целом, экспансионная микроскопия представляется довольно простым и действенным способом увеличить разрешение. С её помощью уже исследовали взаимное расположение некоторых белков мозга мыши.
Если кто-то хочет сам сделать что-то подобное, протоколы для метода находятся на expansionmicroscopy.org.
Литература
- Атомно-силовая микроскопия: увидеть, прикоснувшись;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Fei Chen, Paul W. Tillberg, Edward S. Boyden. (2015). Expansion microscopy. Science. 347, 543-548;
- Toyoichi Tanaka, David Fillmore, Shao-Tang Sun, Izumi Nishio, Gerald Swislow, Arati Shah. (1980). Phase Transitions in Ionic Gels. Phys. Rev. Lett.. 45, 1636-1639.