
По ту сторону дифракционного барьера: Нобелевская премия по химии 2014
09 октября 2014
По ту сторону дифракционного барьера: Нобелевская премия по химии 2014
- 4236
- 0
- 4
Микроскоп Левенгука, доведенный до субдифракционного разрешения. На фоне: принцип STED-микроскопии из материалов пресс-релиза Нобелевского комитета.
-
Автор
-
Редакторы
Изобретение микроскопа в позднем средневековье открыло человечеству целый мир, находившийся испокон веков буквально под носом, — например, клеточное строение всех живых организмов и существование бактерий. Однако волновая природа света диктует ограничение на разрешающую способность оптических микроскопов: оно принципиально не может быть лучше 0,2 мкм. В 2014 году Нобелевскую премию по химии вручили за разработку методов сверхразрешающей микроскопии, позволивших, с использованием ряда ухищрений, преодолеть дифракционный барьер.
Антони ван Левенгук, благодаря предложенным им новшествам в шлифовке линз микроскопов, сделал массу революционных для 17 века открытий: он впервые увидел бактерии, эритроциты, сперматозоиды, дрожжи, простейших, коловраток и т.д. Так техническое, на первый взгляд, усовершенствование одним рывком перебросило естественные науки из средневековья в Новое время. Однако если увеличение микроскопов довольно быстро было доведено до 2000×, с разрешением обнаружились проблемы: в 1873 году Эрнст Аббе установил, что волновая природа света «повинна» в том, что мы принципиально не сможем различить два объекта (или увидеть объект более мелкий), чем половина длины света, т.е. около 0,2 мкм (1 мкм или 1 микрон равен 10−6 м). Это значение было названо дифракционным пределом (рис. 1). Фактически это значит, что с помощью светового микроскопа нельзя изучить тонкое строение клеточных органелл и вообще мелкие детали устройства клетки... Впрочем, есть еще электронный микроскоп, обладающий существенно более высоким разрешением, но он требует фиксации и специальной обработки клеток, а значит, исключает прижизненное наблюдение.

Рисунок 1. Дифракционный предел. В конце 19 века Эрнст Аббе определил минимальное расстояние между объектами, на котором их еще можно различить в световой микроскоп: это половина длина волны света, или около 0,2 мкм. На практике это означает, что без ухищрений мы никогда «глазами» не увидим слишком детальное строение клеток, а вирусы и молекулы — и подавно.
В 2014 году Нобелевская премия по химии вручена «за разработку сверхразрешающей микроскопии» и за преодоление, казалось бы, нерушимого дифракционного барьера. Как же исследователям удалось обойти этот фундаментальный принцип? Здесь не обошлось без заключения «союза» с другим физическим принципом и кое-каких технических уловок. Во-первых, сверхразрешающая микроскопия не простая, а флуоресцентная, и здесь мы видим объект не целиком, а фрагментами, как бы в свете тысяч «нановспышек», создаваемых единичными молекулами флуоресцентных красителей. Во-вторых, регистрация изображения происходит не сразу, а идет с накоплением: микроскоп либо систематически «сканирует» образец, либо собирает многочисленные фрагменты, видимые в свете «вспышек», воедино. Однако давайте разбираться по порядку.
Флуоресценция: по ту сторону дифракционного барьера
«Нормальным» путем дифракционный барьер действительно не преодолеть: это физика. Но с помощью некоторых ухищрений решить задачу все-таки можно. Основной идеей здесь является использование флуоресцентных молекул (таких как широко применяемые в молекулярной биологии флуоресцентные белки [1], [2]), которые не просто отражают или рассеивают свет, а переизлучают его, причем делают это на уровне отдельных молекул. Этот переход — знание о том, что видимое в микроскоп 0,2-микрометровое световое пятнышко создается на самом деле единичной молекулой или очень небольшим их количеством — и лежит в основе увеличения разрешения за пределы дифракционного барьера.
Развитие сверхразрешающих методик шло по нескольким параллельным направлениям, поэтому и «нобелевка» разделена на три равные части: немцу Штефану Хеллю и американцам Эрику Бетцигу и Уильяму Мернеру.
Сканирующая нановспышка
Штефан Хелль с самой аспирантуры, законченной в 1990-м году в Гейдельберге (Германия), мечтал обойти дифракционный барьер. Однако более мастистые ученые воспринимали эту идею с отчетливым недоверием, и Хелль уехал работать в университет Турку (Финляндия) в лабораторию, занимавшуюся флуоресцентной микроскопией. Вспышка света, указавшая дорогу к заветной мечте, сверкнула в голове исследователя, когда тот, утомленно перелистывая талмуд под названием «Квантовая оптика», наткнулся на словосочетание «вынужденное излучение» (stimulated emission).
Это стало ключом к новой методике, за которую Хелль и удостоился Нобелевской премии — микроскопии, основанной на эффекте вынужденного гашения флуоресценции (STED — stimulated emission depletion). В «традиционной» флуоресцентной микроскопии исследователь наблюдает распределение в клетке флуоресцентно-меченных веществ (например, антител), свечение которых индуцируется лазерным лучом определенной длины волны. В STED-микроскопии техника усложнена за счет второго лазерного луча, вызывающего вынужденное гашение флуоресценции образца (да, есть и такой эффект). Причем происходит это не по всему образцу сразу, а только в небольшой его области порядка десятков нанометров, как бы выхватывая ее из тьмы. Особенность этой системы в том, что гасящий импульс кольцом охватывает возбуждающий, заставляя флуоресцировать фрагмент образца, находящийся уже в субдифракционном диапазоне (рис. 2). А это и есть сверхразрешение.
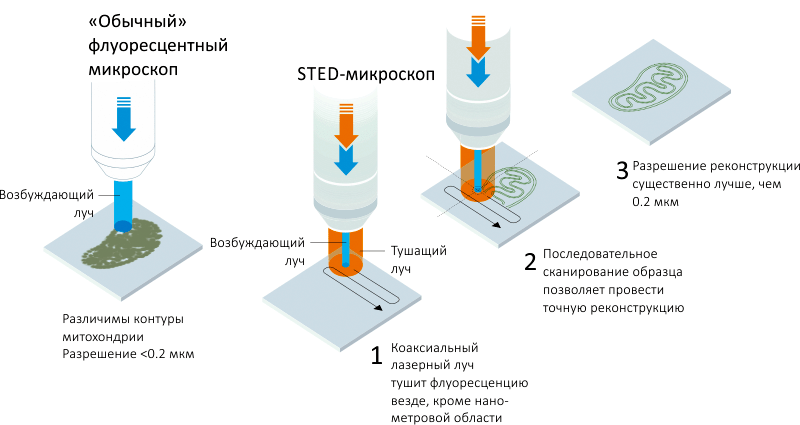
Рисунок 2. STED-микроскопия. Отличие этой методики от «обычной» флуоресцентной микроскопии заключается в использовании двух лазерных лучей: возбуждающего флуоресценцию и концентрического гасящего, что приводит к сокращению эффективного размера флуоресцирующей области до нанометровых (субдифракционных) величин. Последовательное сканирование образца позволяет провести точную реконструкцию, по разрешению существенно превосходящую то, что можно непосредственно увидеть «глазами».

Рисунок 3. Одно из первых изображений на STED-микроскопе (справа) по сравнению с «обычной» микроскопией (слева). Изображена бактерия E. coli.
Дальше эта наноскопическая «вспышка» перемещается по образцу (происходит сканирование), шаг за шагом выстраивая полное изображение. Хитрый физический принцип тушения флуоресценции и продвинутая схема регистрации изображения вкупе с компьютерной реконструкцией позволили перешагнуть через дифракционный барьер. Основы своего метода Хелль опубликовал в 1994 году [3], а подробнее о STED-микроскопии можно почитать на «биомолекуле»: «Лучше один раз увидеть, или микроскопия сверхвысокого разрешения» [4], [5].
Нельзя сказать, чтобы статья сразу «выстрелила», но нужные люди ее заметили, и Хелля пригласили работать в Институт биофизической химии им. Макса Планка в Гёттингене (Германия), где он довел методику до ума, и в 2000-м году представил публике рабочую версию, позволившую получить изображения живых клеток с разрешением, в три–шесть раз превосходящим пресловутый дифракционный барьер [6] (рис. 3).
Микроскопия на одиночных молекулах
В отличие от STED-микроскопии, концепция, разрабатывавшаяся двумя другими лауреатами премии 2014 года — Эриком Бетцигом и Уильямом Мернером, — основана на регистрации флуоресцентного сигнала от одиночных молекул с последующим совмещением в единое изображение. Вообще говоря, это серьезное достижение — увидеть отдельную молекулу, ведь в стандартных физико-химических методах (спектроскопия, флуоресценция и т.д.) ученые получают усредненный сигнал от примерно миллиардов миллиардов молекул. Тем весомее результат Уильяма Мернера, который еще в 1989 году впервые добился этого [7].
В 1997 году Мернер перешел на работу в Университет Калифорнии в Сан-Диего (США), где будущий нобелевский лауреат Роджер Тсин [1] работал с флуоресцентными белками (ФБ), пытаясь расширить их спектр от исходного зеленого до полной радуги. Мернер присоединился к исследованиям и обнаружил, что флуоресценция некоторых из этих белков является фотоуправляемой — при освещении ФБ светом определенной длины волны флуоресценция «выключалась», а после использования исходного света — восстанавливалась. «Растащив» молекулы ФБ в геле, чтобы они гарантированно располагались там по одному (с расстоянием между молекулами больше 0,2 мкм), он продемонстрировал регистрацию и управление одиночными молекулами, что стало весьма впечатляющим достижением [8].
Эта технология стала тем, чего так не хватало Эрику Бетцигу.
Одержимость дифракционным барьером
Бетциг в начале 1990-х работал в исследовательском центре Bell Labs в Нью-Джерси (США), занимаясь микроскопией ближнего поля, которая, с одной стороны, дает разрешение лучшее, чем обычная оптическая микроскопия, а с другой — накладывает слишком строгие ограничения на образец и вообще обладает массой недостатков.
Несмотря на то, что поэзия зрелых исканий тогда уже требовала от Бетцига смены обстановки исследовательской лаборатории на что-нибудь более динамичное, он, как и другие персонажи этой истории, был буквально одержим идеей преодоления дифракционного барьера. И вот, перед тем как в 1995 году все-таки бросить исследования на долгие годы, Бетциг публикует свои соображения об одновременном использовании флуоресцентных меток нескольких цветов и совмещении получающихся изображений для увеличения разрешения метода [9].
...Прошло 10 лет. Карьера в бизнесе так и не принесла Бетцигу успокоения и не освободила его от мыслей о дифракционном барьере. И вот наконец он наткнулся на идею флуоресцентных белков, которые могут пометить любые клеточные компоненты, а также управляться светом. Ключевой идеей, которой ему не хватило за десятилетие до того, стало то, что не нужны метки разных цветов. Нужны просто метки, активирующиеся в разные моменты времени (рис. 4)!
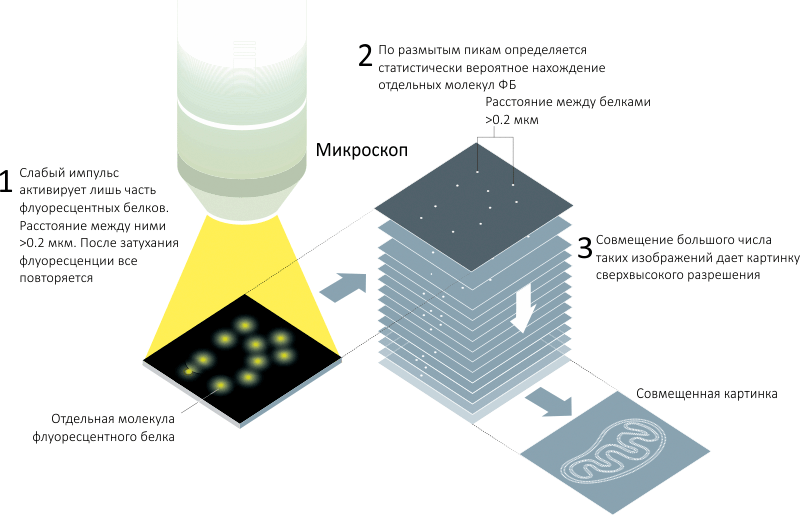
Рисунок 4. Одномолекулярная микроскопия. Высокое разрешение достигается за счет регистрации положения части флуоресцентных меток, после чего, повторив измерение много раз, можно восстановить полную картину и достичь высокого (субдифракционного) разрешения.
Всего через год была опубликована работа, ставшая завершающей в этом нобелевском цикле [10]. Новый принцип, названный PALM-микроскопией (Photoactivated localization microscopy), был использован для получения детальной картины мембраны лизосомы, меченной флуоресцентным белком (рис. 5). Принцип состоит в том, чтобы вследствие использования слабого возбуждающего импульса лишь часть молекул ФБ активировалась и начинала светиться, причем чтобы статистически эти молекулы оказывались на расстоянии, большем дифракционного предела. Регистрируемая при этом картина состоит из редких светящихся точек, но зато про каждую известно, что это отдельная молекула, что многократно повышает разрешение. Спустя какое-то время свечение проходит, и новый импульс активирует уже другой набор молекул ФБ. Накопление и совмещение достаточно большого количества таких кадров позволяет провести очень качественную реконструкцию, эффективное разрешение которой существенно превышает ограничение, наложенное дифракционным пределом.
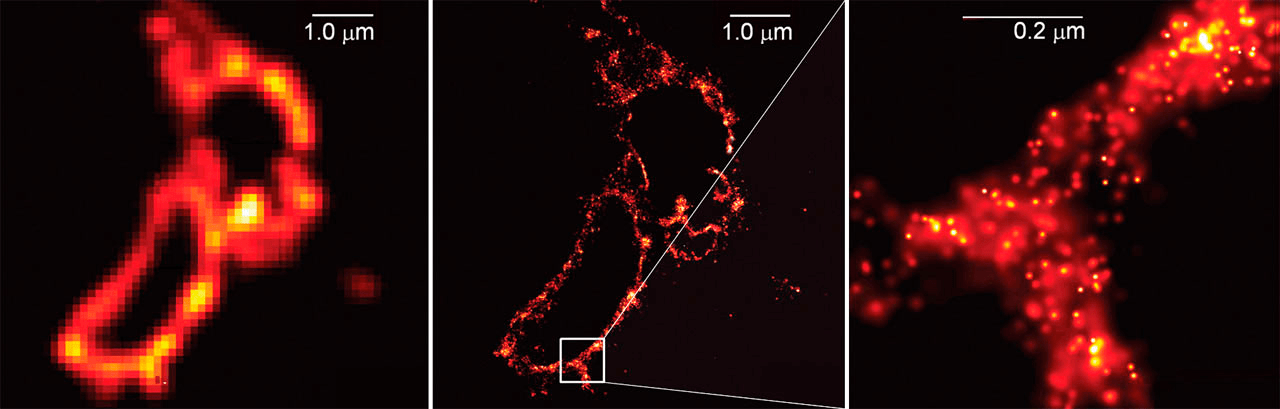
Рисунок 5. Изображение в центре (мембрана лизосом) стало одним из первых, снятых при помощи одномолекулярной микроскопии. Справа: увеличенный фрагмент на субдифракционном масштабе. Слева: изображение, сделанное в «обычной» микроскопии.
На службе биологии
Все трое ученых продолжают активно заниматься исследованиями. Штефан Хелль устремил взор внутрь нервных клеток, чтобы понять детальное устройство синапсов [11]. Уильям Мернер занимается аномальными белками болезни Хантингтона. Эрик Бетциг следит за делением клеток в развивающихся эмбрионах. Созданные лауреатами методики, по праву получившие название «наноскопия», продолжают активно использоваться учеными в лабораториях всего мира. Вот как комментирует вручение Нобелевской премии Алексей Пахомов, научный сотрудник группы химии хромопротеинов Института биоорганической химии (ИБХ) РАН:
Субдифракционная микроскопия позволяет на порядок повысить разрешение флуоресцентных микроскопов с нескольких сотен до нескольких десятков нанометров. Часто эту технологию так и называют — микроскопия суперразрешения.
Интересно, что с момента появления первых суперразрешающих микроскопов до вручения Нобелевской премии прошло не так много времени: первые экземпляры появились всего около 10 лет назад. Это тот редкий случай, когда очевидность пользы изобретения быстро становится понятной даже для Нобелевского комитета :-). К примеру, Нобелевский лауреат по химии 2008 г., О. Шимомура, открывший зеленый флуоресцентный белок (GFP) [1], опубликовал свое открытие в начале 1960-х гг.
Отдельно хочется отметить вклад российских ученых в развитие этой технологии. Использование флуоресцентных белков для получения субдифракционных изображений живых клеток методом PALM (разработка Бетцига [10]) стало возможным благодаря явлению фотоактивации, открытому в лаборатории С.А. Лукьянова ИБХ РАН [12].
В заключение хочется обозначить надежду, что прогресс в области субдифракционной микроскопии не остановится после вручения Нобелевской премии, как это произошло, к примеру, в случае премии за GFP ;-).
Написано по мотивам пресс-релиза Нобелевского комитета [13].
Литература
- Флуоресцирующая Нобелевская премия по химии;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Stefan W. Hell, Jan Wichmann. (1994). Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett.. 19, 780;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Липидный фундамент жизни;
- T. A. Klar, S. Jakobs, M. Dyba, A. Egner, S. W. Hell. (2000). Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proceedings of the National Academy of Sciences. 97, 8206-8210;
- W. E. Moerner, L. Kador. (1989). Optical detection and spectroscopy of single molecules in a solid. Phys. Rev. Lett.. 62, 2535-2538;
- Robert M. Dickson, Andrew B. Cubitt, Roger Y. Tsien, W. E. Moerner. (1997). On/off blinking and switching behaviour of single molecules of green fluorescent protein. Nature. 388, 355-358;
- E. Betzig. (1995). Proposed method for molecular optical imaging. Opt. Lett.. 20, 237;
- E. Betzig, G. H. Patterson, R. Sougrat, O. W. Lindwasser, S. Olenych, et. al.. (2006). Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313, 1642-1645;
- В полном объеме: синаптические везикулы в трехмерной модели синапса;
- Konstantin A. Lukyanov, Dmitry M. Chudakov, Sergey Lukyanov, Vladislav V. Verkhusha. (2005). Photoactivatable fluorescent proteins. Nat Rev Mol Cell Biol. 6, 885-890;
- The Nobel Prize in Chemistry 2014. (2014). The Nobel Prize.






