
Электронно-лучевое повреждение в микроскопии: Pro et contra
09 ноября 2014
Электронно-лучевое повреждение в микроскопии: Pro et contra
- 505
- 0
- 0
«Закипание» капсидов бактериофагов под действием пучка электронов происходит из-за появления в замороженном образце газообразного водорода
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В электронном микроскопе формирование изображений осуществляется с помощью электронов, что обеспечивает высокое разрешение из-за их короткой длины волны. В то же время, взаимодействие пучка электронов с электронами образца вызывает электронно-лучевое повреждение препарата. В статье рассказывается, как исследователи борются с электронно-лучевым повреждением в электронной микроскопии, а также приводятся некоторые неожиданные применения этого феномена для целей структурной биологии.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.

Рисунок 1. Лауреат Нобелевской премии 1986 г. Эрнст Руска
К середине 20-х гг. XX века было хорошо известно, что электромагнитное излучение обладает корпускулярными свойствами, т.е. ведет себя как поток частиц. В 1924 г. французский физик Луи де Бройль высказал гипотезу о том, что частицы, в свою очередь, обладают волновыми свойствами. Де Бройль вычислил, что чем больше энергия электрона, тем короче должна быть длина его волны. Например, электрон с энергией 100 килоэлектронвольт (КэВ) имеет длину волны около 0,1 Å, или около одной десятой диаметра атома.
Экспериментаторы стали подумывать о постройке микроскопа, в котором вместо света использовались бы электроны. Первым физиком, которому это удалось, был немец Эрнст Руска (рис. 1). В конце 20-х годов XX века Э. Руска открыл, что магнитная катушка может действовать как линза для электронов. Кроме того, ему удалось построить магнитные линзы с таким коротким фокусным расстоянием, что их можно было использовать для получения изображения объекта, облучаемого электронами. Таким образом, начала свое существование трансмиссионная (просвечивающая) электронная микроскопия (ПЭМ) — метод получения увеличенных изображений электроннопрозрачных объектов с целью исследования их внутренней микро- и ультраструктуры.
Формирование изображений с помощью электронов обеспечивает высокое разрешение из-за их короткой длины волны. В то же время, взаимодействие пучка электронов с электронами образца вызывает электронно-лучевое повреждение препарата. Характер взаимодействия электронов с образцом зависит от энергии электронов и состава образца [1]. Некоторые электроны проходят через образец без каких-либо взаимодействий, другие отклоняются электростатическим полем ядра, экранированным внешними орбитальными электронами атомов образца, а некоторые электроны могут сталкиваться с атомными ядрами, отклоняясь под большим углом или даже претерпевая обратное рассеяние. Некоторые из взаимодействующих электронов рассеиваются без потери энергии (упругое рассеяние), а другие передают часть своей энергии образцу (неупругое рассеяние) (рис. 2).
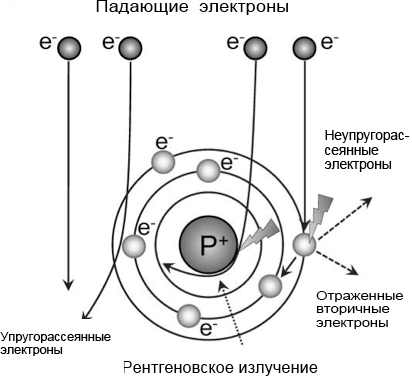
Рисунок 2. Траектории электронов, взаимодействующих с веществом образца
При упругих взаимодействиях кинетическая энергия падающего пучка электронов остается неизменной. Только незначительная часть упругих взаимодействий может повреждать образец, выбивая (knock-on) атомы со своих мест [2]. Большинство лучевых повреждений вызываются неупругими взаимодействиями, когда падающий пучок электронов передает часть своей энергии образцу. Вероятность этих взаимодействий (несущих информацию упругих и повреждающих неупругих) обратно пропорциональна величине ускоряющего напряжения катода [3]. То есть, при увеличении ускоряющего напряжения, необходимо увеличивать и время выдержки.
Рассмотрим аргументы за и против (Pro et Contra) электронно-лучевого повреждения. Начнем с подходов, применяемых экспериментаторами для уменьшения негативных последствий.
Contra
Переданная электронами энергия может ионизировать атомы в образце, вызывать рентгеновское излучение, перегруппировки химических связей и образование свободных радикалов или приводить к рассеиванию вторичных электронов. Все это изменяет структуру образца и приводит к искажению данных. Для минимизации электронно-лучевого повреждения существуют следующие подходы.
1. Уменьшение экспозиции и время облучения образца
Типичные значения электронной экспозиции, используемые для биологических образцов — 1–20 e−/Å2·сек. Хотя биологические образцы могут выдерживать воздействие 100–500 e−/Å2 (в зависимости от образца), его химического состава и температуры, детали, требующие высокого разрешения, претерпевают изменения уже при экспозициях от 10 e−/Å2 и менее [4]. Таким образом, радиационное повреждение определяет условия эксперимента и ограничивает разрешение получаемых биологических структур.
2. Снижение дозы при фокусировке пучка
Во-вторых, для снижения радиационного повреждения во время выбора зоны, выравнивания и фокусировки пучка электронов применяются специальные системы «низкой дозы», чтобы блокировать луч до последнего шага — получения изображения [5]. Однако малые выдержки приводят к потере разрешения, шумным изображениям и, как следствие, к недостатку данных, что очень усложняет последующий процесс обработки изображений для определения трехмерной структуры объекта. Для таких коротких выдержек становится критически важной способность детектора воспринимать каждый попавший на него электрон.
Используемые в микроскопии энергии электронов в сотни кэВ значительно превышают энергии ковалентных связей в биологических образцах (порядка нескольких эВ). Наибольшие повреждения наносятся образцу, когда падающие электроны теряют от ~5–100 эВ своей энергии (в среднем ~20 эВ) [6]. Переданная энергия по большей части возбуждает валентные электроны (которые образуют ковалентные связи), разрывает связи, вызывает появление свободных радикалов и эмиссию вторичных электронов. Этот процесс называется первичным повреждением. Свободные радикалы, в свою очередь, запускают каскад реакций, именуемый вторичным повреждением.
3. Заморозка образца (криомикроскопия)
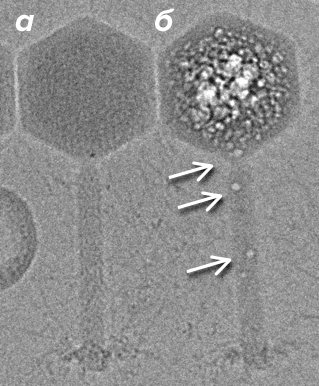
Рисунок 3. Электронно-лучевое повреждение образца в криомикроскопии. а — Бактериофаг EL, замороженный в витрифицированном льду; б — Идентичный бактериофаг после облучения высокой дозой электронов. Заметны пузыри газообразного водорода (стрелки).
Для сохранения структуры образца в 80-е годы XX века была впервые применена крио-микроскопия, позволяющая изучать объекты путем помещения их в моментально замороженный тонкий (около 0,5 нм) слой воды [7], «аморфный лед» (рис. 3а). Важно при этом не допустить образования так называемого кубического льда. Кубический лед представляет собой кристаллическую воду, которая адсорбирует электроны и не дает возможности идентифицировать образец. Кроме этого, растущие ледяные кристаллы разрушают мембраны клеток и макромолекулы.
Разрыв химических связей происходит при любых температурах, следовательно, охлаждение не влияет на первичное повреждение образца. Однако охлаждение замедляет движение молекул, т.е. тормозит вторичное повреждение [8]. Таким образом, низкие температуры позволяют улучшить разрешение в диапазоне от 20 до 60 Å; однако для более высокого разрешения это правило не действует [9]. Как показывает практика, использовать в эксперименте температуры ниже температуры жидкого азота не имеет смысла, т.к. в этом случае меняется качество льда и быстро падает контраст [4], [10], [11].
Третичное повреждение белков происходит от появления в образце газовых пузырей, «кипения» (рис. 3б). «Закипание» под действием электронного пучка [7] происходит из-за появления в замороженном образце газообразного водорода [12]. При этом происходит следующая реакция:
H2O → H·+OH·
В толще льда эти радикалы объединяются обратно в H2O, однако вблизи белковых молекул радикалы, возникшие при радиолизе воды под воздействием электронов, вступают в реакцию с атомами водорода:
OH· + R-H → RO· + H2
Образование пузырей предпочтительно происходит на поверхности молекулы, соприкасающейся со льдом, нежели внутри белка [2]. Газ образуется в таких количествах, что давление внутри пузыря может достигать 103 атм [12].
4. Обработка изображений
С развитием детекторов электронов и разработкой устройств с возможностью прямой детекции электронов (direct detectors), появился новый способ минимизировать электронно-лучевые повреждения образца. Устройства с прямой детекцией электронов позволяют получить за секундную выдержку от 16 до 400 кадров. Благодаря специальной процедуре обработки можно выровнять и сложить изображения одной и той же белковой частицы со всех полученных кадров (рис. 4б). Таким образом, компенсируется движение частиц во льду, происходящее за время длительной выдержки [13]. При такой методике получения изображений, помимо вызываемого пучком электронов сдвига частиц, можно корректировать и эффекты лучевого повреждения. Для этого из всего набора полученных за время выдержки изображений для дальнейших расчетов берут несколько первых, суммарное время экспозиции которых мало [14]. Комбинация этих двух подходов позволила в последние 2–3 года существенно улучшить разрешение получаемых трехмерных реконструкций до 3–4 Å [14].
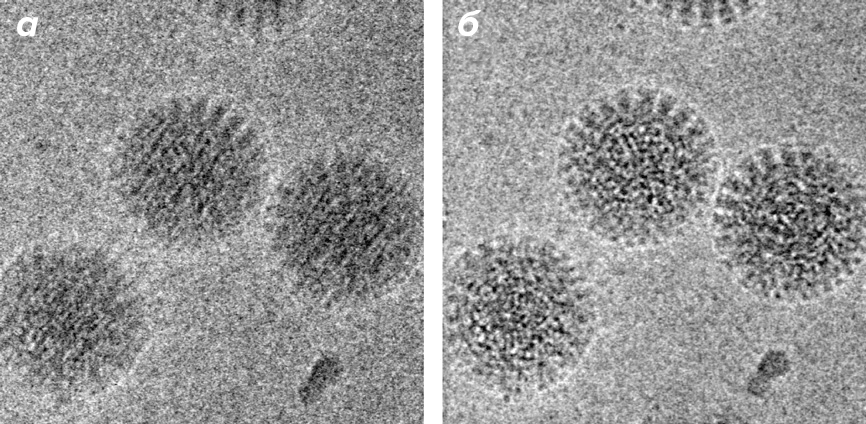
Рисунок 4. Коррекция позволяет получить крио-изображения вирусов с высокой четкостью. а — Суммарное изображение 60 кадров с ротавирусом DLPs без коррекции; б — После коррекции сдвига и поворота.
Остатки цистеина, аспартата и глутамата наиболее чувствительны к лучевому повреждению (рис. 5). Некоторые из дисульфидных связей в белке повреждаются уже при электронной дозе в 5 e−/Å2 и при ускоряющем напряжении 1 МэВ. Каталитические центры ферментов также подвержены повреждениям, т.к. находятся в конформациях с измененной геометрией белка, которая дестабилизирует структуру аминокислот [15].
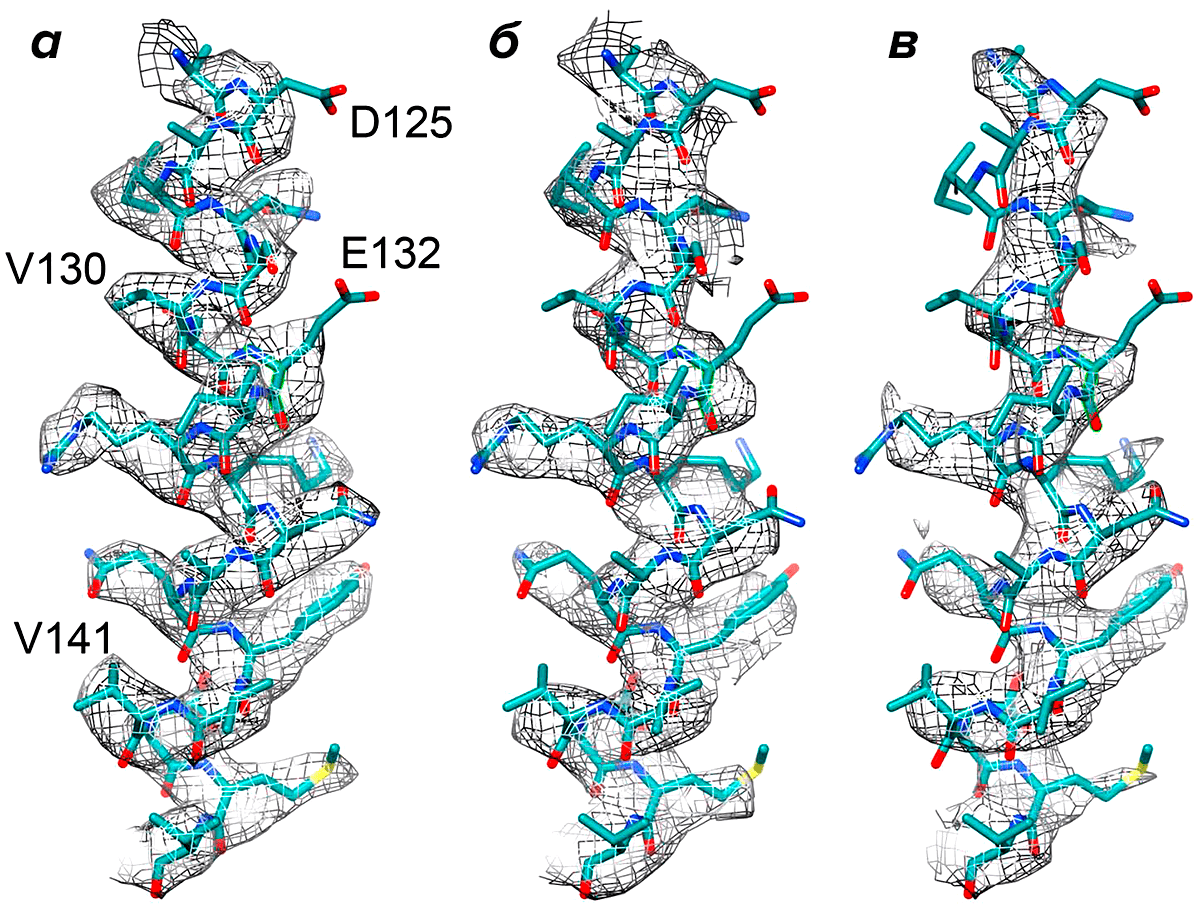
Рисунок 5. Влияние лучевого повреждения на разрешение трехмерной реконструкции белковой молекулы. Реконструкция 124–144 а.к. α-спирали F420 гидрогеназы, рассчитанная с (а) низкой дозой электронов (разрешение 3,36 Å), (б) увеличенной дозой ~24 e−/Å2 (разрешение 3,94 Å), (в) высокой дозой ~49 e−/Å2 (разрешение 4,16 Å). Боковые цепи а.к. Asp125 и Glu132 подверглись повреждению уже при первом облучении.
Pro
Интересно отметить то, что, помимо вышеописанного негативного влияния на электронно-микроскопические изображения, в некоторых случаях лучевые повреждения могут предоставить необходимую структурную информацию. Так, было замечено, что белок, окруженный ДНК, начинает «вскипать» быстрее, чем тот, который расположен в контакте со льдом [16–18]. При этом сама ДНК не кипит и не образует пузырей при получении тех же самых доз электронов. Такое раннее «кипение» может быть связано с тем, что ДНК нарушает диффузию продуктов радиолиза от места их образования, что приводит к их быстрому накоплению и раннему образованию пузырей [17]. В ситуациях, когда белок неразличим на фоне окружающей его ДНК, образование пузырей, имеющих гораздо меньшую плотность и хорошо видимых на изображениях, позволяет судить о наличии и размерах расположенных внутри белковых частиц.
Такие картины наблюдались при изучении строения бактериофагов [16–18]. Гигантские phiKZ-подобные бактериофаги имеют в капсиде белковое «внутреннее тело», вокруг которого плотно упакована ДНК вируса [19]. Ученые заметили, что если сделать пару снимков одной и той же вирусной частицы: с низкой (~10–20 e−/Å2) и с высокой (~40–60 e−/Å2) дозой электронов, то на втором изображении частица начинает «вскипать» в месте, где располагается внутреннее тело (рис. 6б). При этом на первом изображении (рис. 6а) частицы выглядят неповрежденными, и внутреннее тело незаметно на фоне окружающей его ДНК. Линейные размеры объема, в котором происходит вскипание, позволяют реконструировать приблизительные размеры и расположение внутреннего тела [18]. После этого можно рассчитать трехмерную реконструкцию неповрежденных фагов, используя распределение пузырей на изображениях с высокой дозой для точного определения расположения внутреннего тела [16].
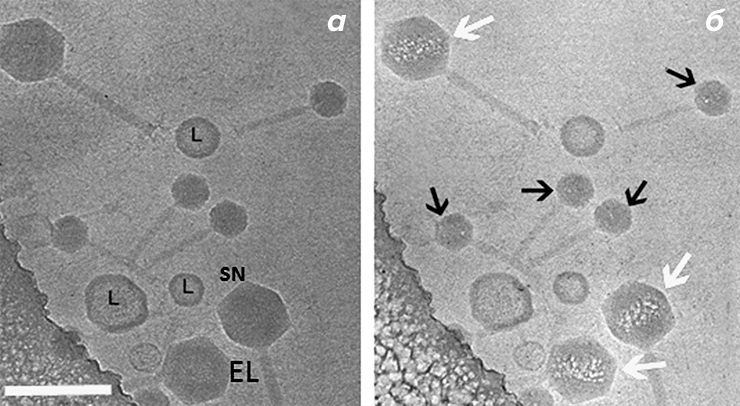
Рисунок 6. Визуализация внутреннего тела в капсиде бактериофага EL с помощью облучения высокой дозой электронов. а — Изображение смеси фагов EL (большие частицы) и фагов SN (малые частицы), снятое в режиме низкой дозы электронов (10–20 e−/Å2). б — То же поле зрения после дополнительной экспозиции (доза ~40–60 e−/Å2). Белые стрелки указывают на закипание в области внутреннего тела в фагах EL. Фаги SN, не имеющие внутреннего тела, начинают гореть в вершинах капсида (черные стрелки). L — липосомы. Масштабный отрезок — 250 нм.
Еще один бактериофаг, внутреннюю структуру которого изучали с помощью высоких доз — T7 [17]. Авторы подробно изучили процесс зарождения пузырьков при облучении фаговых частиц и показали, что «кипение» начинается только после накопления критической концентрации продуктов радиолиза. Мощность дозы электронов влияет на возникновение пузырьков, и ее необходимо оценивать заранее для минимизации повреждения.
Другим параметром, который необходимо учитывать, является температура. Диффузия продуктов радиолиза от места их образования идет медленнее при более низких температурах (жидкий гелий имеет температуру около −270 °C). Это может привести к накоплению продуктов радиолиза и более раннему электронно-лучевому повреждению, по сравнению с замораживанием при температуре жидкого азота (−196 °С). Подобные повреждения наблюдались ранее при томографических экспериментах [11].
Заключение
Таким образом, электронно-лучевое повреждение с одной стороны, накладывает ограничения на разрешение, получаемое при исследовании биологических образцов в крио-электронном просвечивающем микроскопе. С другой стороны, развитие приборной базы позволяет получать изображения, содержащие информацию о все более и более мелких деталях структуры. Благодаря появлению новых подходов к обработке изображений стало возможным зло обратить в благо — использовать лучевое повреждение для локализации объекта и уточнения его трехмерной структуры.
Литература
- Karl-Joseph Hanszen. (2018). The Optical Transfer Theory of the Electron Microscope: Fundamental Principles and Applications ✶ ✶Reprinted from Advances in Optical and Electron Microscopy 4 (1971) 1–84. This work has been supported by Public Health Service Grant No. GM 11852-5.. Advances in Imaging and Electron Physics. 251-341;
- Ben Hankamer, Robert Glaeser, Henning Stahlberg. (2007). Electron crystallography of membrane proteins. Journal of Structural Biology. 160, 263-264;
- Richard Henderson. (1995). The potential and limitations of neutrons, electrons and X-rays for atomic resolution microscopy of unstained biological molecules. Quart. Rev. Biophys.. 28, 171-193;
- Elizabeth R. Wright, Cristina V. Iancu, William F. Tivol, Grant J. Jensen. (2006). Observations on the behavior of vitreous ice at ∼82 and∼12K. Journal of Structural Biology. 153, 241-252;
- Wah Chiu, Robert M. Glaeser. (1975). Single atom image contrast: conventional dark-field and bright-field electron microscopy. Journal of Microscopy. 103, 33-54;
- John P. Langmore, Michael F. Smith. (1992). Quantitative energy-filtered electron microscopy of biological molecules in ice. Ultramicroscopy. 46, 349-373;
- Jacques Dubochet, Marc Adrian, Jiin-Ju Chang, Jean-Claude Homo, Jean Lepault, et. al.. (1988). Cryo-electron microscopy of vitrified specimens. Quart. Rev. Biophys.. 21, 129-228;
- R. Henderson, J.M. Baldwin, T.A. Ceska, F. Zemlin, E. Beckmann, K.H. Downing. (1990). Model for the structure of bacteriorhodopsin based on high-resolution electron cryo-microscopy. Journal of Molecular Biology. 213, 899-929;
- Benjamin E. Bammes, Joanita Jakana, Michael F. Schmid, Wah Chiu. (2010). Radiation damage effects at four specimen temperatures from 4 to 100K. Journal of Structural Biology. 169, 331-341;
- Luis R. Comolli, Kenneth H. Downing. (2005). Dose tolerance at helium and nitrogen temperatures for whole cell electron tomography. Journal of Structural Biology. 152, 149-156;
- Cristina V. Iancu, Elizabeth R. Wright, J. Bernard Heymann, Grant J. Jensen. (2006). A comparison of liquid nitrogen and liquid helium as cryogens for electron cryotomography. Journal of Structural Biology. 153, 231-240;
- Richard D. Leapman, Songquan Sun. (1995). Cryo-electron energy loss spectroscopy: observations on vitrified hydrated specimens and radiation damage. Ultramicroscopy. 59, 71-79;
- Xiao-chen Bai, Israel S Fernandez, Greg McMullan, Sjors HW Scheres. (2013). Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2;
- Matteo Allegretti, Deryck J Mills, Greg McMullan, Werner Kühlbrandt, Janet Vonck. (2014). Atomic model of the F420-reducing [NiFe] hydrogenase by electron cryo-microscopy using a direct electron detector. eLife. 3;
- M. Weik, R. B. G. Ravelli, G. Kryger, S. McSweeney, M. L. Raves, et. al.. (2000). Specific chemical and structural damage to proteins produced by synchrotron radiation. Proceedings of the National Academy of Sciences. 97, 623-628;
- W. Wu, J. A. Thomas, N. Cheng, L. W. Black, A. C. Steven. (2012). Bubblegrams Reveal the Inner Body of Bacteriophage KZ. Science. 335, 182-182;
- Naiqian Cheng, Weimin Wu, Norman R. Watts, Alasdair C. Steven. (2014). Exploiting radiation damage to map proteins in nucleoprotein complexes: The internal structure of bacteriophage T7. Journal of Structural Biology. 185, 250-256;
- O.S. Sokolova, O.V. Shaburova, E.V. Pechnikova, A.K. Shaytan, S.V. Krylov, et. al.. (2014). Genome packaging in EL and Lin68, two giant phiKZ-like bacteriophages of P. aeruginosa. Virology. 468-470, 472-478;
- V. N. Krylov, T. A. Smirnova, I. B. Minenkova, T. G. Plotnikova, I. Z. Zhazikov, E. A. Khrenova. (1984). Pseudomonas bacteriophage contains an inner body in its capsid. Can. J. Microbiol.. 30, 758-762;
- Elena V. Orlova, Helen R. Saibil. (2010). Methods for Three-Dimensional Reconstruction of Heterogeneous Assemblies. Methods in Enzymology. 321-341;
- Axel F. Brilot, James Z. Chen, Anchi Cheng, Junhua Pan, Stephen C. Harrison, et. al.. (2012). Beam-induced motion of vitrified specimen on holey carbon film. Journal of Structural Biology. 177, 630-637.








