Эндометрий как альтернативный источник стволовых клеток
01 ноября 2011
Эндометрий как альтернативный источник стволовых клеток
- 2529
- 0
- 3
Поверхность эндометрия женщины. SEM-съёмка.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В настоящее время мы стоим на пороге широкого (если не повсеместного) применения клеточных технологий в клинической практике. В связи с этим очень актуальным представляется поиск новых доступных источников стволовых клеток.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Стволовые клетки уже занимают свое место в современной клинической практике. Существуют отработанные схемы по выделению субпопуляций стволовых клеток, их культивированию и даже коррекции их дифференцировки в заданном направлении. Но этих достижений недостаточно для реализации всех надежд, которые возлагаются на клеточные технологии.
Ни один из существующих на данный момент источников стволовых клеток человека или методов их получения не может полностью обеспечить потребности исследователей и требования клиницистов . Использование эмбриональных стволовых клеток кроме лавины вопросов этического характера несет с собой высокий риск онкологических осложнений. Получение же взрослых стволовых клеток (син.: региональные стволовые клетки, соматические стволовые клетки), лишенных перечисленных недостатков, ассоциировано с применением инвазивных, травмирующих, болезненных для донора (зачастую не без риска осложнений) и, что немало важно, дорогостоящих процедур. Все это, безусловно, ограничивает экспериментальные исследования стволовых клеток человека и тормозит внедрение клеточных технологий в клиническую практику.
Рекомендуется ознакомиться с другими статьями по стволовым клеткам: «Щадящие стволовые клетки» [17], «Была клетка простая, стала стволовая» [18], «Снежный ком проблем с плюрипотентностью» [19]. — Ред.
В данной статье предлагается рассмотреть возможность использования эндометрия в качестве источника стволовых клеток.
Стволовые клетки — основа функционирования женской репродуктивной системы
Основой нормального функционирования женской репродуктивной системы является высокий регенеративный потенциал ее тканей. Полностью десквамированный функциональный слой эндометрия быстро и полноценно восстанавливается de novo каждый менструальный цикл на протяжении всего репродуктивного периода (в среднем, женщина переживает около 400 менструаций в течение жизни). Сложная гистоструктура эндометрия и относительно «сжатые» сроки женского менструального цикла предъявляют строгие требования к процессам миграции, пролиферации и дифференцировки клеток (рис. 1). Менструация — не единственный момент для реализации регенеративных сил женской репродуктивной системы. Беременность невозможна без развития гиперплазии во всех тканях репродуктивной системы женщины. В послеродовом периоде процессы репарации поврежденных тканей также являются ведущими.
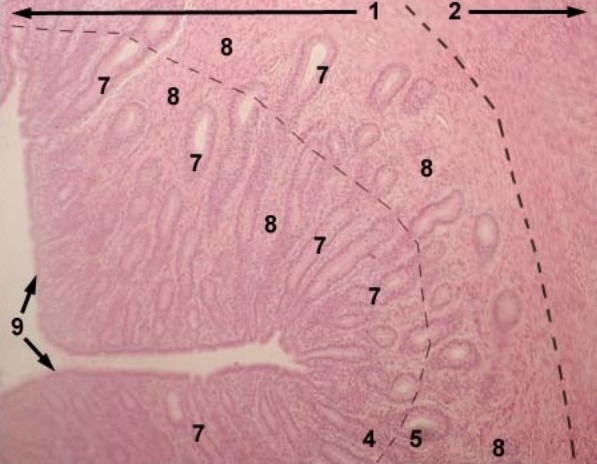
Рисунок 1. Гистологическая картина матки. 1 — слизистая оболочка (эндометрий); 2 — мышечная оболочка (миометрий); 4 — функциональный слой эндометрия; 5 — базальный слой эндометрия; 6 — кровеносные сосуды; 7 — железы эндометрия; 8 — строма эндометрия; 9 — эпителий эндометрия.
«Атлас микрофотографий» А.Г. Гунина
Концепция существования пула прогениторных клеток в ткани эндометрия существовала давно [1], но прямых доказательств наличия в эндометрии клеток, обеспечивающих циклическую регенерацию слизистой матки, до недавнего времени не было. В 2004 году исследовательская команда во главе с R.W. Chan обнаружила присутствие в ткани эндометрия небольшого количества эпителиальных и стромальных клеток, обладающими клоногенными свойствами [2]. Это послужило толчком для более детального изучения прогениторных клеток эндометрия. Описанные клетки по набору экспрессируемых (CD9, CD44, CD73, CD105) и отсутствующих (CD45, CD34, CD19) на их мембране маркерных антигенов были отнесены к клеткам с преобладанием свойств мезенхимальных стволовых клеток. Иммуногистохимическим методом была определена их локализация: параваскулярно в базальном слое эндометрия на границе с миометрием. Была выявлена их роль в воспроизведении стромальных и эпителиальных клеток близлежащих участков эндометрия и доказана относительная безучастность к регулирующему действию стероидных гормонов. Подобные клетки были также обнаружены в эндометрии женщин в постменопаузе и у женщин, принимающих оральные контрацептивы [3].
Необходимость проведения инвазивных процедур для получения ткани эндометрия притормозило изучение стволовых клеток этой локализации до 2007 года, когда X. Meng с соавт. опубликовали статью с описанием клеток со стволовыми свойствами, обнаруженными в клеточной фракции менструальной крови. Эти клетки проявляли мультипотентный рост, способность развиваться в клетки тканей-производных трех зародышевых листков. В 2008 году группа A.N. Pate, изолировав из менструальной крови клетки, которые обладали клоногенными свойствами и способностью дифференцироваться в производные мезо- и эктодермы, описали экспрессируемые ими, кроме остальных прочих, маркеры Oct 3/4, SSEA-4 и c-kit (CD-117). Эти поверхностные белки более характерны для эмбриональных стволовых клеток и определяют плюрипотентыные наклонности стволовых клеток эндометрия.
Сравнительная характеристика стволовых клеток эндометриального происхождения
Стволовые клетки эндометрия представляют собой неоднородный пул прогениторных клеток, которые обладают всеми свойствами, необходимыми для признания их плюрипотентными. Доказана их способность к образованию клеточных колоний в культуральной среде, самообновлению и самоподдержанию этих колоний. Определена важнейшая с практических позиций их способность дифференцироваться в различные производные экто- и мезодермы. Описан комплекс специфических маркеров, соответствующий стандартному набору поверхностных белков мезенхимальных стволовых клеток.
Более того, ряд характеристик клеток-предшественниц эндометрия выгодно отличает их от стволовых клеток иного происхождения.
Источник данного вида прогениторных клеток является, несомненно, легкодоступным. Получение менструальной ткани для выделения стволовых клеток не сопряжено с травмирующими процедурами для донора, может осуществляться неоднократно от одного донора. Исключены какие-либо осложнения, связанные с забором материала. Также технология получения стволовых клеток из менструальной ткани требует минимальных финансовых затрат.
Немаловажным аспектом для выбора оптимального источника стволовых клеток является количество искомых клеток на единицу ткани. Выделение стволовых клеток из прочих постнатальных тканей усложняется крайне низким их содержанием (менее тысячной доли процента в случае пуповинной крови на сроке доношенной беременности). В ткани же эндометрия до 0,22% эпителиальных клеток и до 1,25% стромальных клеток обладают клоногенным потенциалом [2].
Многими исследователями отмечена более высокая скорость пролиферации стволовых клеток эндометриального происхождения без уменьшения продолжительности жизни колонии за счет повышенной теломеразной активности [4–6].
Очевидно преимущество стволовых клеток эндометриального происхождения перед эмбриональными стволовыми клетками — при отсутствии несоответствия этическим и законодательным нормам применение взрослых стволовых клеток, несомненно, обладает меньшим онкогенным потенциалом. Другой положительной стороной использования взрослых стволовых клеток является возможность аутотрансплантации клеточных продуктов, полученных на их основе, что полностью решает иммунологические вопросы, которые всегда сопровождают терапию стволовыми клетками. Кроме того, существуют данные о способности мезенхимальных стволовых клеток, свойствами которых обладают и эндометриальные стволовые клетки, оказывать антипролиферативное, противовоспалительное и иммуномодулирующее действие [7–9].
Самым привлекательным свойством эндометриальных стволовых клеток является их пластичность. Доказана их способность развиваться в хондрогенном, адипогенном, остеогенном, кардиогенном, нейрогенном направлениях in vitro под действием стимулов среды (рис. 2). Не все исследователи согласны со способностью соматических стволовых клеток изменять свою специализацию и дифференцироваться в производные других зародышевых листков. Для практического использования этого качества стволовых клеток не так уж и важно, подвергаются ли клетки истиной трансдифференцировке под действием факторов микроокружения или это «превращение» происходит из-за неоднородности культуры стволовых клеток или слияния стволовой и зрелой клеток. Так или иначе — это свойство эндометриальных стволовых клеток выгодно выделяет их среди других стволовых клеток [4], [5], [10], [11].
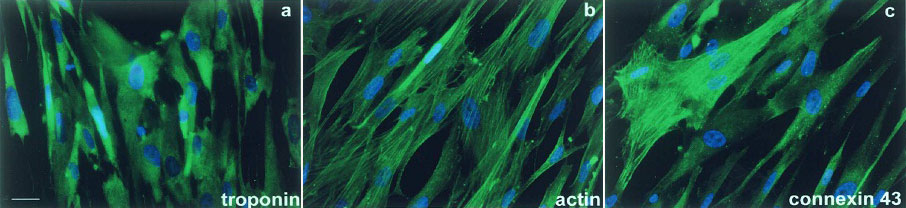
Рисунок 2. Дифференцировка мезенхимальных стволовых клеток эндометриального происхождения в кардиомиоциты. Иммуноцитохимическим методом обнаружены маркеры кардиомиоцитов — тропонин, актин и коннексин 43.
Способы получения ткани эндометрия
На начальных этапах изучения эндометриальных клеток, обладающих регенеративным потенциалом, клетки выделялись из тканей, полученных в ходе радикальных оперативных вмешательств, чаще — удаления матки. Также описаны следующие инвазивные манипуляции с целью получения клеточного материала: диагностическое выскабливание полости матки, выскабливание полости матки в I триместре беременности (децидуальная ткань также содержит искомые клетки), штрих-биопсия эндометрия, пайпель-биопсия.
Операция выскабливания полости матки неприемлема в качестве метода получения стволовых клеток. Эта операция производится по определенным клиническим показаниям зачастую у пациенток, неподготовленных для процедуры донорства; материал, полученный в ходе выскабливания полости матки необходим для уточнения или подтверждения диагноза, контроля эффективности терапии и юридически является собственностью пациентки. Не стоит уточнять, что все инвазивные манипуляции являются небезразличными для пациенток, их нельзя применять для получения материала в программах кадрового донорства. Современным аналогом диагностического выскабливания полости матки является биопсия эндометрия — менее травматичная для пациентки процедура, не требующая обезболивания. Преимущества получения стволовых клеток из менструальной крови (менструальная ткань многокомпонентного состава) описаны ранее. Забор материала может осуществляться пациенткой как самостоятельно (использование менструальной чашечки), так и посредством простых манипуляций, осуществляемых на гинекологическом приеме [5]. Но и этот источник стволовых клеток не лишен недостатков. Менструальная кровь является контаминированым субстратом, т.к. нижние отделы женской репродуктивной системы плотно заселены резидентными микроорганизмами. В связи с этим для культивирования клеток, полученных из менструальной крови необходимы специальные среды с добавлением антибиотика. Тем не менее, выделение клеток из менструальной крови является наиболее перспективным методом получения эндометриальных прогениторных клеток.
Эндометриальные стволовые клетки за пределами пробирки
Существует ряд работ с использованием столовых клеток эндометрия в эксперименте и клинической практике. На данный момент большинство экспериментальных исследований базируется на ангиогенном и трофическом действии мезенхимальных стволовых клеток эндометриального происхождения. Способность этих клеток к трансдифференцировке до полноценных в функциональном плане клеток in vivo доказательной базы еще не имеет.
В исследованиях на животных и человеке, посвященных безопасности использования данного вида мезенхимальных стволовых клеток, осложнений и побочных действий выявлено не было [12–14].
Эффекты эндометриальных стволовых клеток были изучены на экспериментальных моделях следующих патологических состояний: инфаркт миокарда, инсульт, критическая ишемия конечностей, болезнь Паркинсона [10], [12], [14–16]. Во всех работах отмечено развитие менее выраженных патологических изменений органов, более быстрое развитие репаративных процессов. Все эти данные позволили использовать клеточные продукты на основе стволовых клеток эндометрия в комплексной терапии у пациентов с рассеянным склерозом. В течение года последующего наблюдения ни развития осложнений, ни прогрессирования основного заболевания выявлено не было [13].
Перспективы
Стволовые клетки эндометриального происхождения имеют большой потенциал для использования с целью изучения свойств стволовых клеток, поиска новых факторов, определяющих дифференцировку прогениторных клеток, применения генно-инженерных технологий для реализации требуемых клеточных свойств. Перспективно также их использование в клинической практике для терапии различных заболеваний, возможно, неизлечимых прежде.
Высокая потребность в данном виде клеток может потребовать организации программ донорства менструальной ткани, банков криоконсервированных стволовых клеток эндометриального происхождения. Возможность аутодонорства может послужить стимулом для женщин репродуктивного возраста для участия в подобного рода программах.
Литература
- HELEN A. PADYKULA. (1991). Regeneration in the Primate Uterus: The Role of Stem Cells. Ann NY Acad Sci. 622, 47-56;
- Rachel W.S. Chan, Kjiana E. Schwab, Caroline E. Gargett. (2004). Clonogenicity of Human Endometrial Epithelial and Stromal Cells1. Biology of Reproduction. 70, 1738-1750;
- Kjiana Elkje Schwab, Rachel Wah Shan Chan, Caroline Eve Gargett. (2005). Putative stem cell activity of human endometrial epithelial and stromal cells during the menstrual cycle. Fertility and Sterility. 84, 1124-1130;
- Amit N. Patel, Eulsoon Park, Michael Kuzman, Federico Benetti, Francisco J. Silva, Julie G. Allickson. (2008). Multipotent Menstrual Blood Stromal Stem Cells: Isolation, Characterization, and Differentiation. Cell Transplant. 17, 303-311;
- Xiaolong Meng, Thomas E Ichim, Jie Zhong, Andrea Rogers, Zhenglian Yin, et. al.. (2007). Endometrial regenerative cells: A novel stem cell population. J Transl Med. 5;
- Caroline E. Gargett, Kjiana E. Schwab, Rachel M. Zillwood, Hong P.T. Nguyen, Di Wu. (2009). Isolation and Culture of Epithelial Progenitors and Mesenchymal Stem Cells from Human Endometrium1. Biology of Reproduction. 80, 1136-1145;
- Elena Klyushnenkova, Joseph D Mosca, Valentina Zernetkina, Manas K Majumdar, Kirstin J Beggs, et. al.. (2005). T cell responses to allogeneic human mesenchymal stem cells: immunogenicity, tolerance, and suppression. J Biomed Sci. 12, 47-57;
- Katarina Le Blanc, Charlotte Tammik, Kerstin Rosendahl, Eva Zetterberg, Olle Ringdén. (2003). HLA expression and immunologic propertiesof differentiated and undifferentiated mesenchymal stem cells. Experimental Hematology. 31, 890-896;
- K. Le Blanc. (2006). Mesenchymal stromal cells: tissue repair and immune modulation. Cytotherapy. 8, 559-561;
- Naoko Hida, Nobuhiro Nishiyama, Shunichiro Miyoshi, Shinichiro Kira, Kaoru Segawa, et. al.. (2008). Novel Cardiac Precursor-Like Cells from Human Menstrual Blood-Derived Mesenchymal Cells. Stem Cells. 26, 1695-1704;
- Jian Lin, Dennis Xiang, Jin-long Zhang, Julie Allickson, Charlie Xiang. (2011). Plasticity of human menstrual blood stem cells derived from the endometrium. J. Zhejiang Univ. Sci. B. 12, 372-380;
- Julie G. Allickson. (2011). Recent Studies Assessing the Proliferative Capability of a Novel Adult Stem Cell Identified in Menstrual Blood. TOSCJ. 3, 4-10;
- Zhaohui Zhong, Amit N Patel, Thomas E Ichim, Neil H Riordan, Hao Wang, et. al.. (2009). Feasibility investigation of allogeneic endometrial regenerative cells. Journal of Translational Medicine. 7, 15;
- Michael P Murphy, Hao Wang, Amit N Patel, Suman Kambhampati, Niren Angle, et. al.. (2008). Allogeneic endometrial regenerative cells: An "Off the shelf solution" for critical limb ischemia?. Journal of Translational Medicine. 6, 45;
- Erin F. Wolff, Xiao-Bing Gao, Katherine V. Yao, Zane B. Andrews, Hongling Du, et. al.. (2011). Endometrial stem cell transplantation restores dopamine production in a Parkinson’s disease model. Journal of Cellular and Molecular Medicine. 15, 747-755;
- Cesar V. Borlongan, Yuji Kaneko, Mina Maki, Seong-Jin Yu, Mohammed Ali, et. al.. (2010). Menstrual Blood Cells Display Stem Cell–Like Phenotypic Markers and Exert Neuroprotection Following Transplantation in Experimental Stroke. Stem Cells and Development. 19, 439-452;
- Щадящие стволовые клетки;
- Была клетка простая, стала стволовая;
- Снежный ком проблем с плюрипотентностью.