
Эпилепсия, методы ее лечения и роль вальпроевой кислоты в терапии заболевания
04 ноября 2013
Эпилепсия, методы ее лечения и роль вальпроевой кислоты в терапии заболевания
- 17964
- 3
- 6
Как лечить эпилепсию — задача по сей день нерешенная.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Эпилепсия — одно из широко распространенных нервных заболеваний, характеризующееся прежде всего возникновением судорог. Ее терапия включает в себя длительный (часто пожизненный) прием противоэпилептических препаратов (ПэП). До 40% страдающих от эпилепсии — женщины детородного возраста. Для матерей-эпилептиков особенно опасным является то, что им приходится принимать ПэП в больших дозах во время беременности. Прием ПэП-медикаментов (например вальпроата) может приводить к нарушениям развития эмбриона — т.н. фетальный вальпроатный синдром, который приводит к структурным дефектам почти всех систем организма, отставанию в развитии и к умственной неполноценности.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Эпилепсия и ее терапия

Рисунок 1. Генри Перш: Исцеление женщины с падучей болезнью в последовательной серии изображений, из «Книги деяний Святого Луи», 15-й век.
сайт epilepsiemuseum.de
Эпилепсия является патологией, известной человечеству еще в древности (падучая болезнь — одно из первых названий этого недуга; лечили ее изгнанием бесов из тела жертвы — говорят, некоторым помогало; рис. 1). Она может затрагивать сенсорные, моторные, вегетативные функции, память, поведение, эмоциональный статус, восприятие, речь, поведение. Само определение болезни вызывало споры на протяжении долгого времени, пока, наконец, в 2005 г. Международная лига борьбы с эпилепсией не утвердила следующие постулаты:
- Эпилепсия является общим названием для целой группы заболеваний, отражающих последствия дисфункции мозга.
- Эпилепсия — это мозговое расстройство, характеризующееся стойкой предрасположенностью к возникновению припадков и их нейробиологическими, когнитивными, психологическими и социальными последствиями.
- Эпилептический припадок — это кратковременное проявление признаков и/или симптомов, относящихся к аномально чрезмерной или синхронной нейрональной активности мозга.
- Для постановки диагноза требуется хотя бы один эпилептический припадок.
Сегодня около 2% людей во всем мире страдают от эпилепсии, что характеризует ее как одно из самых распространенных неврологических заболеваний. Если не вдаваться в подробности, то возникновение эпилептического припадка вызывается дисбалансом тормозной (основной медиатор — γ-аминомасляная кислота, ГАМК) и возбуждающей (основной медиатор — глутамат) систем головного мозга [8]. Перед припадком действие глутамата намного пересиливает действие ГАМК в какой-либо области мозга, и нейроны этой области начинают генерировать электрические импульсы не разрозненно, как это происходит обычно, а синхронно. Возникает т.н. эпилептический очаг, где клетки разряжаются одновременно. На электроэнцефалограмме (ЭЭГ) можно наблюдать ужасающую картину (рис. 2).

Рисунок 2. Сравнение электроэнцефалограмм здорового пациента и пациента с ювенильными миоклоническими судорогами (одной из форм наследственной эпилепсии, проявляющейся в пубертате).
Прием лекарств является в настоящее время первой и самой важной частью лечения эпилепсии. Обычно рекомендуется начинать с монотерапии противоэпилептическими препаратами (ПэП), что позволяет подавитьприкадки или хотя бы минимизировать частоту приступов у 50–70% пациентов. Для лечения пациентов, которым монотерапия не помогает, используется политерапия, т.е. сочетание нескольких антиконвульсантов. Среди часто используемых ПэП можно назвать вальпроевую кислоту, вигобатрин, тиагабин, ламотриджин, окскарбамозепин, фельбамат, топирамат, габапентин, леветирацетам, зонисамид, прегабалин. Если же медикаментозное лечение не помогает и в этом случае, то используют крайние меры: хирургическое иссечение эпилептогенного очага, кетогенную диету и глубокую вагусную стимуляцию мозга [16], [19].
Для многих ПэП сначала было показано их антиконвульсаторное (т.е., препятствующее возникновению припадка) действие, а затем уже начали выяснять конкретный механизм, по которому препарат предотвращает развитие припадка. Например, лекарство может влиять на работу потенциал-чувствительных ионных каналов и не давать клетке возможность генерировать потенциал действия; может усиливать влияния ГАМК-ергичекой системы, вызывать ослабление влияния глутаматергической системы через рецепторы медиатора, может влиять непосредственно на высвобождение медиаторов. Для части лекарств характерно сочетание нескольких вышеприведенных механизмов [8], [16].
Однако одновременно с изучением терапевтической активности препаратов начали выявляться серьезные побочные эффекты, характерные для ПэП. Поэтому лечение в каждом случае должно подбираться индивидуально, с учетом особенностей конкретного пациента. Особую группу риска представляют женщины-эпилептики детородного возраста, потому что для них стоит не только вопрос, как забеременеть (ПэП изменяют обмен веществ организма и его гормональный фон), но и как сохранить здоровье будущему ребенку — ведь все ПэП тератогенны, т.е. вызывают у ребенка и физические, и умственные дефекты.
Вальпроевая кислота
Одним из самых широко применяемых и изученных препаратов для лечения эпилепсии является вальпроевая кислота. Она помогает в разных дозах пациентам при практически всех разновидностях судорог, в любом возрасте, и именно ее назначают врачи, когда нужно купировать (заблокировать) припадок у пациента с неизвестной этиологией заболевания.
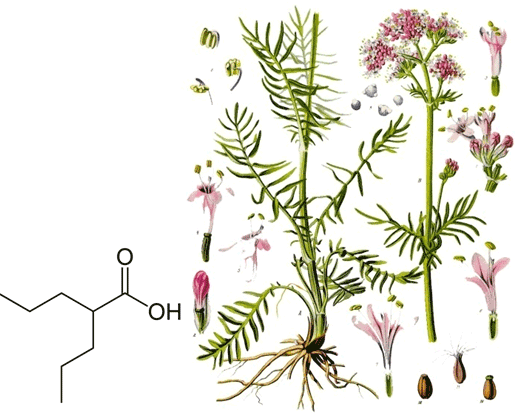
Рисунок 3. Вальпроевая кислота. Слева — химическая структура вальпроевой кислоты. Справа — Валериана лекарственная, из которой ее получают.
Вальпроевая кислота (встречается в литературе как ВПК или анион соли вальпроат) — производное валерьяновой кислоты, получаемой из эфирного масла травянистого растения валерианы лекарственной (Valeriana officinalis). ВПК была открыта в 1882 году Бартоном (B. Burton), но только в 1963 году было обнаружено ее противосудорожное действие. На сегодня, вальпроевую кислоту используют не только в спектре эпилептических заболеваний, но и при лечении биполярных нарушений, старческой деменции, лейкемии, шизофрении, мигрени, депрессиях. Антиэпилептическое действие препарата обычно связывают с тем, что он повышает тормозную активность ГАМК через увеличение ее синтеза и уменьшение деградации. Также показано нейропротекторное действие вальпроата [1], [8]. Известно, что в зоне судорожного очага нейроны повреждаются, но при введении ВПК до припадка или сразу после него, доля погибших клеток намного снижается, и снабжение клеток питательными веществами (нейротрофика) усиливается. (В частности, такое действие наблюдалось в гиппокампе — части головного мозга, ответственной за формирование памяти и ориентировки в пространстве.)
Однако лечение вальпроатом оказывает и непосредственное негативное воздействие на организм пациента-эпилептика, причем, чем выше доза препарата, тем больше обнаруживается нарушений в организме. Если говорить о самых частых проявлениях, то это увеличение массы тела, метаболические осложнения, уменьшение ночной продолжительности сна, панкреатит, острая печеночная недостаточность, коагулопатии, различные реакции гиперчувствительности, энцефалопатия, эмоциональные расстройства, депрессия, нарушения функционирования эндокринной и репродуктивной систем. Последнее особенно отчетливо проявляется у женщин: синдром поликистоза яичников, нарушения фармакокинетики пероральных контрацептивов, нарушения менструального цикла [2], [19]. Кроме того, ВПК затрудняет процесс имплантации эмбриона на начальных стадиях беременности, понижая экспрессию необходимых для этого белков (ламинина, коллагена-IV и виментина) [6]. И именно вальпроевая кислота является самым опасным препаратом для беременных женщин: она легко проникает через плацентарный барьер [3] и вызывает множество необратимых изменений зародыша.
В 1984 году впервые был описан фетальный вальпроатный синдром [4], при котором характерно возникновение мальформаций (структурных дефектов; рис. 4) сердечно-сосудистой и мочеполовой систем, скелета, черт лица; появляются аномалии глаз и центральной нервной системы (самое типичное для вальпроата — незакрытие нервной трубки), респираторного тракта [7], [18]. Само физическое развитие после рождения замедляется: дети меньше весят и медленнее растут, чем их сверстники. Частота таких явлений при монотерапии ВПК в три раза выше по сравнению с монотерапией любым другим ПэП.

Рисунок 4. Мальформации при фетальном вальпроатном синдроме.
Встает вопрос: что же может принести больший вред ребенку? Эпилептический припадок матери во время беременности (а это как минимум резкое уменьшение поступления кислорода в мозг плода, как максимум — его гибель) или лекарственная терапия для предотвращения развития этого припадка? Рассматривая статистику, подсчитанную для людей, на этот вопрос ответить практически невозможно. Поэтому проводят исследования на моделях животных, — в частности, на крысах.
Автор этой статьи взяла четыре группы крыс:
- Контрольная группа.
- Группа, получающая вальпроат натрия внутрибрюшинно в течение всего первого триместра беременности.
- Группа, у которой два раза за первый триместр — до и после имплантации зародыша в стенку матки — вызывались эпилептические припадки классическим химическим конвульсантом пентилентетразолом (ПТЗ), ингибитором постсинаптического торможения нейронов центральной нервной системы.
- Группа, которой вводился как вальпроат натрия каждый день первого триметра, так и дважды вводился ПТЗ (но судороги на фоне ВПК не развивались).
Оказалось, что неблагоприятные исходы беременностей присутствовали во всех группах, кроме контрольной (для группы, получавшей ВПК, — 87,8%; для группы, подвергшейся эпилептическим припадкам вследствие введения ПТЗ, — 50%, для группы, получавшей и ВПК, и ПТЗ, — 100%), однако только у крысят, подвергавшихся только действию ВПК in utero, наблюдалось сильное замедление физического развития (критерии: открытие глаз, набор массы и рост вплоть до взрослого состояния) и увеличение тревожности в поведенческих тестах. Также крысятам уже в выросшем состоянии проводилась МРТ-диагностика, опять же выявившая нарушения в основном в группе, получавшей только вальпроат: на рис. 5 крупные белые пятна на верхней линейке рисунков означают расширение желудочков мозга. Уменьшаются объемы и изменяется клеточная структура многих частей головного мозга:
- таламуса (посредник передачи сенсорных и моторных сигналов в кору головного мозга из низлежащих отделов нервной системы);
- бледного шара и стриатума (это базальные ядра, часть экстрапирамидальной системы, участвуют в планировании и осуществлении движений, влияют на мышечный тонус);
- миндалины (часть лимбической стстемы, отвечает не только за формирование положительных эмоций, но и за чувство страха, агрессии, беспокойства);
- гиппокампа (отвечает за пространственную ориентацию и перезапись информации из кратковременной памяти в долговременную, его объем достоверно уменьшался во всех группах по сравнению с контролем).

Рисунок 5. Томографические срезы мозга двухмесячных крыс, получавших ВПК пренатально в первом триместре (A—D), и крыс из контрольной группы (E—H), режим Т2 RARE. Явственно видны расширения желудочков мозга у опытной группы.
исследование автора статьи
Таким образом, мы можем говорить о том, что пренатальное действие вальпроата может влиять на физическое развитие плода и изменять структуру головного мозга на всю последующую жизнь, затрагивая и моторные функции, и процесс формирования эмоций, и память, и поведение в целом, и это воздействие куда более губительно, чем действие самого припадка.
В других исследованиях обнаружено, что крысята, подвергавшиеся in utero действию ВПК (доза 600–800 мг/кг), меньше весили, их развитие замедлялось, они обладали пониженной болевой чувствительностью и, напротив, повышенной чувствительностью к неболевым стимулам, локомоторной гиперактивностью и стереотипией в сочетании с низкой исследовательской мотивацией, пониженным уровнем социального поведения; у них наблюдалось уменьшенное акустическое преимпульсное ингибирование (т.е. снижение моторной реакции на резкий звук). Обычно такие же нарушения выявляют в патологиях аутизма [12], [14].
Сейчас все активнее исследуют влияние вальпроата не только на животных моделях, но и на людях, изучая статистику отклонений и проводя психологические тесты. Корреляцию между внутриутробным влиянием ВПК и развитием заболеваний спектра аутизма можно считать доказаной: IQ у детей дошкольного и школьного возрастов и склонность с общению ниже нормы, внимание и обучаемость нарушены [11], [15], [17].
Заключение: иметь или не иметь?
Полностью отказаться от использования вальпроевой кислоты в медицине сейчас не представляется возможным. Скорее, наоборот, — открываются всё новые перспективы ее использования (например, рак [2]) и все новые молекулярные мишени (например, действие ВПК на ДНК через ингибирование фермента гистон-деацетилазы, способствующей деконденсации хроматина [2]). Однако очевидно, что необходимо бороться с целым букетом побочных эффектов, которые препарат вызывает. Во-первых, следует более осторожно относиться к самому назначению препарата пациентам, находящимся в «зоне риска» — женщинам, детям и людям пожилого возраста. Во-вторых, исследователи пытаются модифицировать химическую структуру вальпроата с целью уменьшить количество его побочных эффектов и найти менее тератогенные его аналоги. В-третьих, поскольку эффекты ВПК являются дозозависимыми, можно попытаться сократить общую дозу вещества при сохранении нужных эффектов — например, за счет уменьшения количества ВПК, действующего не на мозг (а при внутривенном введении вальпроат через кровоток распределяется по всему организму). Это, например, возможно с помощью адресной доставки вальпроевой кислоты в составе наночастиц или другими современными методами: если помочь препарату эффективно преодолевать гематоэнцефалический барьер, теоретически можно снизить дозу на несколько порядков и обезопасить плод [5].
Но почему же просто не использовать другие ПэП или не создавать новые, когда ясно, на что именно надо действовать? За последние тридцать лет было создано более 15 новых лекарств от эпилепсии. Однако предсказать побочные эффекты при длительном применении, используя классические доклинические модели на животных (с использованием того же пентилентетразола) порой очень трудно. (Как пример можно привести токсическое воздействие при длительном применении фелбамата и вигабатрина.) Также ко многим новым лекарствам вырабатывается привыкание, и пациенту приходится менять лечение (что уже само по себе нехорошо). И, что самое главное, на 20–30% пациентов ПэП нового поколения вообще не действуют [10].
С другой стороны, хотя замены классическим ПэП все еще не создано, именно в последние несколько лет можно смело сказать, что «лед тронулся, господа присяжные заседатели». Обнаружены и изучаются новые молекулярные мишени лекарств и их влияние на воспалительный ответ и иммунную систему, дисфункцию гематоэнцефалического барьера, рецепторы клеточных каналов и систему медиаторов центральной нервной системы (рис. 6).
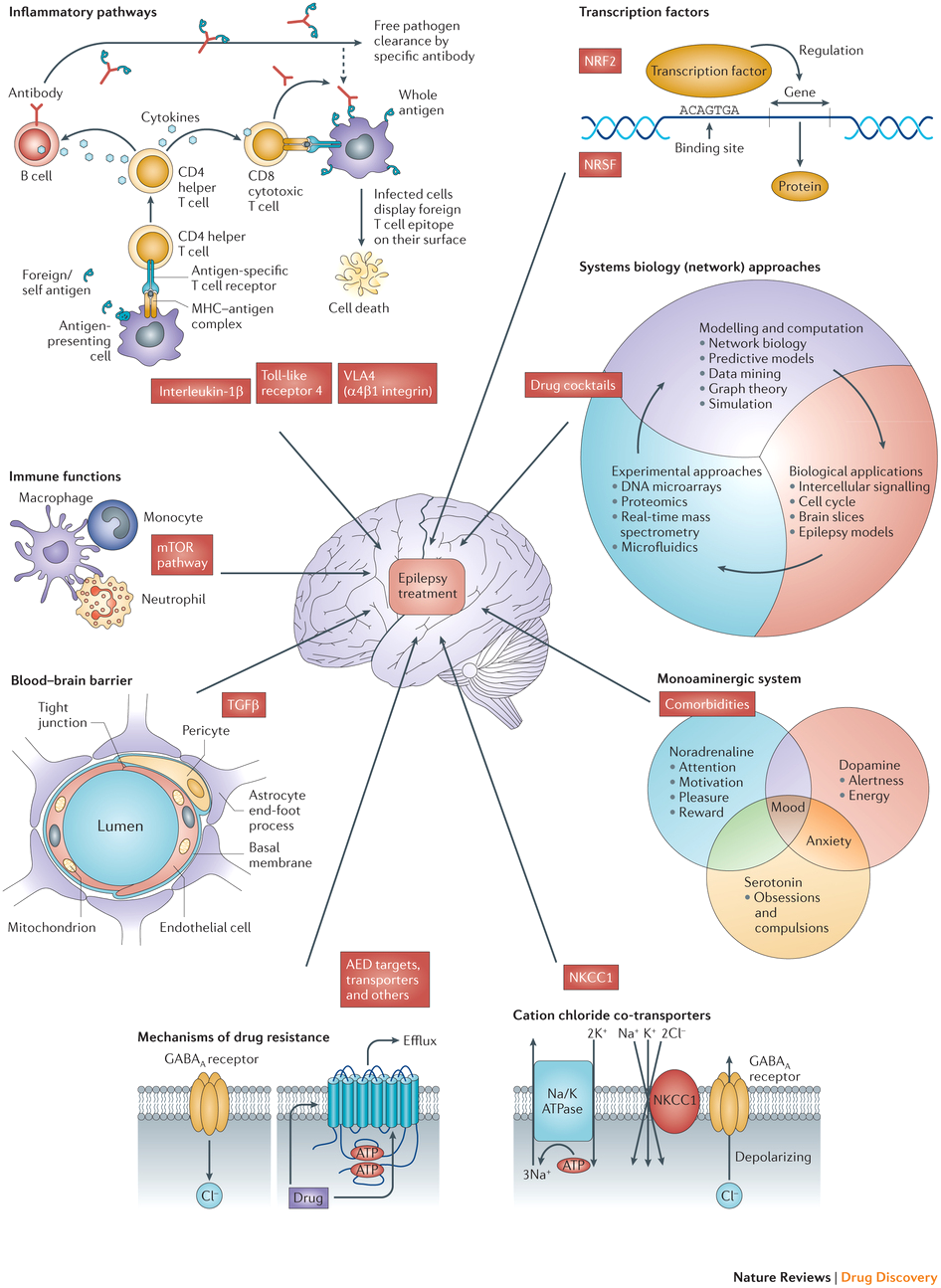
Рисунок 6. Новые молекулярные мишени, являющихся зоной повышенного интереса для будущих исследований эпилепсии.
Удлиняется и корректируется доклиническая часть исследований, и разрабатываются усовершенствованные модели эпилепсии на животных. Часть из новых ПэП уже не дает некоторых побочных эффектов (например, габапентин (Neurontin; Pfizer) или леветицерам (Keppra; UCB Pharma) не вызывают дерматологическую чувствительность). Внимание к проблеме эпилепсии со стороны общества становится все более пристальным, появляется даже спонсирование из частных фондов. Так что, кажется,
О, сколько нам открытий чудных
Готовят просвещенья дух
И опыт, сын ошибок трудных,
И гений, парадоксов друг,
И случай, бог изобретатель.
А.С. Пушкин
Литература
- C BRANDT, A GASTENS, M SUN, M HAUSKNECHT, W LOSCHER. (2006). Treatment with valproate after status epilepticus: Effect on neuronal damage, epileptogenesis, and behavioral alterations in rats. Neuropharmacology. 51, 789-804;
- Sébastien Chateauvieux, Franck Morceau, Mario Dicato, Marc Diederich. (2010). Molecular and Therapeutic Potential and Toxicity of Valproic Acid. Journal of Biomedicine and Biotechnology. 2010, 1-18;
- Dickinson R.G., Lawyer C.H., Kaufman S.N., Lynn R.K., Gerber N., Novy M.J., Cook M.J. (1980). Materno-fetal pharmacokinetics and fetal distribution of valproic acid in a pregnant rhesus monkey. Pediatr. Pharmacol. 1, 71–83;
- John H. DiLiberti, Peter A. Farndon, Nicholas R. Dennis, Cynthia J. R. Curry. (1984). The fetal valproate syndrome. Am. J. Med. Genet.. 19, 473-481;
- Jaleh Varshosaz, Sharareh Eskandari, Mohsen Minaiyan, Majid Tabbakhian. (2011). Brain delivery of valproic acid via intranasal administration of nanostructured lipid carriers: in vivo pharmacodynamic studies using rat electroshock model. IJN. 363;
- Seren Gülşen Gürgen, Deniz Erdoğan, Zafer Kutay Coşkun, Ali Cansu. (2012). The effect of valproic acid and oxcarbazepine on the distribution of adhesion molecules in embryo implantation. Toxicology. 292, 71-77;
- Kini U. (2006). Fetal valproate syndrome: a review. Paediatr. Perinat. Drug Ther. 7, 3;
- Melanie Langer, Claudia Brandt, Christina Zellinger, Wolfgang Löscher. (2011). Therapeutic window of opportunity for the neuroprotective effect of valproate versus the competitive AMPA receptor antagonist NS1209 following status epilepticus in rats. Neuropharmacology. 61, 1033-1047;
- Lason W., Chlebicka M., Rejdak K. (2013). Research advances in basic mechanisms of seizures and antiepileptic drug action. Pharmacol. Rep. 65, 787–801;
- Wolfgang Löscher, Henrik Klitgaard, Roy E. Twyman, Dieter Schmidt. (2013). New avenues for anti-epileptic drug discovery and development. Nat Rev Drug Discov. 12, 757-776;
- Kimford J. Meador, Gus A. Baker, Nancy Browning, Morris J. Cohen, Jill Clayton-Smith, et. al.. (2011). Foetal antiepileptic drug exposure and verbal versus non-verbal abilities at three years of age. Brain. 134, 396-404;
- AD Rasalam, H Hailey, J H G Williams, S J Moore, P D Turnpenny, et. al.. (2007). Characteristics of fetal anticonvulsant syndrome associated autistic disorder. Developmental Medicine & Child Neurology. 47, 551-555;
- Michael A. Rogawski, Wolfgang Löscher. (2004). The neurobiology of antiepileptic drugs. Nat Rev Neurosci. 5, 553-564;
- Tomasz Schneider, Ryszard Przewłocki. (2005). Behavioral Alterations in Rats Prenatally Exposed to Valproic Acid: Animal Model of Autism. Neuropsychopharmacol. 30, 80-89;
- J. Vinten, N. Adab, U. Kini, J. Gorry, J. Gregg, et. al.. (2005). Neuropsychological effects of exposure to anticonvulsant medication in utero. Neurology. 64, 949-954;
- Voronkova K.V., Pylaeva O.A., Kosiakova E.S., Mazal'skaia O.V., Golosnaia G.S., Provatorova M.A. et al. (2010). Modern principles of epilepsy therapy. Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova 110, 24–36;
- Amanda Wood. (2014). Prenatal exposure to sodium valproate is associated with increased risk of childhood autism and autistic spectrum disorder. Evid Based Nurs. 17, 84-84;
- D. F. Wyszynski, M. Nambisan, T. Surve, R. M. Alsdorf, C. R. Smith, et. al.. (2005). Increased rate of major malformations in offspring exposed to valproate during pregnancy. Neurology. 64, 961-965;
- Бурд С.Г., Бадалян О.Л., Чуканова А.С., Авакян, Г.Г., Крикова Е.В. (2008). Современные принципы противоэпилептической терапии взрослых. Лечащий врач 8.






