
Это FACT
08 ноября 2016
Это FACT
- 1434
- 0
- 4
FACT (от англ. facilitates chromatin transcription) — шаперон гистонов, важный для жизни эукариот: от дрожжей до млекопитающих
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Знакомьтесь — это FACT! Фактор с уникальным многообразием функций: способствует экспрессии генов, участвует в клеточном делении, помогает «чинить» геном и, главное, правильно упаковывает ДНК. Да-да, в этом самая суть. FACT одинаково хорош и для дрожжей, и для человека — это шаперон гистонов, который почти не изменился в ходе эволюции. И вот такой многофункциональный и консервативный, на стыке двадцатого и двадцать первого века он заставил ученых предположить существование особого процесса в молекулярной биологии — изменения структуры хроматина без затрат энергии. Итак, в этой статье рассказано про цели и средства белкового комплекса FACT и о том, что нового показали на этот счет в нашем дружном российско-американском коллективе.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2016.

Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Катушки для генома
Наследственная информация эукариот закодирована в молекуле ДНК, которая плотно упакована в ядре клетки. Упаковка эта заключается в том, что ДНК связана с белками-гистонами, которые обеспечивают правильную укладку генома и играют ключевую роль в регуляции его экспрессии. Такой ДНК-белковый комплекс называется хроматином. Повторяющейся единицей хроматина является нуклеосома — «катушка ниток», в которой ДНК-«нитка» совершает примерно два витка вокруг основания из гистонов — «катушки». Структура нуклеосомы была расшифрована Каролин Люгер (рис. 1) с коллегами в 1997 году [1].
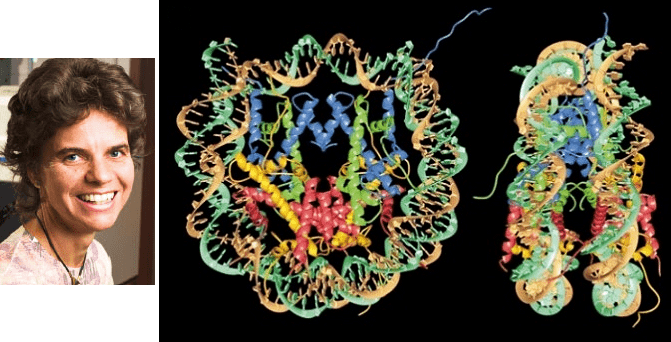
Рисунок 1. Каролин Люгер и расшифрованная ею в 1997 году структура нуклеосомы.
Оказалось, что нуклеосома представляет собой довольно плотный комплекс (рис. 1), практически не изменившийся в ходе эволюции, что лишь подчеркивает его значимость для всего живого [2].
Чем же нуклеосомы заслужили нашу любовь? Ну, они позволяют, во-первых, упаковать огромный геном эукариот в микроскопическое ядро (видео 1), а, во-вторых, управлять им. Белки-гистоны не просто выполняют механическую функцию катушки. Именно они сигнализируют молекулярным машинам клетки, что вот тут, именно в этом месте, находится активный ген. Или, наоборот, неактивный. Или что в данной точке ДНК повреждена, и надо как-то спасать ситуацию. Ну и так далее. Короче говоря, если бы не нуклеосомы, то с геномом была бы полная путаница. И в прямом и в переносном смысле.
Важная роль в образовании правильной структуры хроматина принадлежит шаперонам гистонов. Белки-шапероны укладывают биологические молекулы так, чтобы они могли выполнять свои функции. Шапероны гистонов, в свою очередь, строят нуклеосомы.
Видео 1. Сворачивание ДНК в хромосому
Немного истории
Термин «молекулярный шаперон» впервые использовал в 1978 году Рон Ласкей (рис. 2), профессор эмбриологии из Кембриджского университета, в работе по описанию ядерного белка нуклеоплазмина, предотвращающего агрегацию белков-гистонов с ДНК при образовании нуклеосом [3]. Гистоны содержат множество положительно заряженных аминокислот, которые обладают большим сродством к отрицательно заряженным фосфатным группам в ДНК (рис. 2). Поэтому смешивание гистонов и ДНК in vitro при физиологической концентрации соли ведет к быстрому образованию нерастворимых и неструктурированных агрегатов [4]. Шапероны, участвующие в формировании нуклеосом, несут отрицательный заряд и способны экранировать определенные поверхности гистонов, предотвращая их неспецифическое слипание с ДНК [5].
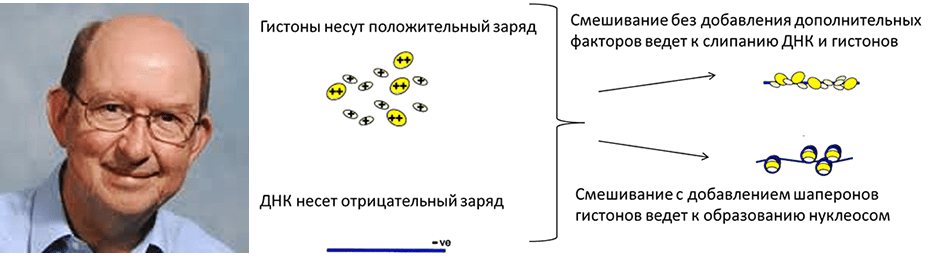
Рисунок 2. Рон Ласкей — ученый, впервые назвавший «молекулярными шаперонами» белки, необходимые гистонам для образования правильной структуры хроматина
FACT — шаперон гистонов с особыми функциями
FACT (от англ. facilitates chromatin transcription) так называется в честь первой функции, которая была для него показана в лаборатории Денни Рейнберга (Danny Reinberg) в конце двадцатого века [6]. А именно, этот фактор облегчал считывание РНК с матрицы ДНК, упакованной в хроматин [7]. Поэтому ему и дали имя, которое переводится как «усиливающий транскрипцию хроматина». На самом деле связь данного белкового комплекса с другим клеточным процессом — с удвоением генома перед делением клетки — была показана еще на год раньше Тимом Формозой (Tim Formosa) в опытах с дрожжами, но зачётно назвать фактор он не сумел, и методы у него были скучные [8], поэтому название осталось за Рейнбергом.
Специфика методов Формозы также не дала ему констатировать 15 лет назад еще одно свойство FACT: оказывается, дрожжевой белковый комплекс может обратимо раскручивать нуклеосому [9] — он берет и разводит витки нуклеосомной ДНК. И ему для этого ничего не нужно, кроме избытка одной из субъединиц . Когда образуется комплекс yFACT—нуклеосома, то катушка практически полностью распрямляется, но все ее составляющие в виде ДНК и гистонов остаются связанными. Если убрать FACT из комплекса, то всё возвращается на круги своя: нуклеосомная ДНК снова наматывается на основание из гистонов. Данная активность шаперона была показана российско-американским коллективом соавторов под руководством профессора медицинского центра Fox Chase Василия Студитского и профессора кафедры биоинженерии МГУ им. Ломоносова Алексея Феованова (и, справедливости ради, если уж перечислять места работы, то Студитский также сотрудник МГУ, а Феофанов — ИБХ РАН).
Считается, что дрожжевой FACT (yFACT) состоит из трех белков: Spt16, Pob3 и Nhp6.
Как именно выглядят раскрученные с помощью FACT нуклеосомы, пока неизвестно (рис. 4). Самым интересным в этом процессе является то, что он не требует затраты АТФ. Ведь чтобы перестроить хроматин, есть специальные машины — АТФ-зависимые комплексы ремоделирования. Они тратят очень много энергии для того, чтобы передвигать гистоновое основание нуклеосомы вдоль ДНК. А FACT может просто развернуть нуклеосомную ДНК. Возможно, такие процессы в клетке экономят энергию в тех случаях, когда хроматин нужно быстро изменить. Например, если требуется активировать какой-либо ген, и структура хроматина соответствующего участка ДНК должна перестроится. Ничего более конкретного пока сказать нельзя — вопрос недостаточно изучен. Однако известно, что FACT участвует в освобождении от нуклеосом промоторов генов при их активации, по-видимому, в сотрудничестве с АТФ-зависимыми факторами ремоделирования хроматина [11]. Поэтому на данный момент раскручивание нуклеосом FACT’ом, скорее, ассоциируется с инициацией транскрипции, чем, например, с элонгацией.
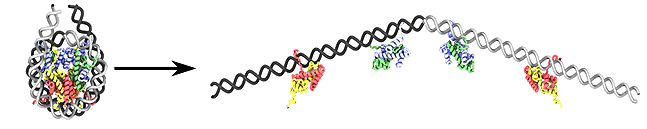
Рисунок 4. Одна из возможных моделей раскручивания нуклеосом белковым комплексом FACT.
Почему FACT важно изучать
Изучать функции белкового комплекса FACT важно не только с научной, но и с медицинской точки зрения. Дело в том, что данного фактора часто очень много в опухолевых тканях. А в нормальных тканях обычно мало [12], [13]. Какую роль он выполняет в активно делящихся клетках? Вероятно, разные. Тем не менее важно понять их все. FACT является мишенью для противоопухолевых препаратов кураксинов, которые сейчас проходят клинические испытания. Эти вещества вызывают перераспределение комплекса в ядре — переводят его из свободного состояния в связанное с хроматином. Как они это делают? Почему это вызывает целый каскад молекулярных процессов, который в итоге приводит к гибели делящихся клеток? С этими вопросами еще предстоит разобраться.
Литература
- Luger K., Mäder A.W., Richmond R.K., Sargent D.F., Richmond T.J. (1997). Crystal structure of the nucleosome core particle at 2.8 Å resolution. Nature. 389, 251–260;
- White C.L., Suto R.K., Luger K. (2001). Structure of the yeast nucleosome core particle reveals fundamental changes in internucleosome interactions. EMBO J. 20, 5207–5218;
- Laskey R.A., Honda B.M., Mills A.D., Finch J.T. (1978). Nucleosomes are assembled by an acidic protein which binds histones and transfers them to DNA. Nature. 275, 416–420;
- D’Arcy S., Martin K.W., Panchenko T., Chen X., Bergeron S., Stargell L.A. et al. (2013). Chaperone Nap1 shields histone surfaces used in a nucleosome and can put H2A-H2B in an unconventional tetrameric form. Mol. Cell. 51, 662–677;
- Tyler J.K. (2002). Chromatin assembly. Cooperation between histone chaperones and ATP-dependent nucleosome remodeling machines. Eur. J. Biochem. FEBS. 269, 2268–2274;
- Orphanides G., LeRoy G., Chang C.H., Luse D.S., Reinberg D. (1998). FACT, a factor that facilitates transcript elongation through nucleosomes. Cell. 92, 105–116;
- Транскрипция в хроматине: как проходить сквозь стены;
- Formosa T., Eriksson P., Wittmeyer J., Ginn J., Yu Y., Stillman D.J. (2001). Spt16-Pob3 and the HMG protein Nhp6 combine to form the nucleosome-binding factor SPN. EMBO J. 20, 3506–3517;
- Valieva M.E., Armeev G.A., Kudryashova K.S., Gerasimova N.S., Shaytan A.K., Kulaeva O.I. et al. (2016). Large-scale ATP-independent nucleosome unfolding by a histone chaperone. Nat. Struct. Mol. Biol. 23, 1111–1116;
- Рулетка для спектроскописта;
- Erkina T.Y. and Erkine A. (2015). ASF1 and the SWI/SNF complex interact functionally during nu-cleosome displacement, while FACT is required for nucleosome reassembly at yeast heat shock gene promoters during sustained stress. Cell Stress Chaperones. 20, 355–369;
- Garcia H., Fleyshman D., Kolesnikova K., Safina A., Commane M., Paszkiewicz G. et al. (2011). Expression of FACT in mammalian tissues suggests its role in maintaining of undifferentiated state of cells. Oncotarget. 2, 783–796;
- Garcia H., Miecznikowski J.C., Safina A., Commane M., Ruusulehto A., Kilpinen S. et al. (2013). Facilitates chromatin transcription complex is an ‘accelerator’ of tumor transformation and potential marker and target of aggressive cancers. Cell Rep. 4, 159–173.






