Фантастические пептиды и где они обитают
23 января 2025
Фантастические пептиды и где они обитают
- 1875
- 0
- 0
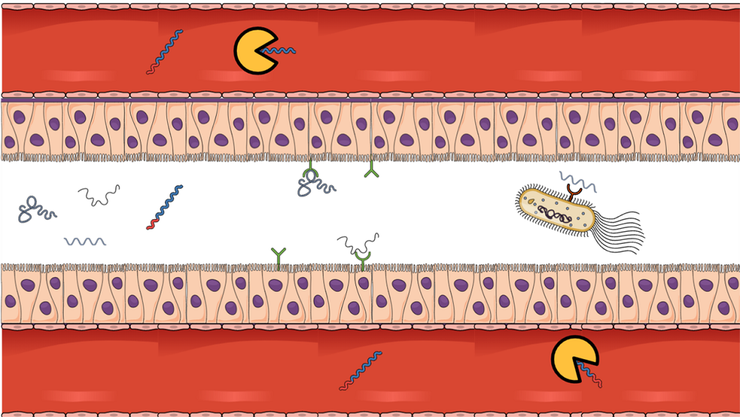
Биологически активные пептиды в поисках компаньона. Оказавшись в кишечнике, биологически активные пептиды могут провзаимодействовать с рецепторами клеток кишечника (энтероциты) или с рецепторами клеток микрофлоры. Иногда пептид проходит сквозь эпителий кишечника, попадает в кровь и начинает свое путешествие по организму. В этом путешествии пептид может встретить фермент и изменить его активность. «Рукопожатия» пептидов с рецепторами или с ферментами могут повлиять на биохимические процессы, происходящие в организме, и изменить физиологическое состояние, например, снизить давление крови.
Рисунок в полном размере.
рисунок автора статьи.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Белковая пища — неотъемлемая часть рациона человека. Задача желудочно-кишечного тракта — разложить белковые молекулы еды сначала до их фрагментов (пептиды), а те — до аминокислот. Аминокислоты из просвета кишечника транспортируются в кровь. Редко, но бывает, что некоторые особенные пептиды могут пройти сквозь эпителий кишечника и оказаться в кровотоке в целости и сохранности. Там, в крови, пептид может найти себе компаньона, например, фермент. Результатом крепкой дружбы пептида и фермента может стать изменение физиологических параметров всего организма, например, снижение давления крови. Другие фантастические пептиды успевают провзаимодействовать с рецепторами клеток эпителия кишечника или с клетками микрофлоры, что тоже может запустить каскад неожиданных биохимических реакций.
Описанные магические пептиды принято называть биологически активными пептидами — чрезвычайная редкость в повседневной пище. Но есть место, где они обитают в большом количестве и разнообразии. Это ферментативные гидролизаты изолятов и концентратов белка.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Изоляты и концентраты белка
На сегодняшний день на Земле проживает более 8 миллиардов человек. Постоянно растущая численность населения приводит к увеличению нагрузки на животноводство, что создает ряд экономических и экологических проблем. В связи с этим делаются попытки вырастить мясо «в пробирке» [1] в промышленном масштабе, однако доступной альтернативой такое мясо пока не назовешь. И здесь на помощь могут прийти растительные источники белка [2]. Основными источниками белка, помимо мяса и рыбы, являются злаковые, бобовые, масличные, корнеплоды, орехи и другие растения. Несмотря на то, что в растительных белках ограничено содержание некоторых аминокислот (в основном метионина, лизина и треонина), растительное сырье имеет высокий потенциал для восполнения дефицита белка в рационе человека [3], [4]. Однако из-за того, что пищеварительной системе человека очень сложно разрушить клеточную стенку растений, биодоступность белка из этого источника снижена. Другая проблема большинства растительных источников — наличие ингибиторов пищеварительных ферментов человека: пепсина, трипсина, химотрипсина, липазы [5–8]. В целом обе проблемы решаются использованием очищенных форм растительного белка: концентраты (>65% белка от сухого вещества) и изоляты (>80%). Технологии производства изолятов и концентратов растительного белка хорошо отработаны и имеют низкую себестоимость по сравнению с производством мяса.
Существует большое разнообразие коммерчески доступных изолятов и концентратов белка, полученных из пшеницы, гороха, картофеля, кукурузы, сои и т.д. Белок сои является одним из самых распространенных в пищевой промышленности по нескольким причинам. Сырье для производства белка — соевые бобы — содержат 35–50% белка (по сухому весу) и низкое содержание жира. Кроме того, соевый белок по составу аминокислот близок к идеальному, лишь метионина в нем немного меньше (состав «идеального белка» предложен ВОЗ в 2007 году).
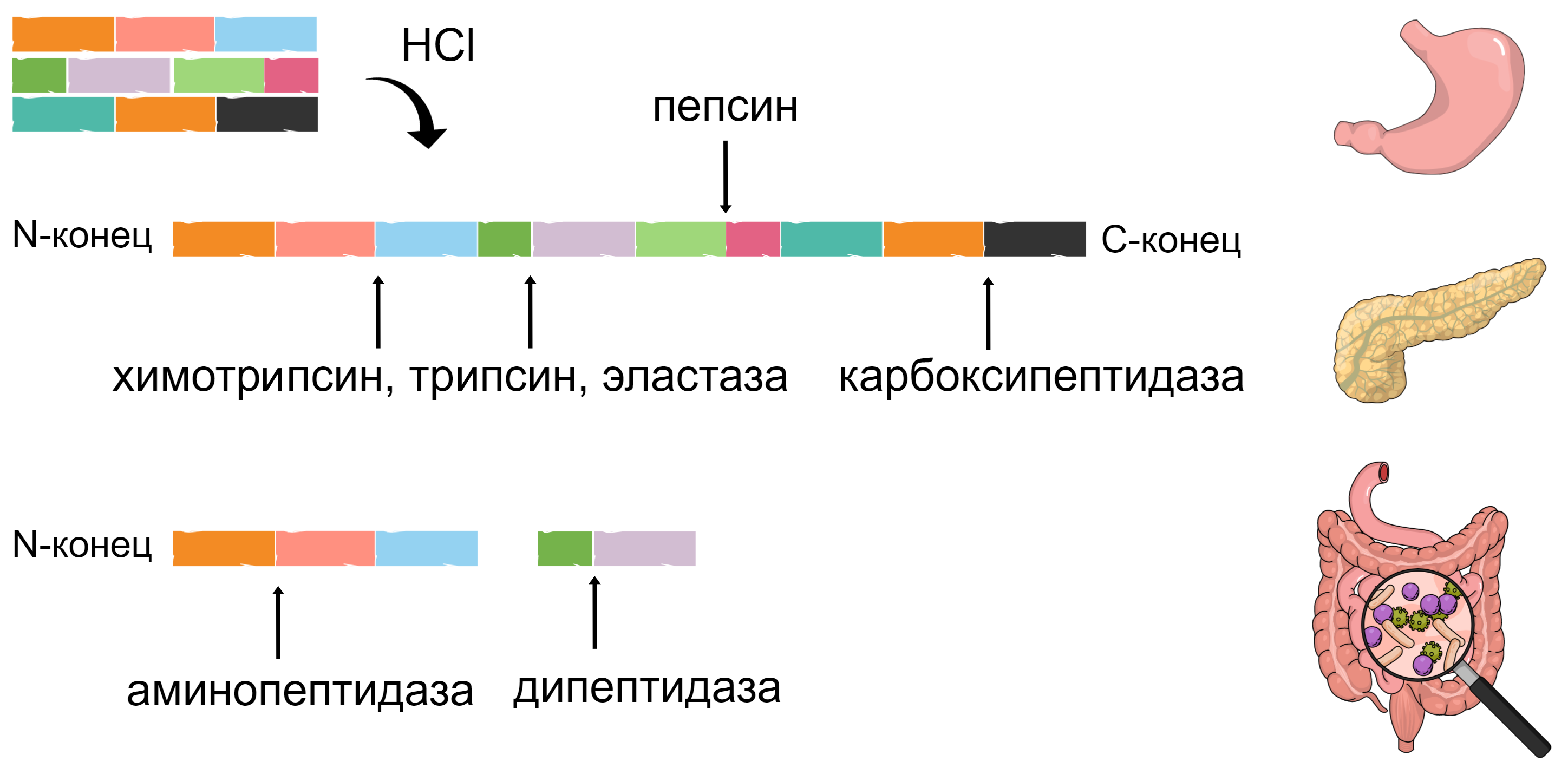
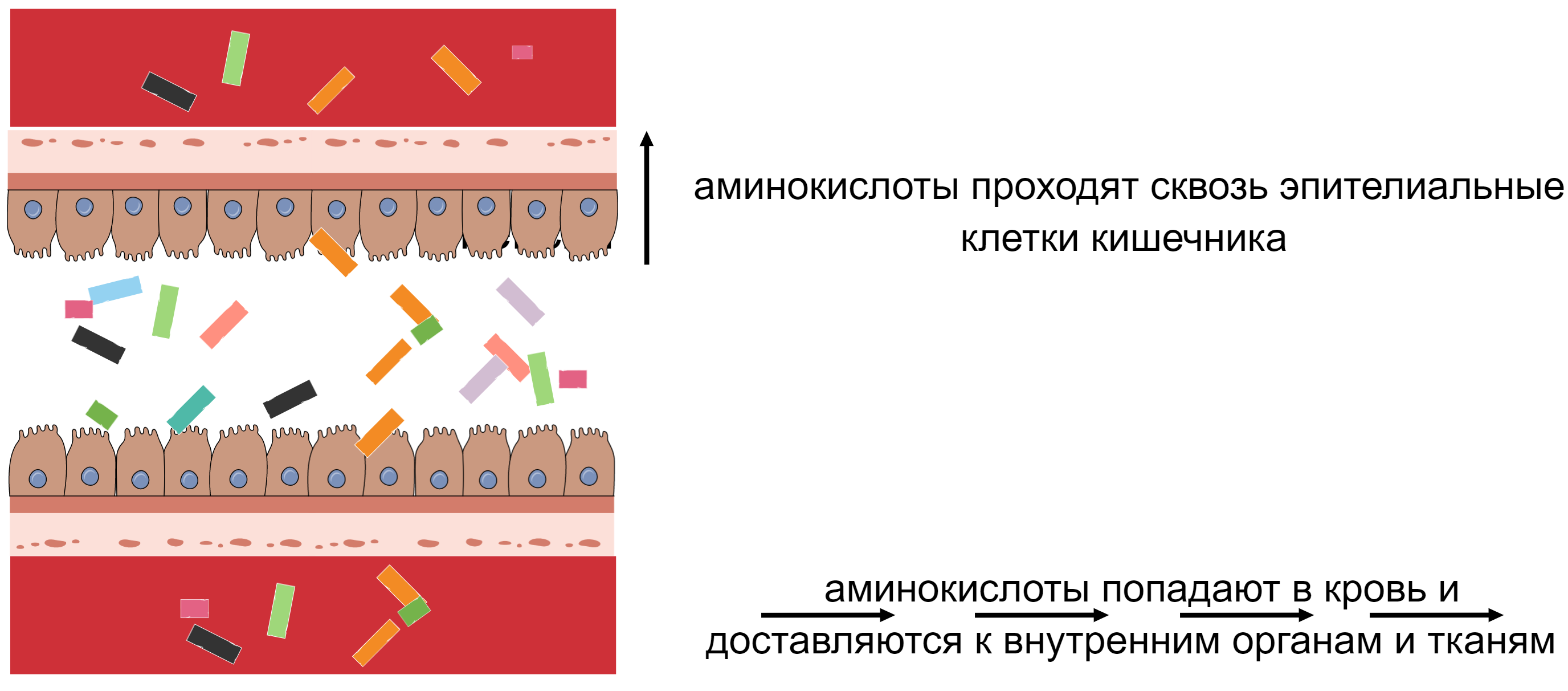
Изоляты и концентраты содержат молекулярную форму белка в том смысле, что молекулы белка находятся в свободной форме — белок не заперт внутри клетки и может быть быстро разобран до аминокислот протеолитическими ферментами пищеварительной системы. Белок расщепляется на пептиды и свободные аминокислоты несколькими протеолитическими ферментами (рис. 1А). Далее аминокислоты, ди- и трипептиды транспортируются из просвета кишечника в энтероциты (клетки эпителия кишечника) специальными транспортерами. Затем внутри энтероцита пептиды расщепляются до аминокислот либо немедленно транспортируются в кровь, где расщепляются до аминокислот (рис. 1Б).
Гидролизаты пищевых белков
Существует два основных способа получения белковых гидролизатов: физико-химический (под действием щелочей и кислот и др.) и биотехнологический (ферментативный и микробиологический) (рис. 2). Ферментативный гидролизат получают с помощью препаратов протеолитических ферментов разного происхождения.
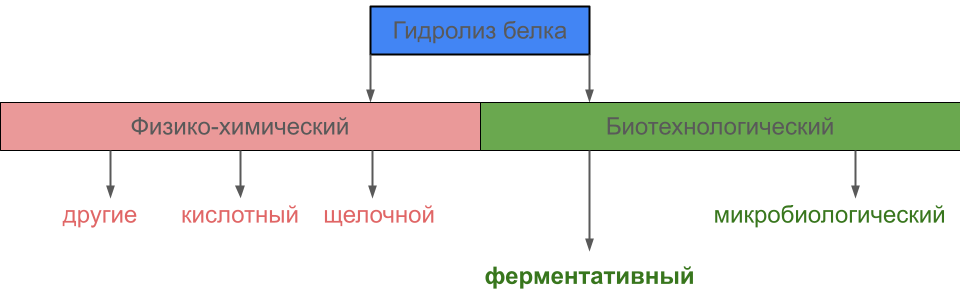
Рисунок 2. Методы гидролиза белка. В промышленности гидролизат получают двумя основными методами: физико-химическим и биотехнологическим. Ферментативный способ считается самым перспективным.
рисунок автора статьи
При щелочном гидролизе снижается содержание аргинина, лизина, цистина, серина, треонина в конечном продукте, также образуются лантионин и лизиноаланин, которые являются потенциально токсичными для организма человека и животных [9]. Таким образом, щелочной гидролиз практически не используют для получения гидролизатов. Более распространенный метод — кислотный гидролиз белка. Чаще всего белок гидролизуют соляной или серной кислотами. При кислотном гидролизе достигается глубокое расщепление белка и исключается возможность бактериального загрязнения гидролизата, однако происходит полное разрушение триптофана [10]. В условиях кислотного гидролиза аминокислоты аспарагин и глутамин превращаются в аспарагиновую и глутаминовую аминокислоты. Кроме того, при нейтрализации кислотных гидролизатов образуется большое количество солей: хлоридов или сульфатов. Поэтому кислотные гидролизаты нуждаются в последующей очистке, что, в свою очередь, усложняет технологию кислотного гидролиза. Ферментативный гидролиз — более щадящий по сравнению с химическим, так как препятствует разрушению в исходном сырье витаминов, углеводов, аминокислот и др. Другим существенным преимуществом большинства протеолитических ферментов является их субстратная специфичность, то есть расщепление происходит только в определенных местах белка. Таким образом, набор получаемых фрагментов белка (пептидов) будет повторяться от партии к партии при производстве гидролизата. При химическом гидролизе расщепление белка происходит случайным образом, что сильно затрудняет контроль количественных и качественных характеристик конечного продукта гидролиза.
Единственным преимуществом применения химического гидролиза мог бы быть полный гидролиз белка до свободных аминокислот. Действительно, конечная задача протеолитических ферментов пищеварительной системы — это разложить белок до составных частей, то есть до аминокислот, которые потом будут доставлены в кровь. Следовательно, можно подумать, что свободные аминокислоты в качестве пищи должны быть максимально легко доступны для усвоения. «Мистическим» оказался факт, что потребление свободных аминокислот в пищу демонстрирует низкую эффективность по сравнению с пептидной формой белка. Например, крысы, которые питались гидролизатом белка, по приросту массы тела обгоняли лабораторных сородичей, которые питались суммой свободных аминокислот [11]. Высокая биодоступность пептидной формы была показана экспериментально еще раз на крысах [12], а позднее и на людях [13]. Этот феномен в дальнейшем был объяснен обнаружением мембранного белка-транспортера PEPT1, способного эффективно переносить ди- и трипептиды из просвета кишечника в энтероцит. PEPT1 оказался не привередливым к последовательности транспортируемого им пептида и намного эффективнее, чем транспортеры свободных аминокислот [14]. Чудеса на этом не закончились — исследования физиологических изменений после употребления в пищу гидролизатов удивили научное сообщество.
Физиологический эффект потребления гидролизатов в пищу
Как известно, часть аминокислот, поступающих из пищи в кровь, участвует в выработке энергии [15], другая часть идет на поддержание синтеза собственного белка, в основном белка мышц. Поэтому первое, что ожидали увидеть от потребления гидролизата в пищу — это увеличение физической выносливости.
Действие гидролизатов белков и пептидов на физическую выносливость широко изучалось на животных в тесте плавания до истощения. Рекордное до сегодняшнего дня увеличение времени плавания лабораторных животных после потребления гидролизата составляло 270% [16]. Исследования на людях (спринтеры) показало, что концентрация треонина, глицина и орнитина в сыворотке крови в группе, потреблявшей гидролизат белка, была выше относительно группы, получавшей исходный белок [17]. Таким образом, увеличение физической выносливости объяснялось быстрым появлением свободных аминокислот в крови, которые служили организму энергией и строительным материалом дабы избежать утомления.
Физическая утомляемость может наступать по двум причинам. Первая — нехватка питательных веществ в мышечной ткани (глюкозы, аминокислот и др.), а также накопление продуктов их катаболизма (например, молочной кислоты). Вторая причина — повышение температуры тканей и органов при избыточной физической нагрузке, то есть гипертермия. Температура тела отслеживается специальными участками головного мозга, которые в случае перегрева генерируют сигналы наступления утомляемости, чтобы снизить физическую активность и, тем самым, снизить температуру тела. Оказалось, что некоторые пептиды гидролизатов способны подавлять сигналы мозга о наступлении гипертермии, то есть снижают ощущение утомляемости [18]. Кроме того, эти необычные пептиды способны запускать механизмы утилизации продуктов катаболизма и тем самым способствуют увеличению физической выносливости (рис. 3) [19].
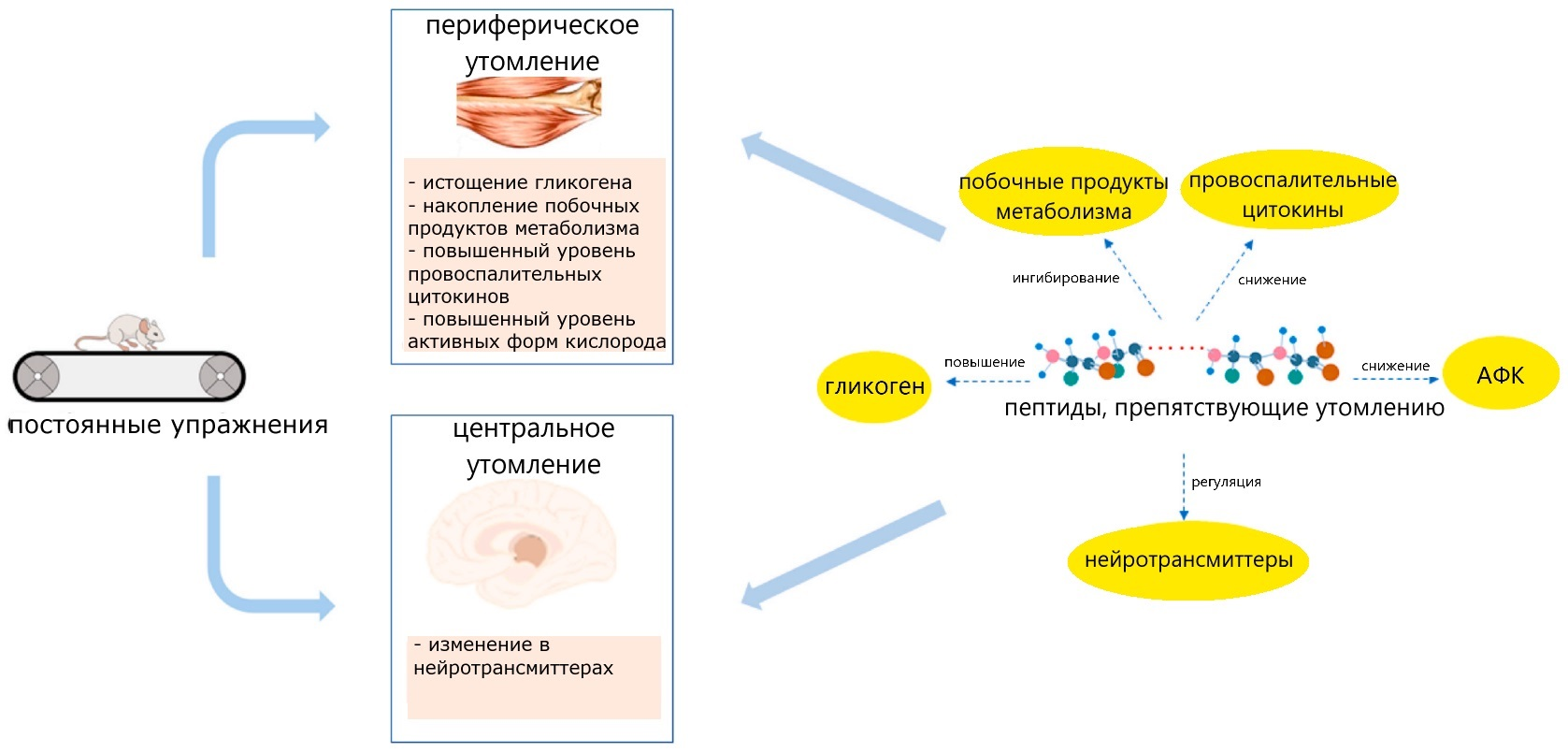
Рисунок 3. Потенциальные механизмы действия биологически активных пептидов гидролизатов белка, препятствующих утомлению при физической нагрузке. Биологически активные пептиды могут снижать физическое утомление на периферии, то есть, например повышать синтез гликогена в мышечной ткани, или регулировать выброс нейротрансмиттеров и изменять активность участков головного мозга, ответственных за регуляцию чувства утомления (центральное утомление).
адаптировано с изменениями из [19]
Пептиды, которые способны запускать подобные физиологические реакции, не разбираясь до аминокислот, назвали биологически активными. В литературе есть множество работ, показывающие антигипертензивные, антиоксидантные, иммуномодулирующие, даже противораковые свойства биологически активных пептидов гидролизатов пищевых белков (рис. 4) [20]. Столь разнообразный набор возможных реакций на некоторые пептиды пищи можно объяснить тем, что ткани живых организмов содержат множество обломков собственных белков, то есть пептидов, участвующих в поддержании биохимического равновесия и регуляции множества жизненно важных процессов [21].

Рисунок 4. Некоторые свойства биологически активных пептидов. Биологически активные пептиды из пищи могут снижать давление крови, иметь антиоксидантные, иммуномодулирующие, и даже противораковые свойства.
облако слов сгенерировано автором статьи на сайте Wordclouds на основе анализа текста (абстракт и введение) обзора [20]
Антигипертензивная активность пептидов — самый изученный пример биологически активных пептидов, очень часто их находят в гидролизатах соевого белка [21]. В организме человека и других животных есть фермент под названием ACE. Функция этого фермента — превращать гормон крови AI в AII. Задача AII- повышать давление крови. Так вот. В соевом соусе (по сути, это гидролизат белка) были обнаружены пептиды, способные связываться с ферментом ACE и ингибировать его: AII не образуется из AI — давление не повышается (рис. 5). Чтобы разыскать в смеси пептидов гидролизата тот самый один волшебный биологически активный пептид, требуется приложить немало усилий.
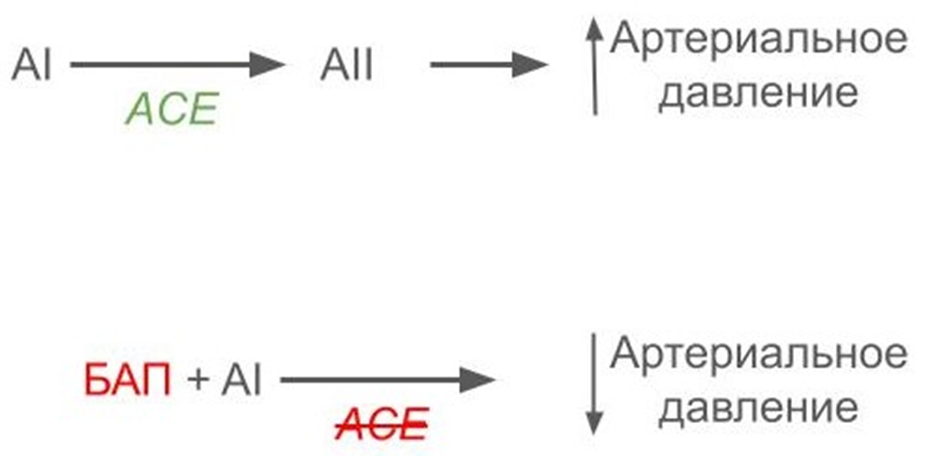
Рисунок 5. Схема механизма действия биологически активного пептида (БАП) на артериальное давление. Некоторые биологически активные пептиды могут ингибировать активность фермента крови ACE. В организме человека этот фермент отвечает за превращение гормона AI в AII. Задача AII — повышение давления в кровяном русле. Если АСЕ ингибирован, то гормон AII не образуется, и давление не повышается, а снижается.
рисунок автора текста
Чтобы выделить из гидролизата биологически активный пептид, сначала используют несколько протеаз для гидролиза, а потом следует этап многоступенчатой очистки: фильтрация, хроматография и последующие шаги для получения конкретных пептидов с минимальной молекулярной массой (2–10 аминокислот). Вероятно, именно из-за дороговизны всего этого процесса биологически активные пептиды гидролизатов пищевых белков не продаются в каждом продуктовом супермаркете. В нашем недавнем исследовании мы показали, что эту проблему высокой стоимости производства можно решить.
Мы создали технологию получения гидролизата изолята белка сои, используя только один препарат протеазы и без этапов фракционирования продуктов гидролиза. Гидролизат имеет широкий спектр молекулярной массы фрагментов белка и пептидов (в среднем 6 кДа) [23]. Этот гидролизат мы проверили на эффективность и безопасность в тесте на физическую выносливость в плавании до истощения (рис. 6). Оказалось, что полученный нами гидролизат изолята белка сои не обладал токсичными свойствами и был способен значительно улучшить физическую выносливость у крыс (500%) [24].
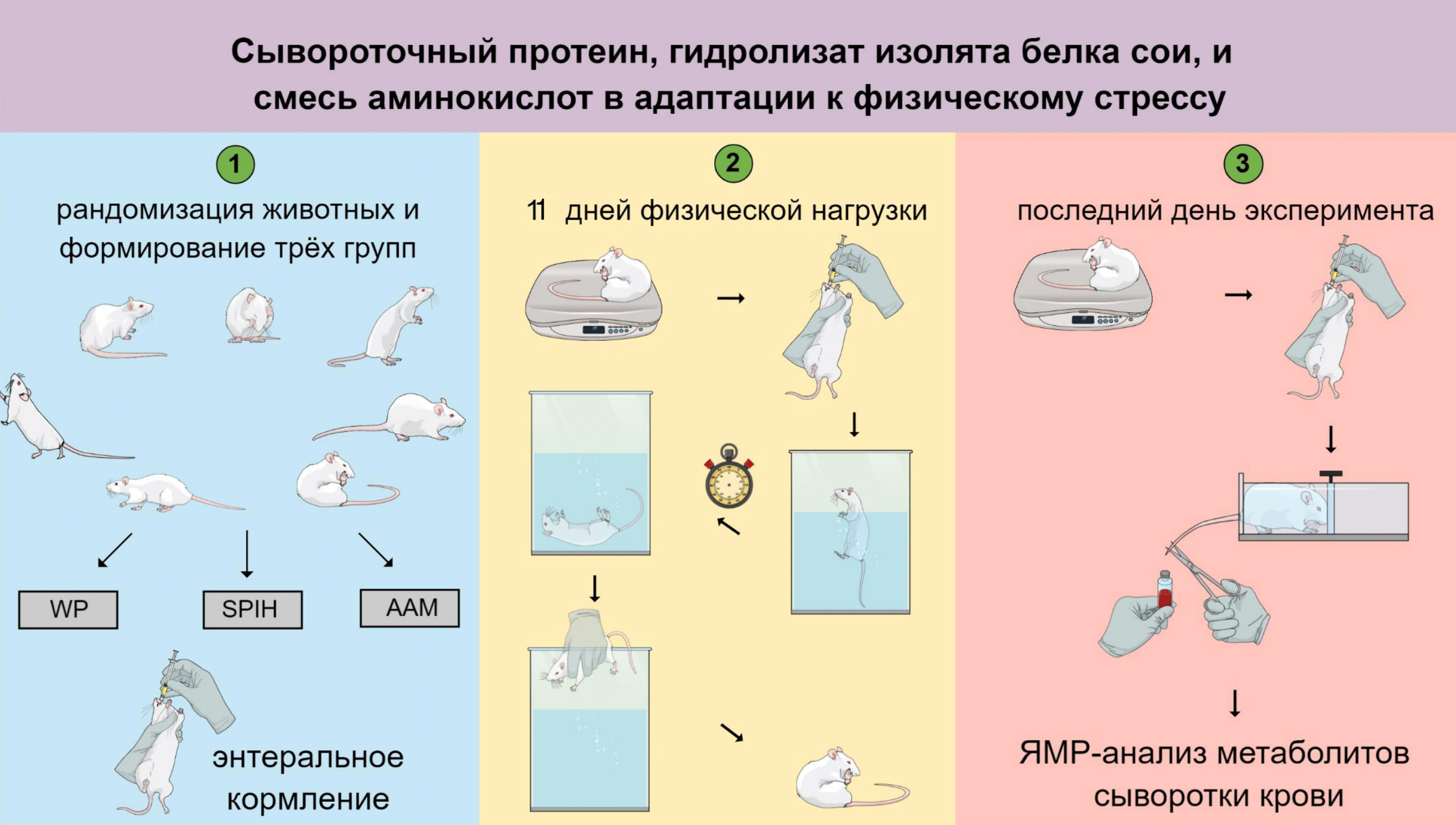
Рисунок 6. Дизайн эксперимента влияния энтерального кормления тремя разными источниками аминокислот на физическую выносливость крыс в тесте «плавание до истощения». Лабораторные животные были поделены на три группы: первая группа получала перед плаванием молочно-сывороточный белок, вторая — гидролизат изолята белка сои, третья — смесь свободных аминокислот. Тест на физическую выносливость проводился 11 раз в течение 40 дней. В конце эксперимента после энтерального кормления у животных брали кровь для анализа метаболитов с помощью ЯМР-спектроскопии.
рисунок автора текста
Анализ метаболитов сыворотки крови крыс показал, что физиологический эффект гидролизата не обусловлен увеличением протеиногенных аминокислот в крови — только концентрация одной аминокислоты (тирозин) выросла и статистически достоверно отличалась от контроля. Опираясь на результаты анализа других метаболитов, нами была предложена гипотеза о стимуляции использования организмом собственных запасов жира для получения энергии (липолиз) под воздействием исследуемого гидролизата изолята белка сои (рис. 7). В крови крыс, получавших гидролизат, обнаружилось повышенное содержание L-орнитина, ацетил-L-карнитина и β-гидроксибутирата. Известно, что эти молекулы являются косвенными признаками повышенного липолиза. Также теоретически можно предположить, что насыщение крови тирозином может способствовать синтезу дофамина, который синтезируется как раз из этой аминокислоты. Дофамин, как было рассказано выше, может блокировать сигналы мозга об утомляемости и тем самым повышать физическую выносливость. Предложенная гипотеза на данный момент проверяется. Так или иначе, технология получения исследованного гидролизата изолята белка сои легко масштабируется и, судя по всему, фантастические пептиды там обитают.
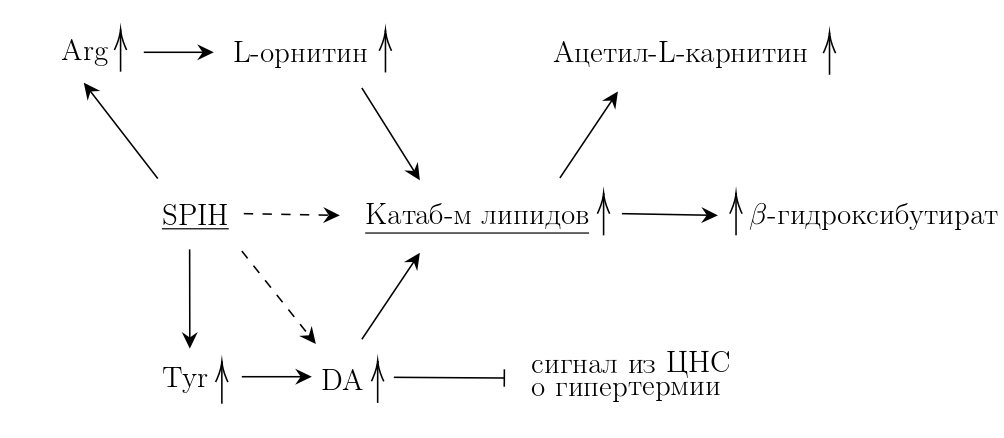
Рисунок 7. Схема предполагаемого механизма увеличения физической выносливости после приема в пищу гидролизата изолята белка сои (SPIH — soy protein isolate hydrolysate). Анализ метаболитов крови крыс, получавших перед тренировкой гидролизат изолята белка сои, выявил повышенное (относительно других групп животных) содержание тирозина, L-орнитина, ацетил-L-карнитина и β-гидроксибутирата. Предполагается, что гидролизат стимулирует катаболизм липидов. Известно, что некоторые пептиды белка сои могут повышать концентрацию дофамина в крови, что, теоретически, имеет место быть в данном случае.
рисунок автора текста
Заключение
Знания о биологически активных пептидах гидролизатов пищевых белков будут использованы для разработки новых потенциальных лекарственных средств пептидной формы. Вероятно, для некоторых пептидов экономически выгоднее будет синтезировать их в пробирке и далее доставлять в кровь напрямую, а не через желудочно-кишечный тракт. Однако действие некоторых пептидов осуществляется на уровне энтероцитов и микроорганизмов кишечной микрофлоры, то есть без перорального введения не обойтись. В этом случае биологически активные пептиды предпочтительно получать в составе гидролизатов пищевых белков — это значительно дешевле, а значит, доступнее более широкому кругу лиц.
Здесь уместно вспомнить о пользе многих традиционных ферментированных продуктов питания (кефир, квашеная капуста и многие другие). В рецепте приготовления этих продуктов обязательно есть этап ферментации — мы разрешаем некоторым микробам пожить в молоке или в свежей капусте несколько дней. За это время микробы растут и размножаются, и, конечно, частично гидролизуют белок, до которого смогут добраться. Вероятно, что польза правильно приготовленных ферментированных продуктов исходит в том числе от пептидов. Некоторые из этих пептидов с малой долей вероятности могут быть биологически активными. Чтобы повысить вероятность обитания полезных фантастических пептидов в продуктах питания, необходимо создавать специальные и контролируемые условия их получения. Изоляты и концентраты пищевых белков — удобное исходное сырье, протеолитические ферменты — предсказуемые в результате. Остается только подобрать правильное заклинание.
Литература
- Культивируемое мясо — продукт завтрашнего дня;
- Протеиновые инвестиции;
- Stefan H. M. Gorissen, Julie J. R. Crombag, Joan M. G. Senden, W. A. Huub Waterval, Jörgen Bierau, et. al.. (2018). Protein content and amino acid composition of commercially available plant-based protein isolates. Amino Acids. 50, 1685-1695;
- Stephan van Vliet, Nicholas A Burd, Luc JC van Loon. (2015). The Skeletal Muscle Anabolic Response to Plant- versus Animal-Based Protein Consumption. The Journal of Nutrition. 145, 1981-1991;
- Мосолов В. (1982). Природные ингибиторы протеолитических ферментов. Успехи биологической химии. М.: «Наука». 22, 100–117;
- Marina Clemente, Mariana G. Corigliano, Sebastián A. Pariani, Edwin F. Sánchez-López, Valeria A. Sander, Víctor A. Ramos-Duarte. (2019). Plant Serine Protease Inhibitors: Biotechnology Application in Agriculture and Molecular Farming. IJMS. 20, 1345;
- Петибская B. (1999). Ингибиторы протеолитических ферментов. Известия высших учебных заведений. Пищевая технология. 5–6, 6–10;
- Кононова С., Муранова Т., Зинченко Д., Белова Н., Мирошников А. (2016). Биотехнологические подходы при использовании белков рапса и сои в кормах аквакультуры лососевых рыб. Биотехнология. 32, 57–68;
- Monique M. P. Provansal, Jean L. A. Cuq, Jean C. Cheftel. (1975). Chemical and nutritional modifications of sunflower proteins due to alkaline processing. Formation of amino acid crosslinks and isomerization of lysine residues. J. Agric. Food Chem.. 23, 938-943;
- Akira TSUGITA, Jean‐Jacques SCHEFFLER. (1982). A Rapid Method for Acid Hydrolysis of Protein with a Mixture of Trifluoroacetic Acid and Hydrochloric Acid. European Journal of Biochemistry. 124, 585-588;
- J.J. Boza, D. Moënnoz, J. Vuichoud, A.R. Jarret, D. Gaudard-de-Weck, O. Ballèvre. (2000). Protein hydrolysate vs free amino acid-based diets on the nutritional recovery of the starved rat. European Journal of Nutrition. 39, 237-243;
- Marie‐Gwenaelle Poullain, Jean‐Pierre Cezard, Loic Roger, Francois Mendy. (1989). Effect of Whey Proteins, Their Oligopeptide Hydrolysates and Free Amino Acid Mixtures on Growth and Nitrogen Retention in Fed and Starved Rats. J Parenter Enteral Nutr. 13, 382-386;
- Masashi Morifuji, Mihoko Ishizaka, Seigo Baba, Kumiko Fukuda, Hitoshi Matsumoto, et. al.. (2010). Comparison of Different Sources and Degrees of Hydrolysis of Dietary Protein: Effect on Plasma Amino Acids, Dipeptides, and Insulin Responses in Human Subjects. J. Agric. Food Chem.. 58, 8788-8797;
- Qingbiao Xu, Hui Hong, Jianping Wu, Xianghua Yan. (2019). Bioavailability of bioactive peptides derived from food proteins across the intestinal epithelial membrane: A review. Trends in Food Science & Technology. 86, 399-411;
- Lennarz W. J., Lane M. D. Encyclopedia of biological chemistry. Academic Press, 2013. — 3232 p.;
- Chen Y., Wang F., Zhou J., Niu T., Xuan R., Chen H., Wu W. (2020). In vivo antifatigue activity of spirulina peptides achieved by their antioxidant activity and by acting on fat metabolism pathway in mice. Natural Product Communications. 15;
- Tom P. Aird, Andrew J. Farquharson, Kate M. Bermingham, Aifric O’Sulllivan, Janice E. Drew, Brian P. Carson. (2021). Divergent serum metabolomic, skeletal muscle signaling, transcriptomic, and performance adaptations to fasted versus whey protein-fed sprint interval training. American Journal of Physiology-Endocrinology and Metabolism. 321, E802-E820;
- Dilshat Yimit, Parida Hoxur, Nurmuhammat Amat, Kimono Uchikawa, Nobuo Yamaguchi. (2012). Effects of soybean peptide on immune function, brain function, and neurochemistry in healthy volunteers. Nutrition. 28, 154-159;
- Peixin Wang, Dehua Wang, Jiamiao Hu, Bee K. Tan, Yi Zhang, Shaoling Lin. (2021). Natural bioactive peptides to beat exercise-induced fatigue: A review. Food Bioscience. 43, 101298;
- Seyed Hadi Peighambardoust, Zohreh Karami, Mirian Pateiro, José M. Lorenzo. (2021). A Review on Health-Promoting, Biological, and Functional Aspects of Bioactive Peptides in Food Applications. Biomolecules. 11, 631;
- Неизвестные пептиды: «теневая» система биорегуляции;
- Takeharu Nakahara, Katsutoshi Sugimoto, Atsushi Sano, Hitomi Yamaguchi, Hiroshi Katayama, Riichiro Uchida. (2011). Antihypertensive Mechanism of a Peptide‐Enriched Soy Sauce‐Like Seasoning: The Active Constituents and Its Suppressive Effect on Renin–Angiotensin–Aldosterone System. Journal of Food Science. 76;
- Nikita Pozdnyakov, Sergey Shilov, Alexander Lukin, Maxim Bolshakov, Evgeny Sogorin. (2022). Investigation of enzymatic hydrolysis kinetics of soy protein isolate: laboratory and semi-industrial scale. Bioresour. Bioprocess.. 9;
- Pozdnyakov N., Molchanov M., Ponomareva T., Rykov V., Lukin A., Shilov S., Sogorin E. (2022). Whey Protein, Soy Protein Isolate Hydrolysate, and Amino Acid Mixture in Adaptation to Physical Stress of Rats. Europe PMC.