
Культивируемое мясо — продукт завтрашнего дня
26 ноября 2019
Культивируемое мясо — продукт завтрашнего дня
- 3702
- 1
- 8
Культивируемое мясо — будущая альтернатива
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Я представляю на суд читателей обзор производства культивируемого мяса — перспективного направления биотехнологии, позволяющего минимизировать использование животного сырья в пищевой промышленности и решить ряд возможных проблем: недостаток пищи, экологические проблемы, расширение масштабов производства, а также этические вопросы мясной промышленности.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Одним из перспективных направлений биотехнологии, помимо производства вакцин, антител и прочих товаров, является весьма любопытное и наукоемкое направление — культивирование мясной продукции, или же, в просторечии, «мясо из пробирки». Относительно активное развитие этой сферы началось не так давно. Сама идея выращивания мяса «отдельно от животного» блуждала в обществе уже много лет. Еще в 1931 году Уинстон Черчилль высказывался: «Нам следует отойти от нелепости выращивания целой курицы на убой с целью съесть только грудку и крылья, и выращивать это отдельно в подходящей среде». Тем не менее хоть как-то претворить эту утопическую идею в жизнь удалось лишь спустя 40 лет, когда в 1971 году профессор патологии Рассел Росс (США) впервые культивировал мышечные фибриллы in vitro («на стекле», то есть в чашке Петри).
Однако дальнейшее развитие это направление получило лишь в 1990 году, когда стало возможным культивирование стволовых клеток животных и небольшого количества тканей, которые были пригодны для приготовления и употребления в пищу. В 1998 некто Джон Вейн (John F. Vein) получил патент на производство мяса путем тканевой инженерии. Затем в 2001 году NASA провело эксперименты по культивированию мяса из клеток индейки. В этом же году была подана заявка на всемирный патент по производству культивируемого мяса — в этот раз врачом-дерматологом Амстердамского университета Витом Вестерхофом (Wiete Westerhof) и бизнесменом Вилемом ван Котеном (Willem van Kooten). Наконец, в 2002 году Исследовательский консорциум NSR получил первый съедобный образец — ученым удалось вырастить клетки золотой рыбки таким образом, что они напоминали рыбное филе.
Развитие продолжалось. В 2003 году Орон Кэттс и Ионат Цурр из Проекта культуры и искусства тканей и Гарвардской медицинской школы продемонстрировали в Нанте «стейк» шириной в несколько сантиметров, который они вырастили на основе стволовых клеток лягушки. Для подтверждения съедобности полученный продукт приготовили и употребили в пищу.
Разработку также стимулировали различными грантами — в 2008 году PETA (People for the Ethical Treatment of Animals, «Люди за этичное отношение к животным») предложила 1 млн долларов компании, которая первой вырастит «синтетическое» куриное мясо до 2012 года, а правительство Голландии и вовсе вложило в эксперименты по культивации мяса 4 млн долларов. Инвестиции пусть и не принесли полноценного результата (так как до сих пор данная технология не реализована в промышленных масштабах), но в определенной степени простимулировали развитие этой сферы. Как пример можно привести голландский стартап Meatable, основатели которого сообщили, что в сентябре 2018 года им удалось вырастить мясо, используя плюрипотентные стволовые клетки из пуповины животных.
Значительным успехом можно считать достижение доктора Марка Поста — в августе 2013 года на пресс-конференции в Лондоне он продемонстрировал (и также употребил в пищу) гамбургер с котлетой из искусственного мяса (рис. 1). В тот момент производство данного продукта обошлось ему в 215 000 фунтов и заняло более двух лет. Тем не менее сам доктор Пост высказывался достаточно оптимистично в отношении падения цены на производство синтетического мяса. Как в дальнейшем выяснится, его оптимизм не был напрасным.

Рисунок 1. Марк Пост представляет первую выращенную в лаборатории котлету для гамбургера в 2013 году
Помимо этого, две компании — Memphis Meats в США и SuperMeat в Израиле — также занялись выращиванием мяса. Заинтересованность компаний продвинула исследования в этой области — производственные мощности и бюджет позволяют проводить более углубленные исследования.
Альтернатива культивируемому мясу — мясо, созданное на основе материалов растительного происхождения. В этом в значительной степени преуспела компания Impossible Foods, которая в тандеме со всемирно известной сетью ресторанов быстрого питания Burger King создала «Невозможный воппер» — гамбургер, в котором используется мясо, изготовленное из растений. В сравнении с обычным «воппером» он всего лишь на 1 доллар дороже. Burger King в рамках маркетингового исследования начал внедрять эту продукцию с апреля 2019 года в городе Сент-Луис (США), и уже сейчас гамбургер с «растительным мясом» можно приобрести в 59 местах в городе. При этом, как сообщает New York Times, Burger King планирует начать продажи этой продукции во всех своих закусочных, то есть в 7200 местах в США [1].
Следует, однако, различать две эти технологии. В случае продукции Impossible Foods мы получаем «мясо, выращенное на грядке», при производстве которого используется гем — координационный комплекс, состоящий из иона железа, координированного с порфирином, действующим в качестве тетрадентатного лиганда, с одним или двумя осевыми лигандами. В случае же культивируемого мяса используются различные клетки животного происхождения (эксплантаты, стволовые клетки). То есть если в первом случае, грубо говоря, превращают растения в мясо, то во втором мясо растят в пробирке, используя питательную среду.
Таким образом, мы можем наблюдать постепенную тенденцию снижения цены производства «мяса из пробирки». Тем не менее кроме денежного вопроса возникает также вопрос и производственный — технология имеет некоторые проблемы, над решениями которых, скорее всего, придется работать не одной только биотехнологии. Чтобы понять текущее положение дел в данном вопросе, целесообразно будет обозреть процесс в общем, вариации технологии, и, разумеется, последние достижения.
Этапы производства
Производство культивируемого мяса состоит из нескольких последовательных этапов, каждый из которых имеет свои нюансы, которые необходимо решить для доведения технологии «до ума».
1. Выбор клеток для производства
Выращивание культивируемого мяса начинается со сбора клеток с высокой скоростью пролиферации (разрастания, размножения). К ним относятся эмбриональные и взрослые стволовые клетки, миосателлиты (одноядерные взрослые стволовые клетки мышечной ткани), а также миобласты (молодые одноядерные, большей частью веретеновидные клетки мышечной ткани, имеющиеся у животных и человека). Плюрипотентные клетки (способные дифференцироваться во все типы клеток, кроме клеток внезародышевых органов) пролиферируют быстрее прочих, однако они еще не дифференцировались на определенные типы клеток, в связи с чем возникает проблема «расщепления» клеток (дифференцировки не в соответствующий тип клеток) и необходимости направлять их рост определенным образом.
В этом плане полностью развитые упомянутые выше мышечные клетки подходят лучше, так как они уже оформились как необходимый для производства тип клеток. Подобные «развитые» клетки называют эксплантатами, и впервые данная методика была использована Бенджаминсоном, Гилкристом и Лоренцом (Benjaminson, Gilchriest, Lorenz) [2]. Они в течение семи дней помещали эксплантаты скелетной мускулатуры золотой рыбки в разные питательные среды и наблюдали увеличение площади эксплантата на 5,2–13,8% (в случае с помещением в среду с диссоциированными клетками скелетной мускулатуры рыбки того же вида площадь и вовсе увеличивалась на 79%).
К сожалению, как можно понять из результатов их исследований, эксплантаты в питательных средах размножаются неохотно. Золотой серединой в данном случае выступают миосателлиты (клетки, каждая из которых по своей «производительности» эквивалентна 70 эмбриональным миобластам; рис. 2) и миобласты, так как они всё еще способны пролиферировать с необходимой скоростью и при этом уже в достаточной степени дифференцировались. Однако в 2012 году Марк Пост отметил, что выделение, культивирование и поддержание динамического пролиферативного состояния миосателлитных клеток возможно, но является сложной задачей. Отмечают также, что миоциты скелетной мышечной ткани могут быть успешно получены путем трансдифференцировки (перепрограммирования) из широко доступных жировых клеток [3].
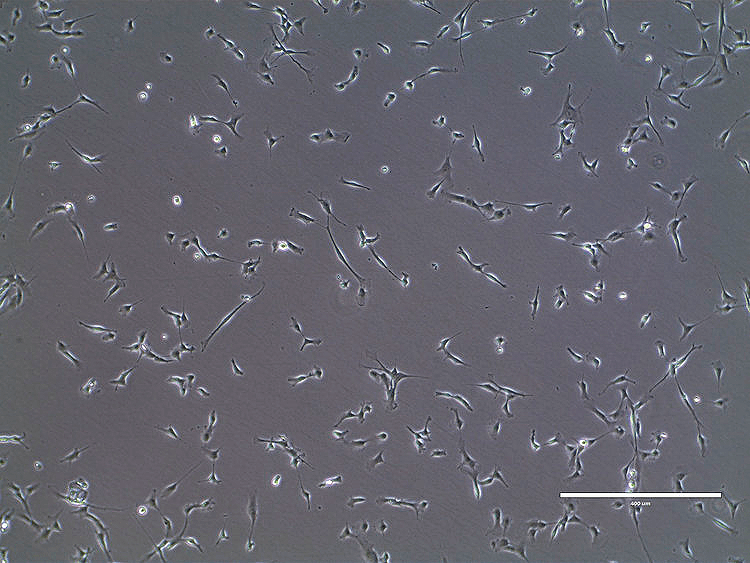
Рисунок 2. Миосателлиты на стадии пролиферации
сайт squarespace-cdn.com
2. Добавление среды и факторов роста
После выделения необходимых для производства клеток к ним добавляют специальный раствор, известный как среда роста. Такие среды должны содержать необходимые питательные компоненты в такой форме, которая будет свободно доступной для миобластов и «сопутствующих» клеток. С этой целью проводят усовершенствования состава коммерчески доступных сред для культивирования клеток, что в свою очередь, повышает способность успешно культивировать многие типы клеток животных (рис. 3).

Рисунок 3. Чашка Петри с сывороткой для выращивания культуры клеток
Одна из наиболее доступных сред — фетальная бычья сыворотка, производимая из крови, взятой у крупного рогатого скота через закрытую систему сбора на бойне (рис. 4). Однако она всё еще имеет животное происхождение. От использования подобной среды в идеале надо постепенно отказываться, в связи с чем ведутся поиски различных альтернатив. К примеру, Макфарланд вместе со своими коллегами разработал бессывороточную среду, которая поддерживала размножение в культуре клеток-сателлитов индейки [4]. Кроме того, существуют различные заменители сыворотки, являющиеся хорошей альтернативой фетальной бычьей сыворотке. Как пример можно привести Ultroser G — один из многих коммерчески доступных заменителей. Успешно использовали также бессывороточную среду, изготовленную из экстракта гриба майтаке, при этом скорость роста в ней была выше, чем при использовании фетальной бычьей сыворотки [2].

Рисунок 4. Фетальная бычья сыворотка — одна из наиболее распространенных сред роста
Альтернативой сыворотке, по заявлению У.С. Аргравеса из Медицинского университета Южной Каролины, могут послужить липиды, такие как сфингозин-1-фосфат — они способны поддерживать рост и дифференциацию эксплантатов эмбриональной ткани [4]. В целом, идеальные питательные среды не должны содержать компонентов животного происхождения — преимущественно, по этическим соображениям, ведь в противном случае придется всё так же выращивать животных, но уже не на убой, а на получение сыворотки. Тем не менее если использовать белки растительного происхождения, необходимо устранить потенциальный риск возникновения аллергии на них.
Процесс разработки технологии производства культивируемого мяса сдерживается также проблемой проведения культивации в больших масштабах в отсутствии «живого» гомеостатического регулирования — то есть, когда в формировании мышечной ткани не принимают участия системы живого организма. Пока еще не созданы системы, способные точно повторить процесс гомеостатической регуляции. Миоциты при этом должны выращиваться в аэробных условиях, чтобы предотвратить подкисление культуральной среды молочной кислотой. Жизнеспособность клеток положительно коррелирует с градиентом кислорода в растущих культурах миоцитов, так что переносчики кислорода, вероятно, потребуются для поддержания концентрации кислорода на достаточно высоком уровне, чтобы предотвратить гипоксию и подкисление [5].
Однако для растущих мышечных клеток необходимо не только правильное питание, но и соответствующие факторы роста — полипептиды, поддерживающие различные терминальные фенотипы (физические характеристики животного или его ткани на конечной стадии развития) и регулирующие дифференцировку стволовых клеток и пролиферацию. Некоторые из них синтезируются и высвобождаются самими мышечными клетками, а в тканях также обеспечиваются другими типами клеток локально (паракринные) и нелокально (эндокринные). Печень является основным источником циркулирующего инсулиноподобного фактора роста I. Теоретически можно разработать соответствующие системы совместной культуры, чтобы клетки печени (гепатоциты) обеспечивали факторы роста, необходимые для производства культивируемых мышц, то есть «мяса из пробирки». Как правило, исследователи вызывают дифференцировку и слияние миобластов путем снижения уровня митогенных факторов роста. После этого пролиферирующие клетки начинают синтез инсулиноподобного фактора роста II; клетки дифференцируются, и образуются многоядерные миотрубки. Также в качестве факторов роста могут использоваться трансформирующий фактор роста β, костные морфогенные белки и факторы роста фибробластов.
Исходя из этого, вытекает необходимость создания такой системы, в которой можно было бы изменять состав факторов роста в среде.
3. Помещение в биореактор
После снабжения питательными веществами клетки помещают в биореактор, где они способны удовлетворять свои энергетические потребности в приемлемой для роста среде. Для производства культивируемого мяса, скорее всего, потребуется разработка новых биореакторов, способных поддерживать низкую степень деформации в структуре вещества (так называемый «сдвиг») и равномерное распределение различных необходимых для роста веществ в больших объемах. Во многих исследованиях в области инженерии скелетных мышц использовали роторные (вращающиеся) биореакторы NASA. Главные их преимущества заключаются в том, что клетки почти непрерывно находятся в суспензии, «сдвиг» жидкости минимален, и суспензия позволяет культивирование тканей до 1 см. Эти биореакторы могут поддерживать концентрацию биомассы до 108 клеток/мл. Роторные биореакторы, использующиеся в исследованиях (размером от 10 до 250 мл), в последствии были увеличены в объеме до трех литров. Это позволило предположить, что теоретически масштабирование до промышленных размеров не должно влиять на физику системы. Промышленные масштабы уже доступны для биопленочных реакторов на основе частиц с малым «сдвигом» — это позволило достичь концентраций биомассы до 30 кг/м3.
Сейчас можно получить полосы мышечного волокна [6], но проект прототипа биореактора, пригодного для массового выращивания, еще не разработан, не говоря уже о модели, необходимой для полномасштабного производства [5]. Как уже говорилось ранее, в идеале структура мышц требует чего-то похожего на систему кровообращения, служащую для доставки питательных веществ и кислорода к растущим клеткам или волокнам, а также для удаления продуктов обмена веществ. Подобные проекты для промышленного использования еще не были реализованы, хотя передовые технологии по производству биоматериалов вполне позволяют создание такого проекта (рис. 5) [7].

Рисунок 5. Биореактор Future Meat
Тем не менее ведутся работы по созданию новых типов биореакторов. В частности, в 2016 году Ю.А. Иванов (член-корреспондент РАН) и Е.Б. Петров (кандидат с.-х. наук, сотрудник Всероссийского научно-исследовательского института механизации животноводства) в своей статье «Разработка биореактора для производства культурального мяса» описали созданный ими двухкамерный биореактор, позволяющий избежать гидроударов, кавитации, высокотурбулентных и застойных зон. Биореактор может работать в двух режимах — без перемешивания в камере роста и с перемешиванием, что потенциально делает его универсальным [8].
4. Использование каркасов для пролиферации
Для придания мясу объема необходима некая «основа» для его роста — своеобразные строительные леса, которые обеспечивают структуру и упорядоченность будущего стейка. В идеале подобный «каркас» должен быть съедобным, чтобы не пришлось потом удалять его из мяса. Также он должен смещаться (имитировать движение), чтобы растягивать развивающуюся мышцу, тем самым имитируя организм животного в период естественного развития мышечной ткани, а получение его должно быть возможным из материала «неживого» происхождения.
Помимо этого, каркас должен быть гибким, чтобы не отделяться от развивающихся миотрубок (мышечных волокон на раннем этапе развития), подверженных спонтанному сокращению, которые затем дифференцируются в миофибриллы. Сократительные и другие типы белков в мышцах играют важную роль в формировании текстуры, цвета и вкуса культивируемой мышечной ткани. Например, гемоглобиновый белок миоглобин отвечает за красный цвет мяса и является важным источником железа в мясе [9]. В качестве оных каркасов используют либо коллагеновую сетку, либо шарики-микроносители (например, Cytodex-3 в роторных биореакторах). Однако все они имеют свои недостатки. Коллагеновая сетка (или шарики) позволяет вырастить слой миоцитов толщиной не более 100–200 мкм (рис. 6) из-за ограничений диффузии [10–12]. В принципе, эту проблему можно решить совмещением слоев или продуктов клеточной культуры, что позволит получить мышечный или мясной продукт приемлемого размера [5], [6]. Шарики-микроносители же не имеют растягивающего потенциала.
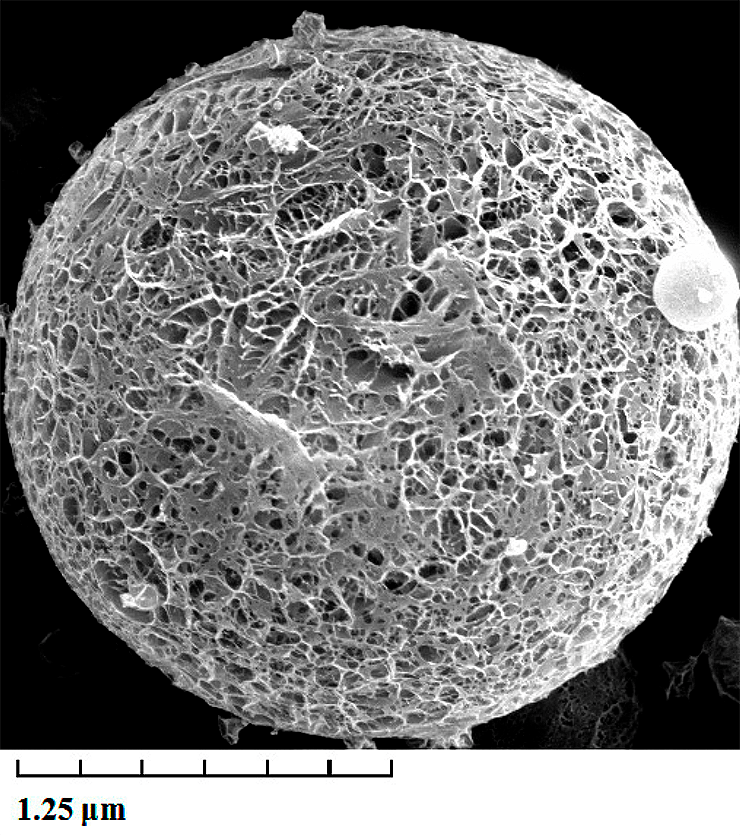
Рисунок 6. Пример каркаса для пролиферации — коллагеновая микросфера
Один из способов механического растяжения миобластов для их дифференцировки заключается в использовании съедобных, чувствительных к стимулам пористых микросфер, изготовленных из целлюлозы, альгината, хитозана или коллагена. Эти сферы могут подвергаться, как минимум, 10%-ному изменению площади поверхности после незначительных изменений температуры или pH среды. Подобный метод может послужить какой-никакой, а все же альтернативой сетке и микроносителям. В ходе исследований [13] было обнаружено, что гидрогель фибрина также является подходящим каркасом для тканей скелетных мышц, поскольку клетки могут мигрировать, пролиферировать и производить свой собственный внеклеточный матрикс.
«Строительные леса» также должны предусматривать возможность развития кровеносных сосудов в культивируемой ткани для нормального ее развития. Создание каркаса, способного обеспечить васкуляризацию, представляет собой весьма сложную задачу. Существует несколько теоретических моделей для решения данной задачи. К примеру, была предложена модель построения разветвленной сети из пищевого, эластичного и пористого материала, через который питательные вещества могли бы перфузироваться (то есть проникать в ткани, омывая их). Миобласты и другие типы клеток затем «подключались» бы к этой сети. Один из способов формирования такой сети — создание отливки, на которую наносится раствор коллагена или биосовместимого полимера. После затвердевания исходный материал растворяется, оставляя разветвленную сеть микроканалов, которые могут накладываться друг на друга, образуя трехмерную сеть [14]. Однако такой способ не подходит для массового производства. Возможная альтернатива — создание мяса без «строительных лесов». Уже упомянутые Бенджаминсон, Гилкриест и Лоренц предложили решить проблему васкуляризации с помощью контролируемого ангиогенеза эксплантатов.
Стоит также учесть, что технология с использованием каркаса может быть применена только в случае культивирования мяса без костей или фарша. В конечном счете, мы получим мясо, которое можно использовать для гамбургеров или колбасы. Для создания же более структурированного мяса, к примеру, бифштекса, необходимо создать структурированную мышечную ткань как самоорганизующуюся конструкцию, либо же культивировать уже сформировавшуюся, полноценную мышечную ткань.
При этом также надо учитывать влияние гравитационного, магнитного и механического поля на скорость пролиферации мышечных клеток. Не стоит забывать и о необходимости обеспечения имитации процессов напряжения (растяжения и расслабления) для улучшения процесса дифференцировки мышечных клеток.
Нынешние проблемы, возможные трудности и потенциальные выгоды
Рассмотренные выше технические проблемы — не единственные трудности, с которыми предстоит столкнуться энтузиастам, решившим вводить данную технологию в промышленность.
В первую очередь возникает проблема конкурентоспособности в сравнении с обычным мясом. Как утверждал Марк Пост в своей работе от 2012 года, двумя безусловно выигрышными характеристиками для любой альтернативы привычному мясу будут эффективность производства в коммерческом смысле, в использовании ресурсов и воздействии на окружающую среду, а также успешность имитации обычного мяса «животного» происхождения. На данный момент синтетический продукт уступает привычному «животному» в плане вкусовых качеств и насыщенности (в сравнении с ним оно немного суховато). Вдобавок к этому отсутствие костей и жира также влияет на вкусовые качества конечной продукции.
Решением данной проблемы может послужить совместное культивирование адипоцитов (жировых клеток) с миофибриллами. Это позволит улучшить структуру, вкус и нежность культивируемого мяса за счет эффективного увеличения внутримышечного жира, как утверждают в статье 2010 года французский ученый Хоккет (Hocquette) в соавторстве со своими коллегами. Культивирование жировых клеток методом тканевой инженерии было описано в соответствующих статьях Фрерихом (Frerich) [15], Додсоном (Dodson) [16] и Версейденом (Verseijden) [17].
Проблемой также может стать обеспечение схожести аромата, причем проблемой достаточно сложной в решении — ведь ароматические качества обеспечиваются множеством водорастворимых и жировых компонентов, а существуют еще и видовые различия и особенности [18].
Однако в целом ценовая эффективность синтетического мяса может стать заметным преимуществом и позволит пренебречь некоторыми параметрами, необходимыми для идеального повторения животного продукта.
Как утверждает Вербеке (Verbeke) с коллегами в своей статье 2010 года, в идеале промышленно производимое культивируемое мясо (рис. 7) должно быть либо схожим по своим вкусовым качествам, аромату, внешнему виду (включая цвет, текстуру, нежность) и питательной ценности, либо вовсе превосходить «животное» мясо. С этим трудно не согласиться.

Рисунок 7. Культивируемое мясо в «сыром» виде
Существует и упомянутая выше проблема себестоимости производства: в настоящий момент данная технология слишком дорогостоящая для масштабного производства. Совершенствование методик и оборудования за прошедшие годы снижает стоимость синтетического мяса, однако о массовом внедрении и широкой доступности речи, к сожалению, идти не может. Как пример можно привести последние попытки отечественного производителя создать заветное «мясо из пробирки». Очаковский комбинат вырастил 40 г продукта, на что затратил 900 тыс. рублей [19]. Но, опять же, при условии дальнейшего развития технологий себестоимость производства «пробирочного» мяса будет закономерно падать. Тут в качестве аргумента можно привести уже достигнутое снижение цены на культивируемое мясо. Если в 2013 году его производство на один гамбургер обошлось Марку Посту в 215 000 фунтов, то в 2017 году цена снизилась аж до 7 фунтов, то есть уменьшилась в 31 000 раз [20]. Это напоминает ситуацию с проектом «Геном человека» [21], на который изначально было затрачено около 3 млрд долларов, а затем, с течением времени и развитием технологии, цена прочтения генома упала ниже 1000 долларов.
В сравнении с «классическим» культивируемое мясо будет иметь ряд преимуществ. Среди них — гарантированное отсутствие болезнетворных микроорганизмов, а также, скорее всего, сниженное содержание гормональных препаратов, которые активно используют некоторые хозяйства при выращивании сельскохозяйственных животных. Некоторые из сторонников данной технологии также предсказывают, что синтетическое мясо будет иметь преимущества с точки зрения уменьшения воздействия опасных химических веществ, таких как пестициды и фунгициды, на окружающую среду и человека.
Примечателен тот факт, что в теории после начала этого процесса мясо можно будет производить практически бесконечно, не включая в процесс новые клетки, взятые из животного организма. В этом вопросе стоит учитывать пределы Хейфлика, которые пока еще не были установлены для различных видов сельскохозяйственных животных. Однако предполагают, что одна родительская клетка, имеющая лимит Хейфлика, равный 75 [4], способна удовлетворить как минимум треть годового глобального спроса на мясо (исходя из пересчета данных за 2005–2012 и 2017 годы, согласно которым мировое потребление мяса растет приблизительно на 100 миллионов тонн за 7 лет и на 70 миллионов тонн за 5 лет). Налицо — огромный потенциал для удовлетворения спроса потребителя.
Однако помимо решения возможной проблемы нехватки продовольствия, существуют также и иные преимущества, которые не приходят на ум сразу. В первую очередь это — освобождение огромных сельскохозяйственных площадей, приспособленных под пастбища. Кроме того, по большей части отпадет необходимость в выращивании части кормовых культур. Сократятся объемы загрязнения окружающей среды метаном, способствующим усугублению парникового эффекта. Оценка потенциала снижения затрат ресурсов основана сейчас лишь на гипотетических моделях того, каким образом может повлиять на эти сферы выращивание мяса. Ханна Туомисто (Hanna Tuomisto) и ее коллеги в статье 2011 года сравнили культивируемое мясо с традиционным производством говядины, овцы, свинины и птицы. В ходе своего исследования они обнаружили, что культивация мяса в сравнении с традиционным выращиванием этих животных на убой производит примерно на 78–96% меньше выбросов парниковых газов, занимает на 99% меньше сельскохозяйственных угодий, требует на 82–96% меньше водных ресурсов, и использует на 7–45% меньше энергии [22]. «Разброс» в процентных показателях здесь зависит от того, с мясной продукцией какого вида идет сравнение (хотя птица потребляет меньше энергии).
Отчасти, конечно, это может навредить некоторым сопутствующим сферам промышленности, будь то производство комбикормов или вакцин для профилактики зоонозов и т.д. Однако можно предположить, что процесс внедрения технологии в промышленность будет происходить достаточно плавно, ведь оно требует оборудования высокотехнологичных заводов с соответствующим персоналом, поэтому «краха» для сопутствующих производств не наступит (хотя объемы и сократятся). Ну и, в конце концов, с точки зрения этики подобная продукция лучше и «гуманнее», нежели привычная мясная продукция, ведь в этом случае нет необходимости убивать огромное число животных для удовлетворения собственных потребностей.
Наконец, существует также проблема продвижения на рынке, возникающая в связи с особенностями общественного восприятия культивируемого мяса. Согласно исследованиям Вербека, Санса и ван Лу [23], невозможно точно предсказать отношение к продукту, так как он еще не был полноценно представлен на рынке. Однако руководствуясь результатами тех же исследований и проведенных опросов, можно сказать, что лишь незначительное количество людей категорически отказывается употреблять подобную продукцию. Одной из возможных проблем на начальных этапах интеграции культивируемого мяса в рынок продуктов питания может стать несколько негативное отношение к нему из-за «искусственного» происхождения, на что указывают соответствующие исследования [24]. Ряд ученых, прогнозирующих восприятие данного продукта потребителем, сходится во мнении, что с точки зрения вегетарианцев культивируемое мясо будет куда более приемлемым, нежели «традиционное». Тем не менее по результатам исследований упомянутых Вербека, Санса и ван Лу [23], вегетарианцы менее склонны верить в «здоровость» культивируемого мяса — потому лишь на их реакцию в данном вопросе опираться не стоит. На восприятие культивируемого мяса может также повлиять и «более ранний» опыт потребления «синтетической» продукции. Если то же искусственное молоко или яичный белок, имеющие возможность более быстрой и широкой коммерциализации, поступят на рынок раньше «мяса из пробирки», то опыт потребления данной продукции может повлиять и на отношение к культивируемому мясу [24].
Что же в итоге? Одно можно сказать точно — данная технология будет развиваться и дальше, но какими темпами — пока точно не ясно. На темпы ее развития в первую очередь влияет интерес со стороны инвесторов, которые могут обеспечить финансовую поддержку энтузиастов, занимающихся развитием этой технологии [24]. Однако постепенное технологическое развитие позволяет находить новые методы совершенствования процесса производства культивируемого мяса. Наиболее актуальными проблемами всё еще являются цена (несмотря на ее значительное снижение), необходимость создания подходящего каркаса, а также придание соответствующих вкуса, запаха, внешнего вида «мясу из пробирки». Согласно исследованиям, можно предположить, что отношение к этому продукту будет зависеть от множества различных факторов [24], однако при правильной подаче и ценовой доступности потребители, скорее всего, положительно воспримут «мясо из пробирки» на прилавках магазинов.
Таким образом, после решения проблем, препятствующих промышленным масштабам производства, человечество плавно перейдет к употреблению культивируемого мяса — в определенном смысле более здоровому и чистому продукту, позволяющему отойти от традиционного производства путем выращивания и убоя сельскохозяйственных животных. Этот процесс, вероятнее всего, неизбежен — численность населения с каждым годом растет, равно как и его запросы на мясную продукцию. Остается надеяться, что эта технология будет отточена и выведена в производство до момента наступления острой нехватки продовольствия, и сполна удовлетворит запросы будущих поколений на мясо.
Литература
- Popper N. (2014). Behold the beefless ‘impossible whopper. The New York Times;
- M.A Benjaminson, J.A Gilchriest, M Lorenz. (2002). In vitro edible muscle protein production system (mpps): stage 1, fish. Acta Astronautica. 51, 879-889;
- Tomohiko Kazama, Masaki Fujie, Tuyoshi Endo, Koichiro Kano. (2008). Mature adipocyte-derived dedifferentiated fat cells can transdifferentiate into skeletal myocytes in vitro. Biochemical and Biophysical Research Communications. 377, 780-785;
- P.D. Edelman, D.C. McFarland, V.A. Mironov, J.G. Matheny. (2005). Commentary: In Vitro-Cultured Meat Production. Tissue Engineering. 11, 659-662;
- Mark J. Post. (2012). Cultured meat from stem cells: Challenges and prospects. Meat Science. 92, 297-301;
- Mark J Post. (2014). Cultured beef: medical technology to produce food. J. Sci. Food Agric.. 94, 1039-1041;
- Aleksander Skardal, Jianxing Zhang, Glenn D. Prestwich. (2010). Bioprinting vessel-like constructs using hyaluronan hydrogels crosslinked with tetrahedral polyethylene glycol tetracrylates. Biomaterials. 31, 6173-6181;
- Иванов Ю.А. и Петров Е.Б. (2016). Разработка биореактора для производства культурального мяса. «Вестник ВНИИМЖ». 1, 3–6;
- Surendranath P. Suman, Poulson Joseph. (2013). Myoglobin Chemistry and Meat Color. Annu. Rev. Food Sci. Technol.. 4, 79-99;
- Rebecca L. Carrier, Maria Papadaki, Maria Rupnick, Frederick J. Schoen, Nenad Bursac, et. al.. (1999). Cardiac tissue engineering: Cell seeding, cultivation parameters, and tissue construct characterization. Biotechnol. Bioeng.. 64, 580-589;
- R. G. Dennis, B. Smith, A. Philp, K. Donnelly, K. Baar. (2009). Bioreactors for Guiding Muscle Tissue Growth and Development. Bioreactor Systems for Tissue Engineering. 39-79;
- Courtney A. Powell, Beth L. Smiley, John Mills, Herman H. Vandenburgh. (2002). Mechanical stimulation improves tissue-engineered human skeletal muscle. American Journal of Physiology-Cell Physiology. 283, C1557-C1565;
- Mai T. Lam, Yen-Chih Huang, Ravi K. Birla, Shuichi Takayama. (2009). Microfeature guided skeletal muscle tissue engineering for highly organized 3-dimensional free-standing constructs. Biomaterials. 30, 1150-1155;
- Jeffrey T. Borenstein, H. Terai, Kevin R. King, E.J. Weinberg, M.R. Kaazempur-Mofrad, J.P. Vacanti. (2002). . Biomedical Microdevices. 4, 167-175;
- Bernhard Frerich, Karsten Winter, Konstanze Scheller, Ulf-Dietrich Braumann. (2012). Comparison of Different Fabrication Techniques for Human Adipose Tissue Engineering in Severe Combined Immunodeficient Mice. Artificial Organs. 36, 227-237;
- M.V. Dodson, S. Wei, M. Duarte, M. Du, Z. Jiang, et. al.. (2013). Cell Supermarket: Adipose Tissue as a Source of Stem Cells. J. Genomics. 1, 39-44;
- Femke Verseijden, Sandra J. Posthumus-van Sluijs, Johan W. van Neck, Stefan O. P. Hofer, Steven E. R. Hovius, Gerjo J. V. M. van Osch. (2012). Vascularization of prevascularized and non-prevascularized fibrin-based human adipose tissue constructs after implantation in nude mice. J Tissue Eng Regen Med. 6, 169-178;
- E. Claeys, S. De Smet, A. Balcaen, K. Raes, D. Demeyer. (2004). Quantification of fresh meat peptides by SDS–PAGE in relation to ageing time and taste intensity. Meat Science. 67, 281-288;
- Бармина С. (2019). Очаковский комбинат пищевых ингредиентов представил первую в России котлету из искусственного мяса. «Площадь Свободы»;
- Кулишов К.Ю. (2017). Инновационная технология производства искусственного мяса. «Материалы международной студенческой научной конференции». 136–138;
- Геном человека: как это было и как это будет;
- Hanna L. Tuomisto, M. Joost Teixeira de Mattos. (2011). Environmental Impacts of Cultured Meat Production. Environ. Sci. Technol.. 45, 6117-6123;
- Wim Verbeke, Pierre Sans, Ellen J Van Loo. (2015). Challenges and prospects for consumer acceptance of cultured meat. Journal of Integrative Agriculture. 14, 285-294;
- Neil Stephens, Lucy Di Silvio, Illtud Dunsford, Marianne Ellis, Abigail Glencross, Alexandra Sexton. (2018). Bringing cultured meat to market: Technical, socio-political, and regulatory challenges in cellular agriculture. Trends in Food Science & Technology. 78, 155-166;
- Jianming Liu, Xin Lv. (2014). The Pharmacokinetics and Pharmacodynamics of Lidocaine- Loaded Biodegradable Poly(lactic-co-glycolic acid) Microspheres. IJMS. 15, 17469-17477.







