Генетический профиль с рождения: эффективность применения полногеномного секвенирования в клинической практике
14 февраля 2022
Генетический профиль с рождения: эффективность применения полногеномного секвенирования в клинической практике
- 1122
- 2
- 1
Сегодня мы входим в новую эру медицины
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В конце сентября 2021 года JAMA Pediatrics опубликовал результаты исследования по внедрению полногеномного секвенирования для ранней диагностики наследственных заболеваний у младенцев, находящихся в критическом состоянии. Авторы статьи отмечают, что представленные результаты демонстрируют эффективность WGS при оценке тяжести состояния новорожденных с подозрением на генетическое заболевание. Действительно ли полногеномное секвенирование ведет к целенаправленному и более качественному уходу за пациентами? Разбираемся вместе!
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Сегодня важно рассматривать реальные возможности прочтения ДНК в рамках персонализированной медицины. А значит, внедрение WGS, или полногеномного секвенирования , и других методов генетического тестирования неоспоримо считается наиболее ценным с точки зрения диагностической мощности. Только на основе генетического профиля человека возможно формирование индивидуального плана лечения заболевания.
WGS (whole-genome sequencing) — исследование всей последовательности ДНК человека, включая как белок-кодирующие участки (экзоны), так и некодирующие, «молчащие», области генома. Полногеномное секвенирование дает максимально полную информацию о выявленных известных или ранее не встречавшихся генетических изменениях, которые могли стать причиной развития заболевания.
Может показаться, что это заявление остается скорее мечтой юного ученого, но за последние годы стремительное накопление геномных, транскриптомных и протеомных данных говорит об обратном .
Образованного человека в 2021 году существованием нуклеотидов не удивить, поэтому разбирать по крупицам историю секвенирования в этой статье мы не будем, но если вдруг появится желание освежить в памяти пройденное или поглубже копнуть в мир биотехнологий, то советуем почитать «12 методов в картинках» на «Биомолекуле» [1].
Камнем преткновения в этом направлении по-прежнему остается недостаток контрольных исследований на реальной популяции, подтверждающих влияние такой диагностики на ведение больных.
Таким образом, чем раньше мы начнем говорить о персонализированной медицине в практике клиницистов — и чем больше исследований они смогут проводить, тем раньше наука получит необходимые популяционные данные, и тем ранее каждый из нас сможет получить грамотное и качественное лечение.
Отнюдь не в мечтах дело: технологии не стоят на месте. Если раньше разбор генома стоил 2,7 миллиарда долларов и отнимал годы, сейчас потребуется несколько дней и цифры, которые хотя бы помещаются в окошке калькулятора [2]. Поэтому сегодня мы говорим не о мечтах юного биохимика, мы говорим о возможностях.
Генетическая патология — одна из главных причин госпитализации новорожденных в ОРИТ (отделение реанимации и интенсивной терапии) . Немаловажно, что заподозрить ее удается не сразу, зачастую методом исключения.
Приоритетом в патологии новорожденных считаются ферментопатии (общее название болезней или патологических состояний, развивающихся вследствие отсутствия или нарушения активности каких-либо ферментов), поскольку их клинический эффект проявляется в первые часы и/или дни жизни. Пока что в России предусмотрено обследование новорожденных на следующие наследственные заболевания: фенилкетонурия, муковисцидоз, врожденный гипотиреоз, адреногенитальный синдром и галактоземия [3]. Однако в июне 2021 года озвучено желание правительства расширить неонатальный скрининг до 36 заболеваний.
В свою очередь, использование полного экзомного секвенирования, при котором исследуется примерно 2% генома, кодирующего белки, не может идти в противовес с WGS, где оценивается 95% ядерной и митохондриальной ДНК. Это и было подтверждено в исследовании, где оценка диагностической эффективности составила от 20% до 50% [4], [5].
Отметим, что традиционное генетическое тестирование рассматривает только один или несколько генов, а ведь ранее неизвестные гены, или гены «молчащей» ДНК, могут быть идентифицированы как способствующие заболеванию. Например, изменения образа жизни или факторов окружающей среды, могут опосредовать эффекты генетической предрасположенности. Гены, участвующие в метаболизме лекарственных препаратов, сыграют решающую роль при назначении дозировки. Генотипирование раковых клеток, позволит врачам выбирать лучшую химиотерапию и потенциально подвергать пациента менее токсичному лечению [6].
В статье, опубликованной в JAMA Pediatrics в сентябре 2021 года, представлены результаты по двум контрольным группам (рис. 1). Первая — группа раннего обследования (через 15 дней после включения в исследование; 176 человек). Вторая — группа отсроченного обследования (через 60 дней после включения в исследование; 178 человек) [4]. Период наблюдения составил 90 дней. Среди отобранных участников были младенцы в возрасте от 0 до 120 дней (средний возраст 15 дней), поступившие в отделение интенсивной терапии с подозрением на генетическое заболевание. Проведение исследования не влияло на длительность госпитализации и выживаемость младенцев. Работа велась в пяти учебных медицинских центрах США при финансовой поддержке компании Illumina Inc. [4].
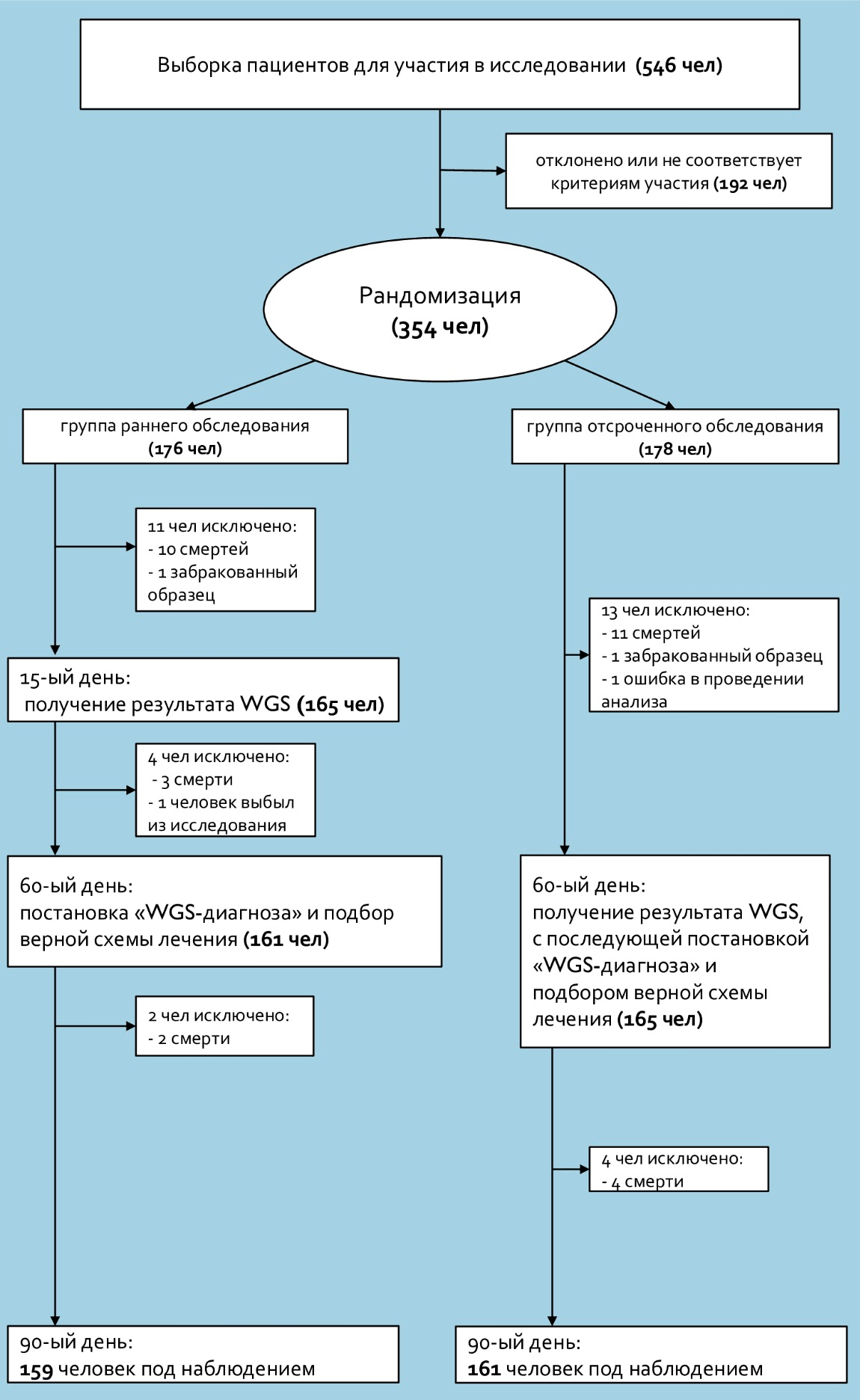
Рисунок 1. Дизайн включения и рандомизации исследования
[4], рисунок адаптирован
Полученные данные подтвердили значимость WGS? Авторы статьи заявляют: внедрение полногеномного секвенирования удваивает эффективность диагностики.
В действительности данные полногеномного секвенирования (табл. 1) позволили уже к концу второго месяца (60 дней) в первой группе (диагностика была проведена на 15-й день после включения в исследование) изменить схему лечения для 34 детей, во второй (диагностика была проведена буквально в день регистрации данных) у 17 детей. К тому же на этом этапе свой «WGS-диагноз» получили 55 детей из первой группы и 27 детей из второй [4].
Вдобавок к приведенным выше результатам, авторы указывают данные, полученные в последний день клинического исследования (90-й день). В них количество младенцев во второй группе с измененной схемой лечения удвоилось (62 из 178), как и младенцев, получивших «WGS-диагноз» (56 из 178) (табл. 1) [4].
| Группа раннего обследования | Группа отсроченного обследования | Все участники исследования | ||
|---|---|---|---|---|
| На 60-й день | ||||
| Диагностическая эффективность (чел.): | 55/176 | 27/178 | 82/354 | |
| Схема лечения (чел.): | ||||
| изменена | 34/161 | 17/165 | 51/326 | |
| без изменений | 127/161 | 148/165 | 275/326 | |
| На 90-й день | ||||
| Диагностическая эффективность (чел.): | 55/176 | 56/178 | 111/354 | |
| Схема лечения (чел.): | ||||
| изменена | 38/159 | 45/161 | 83/326 | |
| без изменений | 123/159 | 120/161 | 243/326 | |
Немаловажно, что с помощью полногеномного секвенирования удалось поставить диагнозы и недоношенным детям, находящимся в критическом состоянии. Изменение схемы лечения в 8% случаев было направлено на обнаруженную с помощью WGS генетическую природу заболевания. Встречались и случаи, затронувшие смену назначенных ранее препаратов [4].
Авторы статьи приводят несколько «WGS-диагнозов», которые привели к интересным клиническим случаям.
У новорожденного мальчика в возрасте 29 дней, благодаря проведенному полногеномному секвенированию, был обнаружен синдром Вискотта—Олдрича . В кратчайшие сроки ребенок получил корректирующую терапию. Позже врачи сумели вовремя провести трансплантацию костного мозга [4].
Синдром Вискотта—Олдрича — наследственное заболевание, сцепленное с Х-хромосомой. Представляет собой первичный иммунодефицит, который включает в себя комбинированные нарушения звеньев гуморального и клеточного иммунитетов [7].
В представленном выше клиническом случае авторы статьи проиллюстрировали значимость результатов полногеномного секвенирования на этапе диагностики. Вовремя обнаруженная генетическая патология способствовала выстраиванию верного, а самое главное, своевременного лечения. Что касается истории второго маленького пациента, то проведенное исследование стало спасением от назначенной ранее общепринятой терапии.
Девочка, 11 дней. Была доставлена в ОРИТ с эпилепсией. В результате секвенирования обнаружили неожиданную вариацию в гене KCNQ2 и при последующем дополнительном обследовании приняли решение остановить неэффективную терапию пиридоксином [4].
Ген KCNQ2 кодирует калиевые потенциал-зависимые ионные каналы в головном мозге. Относится к генам, отвечающим за развитие генетических эпилептических энцефалопатий, регулируемых ионными каналами [8].
Таким образом, исследователи подробно описали свои результаты и значимость комплексного генетического тестирование младенцев, нуждающихся в неотложной помощи. Авторы отмечают, что полногеномное секвенирование должно быть реализовано в системах здравоохранения, поскольку напрямую влияет на ведение маленьких пациентов. В довершение всего, данная методика находит поддержку у врачей и родителей [4].
Пожалуй, основным ограничением этого исследования было время наблюдения. В заключение, авторы указывают на необходимость дальнейших тщательных исследований. Но акценты в статье расставлены все же оптимистично.
Насколько реально внедрить подобную систему диагностики в обычной больнице? Ранее мы озвучивали новость о расширении программы скрининга новорожденных. Основные требования подготовительной работы в этом направлении, по словам директора Медико-генетического научного центра имени академика Н.П. Бочкова Сергея Куцева:
...нужно написать клинические рекомендации, разработать стандарты оказания медицинской помощи. Закупить необходимое оборудование. Обучить врачей, как генетиков, которые ведут прием пациентов, так и лабораторных генетиков, которые будут проводить тестирование [9].
Что касается внедрения полногеномного секвенирования в общую врачебную практику, данная методика потребует минимум подобного объема подготовительной работы. К тому же, полученный объем информации о геноме конкретного человека требует дополнительного разбора ряда тонких этических моментов. Граница между лечением и улучшением в области медицинской генетики — не очевидна. Успехи в изучении генома человека делают реальным скорейшее наступление эпохи персонализированной медицины. Однако ряд проблем возникает при суждениях о возможности такого подхода закрепить неравенство людей не в стартовых условиях: образование, территориальная принадлежность, условия среды, а в самой природе людей .
Здесь разрешить сомнения помогает декларация, принятая ЮНЕСКО, в которой определены обязанности государства по обеспечению свободы проведения научных исследований генома человека с учетом изложенных в ней принципов, соблюдения прав и свобод человека, уважения достоинства и охраны здоровья людей.
Основной целью внедрения WGS должно быть уменьшение страданий, улучшение состояния здоровья каждого человека и предотвращение ущерба здоровью будущих поколений. Результаты данной статьи подтверждают: эти цели реальны. На сегодняшний день WGS уже доказало свою эффективность в первые же дни человеческой жизни. Бóльшая часть попыток развернуть долгосрочные предположения о последствиях граничат с антиутопическим художественным вымыслом.
Более того, к подготовительным этапам по внедрению полногеномного секвенирования необходимо отнести и усовершенствование программ дополнительного образования или программ переподготовки специалистов. На базе каких научных институтов могло бы проводиться обучение? Представителей какого направления специалитета стоит рассматривать первостепенно? Иными словами, только на составление схемы реализации WGS в клинической практике потребуется несколько лет, не говоря уже о его проведении в реальной жизни в обычной больнице.
Затронем также денежный вопрос. Компания Illumina, которая является спонсором данного исследования, обеспечивает полногеномное секвенирование на платформе DRAGEN Bio-IT. Она производит точный и сверхбыстрый вторичный геномный анализ данных секвенирования для всего генома человека с 30-кратным охватом примерно за 25 минут. Данное исследование поддерживает амбиции компании по внедрению ранней коммерческой диагностики, однако стоимость WGS может стать серьезным препятствием для его внедрения в обиход. Все же авторы прогнозируют снижение стоимости к 2030 году, если недавние прогнозы в отношении WGS за 20 долларов верны [4]. Скажем честно, когда-то и NGS казался недосягаемым.
Что касается «косых взглядов» на однозначную выгоду компании от получения конкретных результатов, то в отношении данного исследования такие сомнения малоприменимы в контексте научной значимости публикации. Авторы сделали упор на инновационный подход ранней диагностики новорожденных, средний возраст которых составляет 15 дней. Осуществление такого исследования возможно только при поддержке компании, обладающей существенным авторитетом, репутацией и финансовыми возможностями. Результаты исследования несомненно выгодны компании, так как укрепляют ее позицию в сфере коммерческой диагностики, однако имеют гораздо больший академический вес в силу своей инновационности. Компания известна громкими проектами, так как практически все революционные прорывы в сфере генетического тестирования были совершены с помощью технологий Illumina . Таким образом, финансовая поддержка данного проекта этой компанией — не почва для сомнений, а скорее, негласная гарантия, что WGS — это новые возможности для лечения.
В чем секрет успеха, или как Illumina удается удерживать 90% рынка? Советуем ознакомиться с публикацией Мэттью Херпера в Forbes: «Расшифровать ДНК: как компания Illumina ускоряет генетическую революцию».
В заключении, следует вернуться к вопросу, с которого мы начинали обзор: «Действительно ли полногеномное секвенирование ведет к целенаправленному и более качественному уходу за пациентами?». Данная публикация отвечает положительно. Представленные результаты за три месяца исследования показывают, что методика WGS помогает врачам экстренно реагировать на нетипичные случаи.
С научной точки зрения, полногеномное секвенирование, которое включает в себя не только анализ хромосомной ДНК, в том числе генов «молчащей» ДНК, но и митохондриальной ДНК, вносит значительный вклад в развитие геномных проектов.
Весьма вероятно, что этот подход себя оправдает, как инструмент своевременной диагностики редких заболеваний, и будет служить альтернативой инвазивным методам, разрешая тем самым вопросы прогнозирования, оценки риска рецидива, безопасности и эффективности применения лекарственных препаратов. С оговоркой: если этим вопросом будут заниматься не только научные сотрудники и органы управления, но и практикующие врачи. Нам повезет, если сложные вопросы, возникающие при внедрении и проведении WGS, будут активно обсуждаться и находить «общий знаменатель» на уровне профессиональных, этических и социальных последствий.
Литература
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Pauline C. Ng, Ewen F. Kirkness. (2010). Whole Genome Sequencing. Methods in Molecular Biology. 215-226;
- Литвинова М. (2021). Береги смолоду: в России предложили расширить скрининг новорожденных. «Известия»;
- The NICUSeq Study Group, Ian D. Krantz, Livija Medne, Jamila M. Weatherly, K. Taylor Wild, et. al.. (2021). Effect of Whole-Genome Sequencing on the Clinical Management of Acutely Ill Infants With Suspected Genetic Disease. JAMA Pediatr. 175, 1218;
- The 100,000 Genomes Project Pilot Investigators, Damian Smedley, Katherine R. Smith, Antonio Martin, Ellen A. Thomas, et. al.. (2021). 100,000 Genomes Pilot on Rare-Disease Diagnosis in Health Care — Preliminary Report. N Engl J Med. 385, 1868-1880;
- Hidewaki Nakagawa, Masashi Fujita. (2018). Whole genome sequencing analysis for cancer genomics and precision medicine. Cancer Sci. 109, 513-522;
- Fernandez J. (2021). Синдром Вискотта—Олдрича. Справочник MSD;
- Эпилепсия и эпилептический статус у взрослых и детей. (2021). Клинические рекомендации;
- Невинная И. (2021). Зачем расширяется программа скрининга новорожденных... «Российская газета». 180.