Генномодифицированные свиньи с улучшенным навозом
11 сентября 2023
Генномодифицированные свиньи с улучшенным навозом
- 936
- 0
- 0
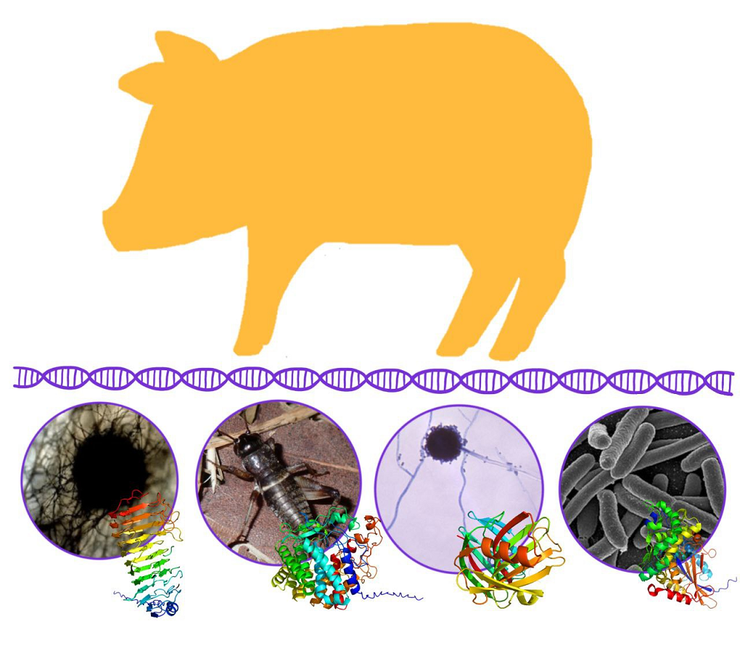
На рисунке изображены ферменты, гены которых были вставлены в геном свиньи: пектиназа, целлюлаза, ксиланаза и фитаза, а также организмы, из которых они были выделены: гриб Thielavia arenaria, сверчок Teleogryllus emma, гриб Aspergillus niger и бактерия Escherichia coli.
Рисунок в полном размере.
коллаж автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Свиноводство наносит большой ущерб окружающей среде, так как забирает большое количество природных ресурсов и производит много опасных отходов. Чтобы смягчить этот ущерб, а заодно и повысить эффективность мясного производства, можно сделать свинью немного похожей на корову. Для этого ученые из Южно-Китайского сельскохозяйственного университета добавили в ее геном гены ферментов, расщепляющих фитиновую кислоту и полисахариды клеточных стенок растений, благодаря чему свиньи смогли усваивать эти соединения. Это позволило им быстрее набирать массу и уменьшило содержание азота и фосфора в навозе. Это наглядный пример использования генной инженерии для решения экологических проблем.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа заняла второе место в спецноминации «Синтетическая биология» конкурса «Био/Мол/Текст»-2023/2024.
Эта работа заняла второе место в спецноминации «Синтетическая биология» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Азот и фосфор. В чем проблема?
Свиноводство требует больших затрат природных ресурсов и наносит значительный ущерб окружающей среде. На огромных территориях исконные экосистемы превращаются в пашни для выращивания кормов. На них приходится более трех четвертей всех сельскохозяйственных угодий.
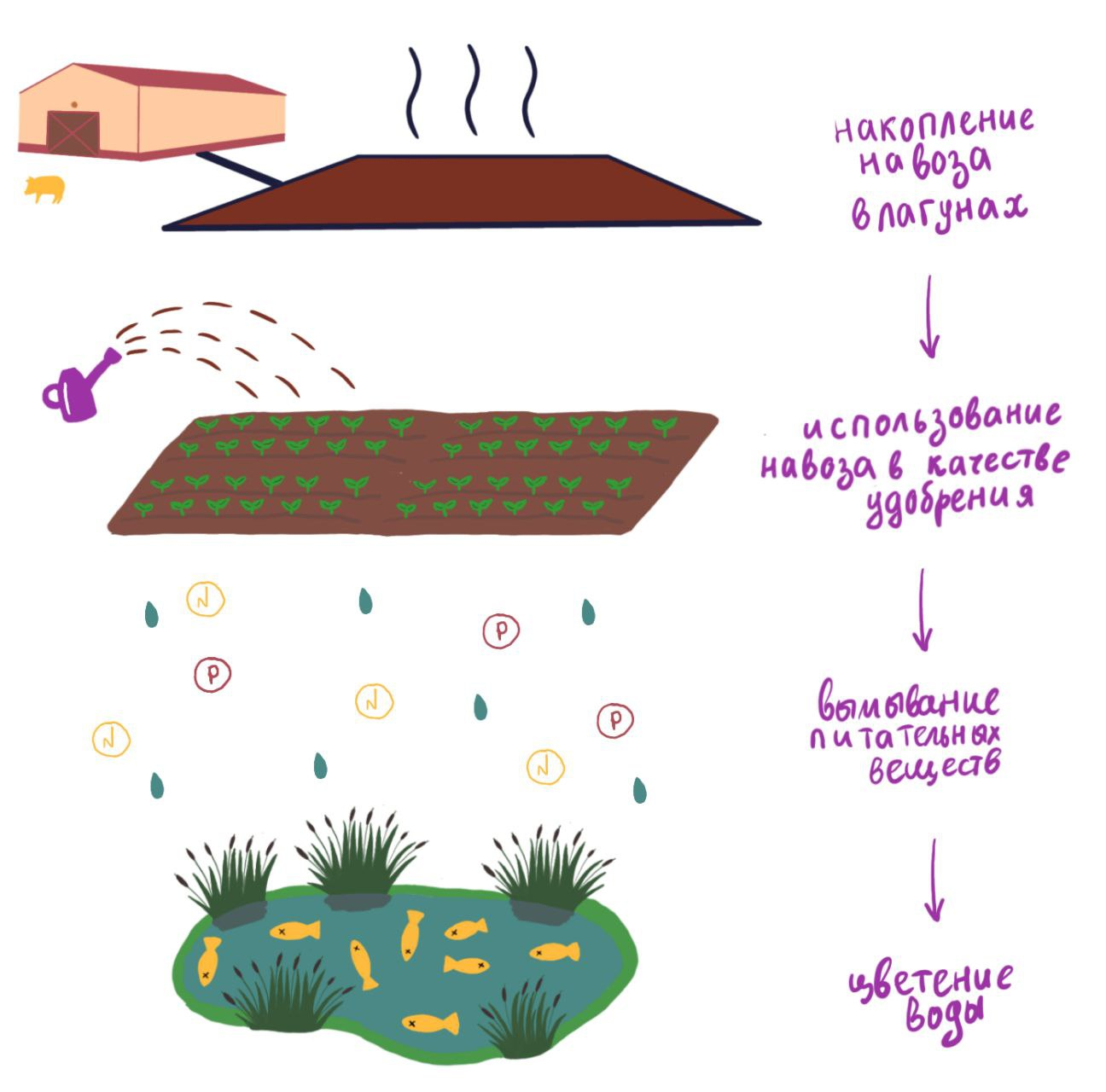
Особенно серьезные проблемы возникают при неправильной утилизации отходов. Навоз содержит большое количество азота и фосфора, и его попадание в водоемы приводит к цветению воды. Из-за бурного размножения микроскопических водорослей, получивших доступ к питательным веществам, уменьшается количество растворенного кислорода, что приводит к гибели водных животных. Кроме того, некоторые водоросли выделяют токсины, из-за чего вода становится опасной для человека. Возможное решение проблемы — уменьшение содержания азота и фосфора в навозе, а для этого необходимо улучшить их усвоение в организме свиньи.
У животных нет ферментов, расщепляющих полисахариды в составе клеточных стенок растений: целлюлозы, гемицеллюлозы и пектинов. Однако у некоторых растительноядных животных есть симбиотические микроорганизмы, обеспечивающие их этими ферментами. Так, у жвачных животных симбионты обитают в сычуге — одной из камер сложного желудка.
Свиньи не являются жвачными животными. Их желудок простой, а не многокамерный, и в нем нет симбиотических микроорганизмов (рис. 1). Поэтому свиньи не могут переваривать полисахариды в растительных клеточных стенках. Энергия, запасенная в этих соединениях, остается для них недоступной. Более того, полисахариды препятствуют расщеплению и всасыванию других питательных веществ. Они остаются запертыми между неразрушенными клеточными стенками и не взаимодействуют с пищеварительными ферментами и эпителием кишечника. Например, основной источник азота в навозе — непереваренные белки [1], [2].
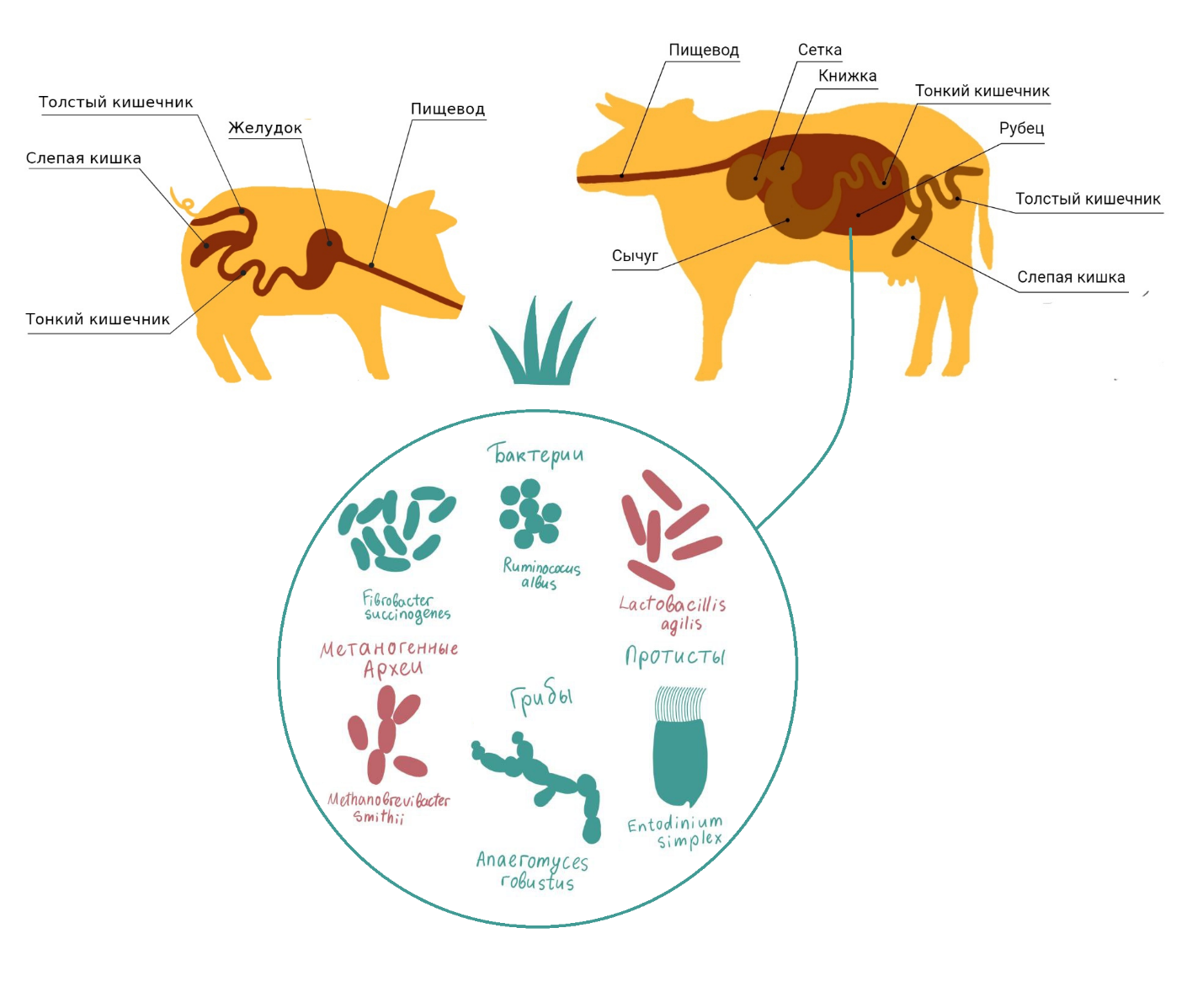
Рисунок 1. Строение пищеварительной системы жвачного и моногастричного животного; представители микрофлоры рубца жвачного. Целлюлитические микроорганизмы показаны зеленым.
на основе [2]
Еще одно соединение, которое не могут переваривать свиньи — фитиновая кислота. Фитиновая кислота служит основной запасной формой фосфора у растений. На нее приходится до 80% фосфора в семенах зерновых, бобовых и масличных культур. Фитиновая кислота содержит целых шесть фосфатных групп, поэтому ее соли — фитаты — образуют прочные комплексы с катионами двухвалентных металлов (рис. 2). Для растений это выгодно, так как это позволяет им запасать в виде фитатов еще и микроэлементы. Однако для свиней минералы в составе фитатных комплексов оказываются недоступными, так как у них нет фитазы — фермента, расщепляющего фитиновую кислоту. В результате фосфор и микроэлементы в составе фитатных комплексов оказывается в навозе, а свиньи нуждаются в пищевых добавках: в их корм добавляют фосфат кальция и другие минералы [3].
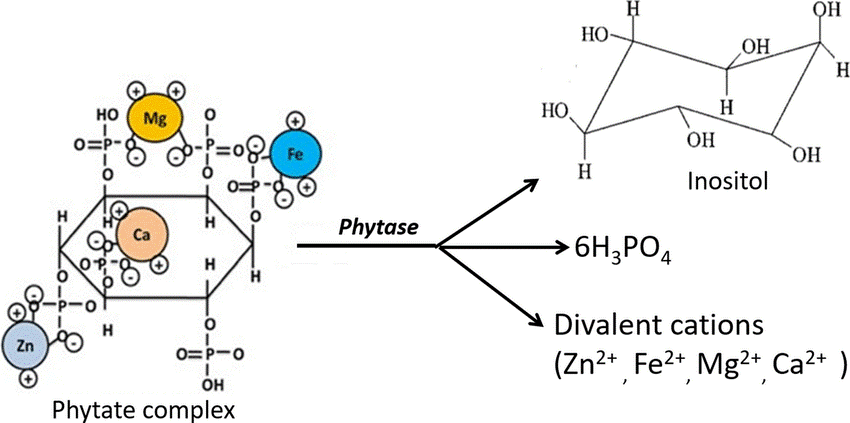
Рисунок 2. Строение фитатного комплекса и реакция, катализируемая фитазой.
Навоз является хорошим удобрением, но при его утилизации возникает ряд проблем. Во-первых, количество навоза, которое за один раз можно разместить на определенной территории, ограничено. Излишек питательных веществ может вымываться с осадками или попадать в грунтовые воды, что в конечном счете приводит к загрязнению водоемов. Избыток также может накапливаться в почве. Это приводит к превышению допустимых концентраций нитратов, фосфора, меди и цинка [4]. Это ухудшает свойства почвы и отрицательно влияет на качество растениеводческой продукции.
Дозы навоза должны рассчитываться, исходя из климатических и почвенных условий. В холодный период, когда земля покрыта снегом и процессы биодеградации замедляются, навоз вообще лучше не использовать. Не всегда поблизости от свиноферм имеется достаточно сельскохозяйственных угодий для его правильной утилизации. Из-за этого его приходится транспортировать на большие расстояния. Кроме того, азот, фосфор и другие элементы не обязательно содержатся в навозе в нужной растениям пропорции. Из-за этого в избытке могут оказываться только некоторые из них. Поэтому часто приходится смешивать навоз с неорганическими удобрениями [4].
Во-вторых, навоз является потенциальным источником патогенных микроорганизмов, поэтому его необходимо обеззараживать. Это достигается путем хранения его в течение не менее 12 месяцев перед использованием. Самый популярный способ хранения навоза — лагуны. Они представляют собой открытые котлованы с изолирующим покрытием, куда закачиваются жидкие навозные массы. При таком хранении происходит загрязнение воздуха газами, образующимися из навоза под воздействием микроорганизмов. Наибольшую опасность представляет аммиак [5]. Схематично воздействие свиноводства на окружающую среду изображено на рис. 3.
К сожалению, очень часто необходимые требования к хранению и использованию навоза нарушаются, что приводит к серьезным экологическим последствиям. Этот ущерб можно уменьшить, сделав так, чтобы свиньи смогли усваивать фитиновую кислоту и некрахмалистые полисахариды. В этих целях в корм свиньям добавляют фитазу и ферменты, расщепляющие полисахариды, полученные из бактерий и грибов [3]. Однако более эффективное и экономически выгодное решение — создание свиней, которые сами могут синтезировать эти ферменты.
Впервые ген фитазы был встроен в геном свиньи еще в 2001 году. Полученная порода была названа Enviropig. Уменьшение содержания фосфора в их навозе может, в зависимости от диеты, достигать 75%. Но, к сожалению, эти свиньи не были допущены к разведению из-за страхов, которые вызывают у людей ГМО [6].
Недавно ученые из Южно-Китайского сельскохозяйственного университета создали свиней, способных, помимо фитатов, усваивать полисахариды в клеточной стенке растений. В их геном были встроены фитаза, ксиланаза и бета-глюканаза. В их навозе содержится на 24% меньше азота и на 44% меньше фосфора. Кроме того, эти свиньи эффективнее усваивают корм и набирают массу на 24% быстрее обычных. Это значит, что им нужно меньше природных ресурсов для производства такого же количества мяса. Такой расклад выгоден и фермерам, и природе [1].
Сейчас ученые работают над созданием еще более усовершенствованной породы свиней. В их геном добавили еще целлюлазу и пектиназу. Теперь они занимаются повышением эффективности работы всех этих ферментов. Для этого можно искать более активные ферменты у других живых организмов или совершенствовать уже известные. Либо можно попытаться повысить уровень экспрессии генов, например, поменяв промотор. Можно также разработать для свиней диету, при которой ферменты будут максимально хорошо себя проявлять. Чем лучше будет новая порода свиней, тем больше у нее будет шансов добиться широкого признания [7].
Путь к успеху
Далее речь пойдет о том, как именно были созданы усовершенствованные экологичные свиньи. Чтобы обеспечить их новыми генами, пришлось преодолеть ряд трудностей, используя при этом много современных технологий.
Выбор ферментов
Для начала необходимо было выбрать ферменты, которые остаются стабильными и хорошо работают в условиях желудка свиньи. Для этого ученые исследовали активность нескольких пектиназ при разных рН и при воздействии желудочных ферментов трипсина и пепсина. Наибольшую активность показала пектиназа Pg7fn из гриба Thielavia arenaria. К тому же на нее, в отличие от других пектиназ, не влияли пищеварительные ферменты. Поэтому именно она была взята в работу. Аналогично были выбраны TeEGI — целлюлаза и β-лактамаза из сверчка Teleogryllus emma; XynB — ксиланаза из гриба Aspergillus niger; и EsAPPA — фитаза из бактерии Escherichia coli. Использованные ферменты и организмы, из которых они были выделены, изображены на обложке статьи [7].
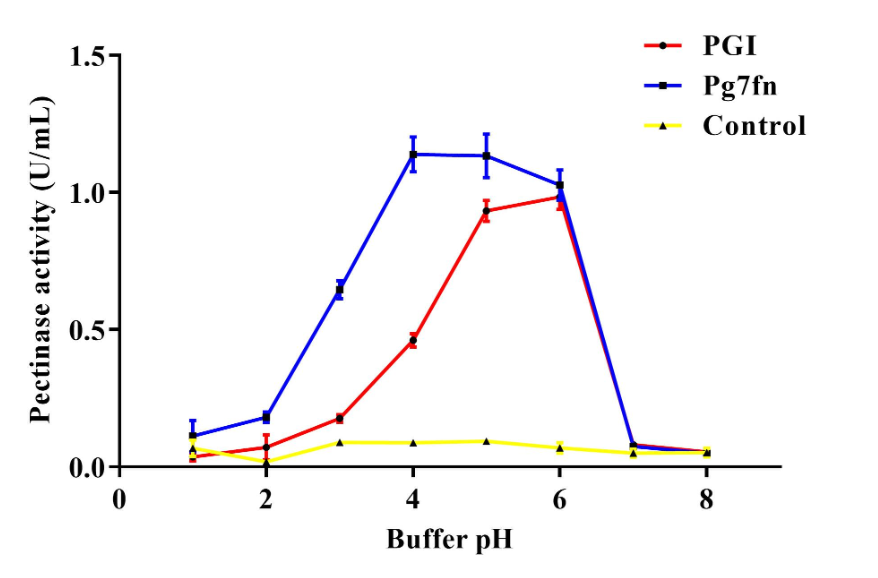
Рисунок 4. Активность двух пектиназ при разных рН.
Оптимизация кодонов
Из-за вырожденности генетического кода на одну аминокислоту приходится несколько кодонов. Несмотря на то, что генетический код более-менее универсален для живых организмов, предпочтение кодонов может варьировать. От выбора кодонов может сильно зависеть активность белкового синтеза. Наличие редких кодонов снижает уровень трансляции и увеличивает количество трансляционных ошибок. Поэтому прежде чем выбранные гены были вставлены в геном свиньи, кодоны, характерные для организмов, из которых получили гены ферментов, были заменены на те, что более распространены у свиней [8].
Передача новых генов свиньям
Для того, чтобы передать желаемые гены свинье, ученым нужно было создать вектор — молекулу ДНК, которая проникнет в клетку и обеспечит встраивание новых последовательностей в геном. Помимо целевых генов, в векторе должно быть много дополнительных элементов, выполняющих различные функции.
Схема итоговой плазмиды с целевыми генами, а также схема вспомогательной плазмиды с транспозазой, показаны на рис. 7. Далее будет подробно рассказано о функциях входящих в них последовательностей.
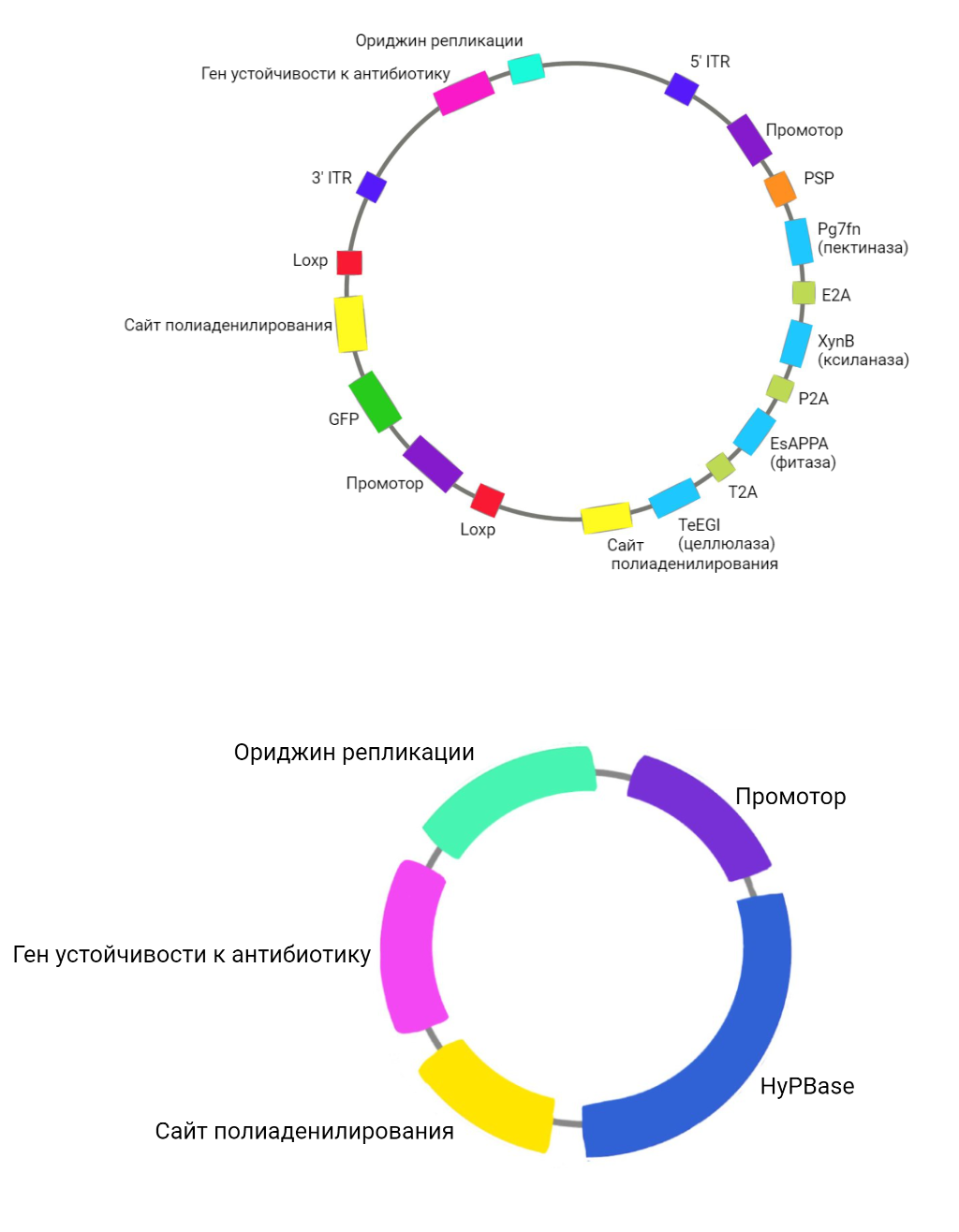
Рисунок 5. Схемы итоговой плазмиды с генами целлюлазы, пектиназы, ксиланазы и фитазы (сверху) и вспомогательной плазмиды с транспозазой (снизу). Пояснения в тексте.
на основе [7] и vectorbuilder.com
Производство плазмид
Прежде чем трансформировать клетки млекопитающего, необходимо произвести достаточное количество плазмид. Для этого, как правило, используется кишечная палочка. Поэтому в плазмидах, помимо прочего, содержались последовательности, которые используются E. coli. Это ориджин репликации — фрагмент, с которого начинается репликация, и ген устойчивости к антибиотику — селективный маркер бактерий, содержащих плазмиду.
После того, как с помощью бактерий было получено достаточное количество плазмид, они были перенесены в свиные эмбриональные фибробласты методом электропорации. Метод представляет собой воздействие на клетки электрическим током, из-за чего в их мембранах появляются временные поры, через которые эффективно проникают плазмиды.
Механизм встраивания в геном
После того, как плазмиды проникли в клетку, закодированные в них гены должны были переместиться в геном. Для этого в плазмиду был включен транспозон piggyBac (РВ). Он является ДНК-транспозоном и работает по обычному для них механизму. По краям последовательности, которую нужно вставить в геном, размещаются специальные участки — инвертированные повторы (inverted terminal repeat — ITR). Фермент транспозаза (HyPBase) распознает их и делает рядом двуцепочечные разрезы. Находящуюся между ними последовательность она встраивает в новое место (рис. 5).
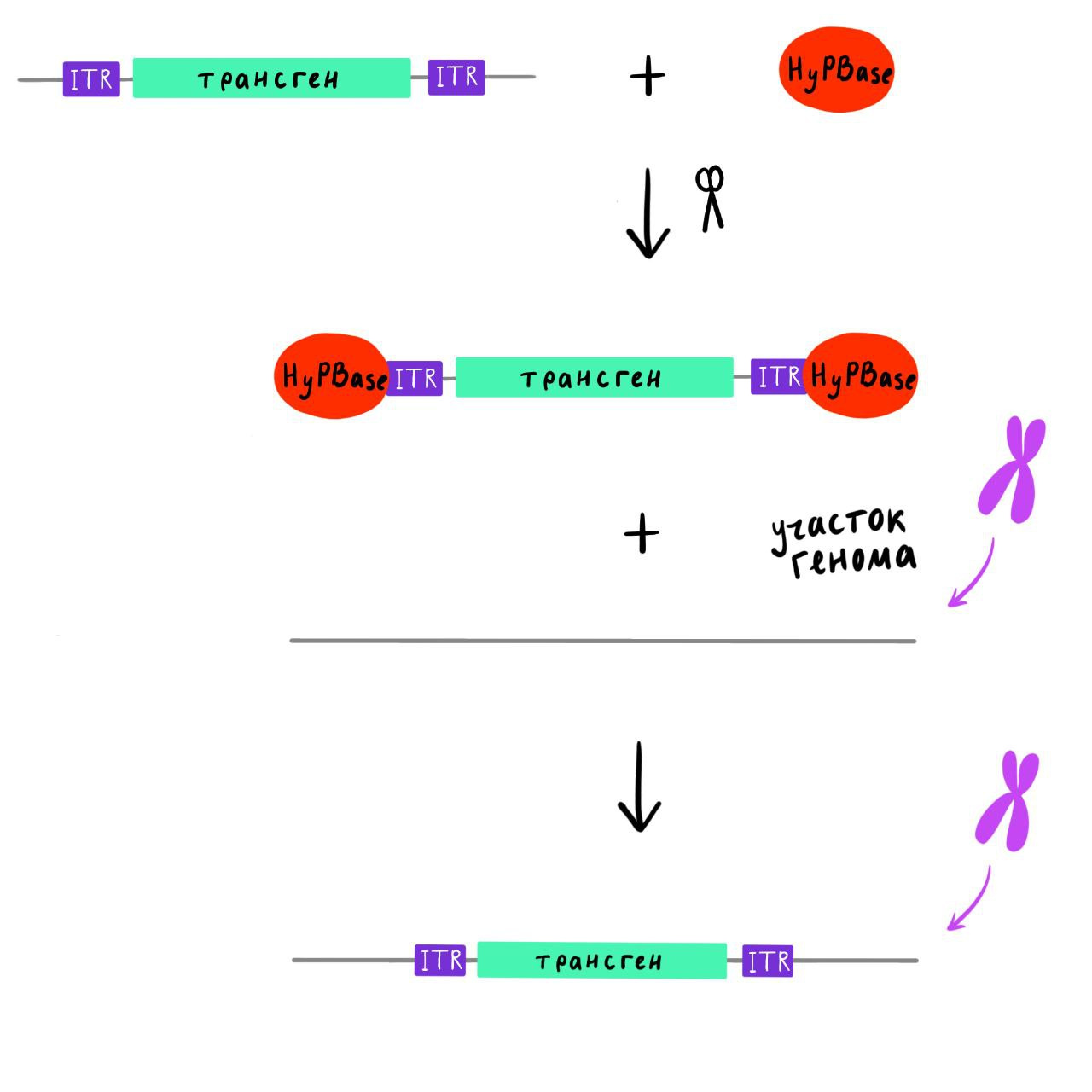
Рисунок 6. Принцип работы транспозона PiggyBac.
на основе [5]
В природных транспозонах ген транспозазы обычно находится между инвертированными повторами [5], поэтому транспозон может самостоятельно перемещаться по геному. В генной инженерии это невыгодно, так как частые перемещения увеличивают вероятность того, что последовательность встроится внутрь какого-нибудь важного гена и нарушит его работу. Для того, чтобы последовательность встроилась в геном только один раз и больше не перемещалась, транспозазу помещают не между инвертированными повторами, а на отдельной плазмиде, как и было сделано в нашем случае [9].
Идентификация клеток, получивших новые гены
Вероятность того, что плазмида проникнет в клетку, и закодированные в ней гены будут перенесены в геном, не равна единице. Поэтому перед учеными встала задача отделения фибробластов, содержащих новые гены, от тех, что их не получили. Для этого был использован стандартный генетический маркер — зеленый флуоресцентный белок, GFP. Этот белок светится зеленым в ответ на облучение синим и фиолетовым светом, поэтому содержащие его клетки легко детектировать.
Включение гена белка GFP в плазмиду сделало удобным отделение трансформированнх клеток от нетрансформированных. Однако самой свинье этот ген совершенно не нужен. Ее клетки зря тратили бы ресурсы на производство бесполезного белка. К тому же тот факт, что свиньи светятся зеленым, мог бы служить лишним поводом для беспокойства общественных масс. Поэтому ген белка GFP был удален из генома после того, как он выполнил свою задачу. Для этого в плазмиду по краям маркерного гена были добавлены специальные Loxp сайты. После того, как были отобраны светящиеся зеленым, а значит, содержащие новые гены, фибробласты, их обработали ферментом Cre-рекомбиназой. Этот фермент вырезает участок между Loxp сайтами вместе с одним из них, соединяя молекулу ДНК в кольцо. После такой обработки в геноме вместо GFP остался только один Loxp сайт [10]. Принцип работы Cre-рекомбиназы показан на рис. 6.
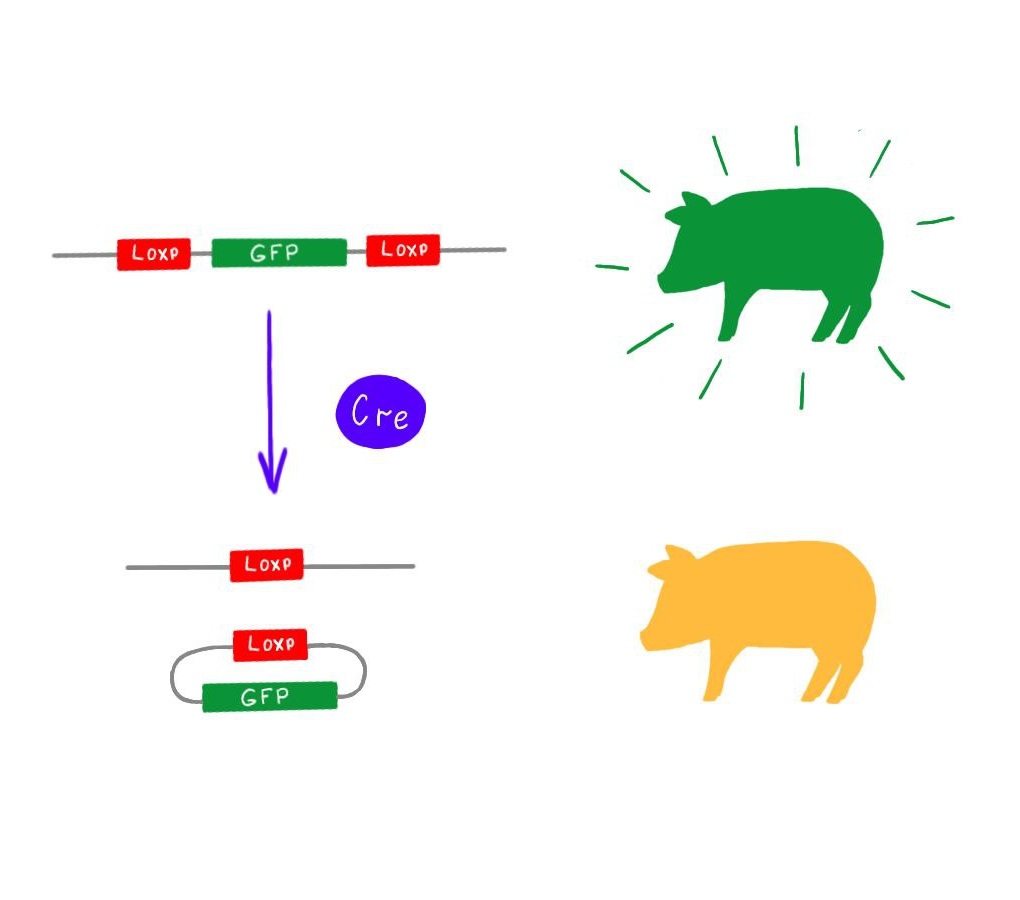
Рисунок 7. Принцип работы системы Cre-Loxp.
на основе [10]
Биосинтез новых ферментов
Для того, чтобы гены хорошо работали, их нужно было вставить в геном свиньи вместе со вспомогательными последовательностями: промотором и сайтом полиаденилирования (эти участки нужны для успешного начала и конца транскрипции, соответственно). В нашем случае в вектор входят сразу несколько генов, и у каждого, по идее, должны были быть свои промотор и сайт полиаденилирования. Из-за этого процесс создания вектора был бы очень трудоемким. Однако можно обойтись и одной парой на все гены, вставив между ними 2А-последовательности.
2А-пептиды — это небольшие последовательности аминокислот, которые могут самостоятельно вырезаться из полипептидной цепи. Происходит это из-за того, что они содержат участок, создающий препятствие для рибосомы. Она проскакивает его, и получается дырка. В природе это встречается у вирусов и нужно им для экономии места в геноме. При транскрипции образуется одна общая мРНК, а при трансляции аминокислотная последовательность распадается на отдельные белки благодаря разделяющим их 2А-пептидам [11].
Именно этот механизм использовали для того, чтобы обеспечить свинью сразу всеми нужными генами. Между ними вставили пептиды E2A, P2A и T2A. Благодаря этому можно было добавить в плазмиду только один промотор перед общей последовательностью четырех генов и один сигнал полиаденилирования после нее [7].
Тканеспецифичная эксперссия
Гены ферментов встраиваются в геном и присутствуют во всех клетках, но не во всех клетках они нужны. Лучше, чтобы они были активны только там, где ферменты смогут эффективно выполнять свою работу, например, в клетках слюнных желез. Для того, чтобы новые белки экспрессировались только там, в последовательность включили N-концевой сигнальный пептид секреторного белка околоушной слюнной железы свиньи (PSP) [7].
От фибробластов к поросятам
После того, как были получены трансформированные фибробласты, их ядра были перенесены в ооциты свиньи, из которых прежде были убраны собственные ядра. Ооциты затем были помещены в матки свиней-доноров, где они развились до поросят. Так и были получены свиньи, способные переваривать фитаты и клеточные стенки растений [7].
Заключение
Ущерб, наносимый природе животноводством, трудно переоценить. Поэтому человечество, вероятно, рано или поздно откажется от продуктов животного происхождения, заменив их растительными — культивируемым мясом и альтернативными белками. Однако этот переход явно будет очень постепенным, а решать экологические проблемы нужно как можно скорее. Поэтому использование пород животных, которые потребляют меньше природных ресурсов и производят меньше опасных отходов — это хорошая временная мера.
Литература
- Xianwei Zhang, Zicong Li, Huaqiang Yang, Dewu Liu, Gengyuan Cai, et. al.. (2018). Novel transgenic pigs with enhanced growth and reduced environmental impact. eLife. 7;
- Chloe Matthews, Fiona Crispie, Eva Lewis, Michael Reid, Paul W. O’Toole, Paul D. Cotter. (2019). The rumen microbiome: a crucial consideration when optimising milk and meat production and nitrogen utilisation efficiency. Gut Microbes. 10, 115-132;
- P. K. Gupta, H. S. Balyan, Shailendra Sharma, Rahul Kumar. (2021). Biofortification and bioavailability of Zn, Fe and Se in wheat: present status and future prospects. Theor Appl Genet. 134, 1-35;
- Lucas Benedet, Guilherme Wilbert Ferreira, Gustavo Brunetto, Arcângelo Loss, Paulo Emílio Lovato, et. al.. (2021). Use of Swine Manure in Agriculture in Southern Brazil: Fertility or Potential Contamination?. Soil Contamination - Threats and Sustainable Solutions;
- Самоделкин А.Г, Титова В.И, Дабахова Е.В. (2013). Проблемы утилизации органических отходов на свиноводческих предприятиях промышленного типа. Агрохимический вестник. 1, 31–33;
- Serguei P. Golovan, Roy G. Meidinger, Ayodele Ajakaiye, Michael Cottrill, Miles Z. Wiederkehr, et. al.. (2001). Pigs expressing salivary phytase produce low-phosphorus manure. Nat Biotechnol. 19, 741-745;
- Haoqiang Wang, Guoling Li, Cuili Zhong, Jianxin Mo, Yue Sun, et. al.. (2020). Generation of Multi-Transgenic Pigs Using PiggyBac Transposons Co-expressing Pectinase, Xylanase, Cellulase, β-1.3-1.4-Glucanase and Phytase. Front. Genet.. 11;
- Claudia Elena, Pablo Ravasi, María E. Castelli, Salvador Peirú, Hugo G. Menzella. (2014). Expression of codon optimized genes in microbial systems: current industrial applications and perspectives. Front. Microbiol.. 5;
- 10.3978/j.issn.2218-6751.2016.01.05;
- Xiuping Zou, Aihong Peng, Lanzhen Xu, Xiaofeng Liu, Tiangang Lei, et. al.. (2013). Efficient auto-excision of a selectable marker gene from transgenic citrus by combining the Cre/loxP system and ipt selection. Plant Cell Rep. 32, 1601-1613;
- Ziqing Liu, Olivia Chen, J. Blake Joseph Wall, Michael Zheng, Yang Zhou, et. al.. (2017). Systematic comparison of 2A peptides for cloning multi-genes in a polycistronic vector. Sci Rep. 7.