Гидроксилапатит — самый главный из фосфатов кальция
17 октября 2013
Гидроксилапатит — самый главный из фосфатов кальция
- 10683
- 0
- 1
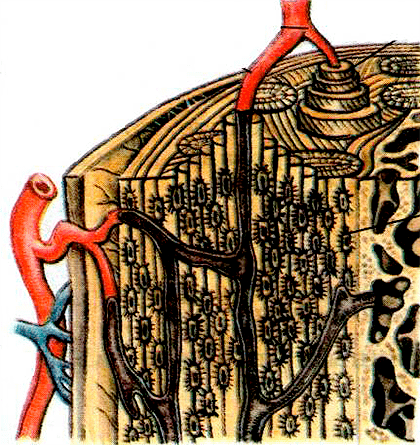
Схематичное изображение трубчатой кости. Разумеется, человеку пока не под силу искусственно создать нечто подобное, но ведь можно заставить сам организм ускорить естественный рост такой ткани!
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Заболевания, связанные с повышенной скоростью деградации костной ткани у пожилых людей, все острее ощущаются населением. Во многом это связано с увеличением продолжительности жизни вообще и состариванием так называемого «золотого миллиарда». Новые материалы на основе фосфатов кальция, пригодные для имплантации больным остеопорозом, могут частично решить эту проблему.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Современная наука ставит одной из главных своих целей продление длительности человеческой жизни. Разрабатываются новые методы лечения заболеваний, облегчается жизнь стариков, многие болезни, считавшиеся неизлечимыми ранее, практически полностью побеждены человечеством. Однако некоторые возрастные изменения заложены в организм генетически, и обычными методами с ними бороться практически невозможно.
Заболевания костной ткани занимают одну из первых строчек в рейтинге наиболее часто встречающихся у пожилых людей проблем. С возрастом нарастает потеря массы кости. Особенно от этого страдают женщины — из-за более активного вымывания из организма катионов кальция, служащего основой нашего скелета. Потеря массы костной ткани может достигать 40% у женщин старше 70 лет [1]!
Это заболевание называется остеопорозом. Пораженные им кости становятся хрупкими, с трудом справляясь с возложенной на них нагрузкой. В случае перелома срастаться такая кость будет значительно дольше, чем здоровая. Как уже упоминалось выше, главной причиной таких изменений является постепенное вымывание кальция из организма. На протяжении всей жизни у нас в организме происходят два равновесных процесса: непрерывное образование новой костной ткани и резорбция (растворение) старой. К старости равновесие смещается в сторону резорбции, и новая ткань просто не успевает занять место растворенной. А избыток катионов кальция, являющегося основным продуктом этого процесса, выводится из организма естественным путем.
Что же представляет собой человеческая кость? На рисунке 1 схематически изображено строение кости человека. Основа состоит из композита (материала, составленного из других материалов и обладающего свойствами, отличными от свойств «родителей»), представляющего собой кристаллы нестехиометрического гидроксилапатита с химической формулой:
Ca10−x−y/2(HPO4)x(CO3)y(PO4)6−x−y(OH)2−x,
и длинных цепочек белка коллагена [2]. Этот композит представляет собой пространственную матрицу, заполненную остеобластами, остеокластами, макрофагами, сетью капилляров и прочим, но в рамках этой статьи мы подробнее строение кости рассматривать не будем.
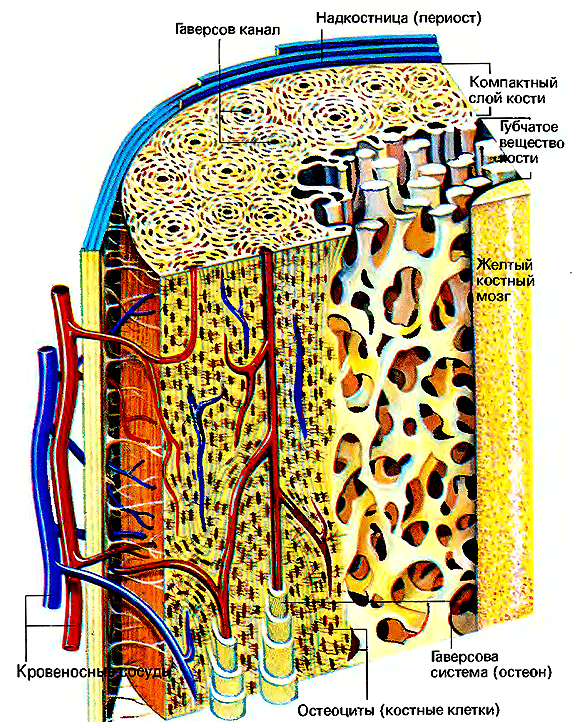
Рисунок 1. Строение трубчатой кости. Хорошо видно, что кость состоит из последовательных слоев: внешнего — надкостницы, — затем идет компактное вещество кости, губчатое вещество кости и желтый костный мозг.
Существуют различные способы сымитировать костную ткань с помощью различных материалов. Для этого используются керамические, металлические, пластиковые и даже стеклянные протезы, но все они далеки от идеала. Полноценной такую замену назвать нельзя. Одна из проблем, к примеру, — различие прочности настоящей и искусственной кости. Если материал слишком прочный, то нагрузка, которой подвергается эта часть скелета, начинает распределяться неравномерно. Наиболее прочная часть «забирает» львиную долю нагрузки, и на стыке протеза и настоящей кости возникает избыточное разрушение костной ткани. Поэтому искусственная кость должна как можно точнее соответствовать заменяемой части скелета по механическим свойствам.
Очевидно, что материал не должен быть токсичным и вызывать отмирание окружающей протез ткани. Но многие материалы, даже не являясь токсичными для человека, начинают при попадании в организм покрываться соединительной тканью. Так организм изолирует чужеродный объект. По толщине такой капсулы, называемой так же шрамом, судят о биосовместимости материала. В идеале искусственный материал должен срастаться с организмом и не оставлять никаких следов. Такой материал называют биоактивным. Примером может служить стеклянный материал BIOGLASS [3]. Служит такое «стекло» и для крепления имплантов из других материалов, и как самостоятельный биоактивный материал для имитации кости. Применяется он главным образом в стоматологии. При попадании импланта в среду организма клетки костной ткани «прорастают» в его поверхностный слой, прочно связывая имплант с костью. Для увеличения числа таких связей и, следовательно, прочности соединения необходимо увеличивать площадь поверхности материала. Чем он более пористый, тем прочнее связывается кость с искусственным элементом [4].
Таким образом, полная замена кости на искусственный материал нежелательна. Наиболее предпочтительным путем к регенерации костной ткани на сегодняшний день стала замена поврежденной части ткани на биоактивный протез, который срастется с окружающими тканями, затем ускорит естественную регенерацию и постепенно растворится без следа, оставив на костном дефекте новую ткань.
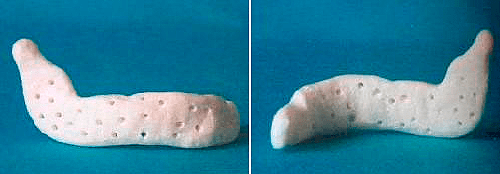
Рисунок 2. Индивидуальный протез фрагмента нижней челюсти для больного саркомой нижней челюсти. Протез изготовлен из полимера и гидроксилапатита.
Традиционно в ортопедии для этих целей применяется гидроксилапатит. Стехиометрически гидроксилапатит (далее для краткости мы будем называть его ГАП) наиболее приближен по составу к минеральной составляющей кости (по сравнению с другими фосфатами кальция). Его формула:
Ca10(PO4)6(OH)2.
Далее в статье мы расскажем, в чем преимущества и недостатки этого материала по сравнению с другими.
Что собой представляет гидроксилапатит?
Долгое время считалось, что гидроксилапатит Ca10(PO4)6(OH)2 — идеальный в плане биосовместимости материал для восстановления поврежденных костей и зубов. Первая документированная попытка использовать ГАП в качестве остеозамещающего материала относится к 1920-м годам. Однако успешное применение ГАП в указанных целях совершилось только через 60 лет. Гидроксилапатит прекрасно совместим с мускульной тканью и кожным покровом; после имплантации он может напрямую срастаться с костной тканью в организме. Высокая биосовместимость гидроксилапатита объясняется кристаллохимическим подобием искусственного материала костному «минералу» позвоночных.
Название минерала происходит от греческого «апатао» — обманываю, поскольку красиво окрашенные природные разновидности апатитов часто путали с бериллами и турмалином. Несмотря на очень широкий спектр окраски природных апатитов, вызванных различными примесями, низкая твердость (он является эталоном значения 5 по 10-балльной шкале Мооса) не позволяет рассматривать его как полудрагоценный поделочный камень.
Известно, что костный минерал содержит в заметном количестве (~8% по массе) карбонат-ионы; существует также природный минерал сходного состава — даллит. Считается, что карбонат-ионы могут занимать две разные позиции в структуре ГАП, замещая гидроксил и/или фосфат-ионы с образованием карбонатгидроксилапатита (КГАП) А- и Б-типа, соответственно. Апатит биологического происхождения относится к Б-типу. Замещение фосфат-ионов карбонат-ионами приводит к уменьшению размеров кристаллов и степени кристалличности ГАП, а это сильно затрудняет исследование природных биоминералов. Увеличение доли карбонат-ионов в составе гидроксилапатита вызывает закономерные изменения в равновесной форме кристалла. Игольчатые кристаллы «сплющиваются» до пластин, которые очень похожи на кристаллиты существующего в организме апатита [5]. Таким образом, внесением в синтезируемый минерал небольшой доли карбонат-ионов можно получить материал, аналогичный биогенному и по химическому составу, и геометрически.
Важной характеристикой ГАП является стехиометрия его состава, которую принято выражать соотношением Ca/P. Переменный состав вызван тем, что при синтезе ГАП из раствора нельзя защититься от ионов H3O+ и HPO42−, которые могут замещать соответственно ионы Са2+ и РО43− в кристаллической структуре гидроксилапатита.
Как используется гидроксилапатит?
Существуют различные методы синтеза гидроксилапатита. Их можно условно разделить на высоко- и низкотемпературные. Высокотемпературные методы не представляют для нас большого интереса, так как полученные таким образом материалы практически не биоактивны. Низкотемпературные методы можно разделить на две большие группы: гидролиз (в том числе так называемые гидротермальные методы синтеза) и осаждение из раствора. Интересен так же комбинированный метод так называемого золь–гель синтеза. В нем сухой остаток геля подвергается разложению при относительно невысокой температуре 400–700 °С (по сравнению с высокотемпературным синтезом). Материалы, полученные таким образом, представляют собой твердую, пористую керамику, по химическому составу и физическим свойствам напоминающую минерал кости.
Как реагирует организм на кальций-фосфатную керамику?
Биоактивность — комплексная характеристика совместимых с организмом материалов, учитывающая, помимо воздействия на биологические процессы роста и дифференциации клеток, также:
- скорость растворения материала в средах, создаваемых определенными группами клеток (биорезорбируемость);
- скорость осаждения материала из межтканевой жидкости на поверхность материала.
Среди требований, которые предъявляются к биоактивным материалам, применяемым в медицинской практике для восстановления целостности костной ткани, на первом месте стоят относительно высокая скорость растворения (порядка десятков мкм в год) — так называемая биорезорбируемость. Активную роль в биохимических реакциях, протекающих на границе раздела кость/имплантат с участием клеток специфических для процесса остеосинтеза, играет поверхность. Говоря о скорости резорбции материала, находящегося в межтканевой жидкости, принято сравнивать новые материалы с уже используемыми в медицине — керамикой на основе гидроксилапатита или β-трикальцийфосфата. Крупнокристаллическая керамика на основе ГАП резорбируется медленно, так что включения искусственного материала можно обнаружить в кости и через много лет. Керамика, полученная с использованием β-Ca3(PO4)2, растворяется столь быстро, что растущая кость не успевает заполнить образующиеся полости. Скорость растворения материала зависит от множества факторов: площади поверхности, строения, состава, дефектности материала. Эти характеристики определяют отклик организма на инородный имплантат. Биоактивные материалы характеризуются быстрым срастанием с костной тканью через образование промежуточного слоя ГАП, образующегося двумя возможными путями:
- Растворение фосфата кальция — осаждение гидроксилапатита.
- Осаждение ГАП из пересыщенного раствора в тканевой жидкости.
Важная процедура оценки биоактивности подразумевает тестирование in vivo. Это дорого и долго, а также сопряжено с риском. Однако ведется активная разработка методик, позволяющих уже на раннем этапе доклинических испытаний ранжировать материалы по степени биоактивности в ходе относительно простых экспериментов in vitro, моделирующих процессы в организме человека — растворение материала и осаждение ГАП на поверхности материала из растворов, подобных жидкостям организма.
Исследование биоактивности материалов проводят с использованием раствора, имитирующего ионный состав межтканевой жидкости человека. Компактные образцы исследуемого материала помещают в раствор на несколько суток при 37 °С. Процесс осаждения карбонатгидроксилапатита из модельного раствора на поверхность материала контролируют методами рентгенофазового анализа, ИК-спектроскопии и растровой электронной микроскопии.
Существует необходимость регулировать биорезорбируемость искусственных материалов, в зависимости от их назначения. Такая возможность существует благодаря различию свойств материалов с разным составом. Чтобы сделать образец более резорбируемым, нужно увеличить долю карбонат- и силикат-ионов в кристаллической решетке материала.
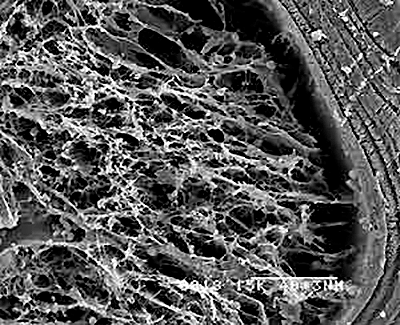
Рисунок 3. Ажурный слой частично резорбированной керамики. Снимок со сканирующего электронного микроскопа. Здесь изображен фрагмент материала, подвергнутый растворению в модельном растворе in vitro. Справа можно увидеть, каким был материал до начала резорбции.
Наилучшую биоактивность в таких исследованиях проявляет кремнийсодержащий материал. На его поверхности образуются силанольные (—SiOH) группы, активно участвуя в минерализации внешнего слоя имплантата. Такой материал интенсивно обменивается ионами с раствором: силанольные группы прочно связывают ионы кальция, способствуя формированию слоя аморфного фосфата кальция на поверхности, расслоение и кристаллизация которого приводит к образованию ажурного слоя, состоящего из частиц ГАП размером ~10 нм (рис. 3). Различия в толщине такого слоя могут служить мерой биоактивности материала: чем он толще, тем проще кость будет встраивать этот материал в свою структуру.
Еще одним из важнейших свойств современных имплантационных материалов является остеоиндуктивность — способность поддерживать жизнедеятельность остеобластов и стимулировать эктопическое (вне кости) образование костной ткани de novo. Это важнейшее свойство для искусственных имплантов. Дело в том, что для инициации костеобразования вокруг импланта необходимо микроокружение частицами живой кости. Вновь образующаяся кость постепенно срастается с окружающими имплантированными частицами, «перескакивая» с одной на другую.
Считается, что наиболее активным с точки зрения остеосинтеза является аморфная модификация гидроксилапатита. Однако в достаточной степени кристалличный ГАП с размерами кристаллитов, приближающимися к размерам кристалла в костной ткани (20–40 нм3), может показывать результаты на порядок выше аморфных цементов, использующихся в настоящее время [6].
Биоинертные материалы никак не влияют на процесс остеосинтеза. На поверхности изготовленных из них имплантатов происходит образование фиброзной ткани, препятствующей образованию связи имплантата с костью. Существует значительная вероятность отторжения таких материалов организмом, часто сопровождающегося воспалительными процессами. Тем не менее, полностью отказаться от этих материалов пока нельзя, поскольку они дешевы и легки в обработке. Основные проблемы, которые решаются при проектировании имплантатов из биоинертных материалов, — приближение упругих характеристик имплантата к характеристикам кости, а также снижение скорости коррозионных процессов.
В отличие от биоинертных синтетических материалов на основе полимеров и металлов, керамика на основе фосфатов кальция биосовместима и биоактивна, а значит, является наиболее перспективным материалом для костных имплантатов. Главным ее недостатком является хрупкость. Пока что наилучшим выходом является применение композитов из покрытых кальцийфосфатной керамикой металлов или полимеров (рис. 4). Они хорошо обеспечивают интеграцию материала в костную ткань, не позволяя образовываться фиброзной ткани вокруг биоинертного металла. Со временем протез очень прочно срастется с окружающей костью, которая заменит слой ГАПа. Процент отказа таких протезов значительно ниже, чем у металлических и пластиковых аналогов.
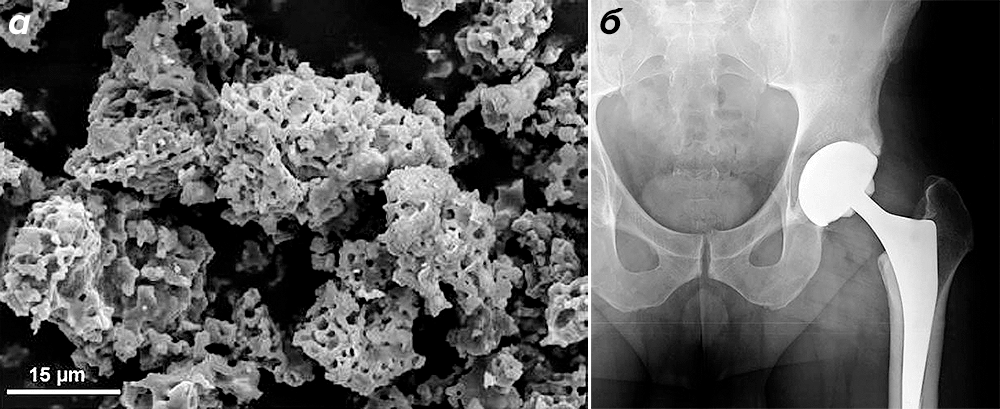
Рисунок 4. Покрытие из биоактивной керамики на протезе тазобедренного сустава. а — Пористая структура керамического покрытия. б — Рентгеновский снимок протеза, имплантированного на место тазоберенного сустава. Сам протез изготовлен из титана и полимеров.
Как придать ГАПу новые свойства?
Не все свойства, необходимые для протезирования, заложены в гидроксилапатит природой. Однако какие-то терапевтические эффекты к материалам можно добавить, усложняя состав композита дополнительными веществами. Однако это не очень удобно, так как усложнит клинические испытания, да и разрабатывать такой материал значительно труднее. Но можно добиться прогресса и получить уникальные свойства, незначительно модифицируя состав и вводя в решетку гидроксилапатита примеси других катионов и анионов. Изменяя состав керамики, можно варьировать ее прочность, размер и форму кристаллитов, скорость растворения и множество других параметров.
Модифицировать кальций-фосфатную керамику можно введением множества компонентов. Возможности для выбора такого модификатора (легирующего компонента) довольно широки: в зависимости от размеров замещаемого иона можно менять состав как на доли, так и на десятки процентов. Например, малые концентрации ионов кремния активируют регенерацию костной ткани, играя роль антигена для соответствующих клеток.
Интересны, например, биологические свойства катионов лантаноидов [7]. Применение ионов лантаноидов в пероральных препаратах ограничено их низкой способностью проходить сквозь стенки желудка и кишечника. Для улучшения доступности катионов лантаноидов можно использовать липофильные оболочки комплексов. Вещества, способные проникать сквозь клеточные мембраны, называются ионофорами. (Подробнее о них можно прочитать в статье «Неизвестные пептиды: „теневая“ система биорегуляции» [8].) Такая оболочка позволит им проникать сквозь мембрану клетки. Этот метод доставки ионов в остеобласты может стать принципиально новым подходом к лечению целого ряда заболеваний кости.
Благодаря высокому сродству к фосфатам лантаноиды прочно связываются в структуре минералов, составляющих основу костной ткани, не нарушая при этом их структуру. Лантаноиды способны даже замещать кальций в костях, параллельно подавляя развитие клеток, отвечающих за разрыв и резорбцию костной ткани. Эта способность «подражать» функциям ионов кальция позволяет рассматривать лантаноиды в качестве компонента для терапии заболеваний кости.
Частичный обмен катионов кальция на катионы лантаноидов открывает широкие перспективы для целого ряда различных материалов на основе фосфатов кальция. С помощью лантаноидов можно влиять на физические свойства получаемой керамики, регулировать скорость резорбции и даже использовать этот материал как препарат для лечения остеопороза.
На практике ГАП используют в виде цемента или пористых вкладок для заполнения трещин, каверн и других дефектов в ортопедии и челюстно-лицевой хирургии. В виде пленки его наносят на протезы из других материалов (чаще всего металлических или полимерных) для снижения риска отторжения и лучшей фиксации за счет образования новых тканей вокруг протеза. Как правило, это протезы тазобедренного сустава и различные зубные протезы.
Разумеется, искусственно синтезированный гидроксилапатит далек от идеала, и в качестве материала для имплантации при создании полноценных протезов крупных костей или суставов его пока использовать нельзя. Но использование его замечательных свойств, таких как сравнительно простое регулирование состава и морфологии кристаллитов, биоактивность и способность ускорять естественную регенерацию, позволяет делать на его основе препараты для исправления и профилактики костных дефектов уже сейчас. А это значит, что в обозримом будущем мы сможем значительно упростить лечение остеопороза, ускорить излечение переломов, а, возможно, даже и возвращать утраченные конечности с помощью искусственных костей.
Литература
- Larry L. Hench. (2005). Bioceramics. Journal of the American Ceramic Society. 81, 1705-1728;
- Вересов А.Г., Путляев В.И., Третьяков Ю.Д. (2000). Достижения в области керамических материалов. «Рос. Хим. Журн.» 6, 32–46;
- Larry L. Hench. (2006). The story of Bioglass®. J Mater Sci: Mater Med. 17, 967-978;
- Дорожкин С.В. и Агатопоулус С. (2002). Биоматериалы: Обзор рынка. «Химия и жизнь». 2, 8;
- E. D. Eanes, A. W. Hailer. (1998). The Effect of Fluoride on the Size and Morphology of Apatite Crystals Grown from Physiologic Solutions. Calcif Tissue Int. 63, 250-257;
- Qinghong Hu, Zhou Tan, Yukan Liu, Jinhui Tao, Yurong Cai, et. al.. (2007). Effect of crystallinity of calcium phosphate nanoparticles on adhesion, proliferation, and differentiation of bone marrow mesenchymal stem cells. J. Mater. Chem.. 17, 4690;
- Cheri A. Barta, Kristina Sachs-Barrable, Jessica Jia, Katherine H. Thompson, Kishor M. Wasan, Chris Orvig. (2007). Lanthanide containing compounds for therapeutic care in bone resorption disorders. Dalton Trans.. 5019;
- Неизвестные пептиды: «теневая» система биорегуляции;
- G. Renaudin, P. Laquerrière, Y. Filinchuk, E. Jallot, J. M. Nedelec. (2008). Structural characterization of sol–gel derived Sr-substituted calcium phosphates with anti-osteoporotic and anti-inflammatory properties. J. Mater. Chem.. 18, 3593.