
Глицин: часть 2. Нейромедиатор и мем
17 августа 2018
Глицин: часть 2. Нейромедиатор и мем
- 13488
- 2
- 18
Глицин имеет славу суперсредства для улучшения памяти и интеллекта. Похожими свойствами наделен препарат NZT из фильма «Области тьмы».
-
Автор
-
Редакторы
Темы
Сегодня мы продолжим разговор о глицине. В этот раз он предстанет как незаметный труженик нервной системы. Глицин — это самая простая аминокислота. Берем два атома углерода, соединяем с одним атомом азота, потом осторожно добавляем два атома кислорода и в конце добавляем протонов, чтобы занять свободные электронные связи (не надо забывать, дорогие молекулярные кулинары, что между одним атомом углерода и кислорода есть двойная связь). Это соединение, несмотря на свою простоту, много значит для нашего организма.
Такой же тормоз, как и ГАМК
Глицин — не только аминокислота, но и нейромедиатор, который выделяется в головном и спинном мозге. Нейромедиатор — это вещество, которое передает сигнал от нейрона к нейрону: один нейрон его «выплевывает», а другой — «ловит» на специальный белок, рецептор. В спинном и головном мозге глицин — тормозной медиатор. На уровне спинного мозга он за счет тормозной функции обеспечивает нормальную двигательную активность и вовлечен в процесс ноцицепции — восприятия боли.
Но нас интересуют не только сами нейромедиаторы, но и точки их приложения — специфические рецепторы. От расположения рецепторов к нейромедиатору в нервной системе, от того, запускают они потенциал действия или препятствуют его возникновению, зависит функция нейромедиатора в головном мозге. Глициновый рецептор — это белковый канал в мембране нейрона, который при активации начинает пропускать ионы хлора внутрь клетки (рис. 1), в результате чего клетка «затормаживается», становится менее восприимчива к возбуждающим сигналам [1]. Рецепторы к глицину могут быть собраны из четырех типов α-субъединиц и одного типа β-субъединиц.
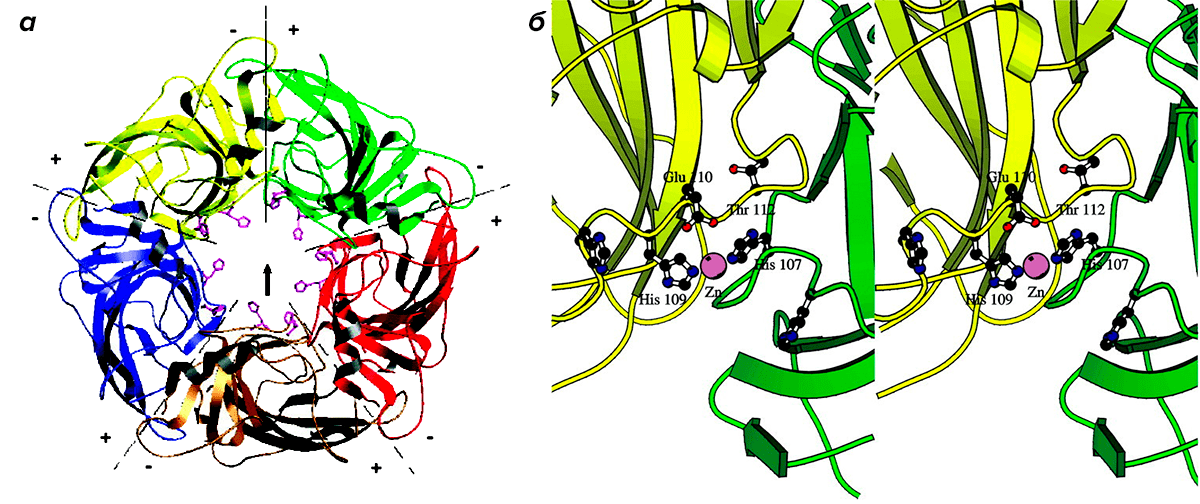
Рисунок 1. Структура глицинового рецептора. На панели а показаны пять субъединиц, составляющих ионный канал. На панели б можно увидеть интерфейсы между субъединицами, в которых участвуют ионы цинка.
Рецепторы, которые получаются при комбинации четырех α1-субъединиц и β-субъединицы (α1-рецепторы), вызывают в нервных клетках быстрое подавление электрической активности. Это основные тормозные глициновые рецепторы в мозге взрослого человека.
Бóльший интерес вызывает то, как работают глициновые рецепторы в развивающемся мозге млекопитающих, в том числе человека. В мозге эмбриона глицин, как и ГАМК, является не тормозным, а возбуждающим нейромедиатором. Когда глицин связывается с описанным выше α1-рецептором, а также α2-рецептором, состоящим из четырех α2-субъединиц и одной β-субъединицы, из нейронов в межклеточное пространство начинает поступать поток ионов хлора. Все дело в том, что во внутриклеточном пространстве нейронов в эмбриональном периоде концентрация отрицательно заряженных ионов хлора выше, чем снаружи мембраны [2]. Итогом движения ионов внутрь клетки становится деполяризация мембраны, и на ней возникает потенциал действия. В «зрелом» же мозге концентрация ионов хлора снаружи клетки выше, чем внутри нее. Открытие хлоридных каналов приводит к тому, что ионы хлора устремляются внутрь нейрона, что вызывает снижение электрической активности, подавление потенциала действия, то есть торможение.
Работа глициновых рецепторов связана с процессами миграции нервных клеток в мозге зародыша. Обнаружено, что количество глициновых рецепторов по сравнению с другими нейронами в три раза больше на клетках Кахаля—Ретциуса, отвечающих за миграцию нейронов. В зрелом возрасте выделение глицина этими клетками приводит к торможению активности близлежащих нервных клеток. Экономная природа использует один и тот же инструмент для двух процессов, протекающих в разные периоды жизни организма.
«Переключение» с возбудительной функции на тормозную протекает постепенно, «от хвоста к голове»: в первую очередь «переключение» происходит в спинном мозге, а потом движется вверх по центральной нервной системе (табл. 1) [2], [3]. Последним отделом мозга, в котором глицин «переключается» с активирующего режима на тормозной, становится кора больших полушарий. После рождения глицин активно вырабатывается в коре, гиппокампе и таламусе. Соотношение между типами рецепторов к глицину мало меняется. Число α1-рецепторов начинает незначительно снижаться, а количество α2-рецепторов остается практически на прежнем уровне. Последние обеспечивают более медленные электрические и метаболические изменения в нервных клетках. В зрелом мозге рецепторы к глицину обнаруживаются в спинном мозге, гиппокампе, мозжечке и таламусе, где оказывают преимущественно тормозное влияние на нейроны.
| Отдел нервной системы | Срок «переключения» |
|---|---|
| Спинной мозг | Непосредственно после рождения |
| Ствол мозга | 3 день после рождения |
| Мозжечок | 7 день после рождения |
| Гиппокамп | 7–12 день после рождения |
| Кора | 16 день после рождения |
Глицин очень похож на ГАМК по своей нейромедиаторной «судьбе» [4]. Оба в эмбриональном периоде являются возбуждающими нейромедиаторами. Они «тренируют» развивающийся мозг, дают ему нагрузки в безопасном режиме. Затем, после рождения, происходит их постепенное «переключение» с активирующей на тормозящую деятельность. При этом в одних частях нервной системы «переключение» по глицину происходит раньше, чем в других. Конечно, эти данные получены в исследованиях на крысах, но надо полагать, что и к людям они применимы.
Много значит хорошо
Глицин настолько добрый нейромедиатор, что готов связываться не только со своими рецепторами, но и, например, с рецепторами к глутамату (NMDA-рецепторы). На глутаматных рецепторах есть сайт связывания глицина (glycine modulatory site, GMS). Его активация необходима для нормального функционирования глутаматного рецептора: без небольшого количества глицина глутамат не сможет вызвать деполяризацию клеточной мембраны.
Недостаточное число глутаматных рецепторов или их неспособность полноценно выполнять свою функцию (гипофункция) — одно из объяснений патогенеза шизофрении [5]. У этого есть прямые и косвенные подтверждения. Известно, что кетамин, анестетик, блокирующий NMDA-рецепторы, может вызвать симптомы, сходные с шизофреническими [6]. При некоторых аутоиммунных поражениях нервной системы образуются антитела к NMDA-рецепторам. В таких случаях возникает схожая с шизофренией клиническая картина [7].
При шизофрении наблюдаются изменения синтеза глутаматных рецепторов: происходит снижение их числа, что приводит к нарушению глутаматной трансмиссии [8]. У пациентов с шизофренией также уменьшено количество D-серина — прямого природного агониста GMS [8]. Методами генной инженерии ученые вывели мышей, у которых не работает серин-рацемаза — фермент, превращающий L-серин в D-серин, другой оптический изомер [9]. У таких мышей недостаточно активируются глутаматные рецепторы, а мозг по структурным и молекулярным изменениям становится похож на мозг пациента, страдающего шизофренией. Когнитивные способности подобных мышей тоже пострадали, в большей степени у самцов [10].
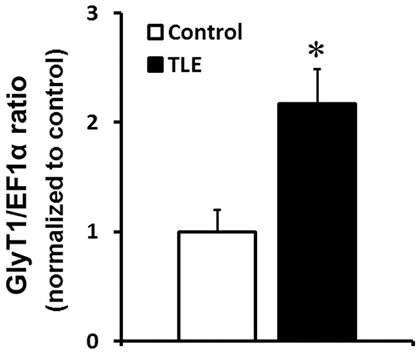
Рисунок 2. Избыточная экспрессия глицинового транспортера 1 типа обнаружена у пациентов с височной эпилепсией.
Другим заболеванием центральной нервной системы, к которому причастен глицин, является эпилепсия. Известно, что нарушения в структуре рецепторов к глицину связаны с повышением риска возникновения височной эпилепсии [11]. Кроме этого, в патогенезе эпилепсии задействован натрий-зависимый транспортер глицина — фермент, который удаляет глицин из синаптического и межклеточного пространства. Транспортеры 1 и 2 типов активно включаются в метаболизм глицина на уровне мозжечка и спинного мозга, но транспортер первого типа также работает в переднем мозге, в больших полушариях [12]. Там он усиленно производится в глиальных клетках возле глутаматных синапсов [13].
При височной эпилепсии важную роль играет электрическая активность гиппокампа. Высвободившись в межнейронное пространство в концентрации 10 наномоль, глицин связывается с глутаматными рецепторами в области гиппокампа и активирует их, о чем уже рассказывалось выше [14]. При высвобождении в бóльшем количестве (100 наномоль) в области глицинового синапса в нервной клетке происходит торможение [15]. Избыточный синтез глицинового транспортера 1 типа, который наблюдается у пациентов с височной эпилепсией, может привести к снижению концентрации глицина в гиппокампе (рис. 2) [15]. Это способно вызвать избыточную активацию глутаматной системы мозга, возникновение повышенного возбуждения в нервной системе и развитие эпилептических припадков.
Лекарство из мемов
Глицин большинству из нас известен не как нейромедиатор, а как маленькие сладкие таблеточки, которые пьются «от нервов» и «для памяти». В этой форме глицин стал героем мемов сообществ «ВКонтакте» (рис. 3). Пользователи издевательски представляют его в виде панацеи от психических расстройств и жизненных проблем, и сарказм тут очевиден. Думается, что его причина кроется в том, что люди, у которых есть значимые проблемы с душевным здоровьем, пытаются получить помощь от специалистов и не встречают должного понимания. От человека в белом халате они слышат советы вроде «Не нервничай», «Выпей валерьянки или глицина».
Возможно, люди заблуждаются, и глицин на самом деле работает? Для того чтобы разобраться в этом, надо обратиться к существующей медицинской практике. В России глицин рекомендуют использовать при комплексной терапии инсульта в дозе 0,7–1 г/сутки. При этом авторы рекомендаций не ссылаются на конкретные исследования, что, скорее, указывает, на повторение сложившейся практики, чем на научно обоснованный совет.
Можно обратиться к опыту зарубежной доказательной медицины — направлению клинических исследований, устанавливающих, насколько применяемые методы лечения эффективны и безопасны. Ведущей организацией в этой области является некоммерческая организация «Кокрейн». Ссылки на исследования этой организации являются хорошим аргументом в дискуссиях об эффективности медицинских вмешательств из-за ее независимости. Если на сайте «Кокрейн» в поиске ввести glycine («глицин»), то мы получим малообнадеживающий результат. На момент написания статьи (начало марта 2018 года) обнаружено 5 исследований эффективности глицина этим обществом. Только одно из них хоть как-то связано с работой нервной системы. Эта работа обсуждает возможности применения глутаматергических препаратов в лечении шизофрении.
Как уже говорилось выше, глицин связан с работой глутаматных рецепторов, а их нарушенная работа может приводить к возникновению симптомов шизофрении. В течение более 20 лет ученые пытаются использовать глицин в качестве лекарства при шизофрении [16]. В ходе этих исследований установили, что эффект в виде уменьшения выраженности симптомов шизофрении наступает, если глицин принимать в дозе 0,8 г/кг в день [17]. Если ваш вес равен 70 килограммам, то для достижения эффекта необходимо употреблять 56 граммов глицина в сутки. Обратимся к инструкции препарата от одного из производителей. Там написано, что его можно пить при самых разных состояниях, но максимальная доза (1 г в сутки) применяется при ишемическом инсульте. 1 грамм против 56 граммов — значительная разница, не правда ли?
Несмотря на большую важность глицина для развивающейся во внутриутробном периоде нервной системы, его ценность как лекарства крайне сомнительна и вряд ли эффективность обусловлена чем-то, кроме эффекта плацебо.
На этом наше знакомство с еще одним нейромедиатором закончено. «Биомолекула» и глицин благодарят вас за прочтение этого текста. :)
Литература
- Joseph W. Lynch. (2004). Molecular Structure and Function of the Glycine Receptor Chloride Channel. Physiological Reviews. 84, 1051-1095;
- Y. Ben-Ari, J.-L. Gaiarsa, R. Tyzio, R. Khazipov. (2007). GABA: A Pioneer Transmitter That Excites Immature Neurons and Generates Primitive Oscillations. Physiological Reviews. 87, 1215-1284;
- Ariel Avila, Laurent Nguyen, Jean-Michel Rigo. (2013). Glycine receptors and brain development. Front. Cell. Neurosci.. 7;
- Спокоен как GABA;
- Болезнь потерянных связей;
- John H. Krystal. (1994). Subanesthetic Effects of the Noncompetitive NMDA Antagonist, Ketamine, in Humans. Arch Gen Psychiatry. 51, 199;
- Josep Dalmau, Erdem Tüzün, Hai-yan Wu, Jaime Masjuan, Jeffrey E. Rossi, et. al.. (2007). Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Ann Neurol.. 61, 25-36;
- C S Weickert, S J Fung, V S Catts, P R Schofield, K M Allen, et. al.. (2013). Molecular evidence of N-methyl-D-aspartate receptor hypofunction in schizophrenia. Mol Psychiatry. 18, 1185-1192;
- D. T. Balu, Y. Li, M. D. Puhl, M. A. Benneyworth, A. C. Basu, et. al.. (2013). Multiple risk pathways for schizophrenia converge in serine racemase knockout mice, a mouse model of NMDA receptor hypofunction. Proceedings of the National Academy of Sciences. 110, E2400-E2409;
- A C Basu, G E Tsai, C-L Ma, J T Ehmsen, A K Mustafa, et. al.. (2009). Targeted disruption of serine racemase affects glutamatergic neurotransmission and behavior. Mol Psychiatry. 14, 719-727;
- Sabrina A. Eichler, Benjamin Förstera, Birthe Smolinsky, René Jüttner, Thomas-Nicolas Lehmann, et. al.. (2009). Splice-specific roles of glycine receptor α3 in the hippocampus. European Journal of Neuroscience. 30, 1077-1091;
- Francisco Zafra, Jesús Gomeza, Luis Olivares, Carmen Aragón, Cecilio Giménez. (1995). Regional Distribution and Developmental Variation of the Glycine Transporters GLYT1 and GLYT2 in the Rat CNS. European Journal of Neuroscience. 7, 1342-1352;
- B. Cubelos. (2005). Localization of the GLYT1 Glycine Transporter at Glutamatergic Synapses in the Rat Brain. Cerebral Cortex. 15, 448-459;
- Rongqing Chen, Akihito Okabe, Haiyan Sun, Salim Sharopov, Ileana L. Hanganu-Opatz, et. al.. (2014). Activation of glycine receptors modulates spontaneous epileptiform activity in the immature rat hippocampus. The Journal of Physiology. 592, 2153-2168;
- Hai-Ying Shen, Erwin A. van Vliet, Kerry-Ann Bright, Marissa Hanthorn, Nikki K. Lytle, et. al.. (2015). Glycine transporter 1 is a target for the treatment of epilepsy. Neuropharmacology. 99, 554-565;
- Marc J. Kaufman, Andrew P. Prescot, Dost Ongur, A. Eden Evins, Tanya L. Barros, et. al.. (2009). Oral glycine administration increases brain glycine/creatine ratios in men: A proton magnetic resonance spectroscopy study. Psychiatry Research: Neuroimaging. 173, 143-149;
- Uriel Heresco-Levy, Daniel C. Javitt, Marina Ermilov, Clara Mordel, Gail Silipo, Michael Lichtenstein. (1999). Efficacy of High-Dose Glycine in the Treatment of Enduring Negative Symptoms of Schizophrenia. Arch Gen Psychiatry. 56, 29.







