
Григорий Никифорович: «От оргазма до бессмертия. Записки драг-дизайнера». Отрывок «Салат “Брадикинин”»
16 ноября 2019
Григорий Никифорович: «От оргазма до бессмертия. Записки драг-дизайнера». Отрывок «Салат “Брадикинин”»
- 546
- 0
- 0
Никифорович Г.В. «От оргазма до бессмертия. Записки драг-дизайнера». — Минск: Издательство «Дискурс», 2019. — 176 с.
-
Автор
-
Редактор
Конформационные карты аминокислотных остатков были хорошим началом — они не противоречили уже имеющимся экспериментальным данным. Но ценность любой теории не столько в умении объяснить уже известное, сколько в возможности успешно предсказать результат эксперимента. В этом, собственно говоря, и заключается основная цель драг-дизайна — предсказать биологические функции молекулы еще до проверки их на практике.
Функции молекул в клетке, особенно пептидных и белковых, зависят от их пространственных структур. Если теоретический конформационный анализ научится надежно предсказывать такие структуры, значительный (и необходимый!) шаг на пути к направленному драг-дизайну пептидных биорегуляторов будет сделан. Членам интернационального клуба конформационных карт это было очевидно с самого начала — но их останавливала тогдашняя неполнота физических моделей молекул, начиная с неточности потенциальных функций межатомных взаимодействий и еще более приблизительного учета взаимодействий с растворителем. Отважиться на проведение конформационного расчета полной молекулы реального пептида с тем, чтобы найти все его стабильные конформации, могли лишь авантюристы. И такие появились — в нашем лице.
Объектом исследования был выбран брадикинин, линейный пептид с последовательностью из девяти аминокислот. Брадикинин расслабляет сосуды и тем самым снижает давление крови; он же участвует в биохимических реакциях при воспалениях и проявлениях боли. Нас, однако, привлекли не его биологические свойства, а сравнительно ограниченные конформационные возможности его пептидного остова.
Рассчитанные заранее конформационные карты показали, что полный конформационный расчет брадикинина должен как минимум проанализировать пятьсот семьдесят шесть пространственных структур пептидного остова; для девятичленного пептида иной последовательности их могло бы быть порядка двадцати тысяч. Пять-шесть сотен — это тоже очень много: ведь каждую из таких конформаций следовало выбрать как начальную точку расчета межатомной энергии. Между тем при наших вычислительных ресурсах этот процесс занимал несколько часов лишь для одной конформации брадикинина. Позволить себе десятки, а то и сотни суток непрерывного счета мы не могли.
Вместо этого пришлось придумать новое упрощение — предположение, что взаимодействия аминокислот, отдаленных в пептидной последовательности друг от друга, менее влияют на конформационную стабильность молекулы в целом, чем взаимодействия отдельных фрагментов, входящих в эту последовательность. Иными словами, в первом приближении можно попытаться составить возможные конформации молекулы брадикинина, комбинируя наборы стабильных конформаций его фрагментов, — а рассчитать энергии этих наборов гораздо легче. Таким способом можно также удлинять цепочку: начать, например, с тетрапептида
Полный конформационный расчет брадикинина показал возможность существования всего нескольких низкоэнергетических конформаций молекулы. Все они характеризовались резким изломом в центре пептидного остова; у некоторых к тому же боковая цепь первого в цепи аминокислотного остатка (заряженная положительно) и группа, замыкающая остов молекулы (заряженная отрицательно), близко подходили друг к другу. Оказалось, таким образом, что линейный пептид брадикинин может образовывать квазициклические конформации. Расчетная стабильность этих структур сохранялась и при нейтрализации заряженных групп, а также при введении в рассмотрение растворителя. Это была маленькая сенсация: мало того что никто в мире до тех пор не осуществил конформационный анализ пептида такой величины, было предсказано еще и новое свойство линейных пептидов — способность к самопроизвольной квазициклизации.
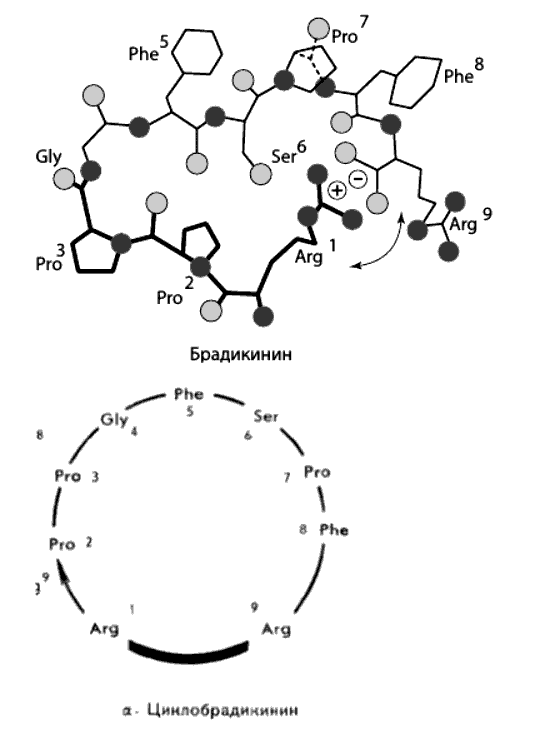
Рисунок 1. Брадикинин. Расчетная конформация брадикинина (сверху) и схематическое изображение циклобрадикинина (снизу). В рисунке использованы условные трехбуквенные обозначения аминокислот.
Главная же сенсация, однако, заключалась не в наших предсказаниях — мало ли что болтают теоретики, — а в том, что они были подтверждены независимым экспериментом.
Одновременно с нашей работой московские ученые (Вадим Тихонович Иванов с сотрудниками) провели целый ряд экспериментальных измерений конформационных характеристик молекулы брадикинина. Их общий вывод был следующим: в конформационном равновесии брадикинина в растворе действительно присутствуют структуры изогнутой или псевдоциклической формы со сближенными концами пептидной цепи.
Тем самым квазициклическая модель пространственной структуры брадикинина получила право на существование, и о ней было доложено на весьма авторитетном форуме — четвертом Американском пептидном симпозиуме в Нью-Йорке. В выступлении Иванова, кроме экспериментальных, были использованы и наши расчетные данные. Текст доклада в «Трудах симпозиума» был завершен фразой: «Более того, открыт новый принцип пространственной организации линейных пептидов, согласно которому молекулы образуют циклы благодаря ионному взаимодействию ионогенных групп, расположенных на противоположных концах молекулы».
Вообще-то дело было не только в том, что положительный и отрицательный электрические заряды притягиваются друг к другу: такое притяжение лишь закрепляет и без того сближенные части молекулы. Но как раз гипотетическое наличие «ионной связи» между концами молекулы и подверглось наиболее ожесточенным нападкам противников новой идеи квазициклизации, многие из которых попросту не могли себе представить, как это линейная пептидная цепочка вдруг примет циклическую форму.
Сразу нашлось и резонное возражение: в водном растворе, этой естественной «среде обитания» пептидных биорегуляторов, заряженные группы окружены плотной оболочкой из молекул воды, и поэтому их взаимодействие резко ослаблено; следовательно, молекулярные квазициклы в воде должны разваливаться. Появились и новые экспериментальные работы по конформациям брадикинина, вроде бы противоречащие данным доклада в Нью-Йорке, — как всегда, новая идея вызвала весьма разноречивые отклики.
Нужен был решающий эксперимент, призванный либо окончательно подтвердить, либо окончательно опровергнуть модель квазициклического строения брадикинина. И здесь центр тяжести событий переместился в Ригу, в лабораторию пептидного химика Гунара Чипенса. Предложение рижан было простым и, пожалуй, даже очевидным: заменить «ионную связь» на обыкновенную валентную и проверить, будет ли получившаяся молекула — циклический аналог — обладать биологической активностью брадикинина. Соответствующий циклоаналог был синтезирован, и его биологические испытания показали, что при введении в кровь крыс он действовал, как и природный брадикинин, — снижал давление крови, но не на протяжении нескольких секунд, а в течение более чем трех часов. Зато он не продемонстрировал никакого влияния на изолированный орган (кишка крысы), обычно реагирующий на брадикинин. (О современных испытаниях на культурах клеток или на изолированных рецепторах в те времена можно было только мечтать.)
Таким образом, удалось не просто подтвердить квазициклическую модель строения брадикинина, но и синтезировать аналог, обладающий длительным и к тому же высокоизбирательным биологическим эффектом. Этот аналог стал первым в ряду совершенно нового класса соединений, которые в дальнейшем оказались весьма перспективными с практической точки зрения, — циклических аналогов линейных пептидов. Следовательно, со всеми возможными оговорками, можно было констатировать, что теоретический конформационный анализ пептидов действительно пригоден как инструмент драг-дизайна — пусть даже это утверждение пока базировалось лишь на расчетах одного единственного брадикинина.





