
Ядерный матриархат, LLPS-революция и анеуплоидия
17 марта 2021
Ядерный матриархат, LLPS-революция и анеуплоидия
- 945
- 1
- 5
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Сегодня проблемы репродукции являются одними из самых обсуждаемых в мире. Но что мы знаем о молекулярной кухне процессов оо- и эмбриогенеза? Ученые из лаборатории морфологии клетки Института цитологии РАН попытались разобраться в закономерностях перестроек хроматина, протекающих в ядрах ооцитов и ранних эмбрионов млекопитающих, и предложили возможные эпигенетические механизмы регуляции данных процессов. Мне, в свою очередь, удалось заглянуть в закулисье и лично пообщаться с авторами статьи. Здесь я не просто хочу поделиться опытом коллег, предупреждающих о возможных трудностях в изучении данной темы. Я хочу объяснить, почему это настолько заинтересовало даже меня, молекулярного онколога, совершенно незнакомого с данной областью исследования.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Такие разные конфигурации
Ирина и Дмитрий Боголюбовы из Института цитологии РАН исследовали закономерности перестроек хроматина в ядрах ооцитов и ранних эмбрионов млекопитающих) и предложили возможные эпигенетические механизмы регуляции этих перестроек (рис. 1) [1], [2]. Но давайте обо всем поговорим по порядку, а вместе с тем послушаем мнение и самих авторов исследования.
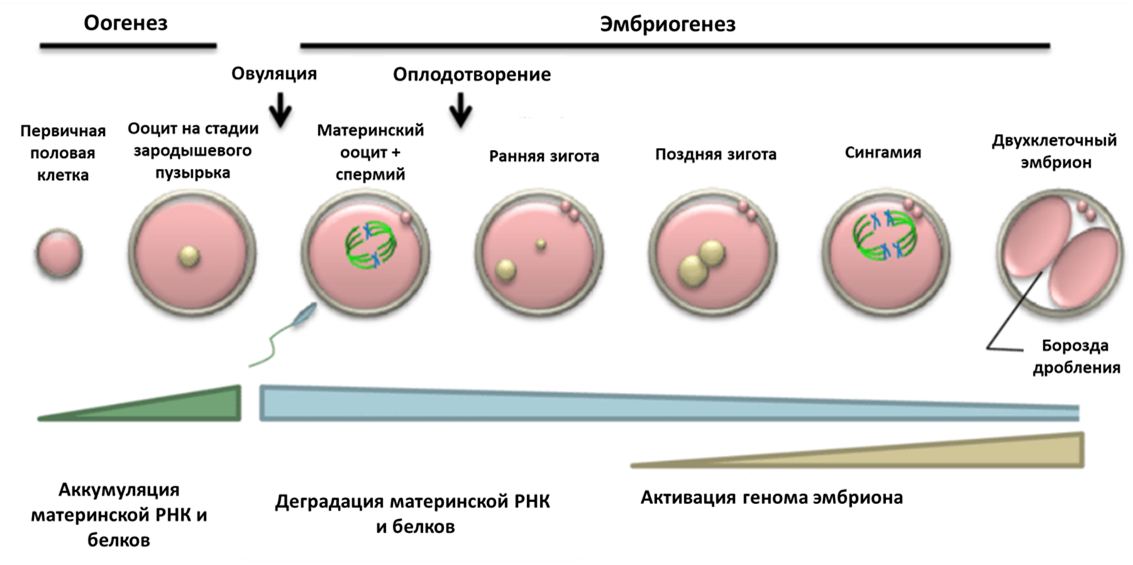
Рисунок 1. Основные стадии раннего развития.
Оогенез и эмбриогенез — это непрерывные, сменяющие друг друга процессы; происходящие в это время преобразования хроматина ооцита предопределяют дальнейшее развитие зиготы после оплодотворения. У некоторых млекопитающих, включая человека, на завершающей стадии развития ооцита перераспределение хроматина в ядре совпадает с преобразованием ядрышка в так называемые атипичные ядрышки или ядрышкоподобные тела (ЯПТ) . Образовавшиеся ЯПТ начинают созывать к себе повсеместно конденсирующийся хроматин, который постепенно окружает ЯПТ по типу «кольца», или, по-научному, хроматин переходит из NSN-состояния (non-surrounded nucleolus) в SN-состояние (surrounded nucleolus) (рис. 2). Почему атипичные ядрышки являются центрообразующей единицей для хроматина, вам не ответит даже самый опытный цитолог. Но давайте поговорим обо всем этом подробно.
ЯПТ (nucleolus-like body, NLB) — особенная ядерная структура, представляющая собой хромосомы, собранные вокруг центрального тела, состоящего преимущественно из фибриллярных белков (ламинов типа А и В). Точный состав центрального тела ЯПТ остается неизвестен [3].

Рисунок 2. Различная конфигурация хроматина в мышиных ооцитах.
(а) — NSN-состояние;
(б) — раннее SN-состояние;
(в) — SN-состояние.
Первым, кто решил разобраться в хроматиновом безобразии, был Молсби Уиллетт Блэкман. Еще в 1901 г. Блэкман работал с хилоподами, правда, не с ооцитами, а со спермацитами (в которых происходят схожие с ооцитами процессы), и наблюдал конденсацию хроматина в ограниченном пространстве ядра на стадии диплотены профазы мейоза [4]. Данному явлению Блэкман дал название «кариосфера», и спорить с ним никто не стал. «Раз никто не спорит, — подумал Блэкман, — можно ввести в историю еще один термин — „кариосома“». Так кариосомой начали обозначать частный подтип кариосферы, когда гетерохроматиновые агрегаты не связаны с какими-либо экстрахроматиновыми включениями. Другой подтип кариосферы — те же самые гетерохроматиновые агрегаты, но уже окруженные внешней капсулой. Данному варианту был гордо присвоен термин «типичная кариосфера». Однако у млекопитающих, которые интересуют биологов больше всего, все совершенно иначе. Поэтому далее мы будем рассматривать процессы оогенеза и эмбриогенеза в контексте именно млекопитающих модельных объектов.
У человека, как и у мыши, хромосомный материал располагается вне экстрахромосомного элемента (тех самых ЯПТ). В таком случае принято говорить «инвертированная кариосфера» (рис. 3) [5].
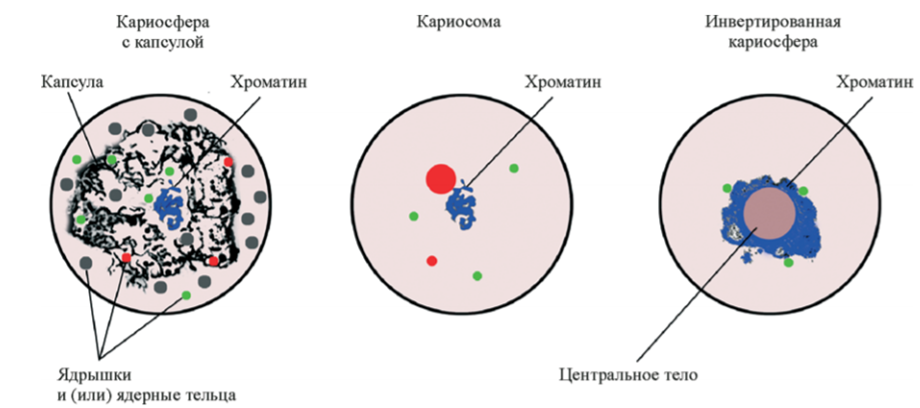
Рисунок 3. Основные типы кариосфер.
С терминологией немного разобрались. Вернемся к морфодинамике. В оогенезе, по мере перехода хроматина из NSN- в SN-состояние происходит инактивация транскрипционной активности ядра, и это очень важный параметр для дальнейшего завершения деления, созревания и осуществления правильного мейоза. Забегая вперед, можно сказать, что на начальных стадиях эмбриогенеза организация хроматина в зиготе морфологически поразительно похожа на таковую в ооцитах на поздних стадиях развития. За исключением того, что случается «рекапитуляция» транскрипционной активности, и она начинает волнообразно нарастать. Но редкая птица долетит до середины Днепра! Проблема заключается в том, что, если мы возьмем фолликулы одинакового размера в яичнике человека или мыши, то в них будут встречаться как SN-, так и NSN-ооциты, с постепенным увеличением процента SN-ооцитов в поздних антральных (готовых к овуляции) фолликулах. Тем не менее, какой-то процент NSN-ооцитов останется. Такие ооциты даже способны к оплодотворению, но развитие получившихся из них эмбрионов останавливается на двухклеточной стадии. Значимость перехода NSN—SN была подтверждена сравнением транскриптомных профилей: уровни мРНК большого набора генов, кодирующих материнские факторы, необходимые для расщепления и развития эмбриона, повышаются именно в SN-ооцитах. В связи с этим встает важный вопрос об отборе качественных ооцитов (например, для ЭКО), поскольку довольно трудно провести сегрегацию между SN- и NSN-ооцитами, полученными из антральных фолликулов одного размера. А размер для специалистов ЭКО имеет значение (как критерий оценки качества, разумеется).
Хорошо, с ооцитами стало понятнее. А у эмбрионов как обстоят дела?
Как уже говорилось ранее, морфологические картины, отражающие изменения конфигурации гетерохроматина в раннем эмбриогенезе, на первый взгляд, напоминают таковые в оогенезе. После оплодотворения ядро ооцита «разбирается», и в зиготе происходит формирование материнского и отцовского пронуклеусов de novo. В этом ведущую роль играют регуляторные белки материнского происхождения. На ранних стадиях эмбриогенеза тельца-предшественники ядрышек или ТПЯ (аналоги ЯПТ) служат платформой для формирования общего хроматинового ландшафта зиготы. Вокруг ТПЯ и ЯПТ конденсируется хроматин, образуя своеобразное гетерохроматиновое кольцо, содержащее области центромер и перицентромер. Именно пространственное расположение определенных гетерохроматиновых участков определяет дальнейшие стадии дробления зиготы (рис. 4).
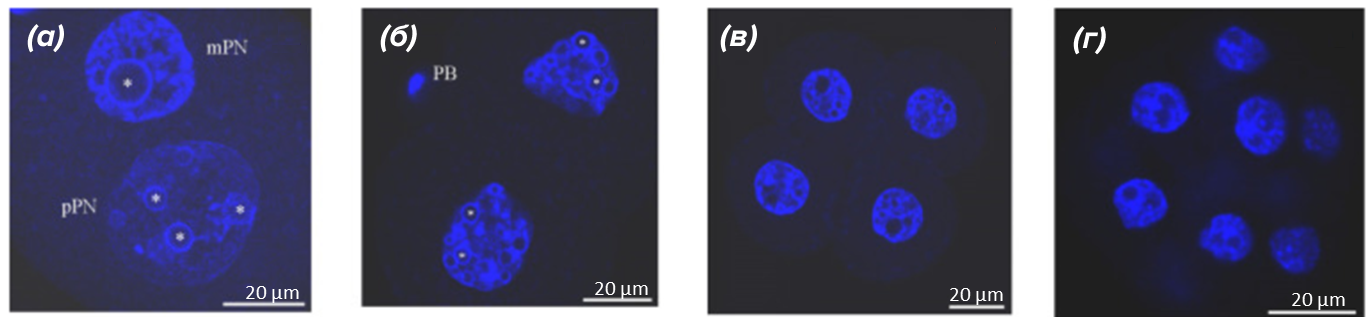
Рисунок 4. Организация хроматина в ранних эмбрионах мышей, развивающихся in vivo.
(а) — зигота: mPN — материнский пронуклеус; pPN — отцовский пронуклеус; вокруг ТПЯ видны гетерохроматиновые кольца;
(б) — двухклеточная стадия: PB — полярное тело; на этом этапе начинают формироваться хромоцентры;
(в) — четырехклеточная стадия: видны многочисленные хромоцентры; гетерохроматиновые кольца вокруг некоторых ТПЯ начинают исчезать;
(г) — морула.
Мощным инструментом в изучении структуры гетерохроматина в ооцитах и зиготах млекопитающих является так называемая «энуклеоляция» — микрохирургическое удаление ЯПТ из ооцитов мыши и ТПЯ из пронуклеусов зигот. Так, было установлено, что ТПЯ/ЯПТ незаменимы для регуляции MaSat и MiSat вскоре после оплодотворения и служат основной структурой, организующей гетерохроматин в ооцитах и зиготах мышей.
MaSat (major satellite DNA, перицентромерный мажорный сателлит) и MiSat (minor satellite DNA, центромерный минорный сателлит) — повторяющиеся участки некодирующей ДНК, образующие тандемные повторы. Различия, главным образом, заключаются в количестве повторяющихся нуклеотидных мономеров и их локализации [6].
Состав самих ЯПТ (как и ТПЯ) пока остается малоизученным. Все дело в том, что на морфологическом уровне компактизация фибриллярных волокон атипичных ядрышек настолько плотная, что не все антитела, использующиеся в традиционных методах выявления белков-мишеней (например, вестерн-блот и иммуноцитохимический анализ), физически могут «достать» свою мишень [7]. Однако доподлинно известно, что ЯПТ и ТПЯ формируются схожим, весьма необычным, образом [8]. «Сейчас в биологии происходит настоящая LLPS-революция (LLPS: liquid-liquid phase separation) [9], т.е. изучается процесс формирования биомакромолекулярных конденсатов, возникающих в результате разделения жидких фаз. Сборка, разборка атипичных ядрышек и телец-предшественников ядрышек, как и протекание дальнейших процессов реорганизации хроматина также определяется законами фазового перехода», — комментирует доктор биологических наук, один из авторов обозреваемой статьи, Дмитрий Сергеевич Боголюбов.
Если все так сложно реализуется уже на уровне макромолекулярных комплексов — что уж говорить про геномный уровень?
Тут правильнее сказать — эпигеномный. В оогенезе и раннем развитии млекопитающих функциональная активность хроматина в значительной степени регулируется уникальным эпигенетическим ландшафтом. В его создании принимают участие следующие процессы [10]:
- пострепликационные модификации ДНК;
- посттрансляционные модификации ДНК-связывающих белков;
- АТФ-зависимое ремоделирование нуклеосом.
Казалось бы, ключевые эпигенетические игроки проанализированы и хорошо изучены. Однако полногеномных исследований с разрешением до одной клетки (single-cell sequencing), позволяющих установить корреляцию между SN- и NSN-состояниями хроматина, на данный момент не так уж много [11], [12]. Еще бы, ведь энуклеоляция с последующим анализом ядра каждой отдельной клетки — задачи не из легких.
Поскольку на поздних стадиях оогенеза происходит инактивация транскрипционной активности ядра, логично предположить, что в районах активно транскрибирующихся генов появляется определенный стоп-сигнал для транскрипционных или хроматин-ремодулирующих факторов, который всем своим видом провозглашает, что сейчас не время для транскрипции. Метилирование ДНК, которое изменяет сайты связывания ряда факторов транскрипции, является таким стоп-сигналом. Метильные группы обнаруживаются в динуклеотидах CpG, которые часто присутствуют в богатых CpG областях генома, называемых CpG-островками. В ооцитах, взятых из примордиальных (зародышевых) фолликулов, ДНК практически не метилирована по сравнению с ооцитами, присутствующими в антральных фолликулах, которые демонстрируют примерно 40% глобального метилирования ДНК. Кроме того, метилирование ДНК «конкурирует» с метилированием гистонов. Например, гистон H3 должен быть триметилирован по лизину 36 (H3K36me3), но не должен быть ди- или триметилирован по лизину 4 (H3K4me2/me3) и лизину 9 (H3K9me2) в областях, предназначенных для метилирования ДНК. Но стоит только часам пробить полночь, а оплодотворению случиться, как несущаяся карета метилирования генома превращается в тыкву деметилирование. Деметилироваться отцовскому и материнскому геномам помогают ДНК-метилтрансферазы DNMT3a и DNMT, опосредующие присутствие и отсутствие метильных групп на 5-метилцитозинах (5mC) и 5-гидроксиметилцитозинах (5hmC). После такого глобального сброса настроек ДНК в зиготе уже метилируется de novo; запускается процесс дробления.
В то время как с самой ДНК все просто (либо метилирована, либо нет), от разнообразия ковалентных гистоновых модификаций, определяющих гистоновый код, голова идет кругом. Здесь нужно пояснить, что гистоновый код — это посттрансляционные модификации определенных аминокислотных остатков гистонов на N-терминальном конце, например, ацетилирование, метилирование, фосфорилирование, убиквитинирование или рибозилирование. Гистоновые модификации необходимы для привлечения хроматин-ремодулирующих белков и, как следствие, для поддержания определенного состояния хроматина. Следует учитывать, что гистоновые модификации довольно видоспецифичны. Тем не менее, общей тенденцией для репрограммирования хроматина как в ооцитах, так и в зиготах млекопитающих, является метилирование гистона Н3 (H3K4me2, H3K4me3, H3K9me2 и H3K9me3) и ацетилирование гистонов Н3 и Н4 (H3K9ac, H3K18ac, H4K5ac и H4K12ac). К примеру, репрезентативными метками «активного» состояния хроматина является наличие паттернов распределения Н3К4me3 и H4K5ac, в то время как за «спящее» состояние хроматина отвечают Н3K27me3 и H3K9me3.
Посттрансляционные модификации гистонов — это, конечно, хорошо... Но только если есть, что модифицировать. Некоторые постоянные или коровые гистоны имеют своих дублеров — вариантные гистоны, замещающие коровые в составе нуклеосом. К примеру, отсутствие материнского гистонового варианта Н3—Н3.3 в зиготе приводит к нарушению репрограммирования и подавлению ключевых генов плюрипотентности [13]. Кроме того, присутствие Н3.3 и гистонового варианта Н1—Н1foo необходимо для замещения протаминов и сборки отцовского пронуклеуса. Вот такие вот они нужные и важные. Не важнее только, пожалуй, варианты гистона Н2A. Например, H2A.Z участвует в активации транскрипции и эпигенетической памяти, H2A.X играет центральную роль в ответе на повреждение ДНК, а MacroH2.A предположительно участвует в инактивации Х-хромосомы.
Помимо всего вышеперечисленного, ни один NSN-SN переход не обходится без участия дополнительных негистоновых белков, а присутствие некоторых даже является критически необходимым. Например, PCBP1 (poly(rC)-binding protein 1) играет ключевую роль в установлении транскрипционно-неактивного состояния хроматина во время формирования кариосферы. Мутации в гене одного из хроматин-ремоделирующих белков, ATRX (α-thalassemia/mental retardation X-linked protein), приводят к нестабильности перицентромерного хроматина и резкому возрастанию числа анеуплоидных ооцитов и эмбрионов. Белок DPPA3 (developmental pluripotency-associated protein 3), как и PCBP1, способствует репрессии транскрипции. Не дремлют и активируемые MAPK (mitogen-activated proteinkinase) сигнальные каскады, регулирующие NSN–SN переход при участии гормонов.
Несмотря на значительный прогресс в понимании молекулярных механизмов перестроек хроматина на поздних стадиях оогенеза и ранних стадиях эмбриогенеза, цельное видение регуляции таких сложных процессов еще не сформировано. Однако актуальность исследования не оставляет сомнений в том, что игра стоит свеч. «С фундаментальной точки зрения, изучение таких уникальных объектов поможет лучше понять законы организации клеточного ядра в целом, — говорит другой автор статьи, доктор биологических наук, Боголюбова Ирина Олеговна. — С прикладной — любые данные о преобразовании ядра в оогенезе позволяют увидеть слабые места уже в эмбриогенезе».
Литература
- Irina Bogolyubova, Dmitry Bogolyubov. (2020). Heterochromatin Morphodynamics in Late Oogenesis and Early Embryogenesis of Mammals. Cells. 9, 1497;
- Velummailum R. Involvement of Nlrp5 Involvement of Nlrp5 in the Maintenance of Genome Integrity in Murine Oocytes. PhD dissertation. — University of Toronto, 2011. — 136 p.;
- Galina N. Pochukalina, Nadya V. Ilicheva, Olga I. Podgornaya, Alexey P. Voronin. (2016). Nucleolus-like body of mouse oocytes contains lamin A and B and TRF2 but not actin and topo II. Mol Cytogenet. 9;
- Blackman M. W. (1901). The spermatogenesis of the myriapods. I. Notes on the spermatocytes and spermatids of Scolopendra. Kansas Univ. Quart. 10, 61–76;
- D.S. Bogolyubov, Institute of Cytology RAS. (2018). THE KARYOSPHERE. Tsitologiya. 60, 147-163;
- Повтор, еще повтор!;
- 12 методов в картинках: иммунологические технологии;
- S. V. Razin, A. A. Gavrilov. (2020). The Role of Liquid–Liquid Phase Separation in the Compartmentalization of Cell Nucleus and Spatial Genome Organization. Biochemistry Moscow. 85, 643-650;
- Simon Alberti, Amy Gladfelter, Tanja Mittag. (2019). Considerations and Challenges in Studying Liquid-Liquid Phase Separation and Biomolecular Condensates. Cell. 176, 419-434;
- Эпигенетика: невидимый командир генома;
- Chan Gu, Shanling Liu, Qihong Wu, Lin Zhang, Fan Guo. (2019). Integrative single-cell analysis of transcriptome, DNA methylome and chromatin accessibility in mouse oocytes. Cell Res. 29, 110-123;
- Byungjin Hwang, Ji Hyun Lee, Duhee Bang. (2018). Single-cell RNA sequencing technologies and bioinformatics pipelines. Exp Mol Med. 50, 1-14;
- D. Wen, L. A. Banaszynski, Y. Liu, F. Geng, K.-M. Noh, et. al.. (2014). Histone variant H3.3 is an essential maternal factor for oocyte reprogramming. Proceedings of the National Academy of Sciences. 111, 7325-7330.







