
Ядерный взрыв в пределах клетки: лечение рака в ногу с биофизикой
11 ноября 2019
Ядерный взрыв в пределах клетки: лечение рака в ногу с биофизикой
- 924
- 1
- 5
-
Автор
-
Редакторы
Комикс на конкурс «био/мол/текст»: Идея о бор-нейтронозахватной терапии (БНЗТ) появилась давно, однако ее воплощение в жизнь оказалось не таким простым. Какие проблемы пришлось решать ученым для создания рабочей установки и что позволило перейти от теории к практике, вам и заблудившимся мышатам Бальбу и Сибии расскажет ученая лабораторная крыса из института ядерной физики Вистар Пасюкович.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
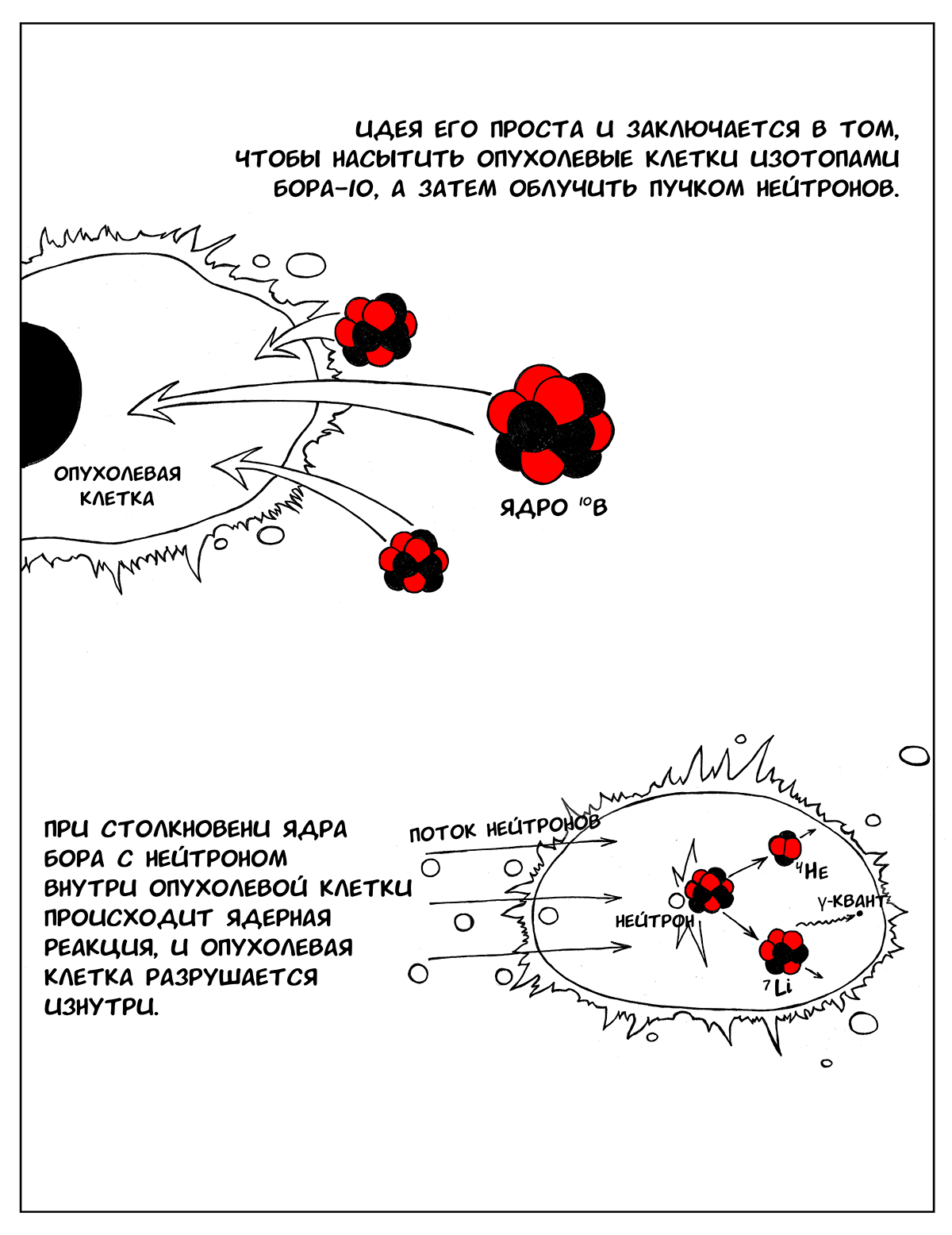
Бор-нейтронозахватная терапия (БНЗТ) — метод лечения рака, основанный на предварительном насыщении опухолевых клеток изотопами 10В с последующим облучением пучком нейтронов, что приводит к уничтожению клетки. Бор обладает способностью легко захватывать нейтроны, пролетающие даже на большом расстоянии от его ядра. При столкновении ядра бора с нейтроном внутри опухолевой клетки происходит ядерная реакция с испусканием гамма-кванта и образованием 7Li и альфа-частицы, которые вызывают разрушение клетки изнутри. Так как литий и альфа-частица обладают малой длиной пробега (менее 10 мкм), весь процесс не выходит за пределы одной клетки и не травмирует или мало травмирует окружающие здоровые ткани [1], [2].
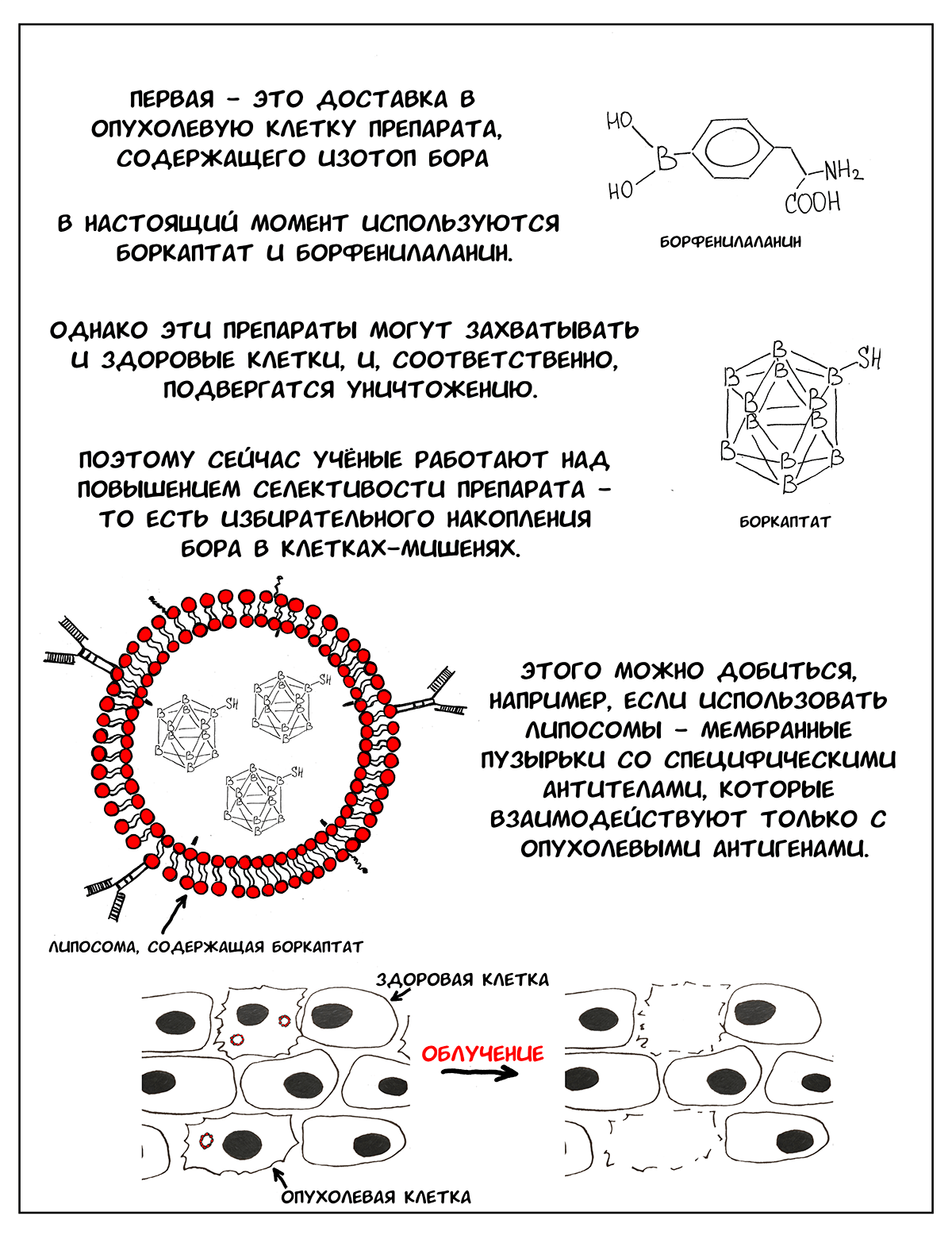
Однако внедрение этой идеи в клиническую практику имеет ряд проблем. Первая — создание эффективного препарата для доставки бора в опухолевую клетку. В идеале это должно быть безвредное вещество, которое захватывается только опухолевыми клетками и содержит большое количество бора [1]. В настоящий момент существует два препарата, которые используются для БНЗТ — боркаптат и борфенилаланин. Это контрастные вещества, которые применяются при проведении МРТ (магнитно-резонансной томографии), они безвредны для человека. Опухолевые клетки активно делятся и хорошо кровоснабжаются, и поэтому захватывают эти препараты [2]. Однако здоровые клетки, особенно активно делящиеся, тоже могут захватывать борсодержащие вещества и далее подвергаться облучению и разрушению. Кроме того, азот и водород, в большом количестве входящие в состав всех клеток тела, также способны захватывать нейтроны, и, если концентрация бора в организме недостаточна, захват будут производить именно они.
Сейчас ученые работают над созданием препаратов нового поколения, которые позволили бы селективно доставлять бор к клеткам-мишеням (то есть исключительно только в опухоль) [2]. Одним из наиболее перспективных направлений является разработка липосом — таких мембранных пузырьков, внутри которых находится борсодержащий препарат, а на поверхности — специфические антитела к опухоль-ассоциированным антигенам. С помощью этих антител, можно «научить» липосомы находить клетки-мишени, проникать внутрь, и адресно доставлять 10В [2–4].
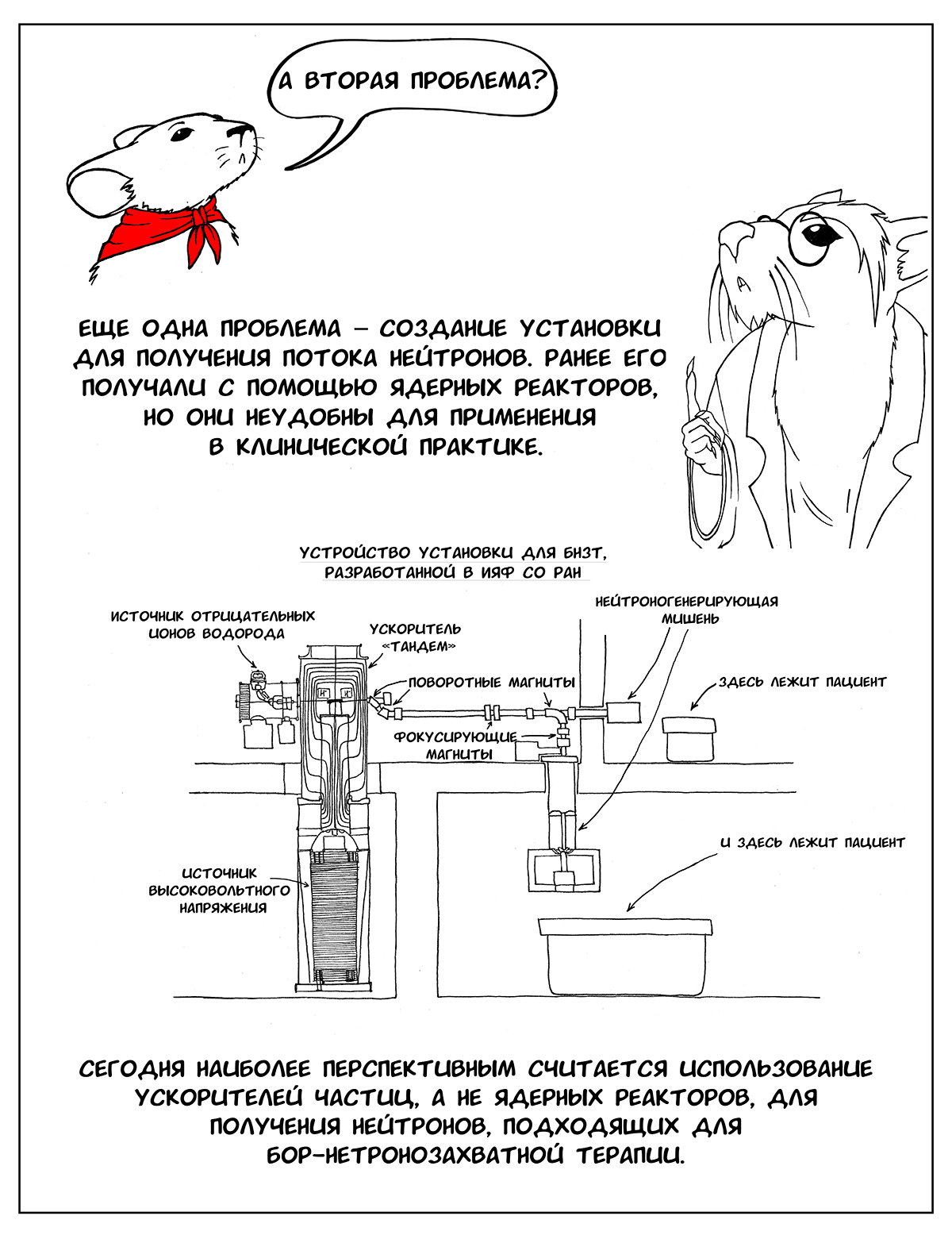
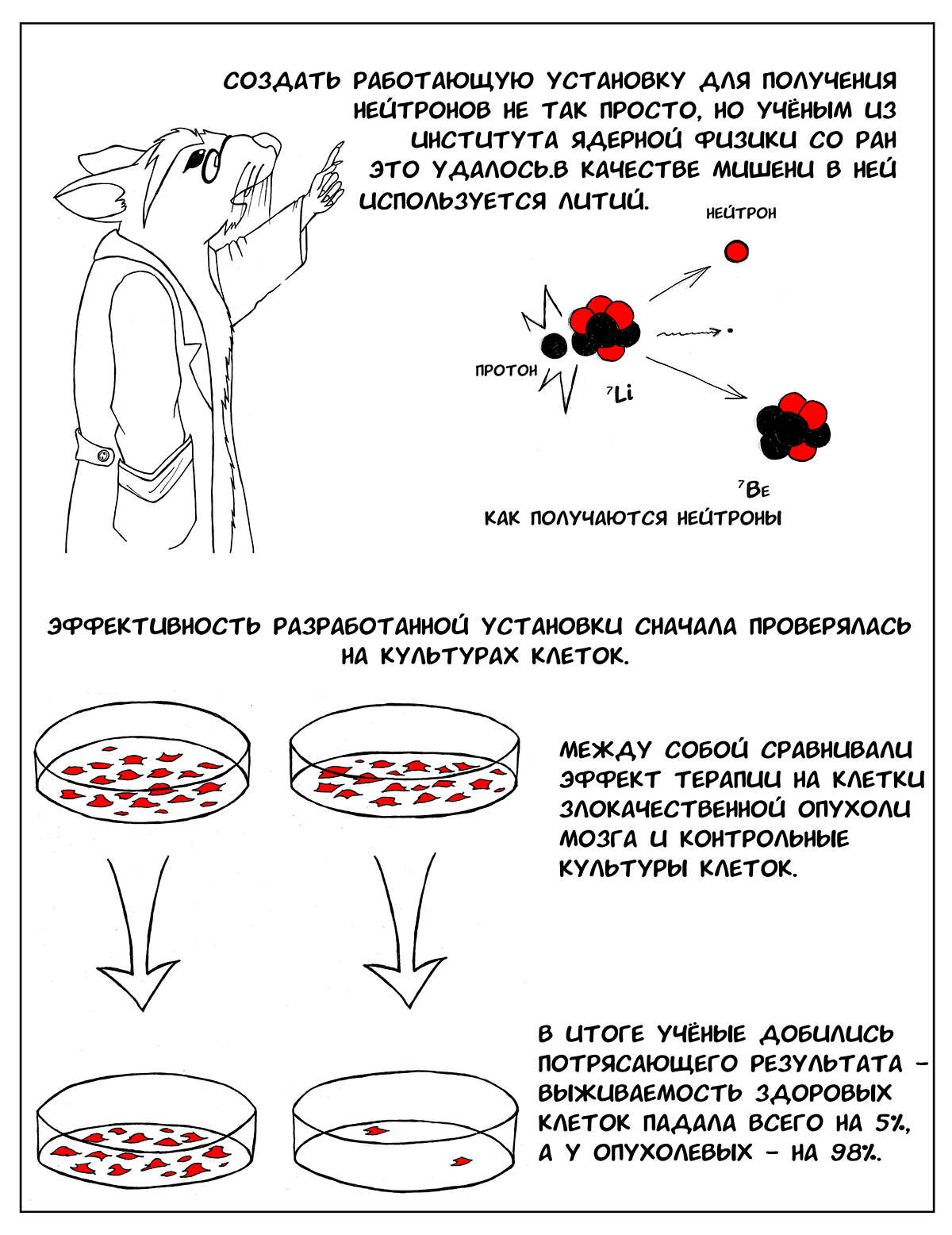
Вторая проблема — создание установки, с помощью которой можно получать плотный поток нейтронов с энергией от 0,5 эВ до 10 кэВ [2]. Используемые ранее в БНЗТ (например, в Японии) ядерные реакторы не слишком удобны в качестве источника получения нейтронов, это не медицинские приборы, они достаточно громоздкие и небезопасные. Более интересны в этом плане ускорители частиц [2], [5].
В институте ядерной физики им. Г.И. Будкера спроектировали такую установку. В ней используется несколько оригинальных разработок, которые позволяют сделать ее рабочей и эффективной. Во-первых, это литиевая мишень [6], [7]. С ее помощью можно получить пучок нейтронов со сравнительно узким диапазоном энергии, что и требуется для БНЗТ. Однако чтобы создать такую мишень, пришлось решить ряд проблем — литий очень мягкий, легкоплавкий металл, поэтому при его использовании мишень быстро выходит из строя и нуждается в замене. Чтобы этого не происходило, необходимо было подумать о его эффективном охлаждении [6]. Другая проблема — сопутствующее гамма-излучение, которое образуется при продвижении протонов внутрь литиевого слоя, когда нейтроны уже перестают образовываться, а гамма-кванты по-прежнему излучаются. Поэтому было решено наносить слой лития на подложку из другого, более тяжелого металла, в котором бы эффективно тормозились протоны, уже не вызывающие образование нейтронов [7]. Наконец, еще один вопрос, который требовал решения — накопление внутри литиевого слоя побочного продукта ядерной реакции — радиоактивного 7Be. Чтобы обезопасить сотрудников, работающих с установкой, и пациентов от излучения, сконструировали защитный контейнер [6].
Помимо использования литиевой мишени для получения нейтронов, разработанная установка имеет еще один уникальный элемент — устройство самого ускорителя. Вместо стандартной ускорительной трубки здесь используется система неразделенных изоляторами электродов, висящих в вакууме на основании-изоляторе [6], [8]. Близкое расположение электродов позволяет получить больший темп ускорения частиц.
Эффективность и безопасной этой установки сначала проверяли на клетках. Эффект БНЗТ оценивали на двух клеточных линиях злокачественной опухоли мозга и сравнивали с контрольными культурами. Клеткам давали борсодержащий препарат, а затем подвергали воздействию потока нейтронов. Затем из суспензии облучаемых клеток готовили серийные разведения и получали колонии клеток, которые фиксировали, окрашивали и подсчитывали. В итоге после серии экспериментов ученые добились того, чтобы после воздействия БНЗТ выживаемость здоровых клеток падала всего на 5%, в то время как опухолевых — на 98% [9], [10].
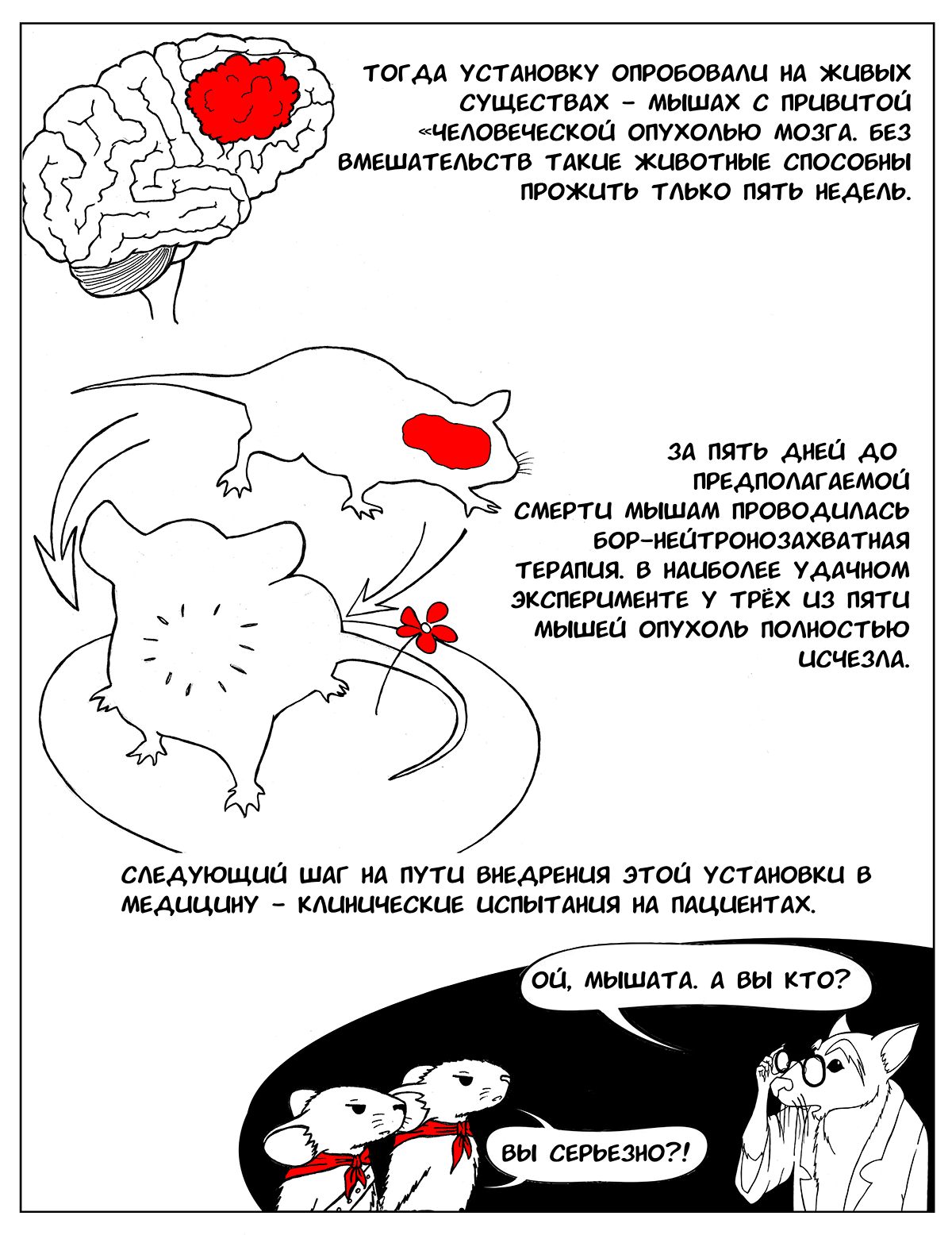
После этого установку опробовали на живых существах — мышах, которым была привита «человеческая» опухоль мозга. Без вмешательств такие животные способны прожить только пять недель. Однако исследователям с помощью своей установки удалось получить потрясающие результаты: в наиболее удачном эксперименте при проведении БНЗТ за пять дней до предполагаемой смерти мышей у трех из пяти животных опухоль полностью исчезла. В течение длительного наблюдения (два месяца) за этими животными рецидивы опухоли не возникли, мыши были здоровы [7], [11]. При этом мыши — очень маленький объект для установки, в отличие от человека, и воздействию пучка нейтронов подвергается все их тело, однако побочных эффектов от проведенной терапии отмечено не было. Поэтому следующий шаг, который будет предпринят в ближайшем будущем, — клинические испытания на пациентах.
Естественно, у этого метода есть ограничения: опухоль должна находиться не глубже 8 см и быть способной накапливать бор. Основными претендентами для мишеней БНЗТ являются опухоли мозга (злокачественные глиобластомы), меланома, опухоли головы и шеи, опухоли печени, рак легких [12]. Дальнейшее развитие этого направления и усовершенствование метода может дать шанс этим больным на исцеление.








Литература
- Kavitaa Nedunchezhian. (2016). Boron Neutron Capture Therapy - A Literature Review. JCDR;
- Каныгин В.В., Кичигин А.И., Губанова Н.В., Таскаев С.Ю. (2015). Возможности бор-нейтронозахватной терапии в лечении злокачественных опухолей головного мозга. «Вестник рентгенологии и радиологии». 6, 36–42;
- Hayato Koganei, Manabu Ueno, Shoji Tachikawa, Lisa Tasaki, Hyun Seung Ban, et. al.. (2013). Development of High Boron Content Liposomes and Their Promising Antitumor Effect for Neutron Capture Therapy of Cancers. Bioconjugate Chem.. 24, 124-132;
- Micah John Luderer, Barbara Muz, Kinan Alhallak, Jennifer Sun, Katherine Wasden, et. al.. (2019). Thermal Sensitive Liposomes Improve Delivery of Boronated Agents for Boron Neutron Capture Therapy. Pharm Res. 36;
- Таскаев С.Ю., Каныгин В.В., Бывальцев В.А., Заборонок А.А., Волкова О.Ю., и др. (2018). Перспективы использования ускорительного источника эпитепловых нейтронов для бор-нейтронозахватной терапии. «Медицинская техника». 2, 1–3;
- Таскаев С.Ю. (2015). Ускорительный источник эпитепловых нейтронов. «Физика элементарных частиц и атомного ядра». 6, 1770–1820;
- Таскаев С.Ю. (2016). Бор-нейтронoзахватная терапия рака: на финишной прямой. «Наука из первых рук». 5/6, 44–47;
- I. Sorokin, S. Taskaev. (2015). A new concept of a vacuum insulation tandem accelerator. Applied Radiation and Isotopes. 106, 101-103;
- Eisuke Sato, Alexander Zaboronok, Tetsuya Yamamoto, Kei Nakai, Sergey Taskaev, et. al.. (2018). Radiobiological response of U251MG, CHO-K1 and V79 cell lines to accelerator-based boron neutron capture therapy. Journal of Radiation Research. 59, 101-107;
- O. Yu. Volkova, L. V. Mechetina, A. V. Taranin, A. A. Zaboronok, K. Nakai, et. al.. (2016). Impact of neutron radiation on the viability of tumor cells cultured in the presence of boron-10 isotope. Vestn. rentgenol. radiol.. 97, 283-288;
- V.V. Kanygin, E.L. Zavyalov, A.E. Simonovich, A.I. Kasatova, A.I. Kichigin, et. al.. (2019). BORON NEUTRON CAPTURE THERAPY FOR HUMAN GLIOBLASTOMA ININ VIVO TUMOR MODELS. СПНО (MPSE);
- Andrea Wittig, Raymond L. Moss, Wolfgang A.G. Sauerwein. (2014). Glioblastoma, brain metastases and soft tissue sarcoma of extremities: Candidate tumors for BNCT. Applied Radiation and Isotopes. 88, 46-49.







