
Имитация сердечного слоя
23 ноября 2017
Имитация сердечного слоя
- 628
- 0
- 5
Кадры из фильма «Я, робот».
сделано на risovach.ru
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В 40% случаев причиной сердечно-сосудистых заболеваний является аритмия. Чтобы понять предпосылки развития аритмии, необходимо учитывать сложную структуру сердечной ткани. Исследовательская группа под руководством Константина Агладзе и Александра Панфилова разработала первую компьютерную модель, которая имитирует форму и взаимодействие реальных клеток.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Чувство ритма
Сердце — это насос, который гонит кровь по организму [1]. Чтобы насос работал, сердце должно ритмично сокращаться. Если насос работает неправильно, и ритм сокращений отличается от нормального (так называемая аритмия), это приводит к нарушениям в организме, порой смертельным. Согласно докладу Всемирной организации здравоохранения, сердечно-сосудистые заболевания являются самой частой причиной смерти по всему миру, причем 40% смертей происходит внезапно и вызваны аритмией [2]. Таким образом, чтобы уменьшить смертность от сердечно-сосудистых заболеваний, необходимо изучать развитие аритмии. Однако in vivo, то есть на пациентах, можно увидеть только финальную стадию, а наблюдать постепенные изменения, которые приводят к аритмии, невозможно. Поэтому логичным шагом является применение методов in silico — имитации живого сердца с помощью компьютерной модели [3].
Модель должна повторять проводящие свойства сердечной ткани, потому что сокращение сердца зависит именно от этих свойств. При аритмии электрические волны распространяются не так, как в норме. На распространение волн могут повлиять значительные изменения в устройстве сердечной ткани [4]. Например, если фибробластов становится слишком много, развивается фиброз — болезнь, приводящая к аритмии. Вообще, структура сердечной ткани строится на взаимодействии фибробластов, кардиомиоцитов и структурных белков. Такую сложную структуру и попытались воспроизвести ученые с помощью математической модели.
Восприятие форм
Передача возбуждения между клетками представляет большой научный интерес, поэтому ее уже пытались моделировать. Создали несколько простых моделей, на которых можно было наблюдать некоторые качественные эффекты [5–7]. Однако до сих пор не было модели, которая бы учитывала формы клеток, их взаимодействие, объединение в группы, а все эти факторы влияют на распространение волн. Исследовательская группа из лаборатории биофизики возбудимых систем МФТИ [8] и Гентского университета (Бельгия) решила разработать модель, в которой все эти факторы будут учтены [3].
Для моделирования требовалось собрать как можно больше экспериментальных данных о формах клеток. Ученые высеивали культуру из сердечных клеток двух типов: кардиомиоцитов и фибробластов. Сначала клетки высаживали изолированно друг от друга, потом — так, чтобы они составляли единый монослой (рис. 1, вверху). Первый случай более простой, поскольку там можно наблюдать за формой клеток без их взаимодействия. Характерные параметры, взятые из экспериментов, использовались в модели.

Рисунок 1. Экспериментальная клеточная культура в четырех случаях. Желтыми оттенками показаны кардиомиоциты, синими — фибробласты. На верхних двух картинках отдельные клетки и клетки в составе единого монослоя без нановолокон, на нижних двух — на подложке из нановолокон.
У нас отлажены методы высаживания клеток, их окрашивание и фотографирование, так что экспериментальная часть была довольно простой. Из собранной базы данных брали все параметры для модели: какую площадь занимает кардиомиоцит или фибробласт, какой они формы, чем отличаются, насколько они ветвистые. Оттуда же брали данные о взаимодействиях фибробласта и фибробласта, кардиомиоцита и кардиомиоцита, фибробласта и кардиомиоцита.
Разностороннее развитие
В сердце волны распространяются в разные стороны по-разному. Из-за того, что клетки имеют вытянутую форму, вдоль мышечного волокна возбуждение передается быстрее, чем поперек. Этот эффект называется анизотропией (когда в разные стороны возбуждение передается одинаково — изотропией). В сердечной ткани этот эффект обеспечивает внеклеточный матрикс. Чтобы воспроизвести анизотропию в модели, ученые повторили вышеописанный эксперимент, но на подложке из нановолокон (рис. 1, внизу). Высаженные клетки вытягивались вдоль волокна, как это происходит и в сердце [9].
В итоге ученые собрали статистику (около 200 клеток) по клеточным формам в четырех разных условиях и взаимодействии клеток друг с другом и подложкой. Эту статистику использовали, чтобы параметризовать модель. За основу взяли математическую модель [10], которая широко используется для описания роста тканей, но до этого момента не была оптимизирована для исследований сердечной ткани. После корректировки модель смогла воспроизвести клетки во всех четырех случаях (рис. 2).
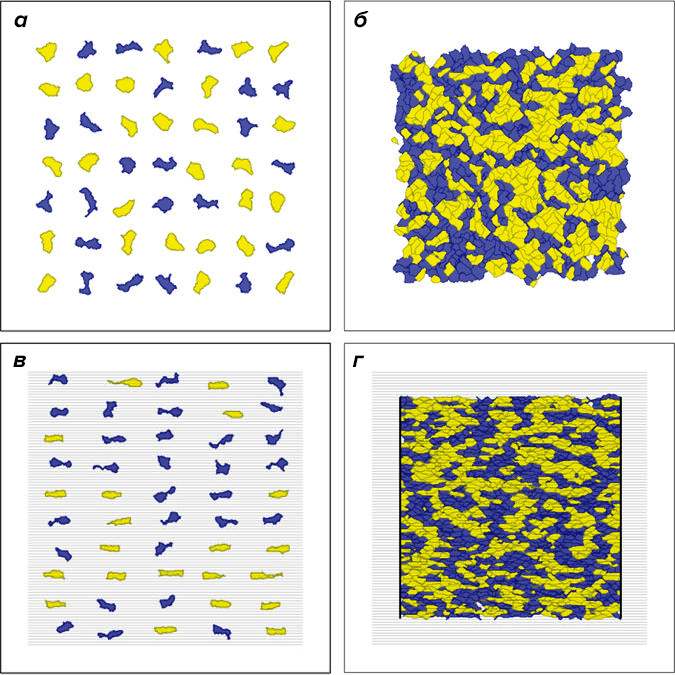
Рисунок 2. Моделирование в четырех случаях. Желтым показаны кардиомиоциты, синим — фибробласты. а — Отдельные клетки на изотропном субстрате. б — Клетки в составе единого монослоя на изотропном субстрате. в — Отдельные клетки на подложке из нановолокон. г — Монослой на подложке из нановолокон.
В течение полугода мы пробовали разные варианты моделей, но ни один из них не давал желаемого результата. Мы попробовали отойти от традиционных подходов к моделированию форм клеток и включили в модель точки контакта с подложкой. Мы сразу же получили очень приличный результат. Затем большое время занял сбор данных, их обработка и, наконец, параметризация модели. Важным шагом был анализ всевозможных морфологических параметров клеток и выбор тех параметров, которые характеризуют клетки.
С помощью экспериментов мы получили виртуальный монослой сердечной ткани, на котором можно моделировать аритмию. То есть мы можем менять разные факторы и смотреть, к чему это приведет и какова в таком случае вероятность аритмии.
Далее исследователи проверили функциональную достоверность модели. С помощью электрода они стимулировали реальный клеточный монослой и следили за распространением волн. То же самое они проделали с виртуальным монослоем. Результаты совпали и в изотропном, и в анизотропном случаях (рис. 3). То есть полученная модель повторяла свойства анизотропии, которые присутствуют в реальном сердце, а виртуальные волны распространялись с такой же скоростью, как и реальные. Конечно, надо помнить, что ученые пока смоделировали только монослой, и в будущем модель предстоит расширить до 3D-модели. Однако уже сейчас компьютерной имитации можно «задать» некоторые научные вопросы [3]. В частности, разработчики модели уже заметили несколько особенностей распространения волн, но об этом — в следующей научной статье.
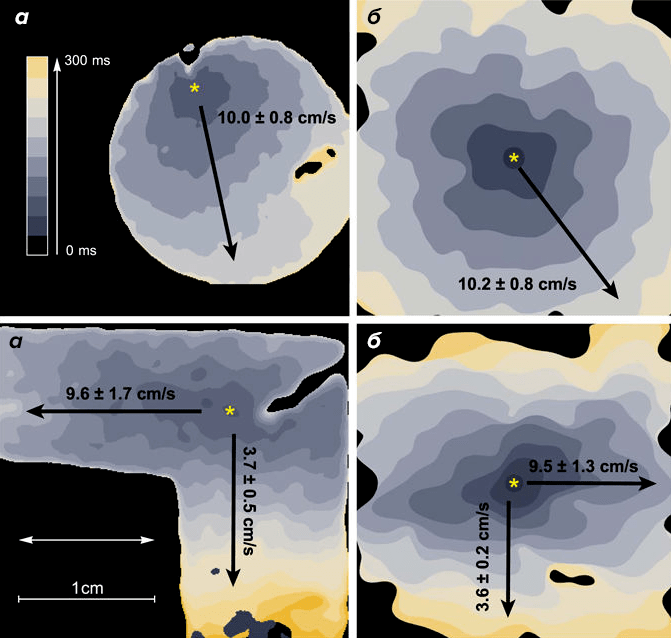
Рисунок 3. Распространение электрических волн. Верхние изображения — для изотропного случая; нижние — для анизотропного. a — Экспериментальные образцы. б — Компьютерная симуляция.
Литература
- Метроном: как руководить разрядами?;
- Rahul Mehra. (2007). Global public health problem of sudden cardiac death. Journal of Electrocardiology. 40, S118-S122;
- Nina Kudryashova, Valeriya Tsvelaya, Konstantin Agladze, Alexander Panfilov. (2017). Virtual cardiac monolayers for electrical wave propagation. Sci Rep. 7;
- Peter Kohl, Patrizia Camelliti, Francis L. Burton, Godfrey L. Smith. (2005). Electrical coupling of fibroblasts and myocytes: relevance for cardiac propagation. Journal of Electrocardiology. 38, 45-50;
- M. S. Spach, J. F. Heidlage. (1995). The Stochastic Nature of Cardiac Propagation at a Microscopic Level : Electrical Description of Myocardial Architecture and Its Application to Conduction. Circulation Research. 76, 366-380;
- Jong M. Kim, Nenad Bursac, Craig S. Henriquez. (2010). A Computer Model of Engineered Cardiac Monolayers. Biophysical Journal. 98, 1762-1771;
- Yann Prudat, Jan P. Kucera. (2014). Nonlinear behaviour of conduction and block in cardiac tissue with heterogeneous expression of connexin 43. Journal of Molecular and Cellular Cardiology. 76, 46-54;
- Лаборатория биофизики возбудимых систем: сердце, его вихри и фотоуправление;
- Yuliya Orlova, Nobuyuki Magome, Li Liu, Yong Chen, Konstantin Agladze. (2011). Electrospun nanofibers as a tool for architecture control in engineered cardiac tissue. Biomaterials. 32, 5615-5624;
- Ariel Balter, Roeland M. H. Merks, Nikodem J. Popławski, Maciej Swat, James A. Glazier. (Unknown published date.). The Glazier-Graner-Hogeweg Model: Extensions, Future Directions, and Opportunities for Further Study. Single-Cell-Based Models in Biology and Medicine. 151-167.






