
Лаборатория биофизики возбудимых систем: сердце, его вихри и фотоуправление
05 июня 2016
Лаборатория биофизики возбудимых систем: сердце, его вихри и фотоуправление
- 2865
- 0
- 4
рисунок Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Любимый подопытный орган в лаборатории биофизики возбудимых систем Московского Физтеха — сердце. Ученые исследуют причины возникновения аритмий и учатся контролировать свойства тканей с помощью света. В норме волны возбуждения, пробегая по сердцу, координируют его сокращения. Если возбудимая ткань нарушена, то такие волны могут разрываться. К чему это приведет? Оказывается, могут возникнуть вихри возбуждения, которые сбивают работу главного насоса организма. Как исследуют сердечное «волнение», управляют им, и вообще, почему всё это так важно — узнáем из первых рук.
Биология в Московском физтехе
XXI век называют «веком живых систем», изучение которых возможно только на стыке наук — математики, физики, химии и биологии. «Биомолекула» представляет серию материалов о том, как занимаются биологией в Московском физико-техническом институте (МФТИ).
Лаборатория биофизики возбудимых систем зародилась в МФТИ в 2010 году, после того как Константин Игоревич Агладзе (ее заведующий) получил мегагрант на свои исследования. Сейчас лаборатория достойно оборудована и населена дружным коллективом ученых, увлеченных своими проектами и угощающих гостей вкусным кофе :)
К.И. Агладзе (рис. 1), выпускник МФТИ, долгое время работал за границей; прямо перед возвращением в Россию он был профессором в Японии, в Киотском университете. Его основные научные работы посвящены исследованиям автоволн [1], [2]. Что это такое? Автоволна характеризуется тем, что энергия на ее поддержание берется из среды — как во время горения бикфордова шнура (фитиля, который тянется к взрывчатке). Такие процессы широко распространены в природе и постоянно происходят в нашем организме; примером их может служить потенциал действия — передача сигнала по аксону нейрона. В лаборатории изучают не просто автоволновые процессы, а те из них, что происходят в сердце, и, разумеется, основным объектом исследования служит сердечная ткань. А именно — специально выращенный слой кардиомиоцитов (клеток сердечной мышцы). Для того чтобы глубже понять специфику такой научной деятельности, давайте вспомним уровни организации живого.
Про уровни организации живого
Итак, пропуская самые глобальные уровни организации биологических систем (биосферный, популяционный и т.д.), начнем с того, что животное — это организм. То есть мы можем изучать его на организменном уровне. На органном уровне рассматриваются органы, а на тканевом — ткани, из которых органы состоят. Ткани, в свою очередь, формируются из клеток, а ниже клеточного уровня спускаться в этой статье мы не будем (на «биомолекуле» и так достаточно материалов про молекулярный уровень).
Важно понять, что, поднимаясь в этой иерархии выше (от клетки к организму), организация живого усложняется. Однако очень многие фундаментальные знания получены исследователями, которые работают с относительно простой системой — с культурами клеток, — а стало быть, не учитывают нюансов клеточной организации в рамках ткани, органа и организма в целом. Очевидно, что многие задачи требуют более глубокого изучения. Например, невозможно понять, как работает сердце, экспериментируя только с отдельными клетками сердечной мышцы (кардиомиоцитами). Важно представлять себе функционирующую ткань и орган в целом.
В лаборатории Агладзе ведется работа с культурами сердечной ткани. Ее выращивают с использованием специальных направляющих волокон, структурирующих рост клеток. Такой подход позволяет изучать именно ткань — в том виде, в котором она функционирует в органе, а не просто однородный слой кардиомиоцитов. Для этих целей сотрудники МФТИ ввели в работу спидроин — белок паутины [3], волокна которого служат основой для выращивания культуры ткани и придают ей нужную архитектуру (рис. 2).

Рисунок 2. Кардиомиоциты крыс растут на нановолоконной подложке из спидроина — белка паутины. Зеленым окрашен α-актин (белок мышечной ткани), синим — ядра клеток, желтым — фибриллы спидроина.
Аритмии и волны
Две ключевых характеристики ткани сердца — это сократимость и возбудимость . Волна возбуждения периодически охватывает сердце и приводит к согласованным сердечным сокращениям [4]. Частоту сердцебиения человека регулирует синусный узел. Пробегает волна — сокращаются предсердия, волна бежит дальше — сокращаются желудочки. Задаваемый ритм жизненно важен: любые отклонения от нормы представляют угрозу для здоровья и называются аритмиями. Нарушения ритма — это, прежде всего, его нерегулярность, а также чрезмерное замедление или ускорение. У таких расстройств причины бывают разные, но чаще они развиваются из-за повреждений сердечной ткани, таких как постинфарктные шрамы и рубцы. Влияние оказывают и менее очевидные факторы: например, обострение сердечно-сосудистых заболеваний часто связано с определенным временем суток [5].
Про передачу импульсов в нервной системе можно прочитать в статье «Отто Лёви: от нерва к нерву» [6], главный герой которой — лауреат Нобелевской премии по физиологии и медицине.
Для того чтобы понять, как шрам может сбить синхронизацию сердечных сокращений, нужно подробнее рассмотреть автоволны и автоволновые вихри. Представьте себе горящий шнур. У него есть несколько частей: нетронутая огнем — ждущая, горящая — возбужденная, сгоревшая и — если это волшебный шнур, который со временем восстанавливается, — восстанавливающаяся. Последняя вскоре окончательно придет в норму и станет ждущей. Если шнур замкнуть в кольцо, в такой системе может возникнуть автоволновой вихрь. Волна возбуждения будет пробегать по шнуру снова и снова, получая энергию для своего распространения из среды. Автоволновые вихри в сердце лежат в основе самых опасных аритмий. Рассинхронизация сокращений кардиомиоцитов может произойти из-за разрыва волны возбуждения, которая распространяется в сердце, начиная от синусного узла. А волна разрывается из-за столкновения с сердечной тканью, которая не проводит возбуждение, — например шрамом или рубцом.
Вихревые аритмии сердца
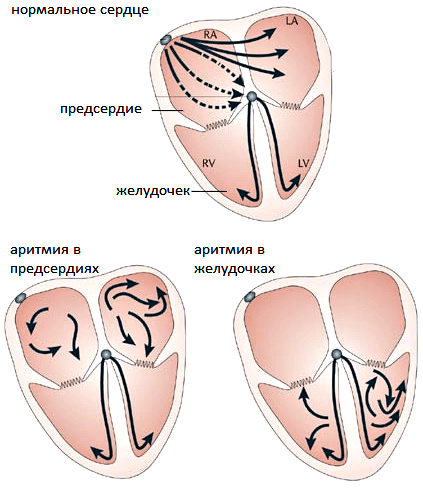
Рисунок 3. Нормальное и аномальное распространение возбуждения по сердечной ткани. Сверху — нормальное сердце. Стрелки соответствуют направлению распространения возбуждения по предсердиям и желудочкам. Снизу — примеры разнонаправленного возбуждения предсердий (слева) или желудочков (справа) при аритмиях.
Почему шрам не проводит возбуждение? Дело в том, что ткань, поврежденная, скажем, во время инфаркта, отличается по своим характеристикам от нормальной. После активной работы ей, как правило, нужно больше времени на восстановление. Возбудившись и сократившись, обычные кардиомиоциты могут стать вновь возбудимыми быстрее, чем поврежденные. Из-за этого в районе шрамов возникают потенциально непроводящие зоны, разрывающие волну. Представьте, что волна их огибает, как поток воды — камень. Но тут многострадальные околошрамные клетки наконец восстанавливают свою возбудимость. Тогда волна возбуждения разворачивается и захватывает их, но получается, что она идет уже не в том направлении. Как если бы камень, огибаемый потоком воды, исчез — поток бы локально изменил направление. Вот так и в сердце. Только в нём изменение направления волн возбуждения очень опасно. Это ведет к тому, что кардиомиоциты начинают сокращаться непоследовательно, и в сердце закручивается вихрь, который называют риентри (рис. 3) [7].
Аритмии — опасные заболевания, которые могут закончиться летальным исходом, поэтому очень важно, во-первых, изучать их причины, а во-вторых, уметь подбирать правильные лекарства. В лаборатории Агладзе на культуре сердечной ткани (которая обладает ключевыми свойствами сердца — возбудимостью и сократимостью) изучают причины аритмий, моделируют шрамы на сердце, создают системы для тестирования лекарств. Эта история началась с культур сердечной ткани крыс. У новорожденных крысят брали кардиомиоциты, из которых выращивали ткань. Ей придавали особую архитектуру, изучение которой представляло интерес, и смотрели, как распространяются волны возбуждения. Следить за этим процессом можно с помощью особой техники, которая называется оптическим картированием (подробнее о ней рассказано во врезке).
Суммируя сказанное, актуальность работ лаборатории биофизики возбудимых систем можно пояснить так:
- Важно изучать ткань, а не отдельные клетки.
- Ткань в модельной системе должна быть похожа на ту, что в органе, то есть должна обладать определенной архитектурой.
- В лаборатории умеют получать кусочки структурированной сердечной ткани, направляя рост клеток с помощью особых полимерных волокон. Эта методика уникальна для России и была разработана К.И. Агладзе.
- Такая экспериментальная система позволяет делать многое: моделировать аритмии, изучая фундаментальные механизмы их возникновения, наблюдать за ответом сердечной ткани на воздействие различных химических веществ, лекарств и т.д. «И т.д.» — это всё, что придумает экспериментатор. Кусочек сердца в чашке Петри — разве не здорово? Это же очень большое поле для удовлетворения любопытства ученых — несмотря на то, что его диаметр может быть всего 3 см!
Кусочек человеческого сердца — зачем это нужно? Изучение синдрома удлиненного QT-интервала
Конечно, огромный интерес для медицины представляют аналогичные работы с человеческой сердечной тканью. Но как ее получают? В случае людей — по сравнению с крысами — путь более сложный. Сначала берут образцы клеток человека, например клетки кожи. Затем методами молекулярной биологии из клеток кожи делают индуцированные плюрипотентные стволовые клетки (ИПСК). То есть такие, которые способны бесконечно делиться и дифференцироваться — производить любой другой тип клеток, и сердечные в том числе. (Кстати, за методику получения ИПСК Нобелевской премии был удостоен Синья Яманака: «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [8].) Итак, имея ИПСК человека, можно вырастить его сердечную ткань.
Константин Агладзе рассказал, что сейчас в лаборатории развиваются направления, связанные с перепрограммированием клеток. Получение ИПСК человека — задача непростая, о реализации которой в лаборатории думали с самого ее основания. Сдвинуться с мертвой точки в этом плане помогло сотрудничество с новосибирскими учеными. «Я не молекулярный биолог, я биофизик, и мои основные знания именно в этой области. В Японии у нас был очень удачный тандем с людьми, которые занимались именно молекулярной биологией, и мы делали хорошие работы. А здесь, в России, найти нормальных партнеров, способных делать хорошие, правильные вещи на мировом уровне, оказалось очень трудно... Наш главный партнер — это Сурен Минасович Закиян, заведующий лабораторией в Институте цитологии и генетики Сибирского отделения РАН. Он умеет делать индуцированные плюрипотентные клетки либо из клеток крови, либо из кожных соскобов пациентов. Он нам помог, и мы поставили у нас в лаборатории дифференцировку этих ИПСК в кардиомиоциты», — говорит Агладзе.
Особенно важно, что методика получения ИПСК открывает возможности для персонализированной кардиомедицины — области, которая развивается семимильными шагами [9]. Ведь соскоб кожи можно взять у любого пациента и перепрограммировать его в сердечную ткань. Почему так важен индивидуальный подход? Ответ на этот вопрос простой и сложный одновременно: все люди разные. У всех нас есть масса генетических особенностей. Лекарство, полезное одному, может навредить другому. Одни и те же симптомы могут быть вызваны разными заболеваниями.
К.И. Агладзе рассказал про разработку подходов персонализированной медицины в лаборатории: «Если взять даже небольшое количество клеточного материала и перевести его в ИПСК, то после этого можно, на самом деле, наработать сколько хотите клеток. Это очень важный момент, потому что здесь еще возникает такая совершенно фантастическая возможность: наконец получить пациент-специфические культуры сердечной ткани. А раз мы получаем пациент-специфические ткани, то мы можем на этих культурах тестировать лекарства и повреждающие воздействия различных химических веществ, смотреть индивидуальную чувствительность и вообще всё что угодно. То есть тут возникает целый огромный куст возможностей». В частности, в лаборатории ведутся исследования синдрома удлиненного QT-интервала. Это генетическое заболевание, предрасполагающее людей к аритмиям.
Многие примерно представляют себе, как выглядит электрокардиограмма (ЭКГ). Она характеризует электрические поля, возникающие при работе сердца [10]. На ЭКГ можно видеть различные пики, зубцы и впадины (рис. 5), носящие индивидуальные буквенные обозначения и соответствуюшие определенным процессам в сердце. Причем ЭКГ здорового человека отличается от ЭКГ страдающего сердечными заболеваниями. Такие отличия могут быть как врожденными (наследуемыми), так и приобретенными. Синдром удлиненного интервала QT — это наследственное заболевание. QT-интервал соответствует на ЭКГ промежутку от начала распространения возбуждения по клеткам желудочков до восстановления на их мембранах потенциала покоя [11]. Удлиненный интервал очень опасен, потому что часто вызывает аритмии, приводящие к летальному исходу.
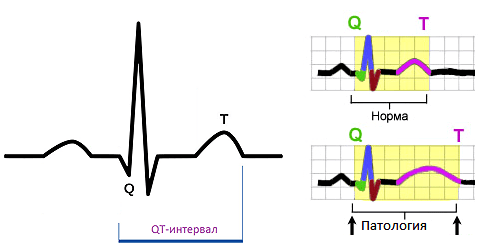
Рисунок 5. Электрокардиограмма человека (ЭКГ) — графическое представление разности потенциалов, возникающих в результате работы сердца и проводящихся на поверхность тела. QT-интервал соответствует периоду от начала распространения возбуждения по клеткам желудочков до восстановления на их мембранах потенциала покоя. Границы QT-интервала на ЭКГ показаны на левой части рисунка. На правой части представлено сравнение ЭКГ в норме и при патологии. На нижней правой панели показано, что QT-интервал удлиняется при соответствующем синдроме.
сайт meduniver.com, рисунок адаптирован
По словам К.И. Агладзе, в лабораторию биофизики возбудимых систем персонализированная медицина пришла из Новосибирска. Сурен Минасович Закиян, находясь в тесном контакте с кардиологической клиникой имени Мешалкина, получил линии клеток людей с мутациями, приводящими к измененной электрокардиограмме, к удлиненному QT-интервалу.
В проекте по изучению синдрома удлиненного интервала QT участвует Цвелая Валерия (см. врезку). Основная техническая задача в рамках проекта — получить пациент-специфические культуры ткани, соответствующие здоровым людям и больным синдромом удлиненного QT-интервала. Достижение этой цели откроет возможности для изучения фундаментальных механизмов возникновения аритмий у доноров клеток и у людей, страдающих аналогичными заболеваниями, а также позволит подобрать антиаритмики, которые подходят каждому донору индивидуально (а это и есть пресловутая персонализированная медицина).
Моделирование аритмий на компьютере и не только
Ну и конечно, какая современная биологическая лаборатория обходится без компьютерного моделирования [12]? Вот и лаборатория биофизики возбудимых систем не обходится. Это еще один метод исследования [13], который помогает понять, почему развиваются аритмии. По словам Константина Агладзе, за последние годы компьютерное моделирование процессов, происходящих в сердце, шагнуло далеко вперед. Существуют очень подробные модели, специфичные для крыс, кролика и человека. Они довольно близки к реальности и обладают значительной предсказательной силой. Например, в 2015 году сотрудниками лаборатории была опубликована работа, сделанная с помощью модели ткани человеческих желудочков «ten Tusscher, Panfilov, 2006» [14].
Кстати, полезные советы начинающим биоинформатикам можно прочитать в другой статье на «биомолекуле»: «Я б в биоинформатики пошел, пусть меня научат!» [15].
Константин Агладзе уверен, что компьютерное моделирование очень сильно дополняет эксперимент: «Как всегда в физике, есть опыт, а есть уравнение. Например, мы случайно обнаружили, что волна вдоль определенного вида границы ускоряется при каких-то условиях, а при каких-то замедляется (подробнее про эту работу см. врезку ниже). Из этого могут возникнуть всякие варианты хаотизации (процессы, приводящие к аритмиям). Следующая волна, например, натыкается на хвост предыдущей. Возникают разрывы, и закручиваются вихри. Но мы должны понимать: это у нас артефакт эксперимента или какое-то общее свойство?» Примерно такие вопросы можно задать компьютеру, и он ответит — если только вопросы были заданы на понятном машине языке. Таким образом, моделирование открывает новые возможности изучения биологии.
Актуальность компьютерных исследований Константин Игоревич аргументирует и с экономической точки зрения: «Биомедицинские эксперименты очень дороги. Это совершенно неприятная новость для тех, кто руководит нашей наукой. Для того чтобы понять, стоит ли делать некоторые вещи или нет, мы можем их проверить на компьютерных моделях».
Пример реальной задачи, которая решается в лаборатории моделированием, приводит Валерия Цвелая: «Хотите моделировать? У нас есть это. У нас потрясающее компьютерное моделирование. Мы сейчас, например, делаем полную модель монослоя кардиомиоцитов как он есть. Со всеми контактами и так далее. Это параллельно и экспериментальная работа, естественно, и компьютерное моделирование процессов. Это моделирование различных подложек, колоссальные фундаментальные задачи по аритмиям, по формированию структуры ткани». То есть в перспективе проект должен дать довольно полную модель сердечной ткани, полезную для анализа экспериментальных данных и служащую самостоятельным инструментом исследования.
Культура сердечных клеток на стеклянной подложке диаметром 25 мм. Конечно, изображенное на видео слегка непонятно. Вот как описал наблюдаемое сам Константин Игоревич: «Изначально была спиральная волна, а черная точка — это электрод. Когда на электрод подали серию стимулирующих импульсов с частотой выше, чем частота вращения спиральной волны, волны от электрода засинхронизовали спиральную волну, а затем вытолкнули ее за границу среды, уничтожили. Это видео опубликовано в моей статье в Amer. J. Physiol. [27] и объясняет механизм снятия тахиаритмии процедурой overdrive pacing».
Фотоуправление возбудимыми тканями
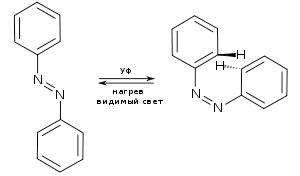
Рисунок 9. Переключение транс-азобензола (слева) в цис-азобензол (справа) под действием ультрафиолета.
сайт ru.wikipedia.org
В 2016 году сотрудники лаборатории опубликовали статью, в которой описали механизм управления клетками возбудимых тканей, такими как нервная и сердечная, с помощью света [28]. Разработка может дать ряд интересных решений для медицины, о которых будет сказано чуть ниже. Основные преимущества фотоуправления — это дистанционность, точность и легкая обратимость всех манипуляций. Ключевую роль в этом процессе играет вещество азоТАБ (бромид триметиламина азобензола). Производные азобензола известны уже около восьмидесяти лет и с точки зрения структуры обладают двумя интересными свойствами: изменять конформацию при действии на них ультрафиолета (рис. 9) и довольно легко подвергаться химическим изменениям [29]. У азоТАБа есть две формы: активная, блокирующая проведение возбуждения в тканях, и пассивная, не влияющая на работу ткани. «Переключать» азоТАБ можно множество раз (важно, что он стабилен!) светом определенных длин волн. Переключение происходит менее чем за одну минуту.
Производные азобензола и ранее использовали для блокировки возбуждения в тканях [30]. Они вызывали интерес у ученых, потому что позволяли контролировать поведение клеток с помощью света. (Но не путайте с оптогенетикой [31], это другая история!) Но как именно азоТАБ работает? Детальный механизм его действия долго оставался неизученным. Пролить на него свет удалось как раз ученым из лаборатории Агладзе [28]. Клетка возбуждается из-за того, что меняется потенциал на ее мембране [11], а именно: в состоянии покоя суммарный заряд на внешней стороне мембраны больше, чем на внутренней (такое соотношение достигается за счет работы ионных каналов), при возбуждении мембранный потенциал сердечной клетки временно меняется — возникает потенциал действия, что влечет за собой сокращение кардиомиоцита. В генерации потенциала действия участвуют ионные каналы, такие как натриевый, кальциевый и калиевый. Они регулируют перенос через мембрану ионов Na+, Ca2+ и K+ соответственно. Подробнее работа каналов описана в статье «Калиевый канал in silico» [32], а сейчас важно понять, что азоТАБ блокирует возбуждение кардиомиоцитов, именно изменяя перенос ионов через мембрану. Оказалось, что активная форма азоТАБа подавляет работу натриевого и кальциевого каналов [28]. Почему же это всё интересно?
Если добавить азоТАБ к культуре сердечной ткани, то этой культурой будет очень легко управлять: достаточно посветить ультрафиолетом. По словам Константина Игоревича Агладзе, не обязательно облучать всю ткань: на нее можно проецировать сложные световые картинки и делать так, что возбуждение будет распространяться только согласно проекции. Причем экспериментатор способен со временем изменять картинку. Конечно, эта разработка крайне полезна для изучения фундаментальных законов передачи сигналов в сердечной ткани. Возможность изменять во времени свет, спроецированный на ткань, — важное преимущество. Это значит, что азоТАБ поможет в изучении нестационарных процессов: ключевое значение для медицины имеет понимание динамики работы органа, его изменение во времени.
Применение азоТАБа сильно расширило возможности фундаментальных исследований в лаборатории. Как же в целом изучают механизмы возникновения аритмий? Методами тканевой инженерии кардиомиоциты выстраивают так, чтобы полученная система отражала патологии сердца с точки зрения физиков и биофизиков. В таких системах оценивают, например, влияние шрамов на работу сердечной ткани. Будет ли волна возбуждения разрываться и образовывать вихри или не будет? Блокирование азоТАБом локальных участков ткани позволяет смоделировать шрам с помощью света, минуя сложные биоинженерные манипуляции!
Менее токсичные аналоги азоТАБа могут легко найти применение в фармацевтике. Есть такая процедура, которая называется радиоаблация: это когда в сердце выжигается паразитный источник возбуждения, чтобы убрать аритмию. Минусом процедуры является то, что целевой фрагмент ткани часто находят не с первого раза, прожигая здоровую ткань. Из-за этого на сердце остаются шрамы, что плохо само по себе. Фотоуправление с помощью аналогов азоТАБа позволит не выжигать ткань, а временно выключать. Если выключить неправильный участок ткани, то можно опять его включить и найти другой. А когда таки обнаружится зловредный источник паразитных возбуждений, то его можно будет уже и прижечь. Для того чтобы осуществить такую процедуру в живом человеке, еще предстоит получить нетоксичные аналоги азоТАБа. Тогда эти вещества можно будет с помощью шприца вводить в целевой участок органа.
Константин Игоревич планирует расширять лабораторию в зависимости от имеющихся ресурсов. С новыми идеями проблем точно нет: «Идей и потенциальных направлений у нас сейчас очень много. Очень много. Особенно в связи с тем, что сейчас пошла хорошая коллаборация с Новосибирском».
К новым сотрудникам заведующий лабораторией предъявляет довольно лояльные требования: «Главное — желание работать и общая грамотность. Во-первых, человек должен быть ответственным: если он обещал что-то сделать, то он это делает. Во-вторых, обладать разумной креативностью. Потому что креативность бывает разумная, а бывает неразумная — слишком большая. Главное, уметь находить границы всего этого. Что касается общей подготовки, то ко мне приходят работать студенты даже с первого курса. Они еще много чего не знают, но в процессе получают необходимое образование».
Литература
- Agladze K.I. and Krinsky V.I. (1982). Multi-armed vortices in an active chemical medium. Nature. 296, 424–426;
- Agladze K.I., Krinsky V.I., Pertsov A.M. (1984). Chaos in the non-stirred Belousov—Zhabotinsky reaction is induced by interaction of waves and stationary dissipative structures. Nature. 308, 834–835;
- Teplenin A., Krasheninnikova A., Agladze N., Sidoruk K., Agapova O., Agapov I. et al. (2015). Functional analysis of the engineered cardiac tissue grown on recombinant spidroin fiber meshes. PloS One. 10, e0121155;
- Метроном: как руководить разрядами?;
- Молекулярные часы нашего сердца;
- Отто Лёви: от нерва к нерву;
- Nattel S. and Carlsson L. (2006). Innovative approaches to anti-arrhythmic drug therapy. Nat. Rev. Drug. Discov. 5, 1034–1049;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- От медицины для всех — к медицине для каждого!;
- Автор главного треугольника медицины;
- Формирование мембранного потенциала покоя;
- Исследовательская группа Филиппа Хайтовича, или Как биологи работают с большими массивами данных;
- Вычислительное будущее биологии;
- Kudryashova N.N., Kazbanov I.V., Panfilov A.V., Agladze K.I. (2015). Conditions for waveblock due to anisotropy in a model of human ventricular tissue. PloS One. 10, e0141832;
- Я б в биоинформатики пошёл, пусть меня научат!;
- Miki K., Uenaka H., Saito A., Miyagawa S., Sakaguchi T., Higuchi T. et al. (2012). Bioengineered myocardium derived from induced pluripotent stem cells improves cardiac function and attenuates cardiac remodeling following chronic myocardial infarction in rats. Stem Cells Transl. Med. 1, 430–437;
- Кровеносные сосуды XXI века;
- Bursac N., Parker K.K., Iravanian S., Tung L. (2002). Cardiomyocyte cultures with controlled macroscopic anisotropy: a model for functional electrophysiological studies of cardiac muscle. Circ. Res. 91, e45–e54;
- Kai D., Prabhakaran M.P., Jin G., Ramakrishna S. (2011). Guided orientation of cardiomyocytes on electrospun aligned nanofibers for cardiac tissue engineering. J. Biomed. Mater. Res. B Appl. Biomater. 98B, 379–386;
- Kudryashova N.N., Teplenin A.S., Orlova Y.V., Selina L.V., Agladze K. (2014). Arrhythmogenic role of the border between two areas of cardiac cell alignment. J. Mol. Cell. Cardiol. 76, 227–234;
- Agladze K., Keener J.P., Müller S.C., Panfilov A. (1994). Rotating spiral waves created by geometry. Science. 264, 1746–1748;
- Cabo C., Pertsov A.M., Baxter W.T., Davidenko J.M., Gray R.A., Jalife J. (1994). Wave-front curvature as a cause of slow conduction and block in isolated cardiac muscle. Circ. Res. 75, 1014–1028;
- Kadota S., Kay M.W., Magome N., Agladze K. (2012). Curvature-dependent excitation propagation in cultured cardiac tissue. JETP Lett. 94, 824–830;
- Ho S.Y., Anderson R.H., Sánchez-Quintana D. (2002). Atrial structure and fibres: morphologic bases of atrial conduction. Cardiovasc. Res. 54, 325–336;
- Vetter F.J., Simons S.B., Mironov S., Hyatt C.J., Pertsov A.M. (2005). Epicardial fiber organization in swine right ventricle and its impact on propagation. Circ. Res. 96, 244–251;
- Orlova Y., Magome N., Liu L., Chen Y., Agladze K. (2011). Electrospun nanofibers as a tool for architecture control in engineered cardiac tissue. Biomaterials. 32, 5615–5624;
- Agladze K., Kay M.W., Krinsky V., Sarvazyan N. (2007). Interaction between spiral and paced waves in cardiac tissue. Am. J. Physiol. Heart Circ. Physiol. 293, H503–H513;
- Frolova S.R., Gaiko O., Tsvelaya V.A., Pimenov O.Y., Agladze K.I. (2016). Photocontrol of voltage-gated Ion channel activity by azobenzene trimethylammonium bromide in neonatal rat cardiomyocytes. PLoS One. 11, e0152018;
- Beharry A.A. and Woolley G.A. (2011). Azobenzene photoswitches for biomolecules. Chem. Soc. Rev. 40, 4422–4437;
- Hoppmann C., Schmieder P., Domaing P., Vogelreiter G., Eichhorst J., Wiesner B. et al. (2011). Photocontrol of contracting muscle fibers. Angew. Chem. Int. Ed. Engl. 50, 7699–7702;
- Светлая голова;
- Калиевый канал in silico;
- Галайдыч О.В, Ерофеев И.С, Агладзе К.И. (2013). Оптическое картирование волн возбуждения в светочувствительной иммортализованной культуре кардиомиоцитов. Труды МФТИ. 5, 94–102.







