Ингибируй, властвуй, понижай
30 октября 2014
Ингибируй, властвуй, понижай
- 1234
- 0
- 1
Полученные в ходе работы экстракты, концентраты и элюаты из репы и свёклы
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Как ни заглянешь в лабораторию биофизики на Школе молекулярной и теоретической биологии в Пущино — удивишься: вот ребята режут свёклу, вот измельчают репку на тёрке, вот сотрудники рисуют на доске куски пиццы... Темноволосый старшеклассник в фартуке достаёт прихваткой контейнер из микроволновки. Нет, он не записался на кулинарные курсы. Он окрашивает белки в геле после электрофореза.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Своя работа».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Слизни, насекомые и прочие «поедатели» растений, а также патогенные микроорганизмы расщепляют белки своих молчаливых жертв с помощью особой группы ферментов — сериновых протеиназ (в частности, к ним относится трипсин). Но в эволюционных войнах не выигрывает тот, кто ничего не изобретает, и растения выработали различные механизмы защиты. Дать отпор врагам на биохимическом уровне помогают ингибиторы различных протеиназ, в том числе и сериновых, которые мешают консументам 1-го порядка переварить растительные белки.
Учёные постоянно ищут новые ингибиторы сериновых протеиназ в культурных растениях. Уже известны ингибиторы трипсина, выделенные из кукурузы, сои, гороха, картофеля и других овощных культур, однако малоизвестные за рубежом, но такие традиционные для России репа и свёкла до недавних пор не были исследованы на предмет наличия таких белков. А что, если (и это даже вполне вероятно) ингибиторы из этих корнеплодов даже лучше справятся с некоторыми задачами, чем их известные аналоги?
Девица в темнице, коса на улице
Цели? Мы что, борцы за права растений и хотим помочь им не быть съеденными? — И это тоже. Защищать сельскохозяйственные культуры от вредителей, подавляя активность ферментов последних — интересная идея, но не единственный способ использования найденных веществ. В силу собственной эгоистичности человек, конечно, в первую очередь будет искать вещества, регулирующие различные функции его организма (и в данном случае не промахнётся): сериновые протеиназы участвуют в таких важных процессах, как пищеварение (что неудивительно — мы и начинали с разговора о расщеплении растительных белков), свёртывание крови, иммунный ответ и даже размножение. Некоторые ингибиторы протеиназ уже нашли применение в медицине — как препарат Инвираза® (сакнавир), используемый для лечения ВИЧ-инфекции и удостоенный премии Галена (одной из высочайших наград, присуждаемых за создание лекарственных препаратов). Представляете, какие возможности могут скрывать под землёй такие обыденные, привычные корнеплоды?
Рисунок 1. Типы ингибирования на примере Pac-Man («олицетворяет» фермент) и пиццы (субстрат/ингибитор). При конкурентном типе ингибирования Pac-Man ест пиццу-ингибитор. Она у него «во рту», заткнула активный центр, но через некоторое время он может её «выплюнуть», если увидит кусок получше. При неконкурентном ингибировании пицца не съедается, а ударяет Pac-Man-а так, что тот уже не может есть новую пиццу.
Ешь свёклу — и тромбов не будет?
К тому же классу ферментов — сериновым протеиназам — относится и тромбин, который в каскаде свёртывания «отрезает хвостики» молекулы фибриногена (подробнее об этом можно прочитать в статье «Как работает свертывание крови?» [2]). Таким образом он «распаковывает» мономеры фибрина — кирпичики, из которых строится «каркас» кровяного сгустка, укрепляя наскоро собранную «дамбу» из тромбоцитов. К этому каркасу вскоре прилипают клетки крови, формируя сначала белый, а потом и красный тромб. Работа этой системы помогает нам избежать риска смерти от потери крови после каждой царапины (у людей с гемофилией даже самый маленький синяк превращается в огромную гематому). Одним из сигналов, запускающих каскад реакций свёртывания, является белок тканевый фактор (как нетрудно догадаться, попадающий в кровь из повреждённых тканей). Реакции идут на отрицательно заряженных поверхностях, сформированных обрывками повреждённых клеток.
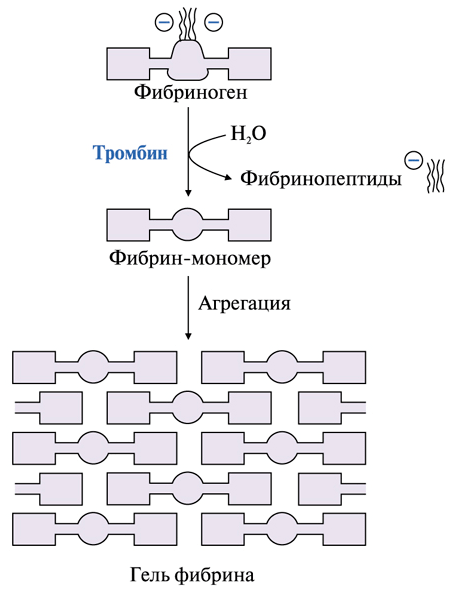
Рисунок 2. Схема механизма сворачивания крови
Однако отрицательный заряд формируется в ответ ещё и на различные металлические протезы или сердечные клапаны. Что же получается? Белки-активаторы, как дозорные, следящие за общим состоянием крови, решают, что крепостная стена — стенка кровеносного сосуда — разрушена, и через нескольких промежуточных «гонцов» передают экстренное послание тромбину. Тромбин, конечно, бросает все силы на распаковку кирпичей и строительство баррикад. Тромбоциты, сформировавшие так называемый белый тромб в течение 3–5 минут, как наскоро набросанные мешки с песком, укрепляются «цементным» каркасом, в котором застревают проезжающие повозки с кислородом — эритроциты, — и дыра в крепостной стене (или в плотине, как вам угодно) оказывается залатанной. Но тревога-то ложная, никаких разрушений изначально не было! Поэтому внезапно выросшая на оживлённой магистрали баррикада тормозит жизнь города, не пропускает машины и вызывает настоящий транспортный коллапс. А дальше может произойти то, что на научном языке называют зловещим термином «лёгочная тромбоэмболия» — всё это сооружение отрывается от стенки сосуда и плывёт вместе с кровотоком к сердцу, а оттуда попадает в лёгочную артерию, где и застревает, чем лишает лёгочные сосуды кровоснабжения (что может привести к мгновенному летальному исходу).
Учёные разрабатывают методы борьбы с тромбозом (аккуратно, без повреждения самого сосуда, не дать сформироваться сгустку или «распилить» уже сформировавшийся), но диагностировать наличие тромба до тех пор, пока он не начал доставлять серьёзных неприятностей, непросто. Поэтому создание лекарства, которое предотвращает образование тромбов (особенно у групп риска), спасло бы миллионы жизней. А нахождение вещества, подавляющего активность сериновой протеиназы тромбина, сразу «выключало» бы этот фермент из сложной цепи реакций, вытаскивая костяшку из огромной череды домино и останавливая падение следующих. И это лишь один из примеров возможного использования в будущем свойств белков этого класса.
Разумеется, на двухнедельной школе никто не ставил цели открыть универсальное лекарство от всех болезней — мы хотели лишь выделить и изучить ингибиторы (заодно выделялись и протеиназы — из личинок мясной мухи). Никто не утверждает, что если кушать много репки и свёклы — можно спастись от тромбоза (собственно, способность наших ингибиторов как-то воздействовать на тромбин ещё не проверялась, да и не в этом состояла задача Школы). Тем более, что через желудочно-кишечный тракт ингибиторы в кровь не попадут — расщепятся. Однако проделанная работа — капля в море — чернильной точкой закроет ещё одно (пусть и небольшое) белое пятнышко в науке. Или — что даже важнее — станет поворотным моментом в судьбе детей, которые, выполняя её, получили шанс погрузиться в настоящую лабораторную жизнь.

Рисунок 3. Лабораторная работа
Вытянули репку!
То, что ингибиторы трипсина вообще содержатся в репе и свёкле, впервые было установлено в ходе работы лаборатории системной биологии (под руководством Михаила Пантелеева) на Школе молекулярной и теоретической биологии в 2013 году. Активность ингибиторов, содержащихся в экстракте свёклы (Beta vulgaris) и репы (Brassica rapa) проверялась по эффекту на модельную инфекцию (грибок Aspergillus flavus или бактерия Esherichia coli). По первоначальному замыслу, рост патогенных грибков и бактерий должен был быть подавлен добавлением ингибиторов (выделенных методами фильтрования, центрифугирования, термообработки и доведения рН) по сравнению с контролем — ампициллином для кишечной палочки и клотримазолом для гриба.
Однако тогда было очищено недостаточное количество белка (вероятнее, даже нескольких белков) для аминокислотного секвенирования, и даже наличия белков в репе доказать не удалось. В 2014-м был использован более сложный метод очистки (аффинная хроматография), благодаря чему ингибиторы были очищены от примесей, выделены в нужном объёме, и их наличие в репе было доказано.
Оставшиеся «хвостики», которые могли присоединить к себе ненужные белки, мы «заткнули» с помощью аминокислоты глицина. Так получилась «удочка», на которую мы и ловили наши ингибиторы. Свой «улов» смывали в несколько приёмов, и то, что получилось (см. элюат 1 на рис. 4), нанесли на белковый электрофорез , чтобы выделить белки нужной длины.
Электрофорез белков (напомним, что он отличается от электрофореза ДНК, главным образом, вертикальным расположением камеры и составом геля, но главный принцип — движение заряженных молекул под действием электрического поля сквозь пористый гель со скоростью, обратно пропорциональной размеру молекул — остаётся тем же) был проведён в полиакриламидном геле.

Рисунок 4. Гельэлектрофорез. МВ — маркер молекулярного веса белков (в килодальтонах).
После (с помощью измерения поглощения фиолетового света на спектрофотометре) сравнивалась активность трипсина в присутствии ингибитора и без него: фермент взаимодействовал с меченым субстратом, отщепляя краситель, в результате чего смесь желтела, а ингибитор этому мешал. Спектрофотометр фиксировал изменения цвета. На основании полученных данных мы оценили константу ингибирования (Ki = 15—60±10 нМ). Вот как комментирует этот результат Владимир Колядко, сотрудник Лаборатории системной биологии и биофизики на ШМТБ: «При такой концентрации половина всех молекул трипсина подавлена. Много это или мало? Это означает, что для защиты от трипсина достаточно всего лишь порядка 10−8 моль/литр ингибитора — такой же эффективностью обладают многие „лекарственные“ ингибиторы».
Установлено, что активность трипсина подавляется ингибитором на 95% (у нас было два типа трипсина: коммерческий и выделенный на Школе из личинок мясной мухи). Дальнейшее изучение найденных белков покажет возможность их практического применения.
Благодарности
Выражаю благодарности сотрудникам Лаборатории системной биологии и биофизики на ШМТБ: Колядко В.Н.; Корнеевой В.А.; Нечипуренко Д.Ю.; Овсепян Р.А.; Подоплеловой Н.А.; школьникам-участникам, дирекции Школы. Без них эта статья не была бы написана, а работа — сделана.
Литература
- НИИ ЧАВО себе!;
- Как работает свертывание крови?;
- Валуева Т.А. и Мосолов В.В. (2002). Роль ингибиторов протеолитических ферментов в защите растений. «Успехи биол. химии». 42, 193–216.