Искусственный интеллект для анализа синапсов: от формы к функции
04 февраля 2026
Искусственный интеллект для анализа синапсов: от формы к функции
- 92
- 0
- 2
Нейрональная клетка с большим количеством шипиков на соме и отростках.
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Дендритные шипики — это выступы плазматической мембраны нейронов на их отростках (дендритах), отвечающие за синаптические связи с другими нейронами (в синапсе они выступают в роли постсинаптической мембраны). Дендритные шипики могут иметь самые разные формы; в течении жизни они появляются, растут, меняются и исчезают. Считается, что морфология (форма) дендритных шипиков тесно связана с тем, как они функционируют. Также выдвигаются гипотезы о связи расположения шипиков на нейроне и их функционировании. Область исследования формы шипиков и их расположения при различных состояниях и заболеваниях поистине безгранична.
Ранее разработанные математические методы и ПО для анализа изображений шипиков с ростом объема данных теряют свою актуальность, так как они лишь упрощают или совершенствуют неточную и долгую ручную обработку таких сложных данных. На сцену выходит искусственный интеллект: нейросетевые методы сегментации дендритов и шипиков, машинная классификация шипиков и дендритов на основе математических метрик, графовые нейронные сети для классификации нейронов. Об этих методиках и перспективах использования их в исследованиях дендритных шипиков расскажем ниже.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в спецноминации «Искусственный интеллект в биологии» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания Центральный университет в лице совместной с институтом AIRI Лаборатории ИИ, анализа данных и моделирования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Прошлое и настоящее — от визуальной оценки до полуавтоматических методов
Тело и отростки нейрона буквально «усыпаны» выростами плазматической мембраны, называемыми дендритными шипиками. Они могут принимать разнообразные формы, однако чаще всего имеют форму отростков, похожих на булаву или гриб (рис. 1), — тогда говорят, что у шипика можно различить головку и шейку. Дендритными шипиками сформирована большая часть возбуждающих синаптических контактов. Синапсы — контакты между нейронами — состоят из двух частей: пре- и постсинаптической, разделенных щелью между клетками. Пресинаптическая часть содержит разнообразную молекулярную машинерию для передачи сигнала — выброса нейромедиаторов в синаптическую щель. Постсинаптическая часть как раз и представленная дендритным шипиком; она содержит машинерию для приема этого сигнала. Объем головки дендритного шипика, толщина его шейки, а возможно, и другие аспекты его формы тесно связаны с выполняемой функцией [1]. В связи с этим изучение формы (морфологии) этих маленьких выростов имеет огромное значение в современной нейробиологии.

Рисунок 1. Нейроны, их шипики и синаптический контакт. 1 — схематичное изображение дендритного шипика. 2 — схематичное изображение синапса.
рисунок автора
Традиционные методы оценки морфологии достаточно понятны с математической точки зрения (рис. 2). Сначала исследователи получают с микроскопа изображения нейрональной культуры или срезов мозга нужной области. Затем с помощью специальных программ, таких как ImageJ, можно по снимку оценить длину и ширину шипика; длины его шейки и головки; плотность шипиков на 1 микрометр дендритного ствола [2], [3]. Помимо этого, на основе серии снимков вдоль вертикальной оси (так называемом Z-стеке) можно реконструировать трехмерную модель дендрита, отделить шипики от ствола и подсчитать для них такие метрики как диаметр головки, объем шипика и площадь его поверхности [4]. Программ, позволяющих реконструировать трехмерные модели шипиков и рассчитывать их метрики, уже достаточно много: есть проприетарные ПО NeuroLucida и Imaris; есть open-source проекты 3dSpAn [5], SpineTool [6], SpyDen [7]; и другие кастомные решения [8–10].
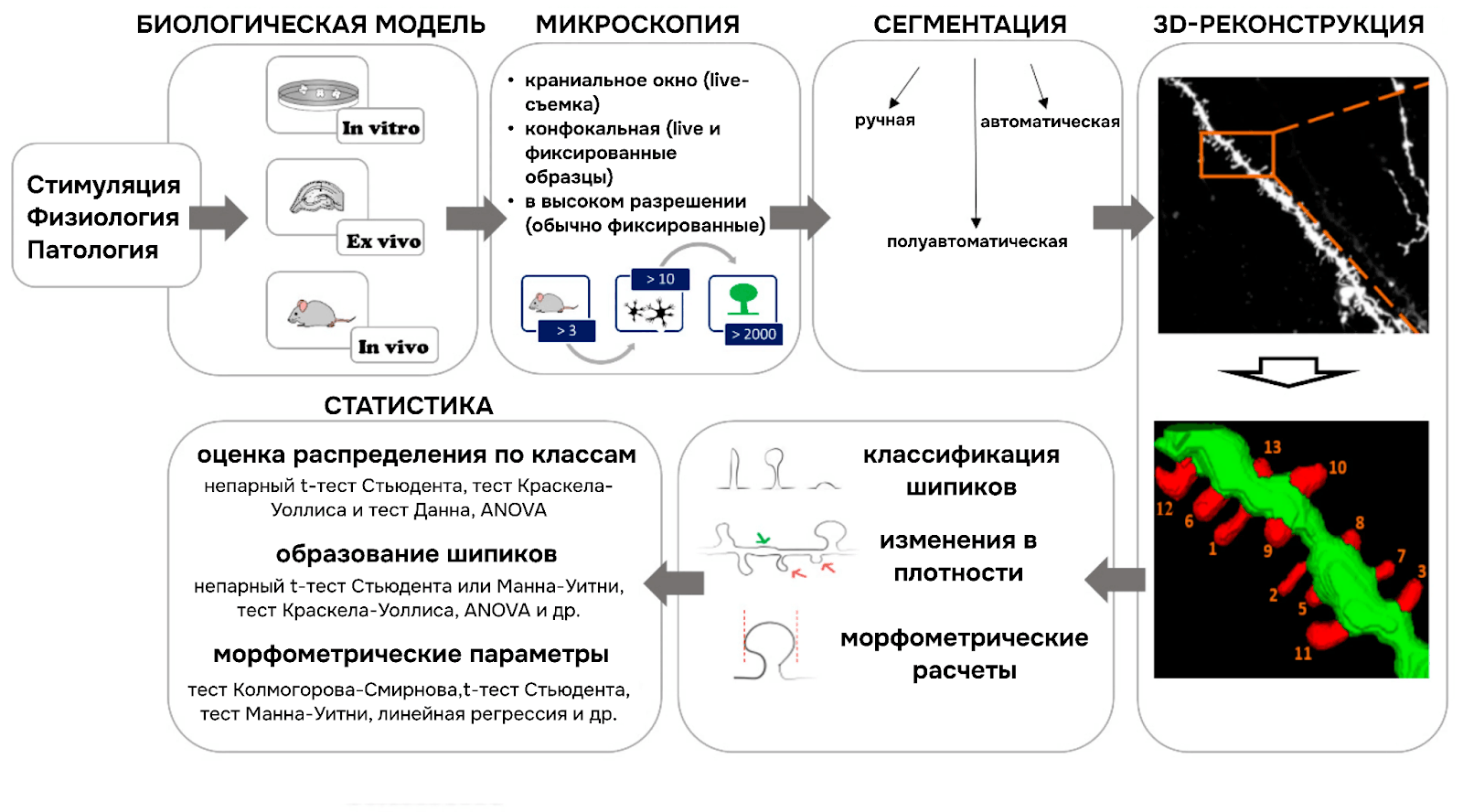
Рисунок 2. Устоявшийся дизайн эксперимента анализа морфологии шипиков при различных состояниях/заболеваниях.
адаптировано из [11]
Часто дендритные шипики классифицируют вручную на основе их формы на четыре типа: грибовидные, тонкие, пеньковидные и филоподии. Иногда также выделяют и другие классы, такие как разветвленные и чашевидные, но они не особо популярны. Грибовидные шипики имеют достаточно большую головку относительно их шейки; считается, что такой тип шипиков наиболее устойчив и отвечает за процессы долговременной памяти. У тонких шипиков отношение размера головы к шейке меньше, чем у грибовидных, они считаются более динамичными и способными к формированию новых синаптических связей, и как следствие, увеличению головки. Пеньковидные шипики не имеют ярко выраженной шейки и встречаются преимущественно на ранних этапах развития организмов, но иногда и у взрослых, что, вероятно, связано с исчезновением грибовидных шипиков. Филоподии — сильно вытянутые структуры без четко выраженной головки — достаточно подвижны и изменчивы, имеют короткий срок жизни, вероятно не образуют синаптические контакты. Филоподии встречаются в основном в развивающихся нейронах, а во взрослых только при определенных условиях [12].
Соотношение распределения шипиков по классам при разных патологиях и стимулах также отмечается учеными. Например, в исследовании функции белков Cascin после двойного нокаута экспрессии генов белков Cascin1 и Cascin2 было замечено уменьшение грибовидных стабильных шипиков и увеличение тонких/филоподий в культуре нейронов [13]; аналогичное наблюдение в изменениях форм шипиков в гиппокампе заметили при остром стрессе у крыс [14].
Таким образом, существует достаточно устоявшийся пайплайн исследования изменения морфологии шипиков в норме и при различных воздействиях/патологических состояниях. Однако часть этапов анализа получаемых изображений трудоемка, либо неточна. А классификация, особенно вручную визуально, и вовсе достаточно субъективна и может влиять на качество и точность анализа.
И тут на помощь приходят искусственный интеллект (ИИ) и машинное обучение (МО, Machine learning/ML) в частности — набор ИИ-методов, позволяющих решить задачу через обучение на подготовленных данных [15]. Входными данными для алгоритма МО могут быть как задачи с готовыми решениями (например, для задачи классификации и нейросетей, которые сегментируют изображения), так и без него (для задачи кластеризации данных и поисков схожих паттернов). На основе вида данных, на которых обучается алгоритм, машинное обучение делят на несколько основных видов: обучение с учителем, обучение без учителя, обучение с частичным привлечением учителя и обучение с подкреплением [16]. Для обработки изображений дендритов, анализа нейронов и шипиков уже применяют нейросетевую сегментацию, нейросетевую и ML-классификацию, кластеризацию (рис. 3)
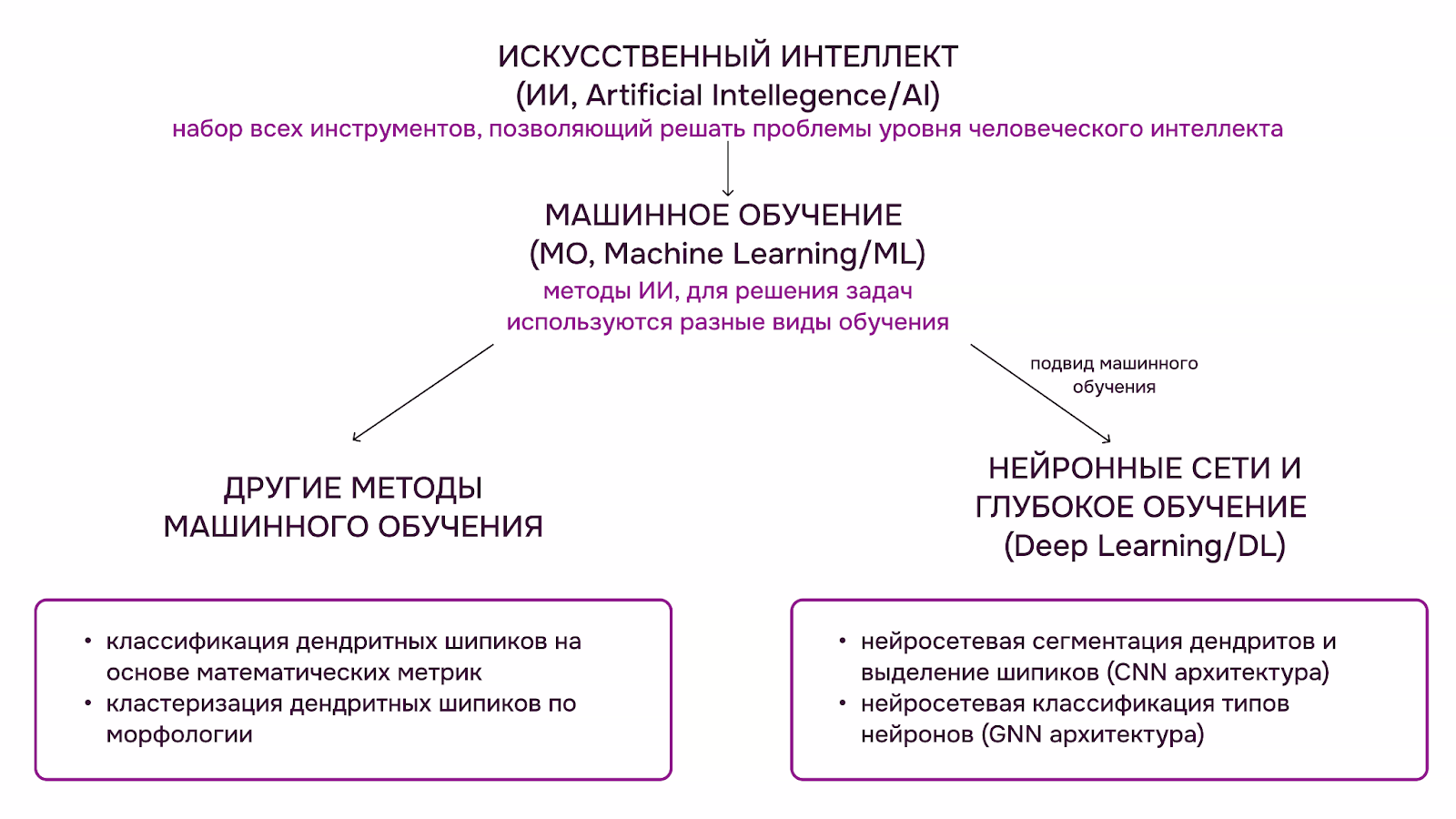
Рисунок 3. Обзор общих понятий машинного обучения и их взаимосвязей, примеры применения к анализу дендритных шипиков и нейронов. Подробнее эта тема разобрана в статье «Как искусственный интеллект спасает интеллект человеческий» [16].
рисунок автора
В погоне за точными и быстрыми данными — ИИ-сегментация изображений
Первым этапом существующих пайпланов анализа морфологии шипиков является получение трехмерных моделей дендритов и отделение и получение моделей шипиков от них на основе Z-стека изображений с микроскопа. Для этого исследователи используют полуавтоматические методы, которые упоминались ранее. Наиболее частый подход включает в себя этапы: предобработка изображения (удаление шумов, деконволюция); бинаризация снимка; скелетизация дендрита; построение полигональной сетки/другого вида трехмерных моделей; отделение шипиков от дендритного ствола; ручная коррекция мест отделений. Предобработка, бинаризация и ручная коррекция требуют подбора параметров и затрат приличного количества времени. Обработка одного снимка с несколькими дендритами может занять до нескольких часов! А привлечение нескольких сотрудников к такой задаче может даже усугубить положение — все видят нейроны и шипики по-своему.
В этой задаче на помощь приходят нейросети глубокого обучения — подробнее об их применении к задачам компьютерного зрения разбирается в статье «Глаза прогресса: как глубокое обучение помогает видеть невидимое для человека» [17]. Загрузил Z-стек изображение дендритов в обученную модель — получил готовую разметку, по которой легко построить трехмерную модель, и даже набор различных скалярных метрик для шипиков и дендрита в целом. Существующие решения для сегментации шипиков опираются на нейросеть с U-net архитектурой — представителем сверточных нейросетей (или CNN — Convolutional Neural Network) (рис. 4).

Рисунок 4. Типичная архитектура U-net.
адаптировано из Zefs Guides
Архитектура U-Net, напоминающая своей формой букву U, является симметричной и работает по принципу анализа и последующего восстановления изображения.
Вначале происходит «кодирование» данных — путь сжатия, на котором изображение рассматривается шаг за шагом. Эту часть еще называют энкодером. Используя небольшие фильтры (каналы), энкодер выявляет в изображении все более сложные и абстрактные особенности — от простых линий до целых объектов. Сеть периодически сжимает промежуточные данные (максимальное объединение, оно же оконное сжатие с взятием максимального элемента), сохраняя лишь самую существенную информацию. На каждом уровне пространственный размер изображения уменьшается, а количество каналов признаков увеличивается, позволяя модели улавливать закономерности более высокого уровня. По мере уменьшения изображения общая картина становится яснее, но мелкие подробности временно отходят на второй план.
В самой узкой, центральной точке сети («бутылочное горлышко») содержится максимально сжатое, но смысловое ядро изображения. Далее идет декодер. Его задача — заново «собрать» картинку в полном размере, но уже в виде карты сегментации, где каждому участку присвоена метка. Для этого декодер последовательно увеличивает разрешение данных. В процессе кодирования могли потеряться детальные признаки, поэтому также есть пропускные соединения — они напрямую передают детализированную информацию в декодер с соответствующих уровней энкодера.
В результате на выходе сети U-net получается изображение, совпадающее по размеру с исходным, где каждый пиксель однозначно классифицирован, например, как часть объекта или фона.
На основе этой архитектуры для сегментации изображения дендритов существует два решения: RESPAN [18] и DeepD3 [19]. В RESPAN для сегментации применена обновленная версия U-net — nn-UNet (no-new-UNet), особенность которой в том, что при обучении часть параметров (например, размер канала или количество слоев свертки) подбирается автоматически в зависимости от самих данных. В DeepD3 особенность архитектуры заключается в целых двух декодерах: один используется для выделения дендритного ствола на изображении, а другой — для выделения шипиков (рис. 5). Еще одно важное замечание — через сеть в DeepD3 каждый слой Z-стека снимка проходит поочередно, то есть на входе стек разделяется и подается двухмерная картинка (2D U-net), а в RESPAN также возможна обработка разом всего стека (2D/3D U-net).
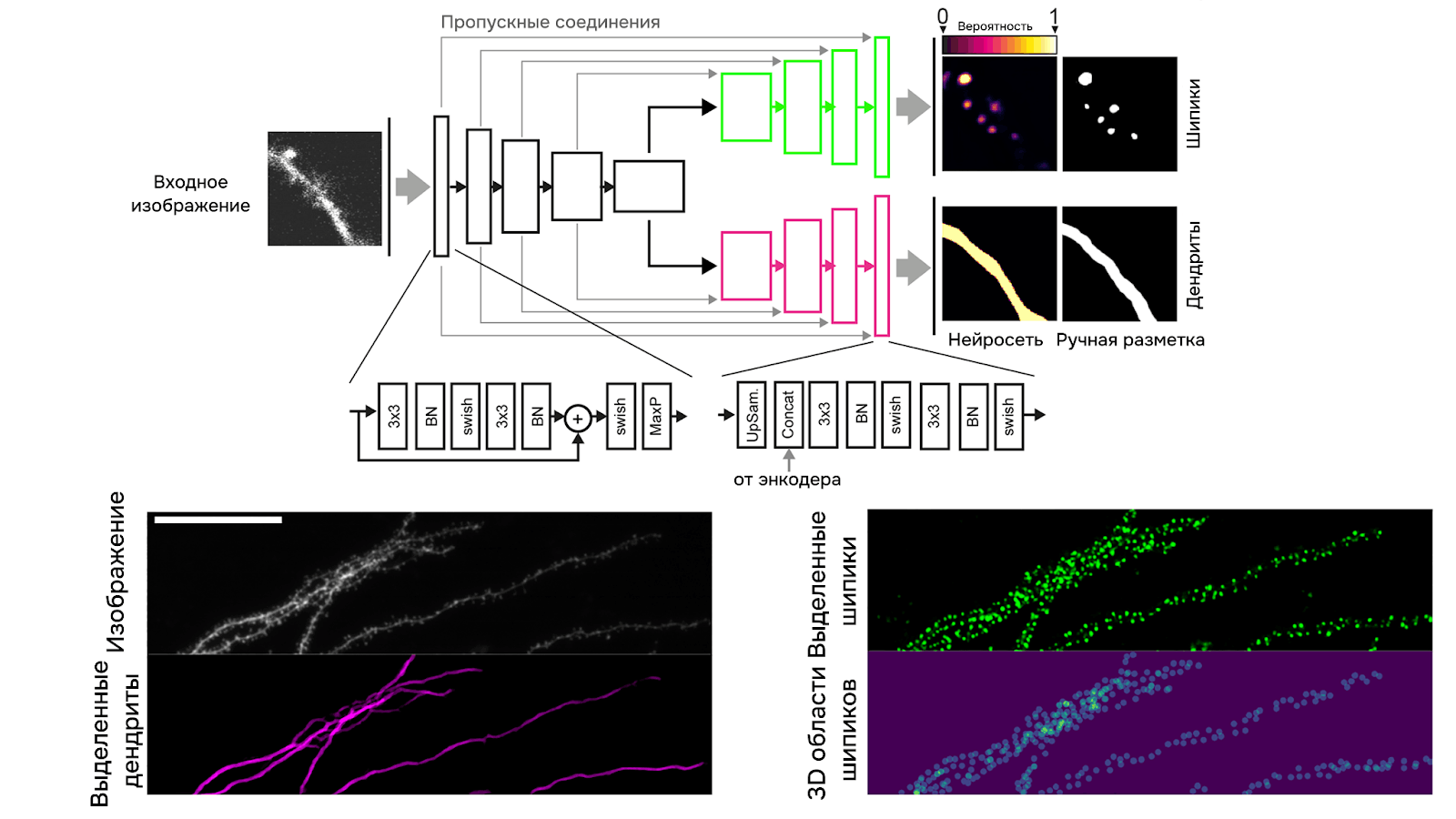
Рисунок 5. Архитектура нейросети DeepD3 и выходные данные на примере изображения дендритов. 3⨉3 — свертка 3 на 3. BN (batch norm) — нормализация батча (куска снимка). Swish — слой активации. MaxP (Max Pooling) — оконное сжатие с взятием максимального элемента. UpSam (upsampling) — увеличение размера снимка. Concat (Concatenation) — объединение пропускного и входящего слоев.
адаптировано из [19]
На выходе обе нейросети предоставляют разметку шипиков и дендрита в бинаризованных изображениях. Уже по ним можно построить трехмерную полигональную сетку (mesh) дендрита и каждого шипика отдельно, и с помощью специальных библиотек (часто используют CGAL — Computational Geometry Analysis Library) посчитать различные метрики (например, площадь поверхности шипика или его объем).
Понять форму — понять функцию
На основе рассчитываемых метрик, вместо монотонной и излишне субъективной ручной классификации, можно провести машинную разметку семейством методов опорных векторов (или SVM — Support Vector Machine), которые являются представителями алгоритмов машинного обучения с учителем.
Метод опорных векторов основан на возможности построить гиперплоскость в многомерном пространстве, при этом по каждую сторону от гиперплоскости будут находиться разные классы. По обе стороны от гиперплоскости, на одинаковом расстоянии строятся дополнительные параллельные плоскости, расстояние между которыми называют зазором. В зазоре не должно находиться ни одного вектора пространства, а задача самого алгоритма — построить гиперплоскости так, чтобы зазор был максимальным, то есть объекты, которые мы классифицируем, максимально различались между собой. Не всегда пространство можно поделить линейно, и потому также используются нелинейные функции построения «границы раздела» (рис. 6а).
Представим каждый шипик как точку в пространстве рассчитанных метрик, например, по оси x значение объема шипика, по y — его средней длины, а по z — площадь шипика. Набор (x, y, z) — вектор шипика в пространстве, при этом для части шипиков из набора данных у нас есть информация о его классе (грибовидный, пеньковидный или тонкий), данная пользователем. SVM-алгоритм построит гиперплоскости так, чтобы вектора шипиков разных классов находились по разные стороны друг от друга, а остальным неразмеченным шипикам присвоит класс в соответствии с разделением пространства.
Пример такой машинной классификации шипиков на основе их метрик представлен в работе [6]. Датасет из 275 полигональных сеток дендритных шипиков был визуально классифицирован на грибовидные, тонкие, пеньковидные, филоподии и выбросы восемью экспертами. На основе консенсуса была получена окончательная метка класса для каждого шипика, выбросы и филоподии удалили (их было мало). Для шипиков были рассчитаны 11 скалярных метрик, а также гистограмма распределения длин хорд внутри каждого шипика. Получились 11-мерные, 100-мерные (для хорд) и 111-мерные (объеденные скаляры и хорды) вектора для каждого шипика. Далее определенный процент от размеченных данных (он же коэффициент обучения на рис. 6б) подавался на вход SVM-алгоритму, остальные шипики были без метки класса. Точность, сопоставимая с уровнем консенсуса между восемью людьми, была достигнута в случае, если ровно половина шипиков была с метками класса. Как минимум, это значит, что для качественной классификации достаточно вручную разметить всего лишь половину от набора данных, что уже значительно может ускорить исследовательский процесс и частично избавить от проблемы субъективности.
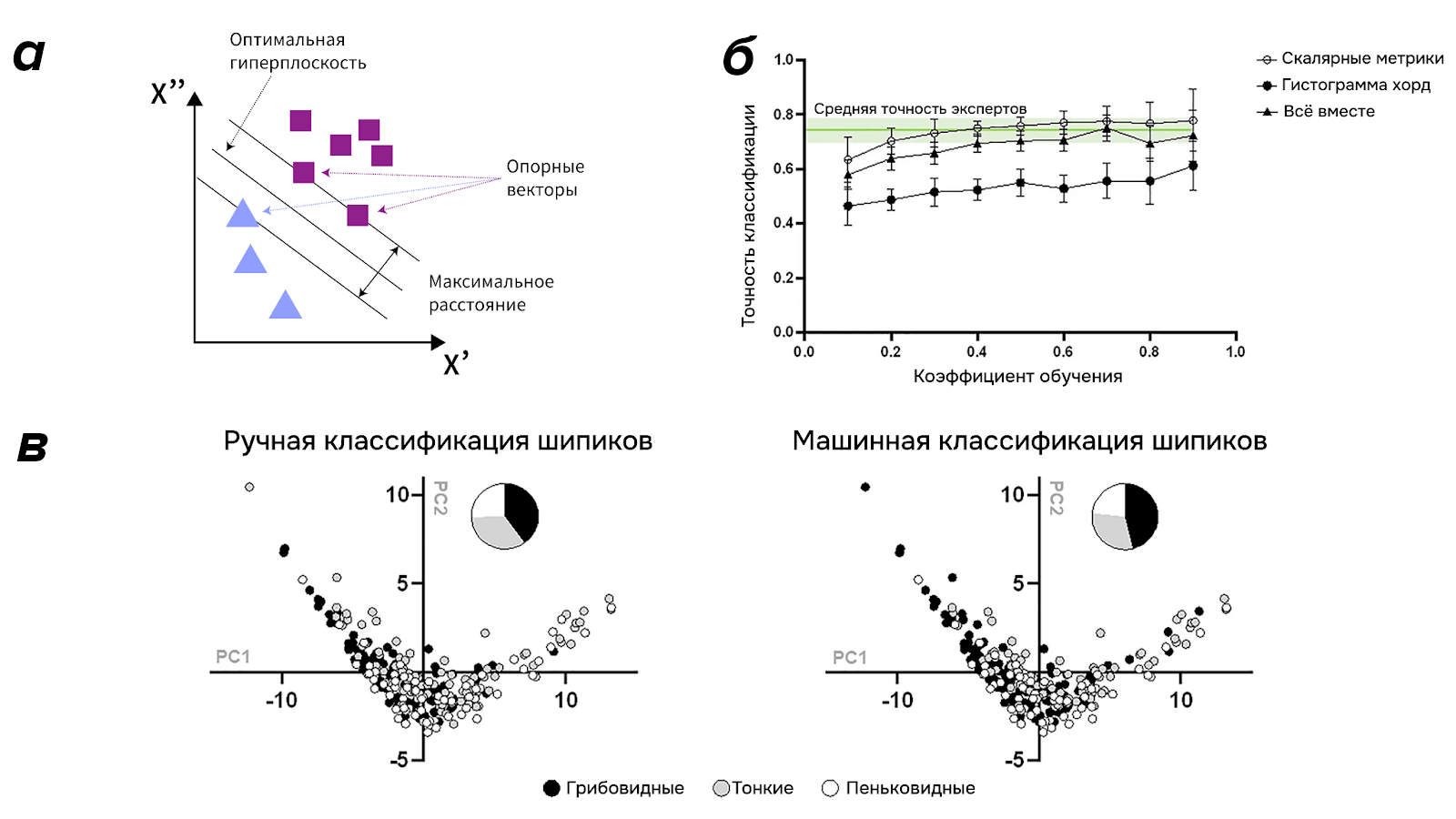
Рисунок 6. Метод опорных векторов. а. общая иллюстрация метода. б. Точность классификации шипиков на основе нескольких метрик в зависимости от количества данных, на котором обучался алгоритм. в. Визуальное сравнение ручной и машинной классификаций на основе классических метрик в двухмерном пространстве.
Шипики — динамические структуры, способные меняться с течением времени. Существуют исследования, на основании которых вариации форм шипиков можно представить не в виде отдельных классов, а как морфологический континуум [20]. И для анализа в таком случае более подходящей методикой является кластеризация шипиков на основе рассчитанных метрик, а не классификация, которая так или иначе зависит от взгляда исследователя.
Кластеризация — семейство алгоритмов машинного обучения без учителя. Кластеризацией решается задача объединения объектов в группы (т. е. в кластеры) на основе их схожести друг с другом, при этом так, чтобы сами кластеры друг от друга максимально различались. Часто используются следующие алгоритмы (рис. 7):
-
Метод k-средних (k-means) — наиболее популярный метод, который делит данные на k заранее заданных сферических кластеров, минимизируя расстояния между точками внутри кластера; он быстрый и легко работает с большим набором данных, но для него нужно самому выбирать число кластеров (для этого есть отдельные метрики!); он чувствителен к выбросам и несферическим формам кластеров (в поисках «сферичности» и сглаживанию выбросов можно экспериментировать с методами понижениями размерности, если у вас многомерное пространство);
-
Иерархическая кластеризация — в основе метода лежит построение древовидной структуры (дендрограммы) слияний и разделений кластеров. в случае агломеративной кластеризации — на первом этапе каждая точка считается отдельным кластером, после чего близкие друг к другу кластеры постепенно сливаются, пока не образуется один большой кластер. Каждый этап представлен в дендрограмме, это позволяет визуально изучать вложенность кластеров и не требует задавать их число заранее, однако иерархическая кластеризация вычислительно затратна для больших данных и чувствительна к шуму;
-
DBSCAN (Density-based spatial clustering of applications with noise) — алгоритм кластеризации точек на основе плотности. DBSCAN устойчив к шуму (не учитывает выбросы в кластерах), сам определяет число кластеров и хорошо работает с кластерами сложной формы, но сложен в подборе параметров (плотность кластера и минимальное количество точек в кластере) и плохо справляется с кластерами разной плотности.
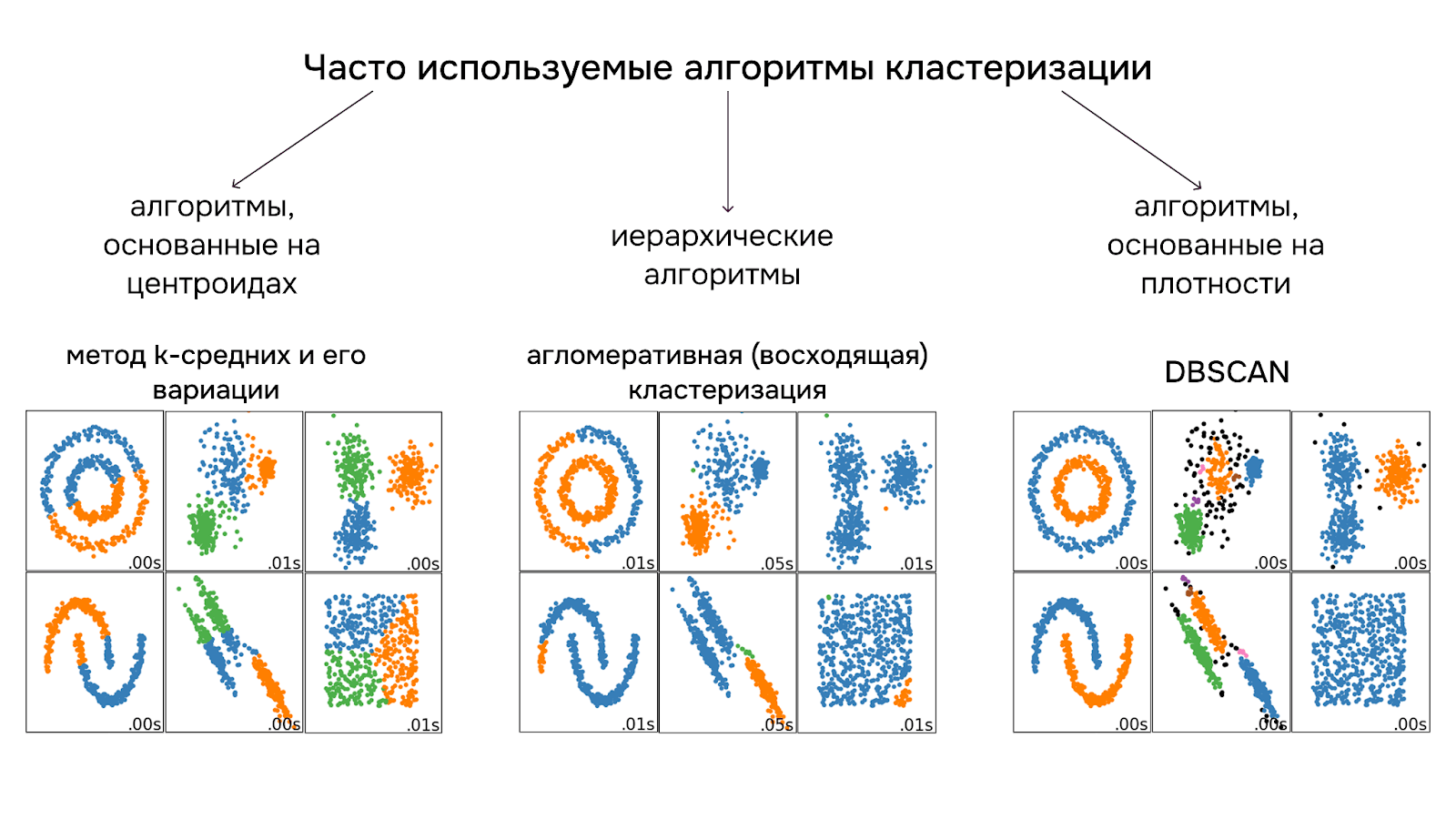
Рисунок 7. Вариации алгоритмов кластеризации с примерами разделения точек на кластеры в двухмерных пространствах.
адаптировано из документации Scikit learn.
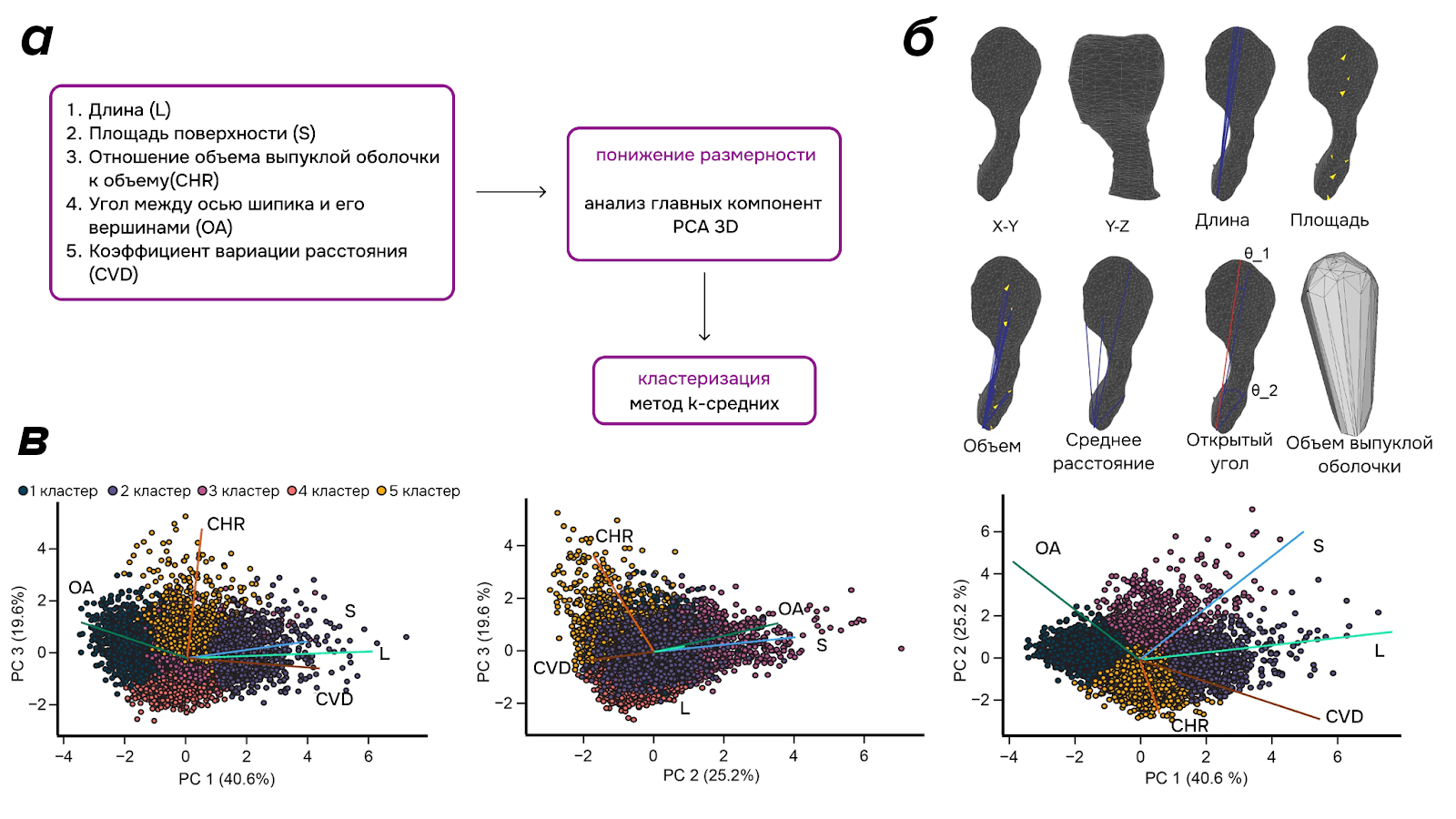
С помощью кластеризации в работе [21] нейробиологи оценили нейропластичность через изменение формы шипиков гранулярных клеток (тип вставочных нейронов в обонятельных луковицах) у взрослых мышей. Часть мышей была подвержена односторонней обонятельной депривации, вторая часть была обучена различать простые запахи, третью часть обучили различать сложные запахи. Используя конфокальную микроскопию, исследователи получили изображения дендритов гранулярных клеток, затем обработали снимки для лучшего качества и восстановили трехмерные полигональные сетки дендритных шипиков.
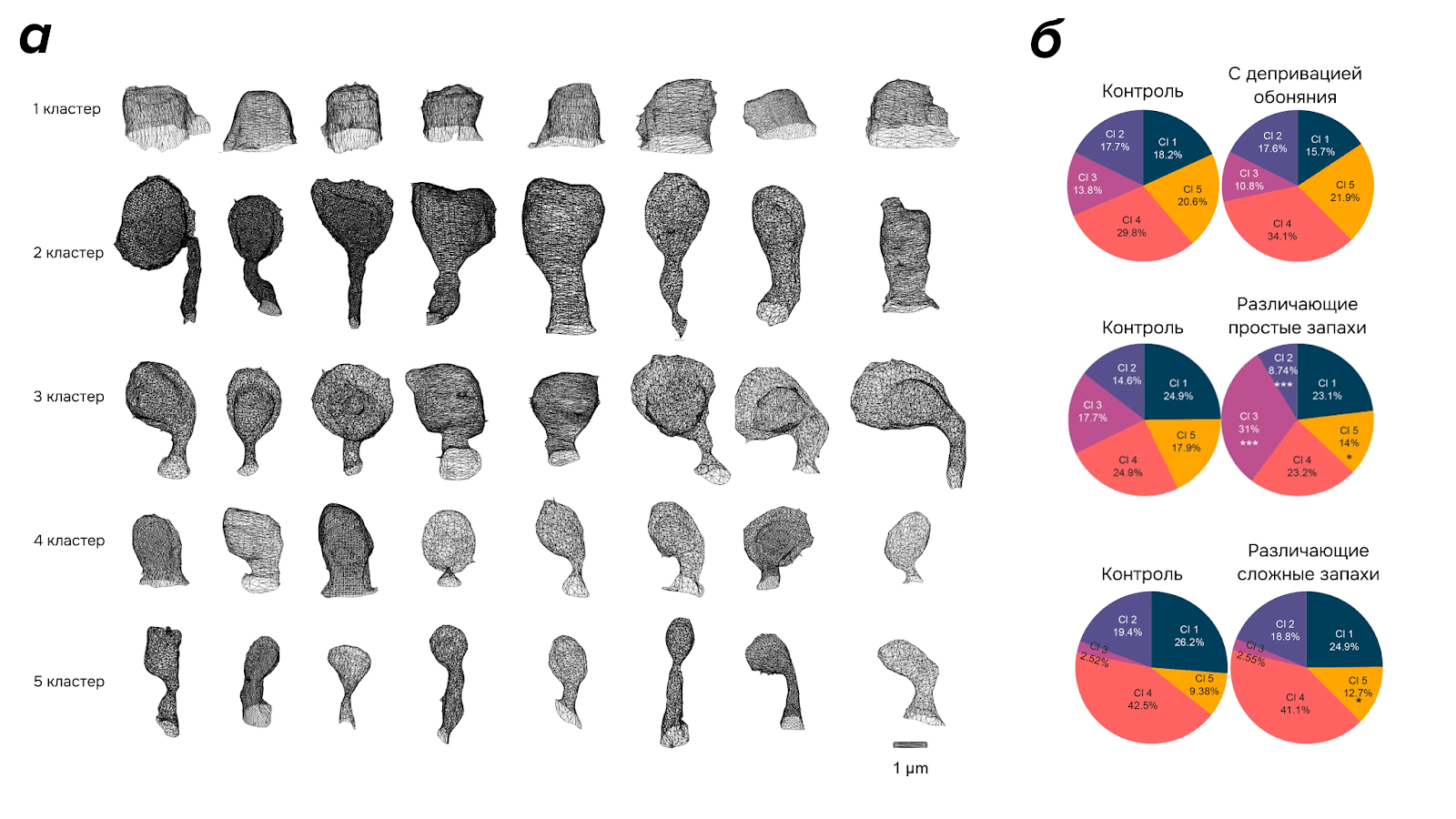
Для каждого шипика были подсчитаны пять метрик: длина, площадь поверхности, отношение объема выпуклой оболочки к объему шипика, средний угол между осью шипика и его вершинами и коэффициент вариации расстояния. Итого все шипики можно представить в 5-мерном пространстве. Затем методом анализа главных компонент (PCA — Principal Component Analysis) 5-мерное пространство было понижено до трех, после чего проведена кластеризация алгоритмом k-средних (рис. 8а,б). Число кластеров было определено методом «Силуэт» и оказалось равным пяти (рис. 8в и 9а в крутилке). Далее распределение шипиков каждой экспериментальной группы по кластерам было сравнено с распределением шипиков групп контроля (рис. 9б) Также для экспериментальных групп по снимкам была подсчитана плотность шипиков, как количество шипиков на 1 мкм дендрита.
Оценка распределений шипиков показала:
-
При обонятельной депривации не произошло морфологических изменений в шипиках, но плотность шипиков стала ниже;
-
При обучении простой задаче плотность шипиков не изменилась, однако снизилось количество шипиков в кластерах 2 и 5 (достаточно тонких дендритных шипиков), но при этом увеличилось количество шипиков в кластере 3 (с достаточно большой площадью головки);
-
При обучении различению сложных запахов увеличилась общая плотность шипиков, при этом увеличилось процентное соотношение шипиков в кластере 5 (похожие по форме на тонкие).
Авторы выдвинули предположение, что глобальное снижение активности из-за депривации не требует формирования новых ансамблей нейронов и, соответственно, дополнительной структурной перестройки шипиков. При этом сложная задача обучения, требующая синхронизации новых ансамблей нейронов, приводит к формированию новых шипиков (в основном, относящихся к кластеру 5 — длинные тонкие шипики). А вот обучение простой задаче достигается за счет увеличения уже существующих шипиков, которые меняли свою морфологию в сторону кластера шипиков с большей площадью поверхности, что может указывать на увеличение синаптической эффективности.
Принципиальное преимущество кластерного анализа перед простым сравнением метрик шипиков контроля и экспериментальной групп в возможности не просто сравнить распределение метрики, а оценить набор метрик каждого шипика с метриками остальных шипиков за счет представления их как точек в многомерном пространстве.
Преимущество перед классификационным подходом, как было сказано ранее — в минимизации субъективности оценки формы шипиков. Кластеризация позволяет пронаблюдать переходные формы шипиков, которые несколько исследователей могут отнести к разным классам. А возможность точнее зафиксировать изменение формы дендритных шипиков может позволить лучше понять влияние различных воздействий / патологий / терапевтических агентов на их функцию в том числе.
Место тоже имеет значение
Эксперименты in vivo [22] показали, что шипики не появляются и не исчезают случайно вдоль дендрита. Они образуют «горячие точки» оборота — участки, где шипики чаще всего рождаются и исчезают, формируя при этом определенные кластеры (в кластер выделяли два и более шипиков на расстоянии 5 мкм). Появление таких кластеров напрямую связано с обучением и памятью: после обучения новые шипики добавляются группами в определенных зонах дендритного ствола. Результаты были получены путем подсчета шипиков и расстояний между ними на выделенных сегментах на снимках (т.е. это двухмерный анализ), а также были подтверждены с помощью компьютерного биофизического моделирования.
Еще одним способом анализа взаимного расположения шипиков на дендрите являются пространственные статистики в комбинации с кластерным анализом шипиков в пространстве. Для проведения такого анализа необходимо проведение предобработки данных, а именно перевод исходных трехмерных координат шипиков в цилиндрические, рассчитанные относительно оси дендрита.
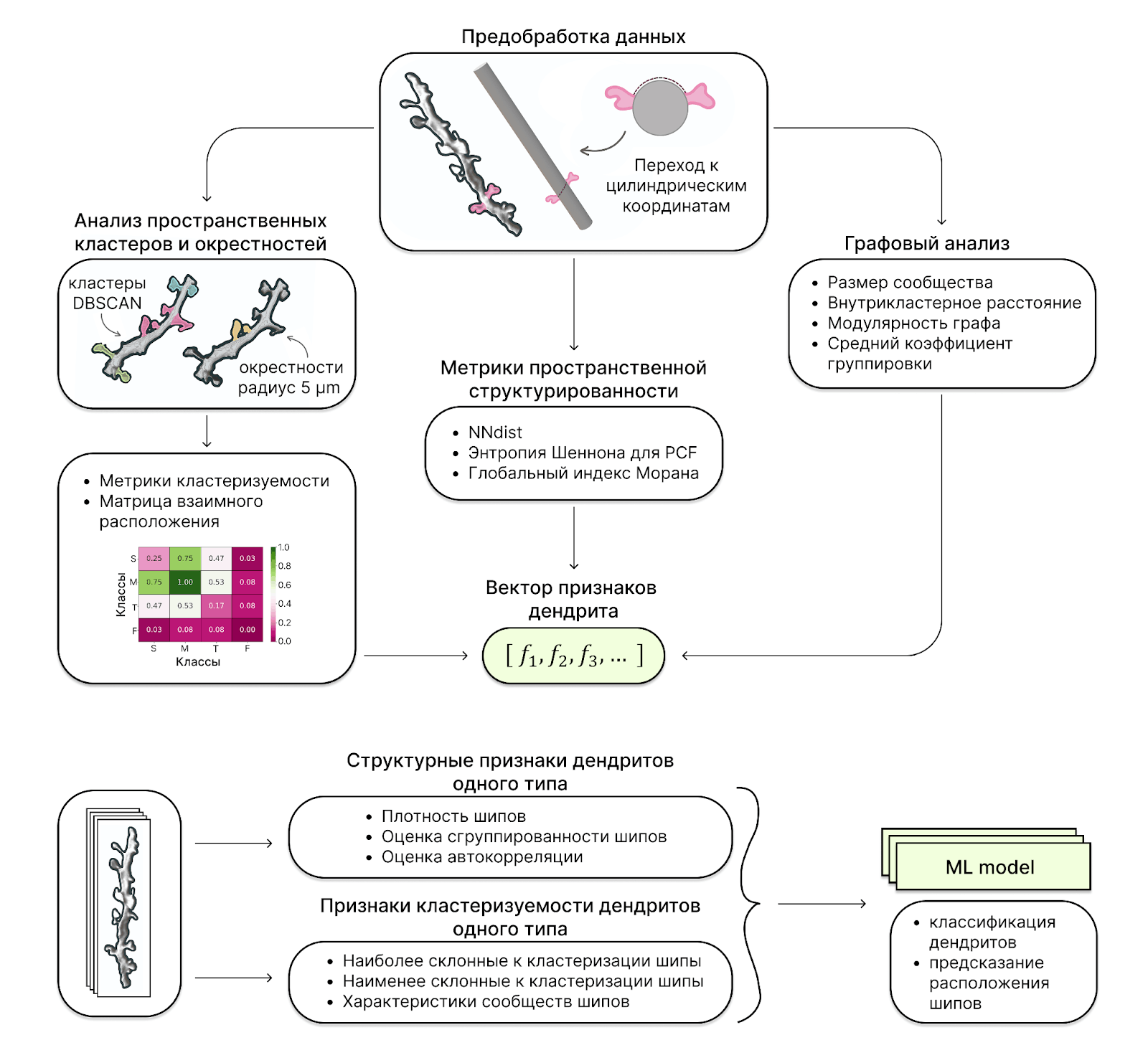
Рисунок 10. Пайплайн получения вектора морфологических признаков дендрита. NNdist (nearest neighbor distance) — среднее расстояние до ближайшего соседа; PCF (pair correlation function) — функция, показывающая, на каких расстояниях от шипика другие шипики появляются чаще (или реже), чем при случайном расположении; глобальный индекс Морана — показатель автокорреляции (схожесть значений метрик у соседних в пространстве объектов).
адаптировано из [23]
В работе [23] для характеристики структурной организации дендрита была применена кластеризация с использованием метода DBSCAN для выделения шипиков в кластеры на основе их близости на полигональной сетки дендрита, где набором признаков являются непосредственно координаты шипиков в трехмерном пространстве. Особенность данного метода кластеризации заключается в том, что он способен выделять не только пространственные кластеры, но и шум, то есть точки, не принадлежащие ни одному из сообществ близких точек. В случае анализа взаимного расположения шипиков этот момент особенно важен, так как не все шипики образуют пространственные кластеры (рис. 10).
После выделения кластеров для всех шипиков в каждом кластере был проведен анализ их морфологических метрик и принадлежности к конкретному классу, на основании чего были построены таблицы, показывающие вероятность, с которой два шипика определенных классов склонны располагаться в одном кластере. В результате данного анализа было выявлено, что действительно существует корреляция между морфологическими характеристиками шипов и их взаимным расположением, причем данная корреляция различается в клеточной культуре «здоровых» дендритов и дендритов, подвергнутым низкой амилоидной токсичности (клеточное моделирование болезни Альцгеймера) (рис. 11).
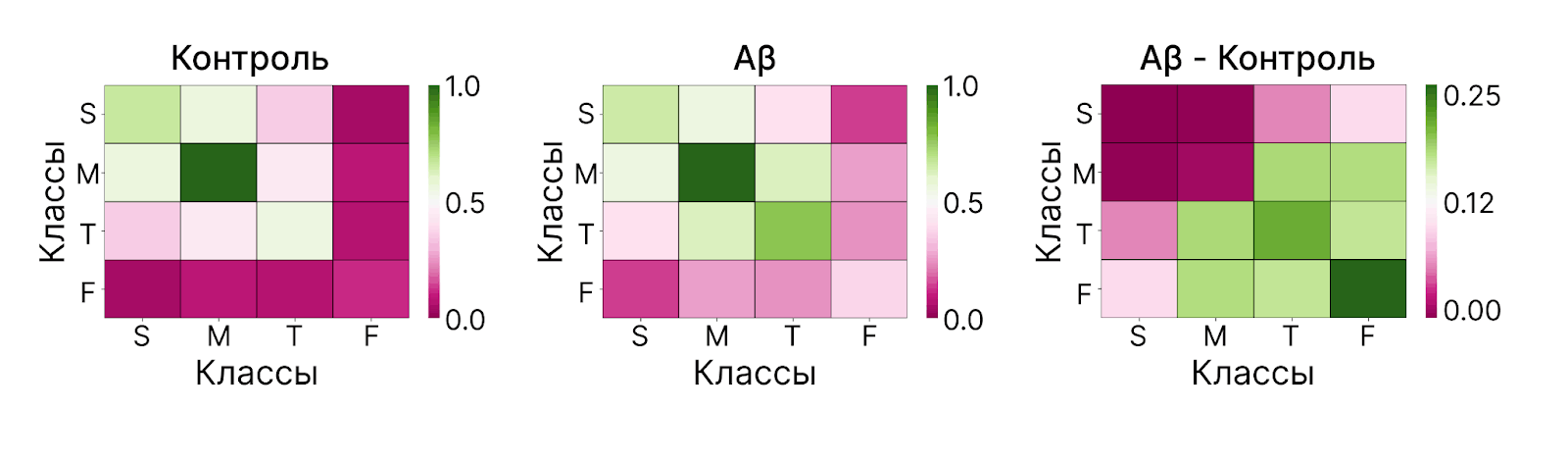
Рисунок 11. Таблицы, демонстрирующие вероятность, с которой шипики определенных классов склонны располагаться в одном пространственном кластере. S (stubby) — пеньковидные шипики, M (mushroom) — грибовидные, T (thin) — тонкие, F (filopodia) — филоподии. Aβ — группа нейронов, подверженная воздействию олигомера бета-амилоида (клеточное моделирование болезни Альцгеймера).
адаптировано из [23]
Таким образом, благодаря описанным выше характеристикам и методам анализа, дендрит и шипики на нем с легкостью превращаются в набор чисел — вектор признаков дендрита, с которыми смогут работать методы машинного обучения. Векторы признаков можно использовать как для сравнения изменения положения шипиков при разных состояниях, так и для обучения классификаторов (например, тот же метод опорных векторов) и предсказания локализации шипиков.
Еще одним способом оценить положение шипиков в дендрите является графовый анализ. С помощью него при болезни Альцгеймера были отмечены закономерности в потере шипиков: они вымирают не по одному, а целыми группами [24]. Для анализа взаимного расположения шипиков графовым методом дендрит представляется в виде графа, вершинами которого являются сами шипики, а веса ребер — функция их близости (например, обратное расстояние между ними) (рис. 12). Полученный граф разбивается на сообщества с помощью алгоритма Лувена, после чего вычисляются такие характеристики как модулярность графа, коэффициент кластеризации, средний размер кластеров и внутрикластерные расстояния.
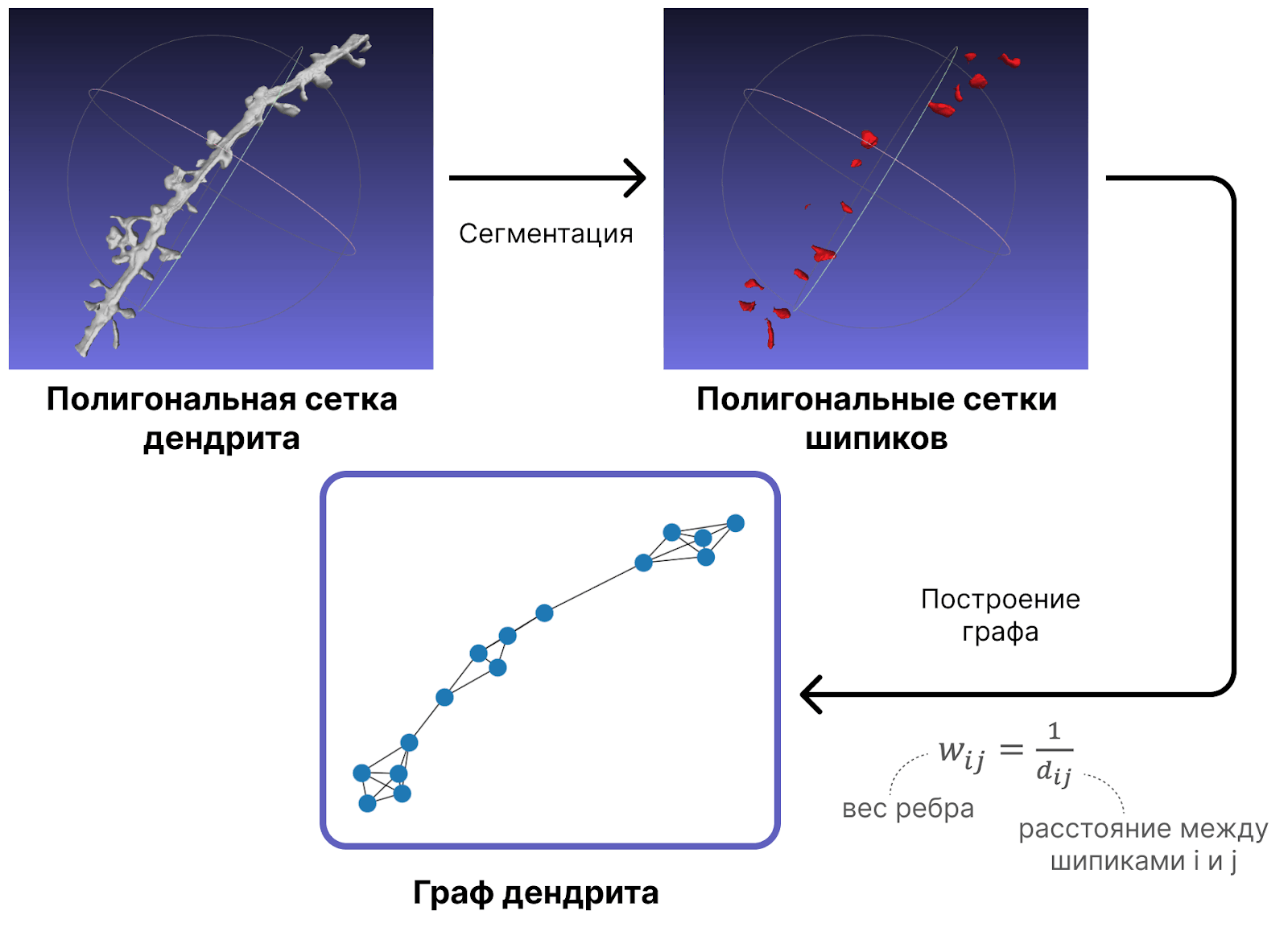
Рисунок 12. Построение графа дендрита по его полигональной сетке.
рисунок автора
Мир больших данных в нейробиологии не останавливается на сотнях и даже тысячах дендритов. Современная электронная микроскопия позволяет сканировать кубические миллиметры ткани мозга с нанометровым разрешением — это миллиарды синапсов и еще взаимосвязи между ними. Яркий пример — проект MICrONS, содержащий трехмерную реконструкцию нейронных цепей визуальной коры мыши с соответствующими данными функциональной активности этих же самых нейронов. Цель проекта — выявить вычислительные принципы, лежащие в основе работы коры головного мозга, чтобы способствовать развитию следующего поколения алгоритмов машинного обучения. И один недавно опубликованный программный пакет NEURD (от Neural Decomposition) [25], связанный с проектом MICrONS, как раз использует графы!
Что именно предложили авторы? Python-пакет, который берет 3D-модели (полигональные сетки) нейронов из электронно-микроскопических реконструкций. Разбивает их на компактные, богато аннотированные графовые представления (рис. 13). И уже на основе этих графов решает целый набор задач:
-
proofreading сегментации — поиск и исправление ошибок «слияния»/«разделения» нейронов;
-
классификация клеток;
-
детекция шипиков;
-
анализ расстояний между аксонами и дендритами.

Рисунок 13. Работа NEURD.
адаптировано из [20]
NEURD опирается на сочетание геометрических признаков, извлеченных из сетки, графовых признаков, а также моделей машинного обучения, включая методы на основе сверточных нейросетей, для ряда подзадач. А именно для классификации клеток на основе описанного выше графа используется Graph Convolutional Network (GCN) (рис 14).
Главная идея такой нейронной сети — обмен сообщениями на графе (рис. 14). Представим, что у нас уже есть какой-то начальный набор признаков для каждой вершины графа. GCN устроена так, что на каждом слое она сначала агрегирует информацию, полученную от соседней вершины, после чего объединяет агрегированный вектор соседей с вектором признаком данной вершины, далее все это пропускается через обучаемое преобразование. На этом шаге и находится «умный» набор весов, который сеть учится подбирать во время обучения. Результатом данного конвейера является новый вектор признаков вершины, который учитывает локальный контекст: не только ее собственную геометрию, но и информацию о ее соседях. Один такой слой GCN дает вершине информацию о ближайших соседях. Два слоя — уже о соседях соседей. После нескольких слоев у нас появляется некое контекстное представление вершины в структуре графа.
.png)
Рисунок 14. Архитектура Graph Convolutional Network (GCN).
Таким образом, NEURD работает как некий полуавтоматический «конвейер», который не только достраивает и исправляет карту связей в мозге, автоматически размечает места синапсов и дендритных шипиков, а также классифицирует клетки, опираясь на их морфологические характеристики. Это значительно облегчает работу исследователей и позволяет им сосредоточить усилия на более сложных задачах, связанных, например, с интерпретацией полученных результатов.
Перспективы
Современные методы на базе ИИ меняют научные подходы во многих научных областях, и нейробиология здесь не является исключением. ИИ помогает изучать морфологические изменения в нейронах и дендритных шипиках: субъективность в отношении изображений и моделей минимизируется ML-классификацией и графовыми моделями, чувствительность к изменениям в морфологии шипиков повышается кластерными методами анализа, а обработка большого массива данных становится доступна благодаря сегментационным нейросетям.
Кстати о данных: их количество с появлением мощных технологий и налаживанием новых методик растет во всех научных сферах. Вместе с этим, все чаще к своим исследованиям / разработанным алгоритмам обработки журналы требуют прикладывать используемые наборы данных, требования к data availability statement в публикациях растут. Уже существуют отдельные экосистемы хранения данных, например Zenodo или Dryad, имеющий непосредственную биомедицинскую направленность.
Получается своего рода колесо Сансары: технологии и алгоритмы увеличивают потребность в данных, особенно богато аннотированных, а массивные данные требуют качественных рабочих алгоритмов обработки (стоит только вспомнить ранее упомянутый датасет MICrONS).
К чему все идет? Сравнение морфологических особенностей тех или иных экспериментальных групп дендритов / шипиков приближают к пониманию функционирования данных структур, построению взаимосвязей «состояние — форма». Такие же взаимосвязи полезны для анализа воздействия потенциальных терапевтических веществ: зная точно, как именно изменяется морфология шипиков / их пространственное положение при заболеваниях, проще оценить, как влияет на них исследуемое вещество. А с применением, например, нейросетевых классификаторов в купе со слоями внимания, можно понять, на какие особенности в структуре данных нейросеть «обращает внимание», что также немаловажно для исследователей (такого в контексте шипиков мы еще не видели, но уверены, все впереди!).
В конечном счете, искусственный интеллект не заменит интеллект естественный, но он уже становится хорошим помощником в решении нейробиологических задач.
Литература
- Heck N. & Benavides-Piccione R. Dendritic Spines: From Shape to Function. Lausanne: Frontiers Media SA, 2016.;
- Sam A. Booker, Aleksander P. F. Domanski, Owen R. Dando, Adam D. Jackson, John T. R. Isaac, et. al.. (2019). Altered dendritic spine function and integration in a mouse model of fragile X syndrome. Nat Commun. 10;
- Piotr Michaluk, Marcin Wawrzyniak, Przemyslaw Alot, Marcin Szczot, Paulina Wyrembek, et. al.. (2011). Influence of matrix metalloproteinase MMP-9 on dendritic spine morphology. Journal of Cell Science. 124, 3369-3380;
- Benjamin D. Boros, Kelsey M. Greathouse, Marla Gearing, Jeremy H. Herskowitz. (2019). Dendritic spine remodeling accompanies Alzheimer's disease pathology and genetic susceptibility in cognitively normal aging. Neurobiology of Aging. 73, 92-103;
- Nirmal Das, Ewa Baczynska, Monika Bijata, Blazej Ruszczycki, Andre Zeug, et. al.. (2022). 3dSpAn: An interactive software for 3D segmentation and analysis of dendritic spines. Neuroinform. 20, 679-698;
- Ekaterina Pchitskaya, Peter Vasiliev, Daria Smirnova, Vyacheslav Chukanov, Ilya Bezprozvanny. (2023). SpineTool is an open-source software for analysis of morphology of dendritic spines. Sci Rep. 13;
- Maximilian F Eggl, Surbhit Wagle, Jean P Filling, Thomas E Chater, Yukiko Goda, Tatjana Tchumatchenko. (2025). SpyDen: simplifying molecular and structural analysis across spines and dendrites. Bioinformatics. 41;
- Michael S. Smirnov, Tavita R. Garrett, Ryohei Yasuda. (2018). An open-source tool for analysis and automatic identification of dendritic spines using machine learning. PLoS ONE. 13, e0199589;
- Subhadip Basu, Punam Kumar Saha, Matylda Roszkowska, Marta Magnowska, Ewa Baczynska, et. al.. (2018). Quantitative 3-D morphometric analysis of individual dendritic spines. Sci Rep. 8;
- Boyu Lyu, Jiangxiong Wang, William Christopher Risher, Guoqiang Yu. (2025). VSOT: volume-surface optimization for accurate ultrastructure analysis of dendritic spines. Bioinformatics. 41;
- Ewa Bączyńska, Katarzyna Karolina Pels, Subhadip Basu, Jakub Włodarczyk, Błażej Ruszczycki. (2021). Quantification of Dendritic Spines Remodeling under Physiological Stimuli and in Pathological Conditions. IJMS. 22, 4053;
- 10.3389/fnsyn.2020.00031/full;
- Norbert Bencsik, Szilvia Pusztai, Sándor Borbély, Anna Fekete, Metta Dülk, et. al.. (2019). Dendritic spine morphology and memory formation depend on postsynaptic Caskin proteins. Sci Rep. 9;
- 10.3389/fnmol.2018.00283/full;
- История развития искусственного интеллекта и его пришествия в биологию;
- Как искусственный интеллект спасает интеллект человеческий;
- Глаза прогресса: как глубокое обучение помогает видеть невидимое для человека;
- Sergio Bernal-Garcia, Alexa P. Schlotter, Daniela B. Pereira, Aleksandra J. Recupero, Franck Polleux, Luke A. Hammond. (2025). A deep learning pipeline for accurate and automated restoration, segmentation, and quantification of dendritic spines. Cell Reports Methods. 5, 101179;
- Martin H. P. Fernholz, Drago A. Guggiana Nilo, Tobias Bonhoeffer, Andreas M. Kist. (2024). DeepD3, an open framework for automated quantification of dendritic spines. PLoS Comput Biol. 20, e1011774;
- Netanel Ofer, Ruth Benavides-Piccione, Javier DeFelipe, Rafael Yuste. (2022). Structural Analysis of Human and Mouse Dendritic Spines Reveals a Morphological Continuum and Differences across Ages and Species. eNeuro. 9, ENEURO.0039-22.2022;
- Aymeric Ferreira, Vlad-Stefan Constantinescu, Sarah Malvaut, Armen Saghatelyan, Simon V. Hardy. (2024). Distinct forms of structural plasticity of adult-born interneuron spines in the mouse olfactory bulb induced by different odor learning paradigms. Commun Biol. 7;
- Adam C. Frank, Shan Huang, Miou Zhou, Amos Gdalyahu, George Kastellakis, et. al.. (2018). Hotspots of dendritic spine turnover facilitate clustered spine addition and learning and memory. Nat Commun. 9;
- Ekaterina K. Lips, Daria S. Smirnova, Vyacheslav S. Chukanov, Ekaterina I. Pchitskaya. (2025). Structural Analysis of Spatial Dendritic Spines Distribution Patterns in Norm and Alzheimer’s Disease Pathology. 2025 Systems and Technologies of the Digital HealthCare (STDH). 42-46;
- Mite Mijalkov, Giovanni Volpe, Isabel Fernaud-Espinosa, Javier DeFelipe, Joana B. Pereira, Paula Merino-Serrais. (2021). Dendritic spines are lost in clusters in Alzheimer’s disease. Sci Rep. 11;
- Brendan Celii, Stelios Papadopoulos, Zhuokun Ding, Paul G. Fahey, Eric Wang, et. al.. (2025). NEURD offers automated proofreading and feature extraction for connectomics. Nature. 640, 487-496.