Как искусственный интеллект спасает интеллект человеческий
01 апреля 2025
Как искусственный интеллект спасает интеллект человеческий
- 318
- 2
- 3
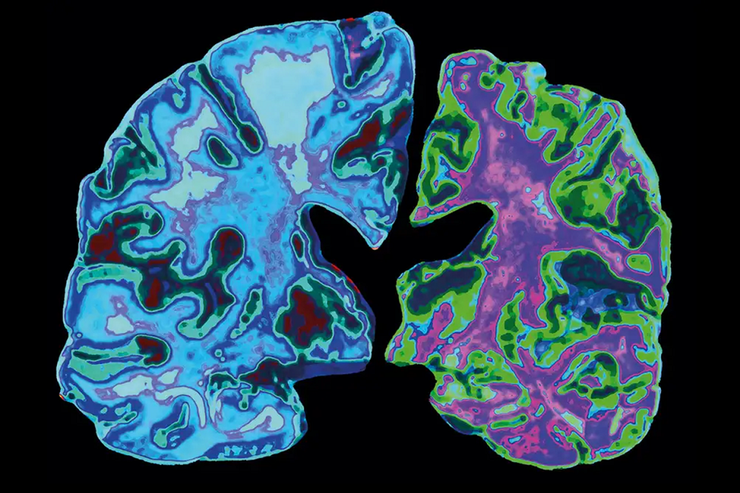
Сравнение мозга здорового 70-летнего человека (слева) с мозгом 70-летнего человека с болезнью Альцгеймера (справа), разрушенным из-за гибели нейронов и утраты связей между ними.
Рисунок в полном размере.
Jessica Wilson/Science Photo Library
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В последние несколько лет искусственный интеллект все прочнее входит в наши жизни. Первая способная рассуждать программа была написана в 1956 году, она могла доказывать теоремы символической логики из «Математических принципов» Уайтхеда и Рассела. Сейчас же системы ИИ применяются, кажется, везде, от рутинной автоматизации офисных процессов до цифрового искусства и построения виртуальных миров.
По-настоящему потенциал искусственного интеллекта можно раскрыть в одной из самых непростых сфер — в медицине, ведь несмотря на колоссальный прогресс в последние десятилетия диагностика многих заболеваний по-прежнему остается серьезным вызовом для ученых и врачей. Одна из актуальных на сегодняшний день задач — лечение нейродегенеративных заболеваний, в частности, болезни Альцгеймера. Может ли ИИ помочь преодолеть трудности в диагностике этой болезни? Какие технологии изобретены и применяются уже сегодня? Об этом и поговорим.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Старость подкралась незаметно
Старение — естественный биологический процесс в организме, сопровождающийся деградацией органов и тканей. Когда речь заходит о причинах старения, одним из первых на ум приходит лимит Хейфлика: клетки прекращают делиться из-за критического укорачивания теломер. Но точнее будет сказать, что старение — это не просто «поломка» конкретного механизма в системе, а следствие сложного компромисса между необходимостью подавления мутаций и потребностью в поддержании регенерации. Так, теломераза способна обходить лимит Хейфлика, но это может быть опасно из-за возможного неконтролируемого роста клеток [1]. К механизмам старения, в которых также важен баланс процессов, относятся накопление активных форм кислорода, ослабление передачи сигналов по инсулиновому пути, воспаление (подробнее об этом можно прочитать в статье [2]).
Факторов, влияющих на старение, разумеется, много. Ранее говорилось о девяти [3], тогда как на сегодняшний день выделяют уже двенадцать основных признаков старения, среди которых нестабильность генома, укорочение теломер, эпигенетические изменения, нарушение протеостаза (процесса поддержания пула белков в клетке), нарушение макроаутофагии и восприятия питательных веществ, дисфункция митохондрий, старение клеток, истощение пула стволовых клеток, нарушение межклеточных коммуникаций, хроническое воспаление и дисбактериоз (рис. 1) [4].
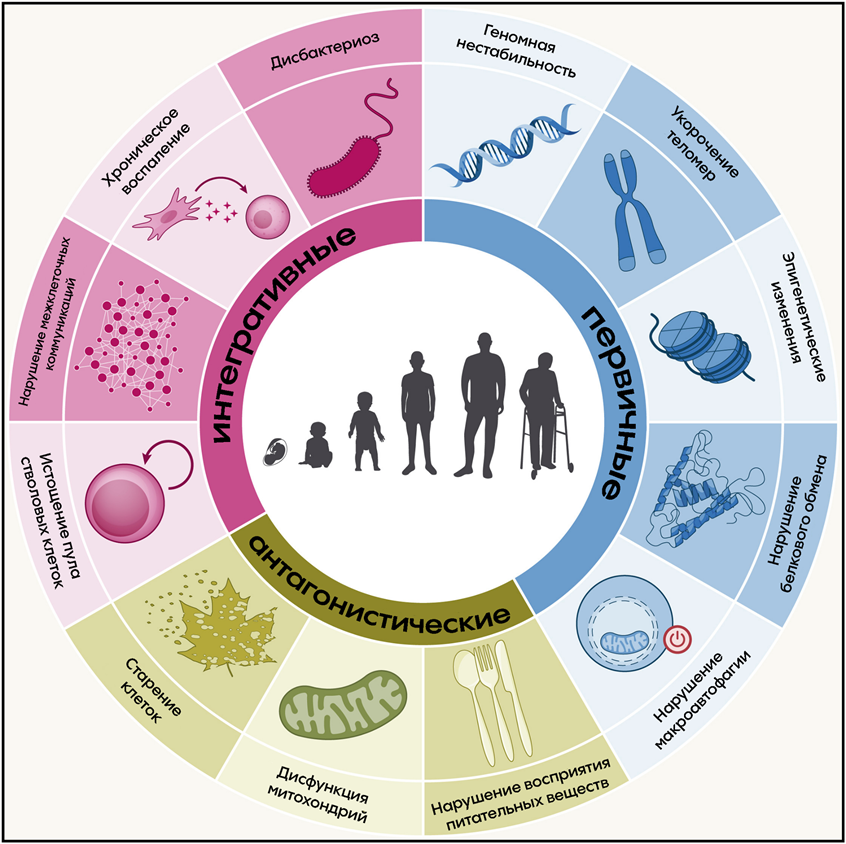
Рисунок 1. 12 признаков старения. Они разделены на три группы: первичные, антагонистические (отражают реакцию на повреждения) и интегративные (возникают, когда накопленный первичными и антагонистическими признаками ущерб больше не может быть компенсирован другими системами клетки).
адаптировано из [4]
Одна из главных причин старения — нарушение протеостаза, при котором происходит накопление окисленных, убиквитинилированных или неправильно свернутых белков, из-за чего могут образовываться внутриклеточные тельца включения и внеклеточные амилоидные бляшки (нерастворимые пептидные агрегаты) [5]. Именно это запускает прогрессирование болезни Альцгеймера.
В 1991 году впервые выдвинули «амилоидную гипотезу», согласно которой болезнь Альцгеймера возникает из-за накопления пептида β-амилоида (Aβ) в виде амилоидных бляшек во внеклеточной паренхиме головного мозга и образования клубков внутри нейронов в результате аномального гиперфосфорилирования белка 𝜏2, который обычно стабилизирует микротрубочки. Дисбаланс между выработкой Aβ и выведением его из организма приводит к накоплению клубков амилоида, в конечном итоге приводя к заметной потере нейронов в неокортексе и гиппокампе (рис. 2).
Aβ является фрагментом трансмембранного белка APP (amyloid precursor protein, предшественник бета-амилоида), важного рецептора клеточной мембраны, экспрессируемого во многих тканях. Он участвует в формировании отростков нейронов, поддерживает нейрональную адгезию (способность нейронов соединяться) и синаптогенез (процесс формирования синапсов между нейронами) [9]. Мутации в гене APP могут приводить к увеличению экспрессии и дальнейшему отложению Aβ, но в основном за пределами паренхимы мозга [8]. Кроме генетической предрасположенности, важную роль в накоплении β-амилоида играют мутации, связанные с работой белков-пресенилинов (гены PSEN1 и PSEN2). Эти белки входят в состав особого мультисубъединичного протеазного комплекса, называемого гамма-секретазой. APP сначала «разрезается» другим молекулярным «ножом» — бета-секретазой, а затем гамма-секретаза завершает процесс, отрезая от него кусочек (рис. 3). В некоторых случаях этот отрезанный фрагмент превращается в β-амилоид. Мутации в генах пресенилинов нарушают работу гамма-секретазы, из-за чего она начинает производить больше β-амилоида. Эти фрагменты более склонны к слипанию, что ускоряет образование бляшек в мозге [10], [11].
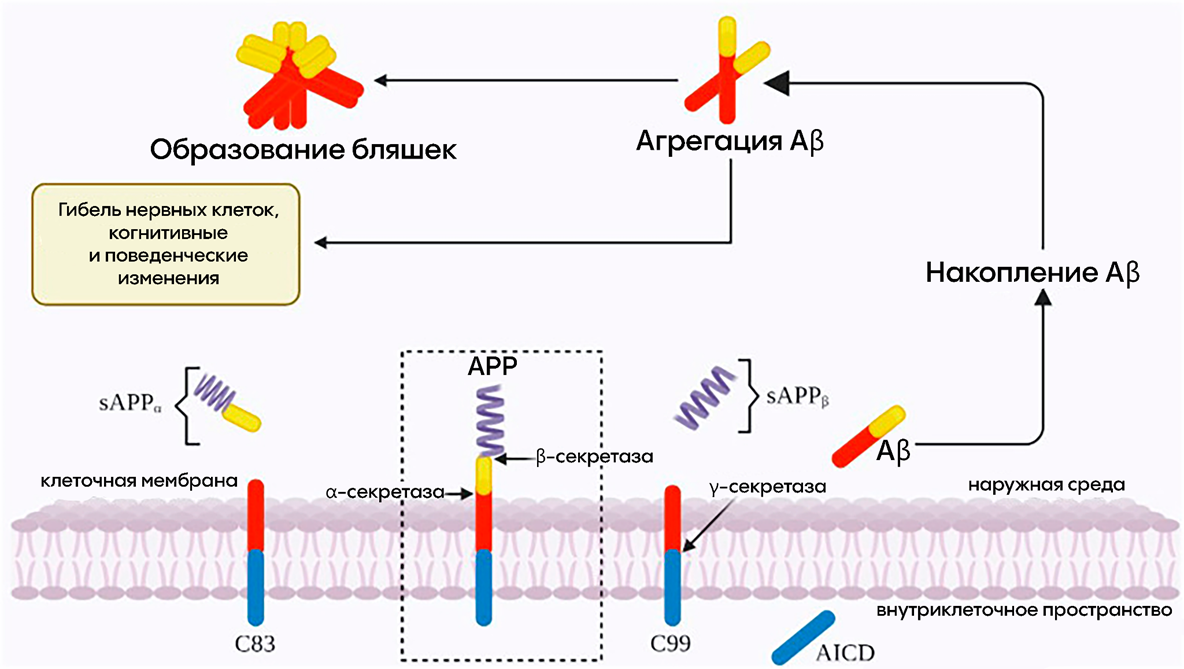
Рисунок 3. Пути процессинга APP, амилоидный (справа) и неамилоидный (слева). Белок-предшественник амилоидов (APP), встроенный в мембрану клетки, разрезается ферментами-секретазами. Расщепление альфа-секретазой — преобладающий путь, предотвращающий образование бета-амилоида. Если расщепление опосредовано бета-секретазой, то образуется C99, который будет разрезаться гамма-секретазой с образованием AICD (Amyloid precursor protein Intracellular Cytoplasmic Domain) и, собственно, Aβ.
адаптировано из [11]
Через несколько лет после появления амилоидной гипотезы в научном сообществе начали возникать споры о достоверности данных открытий, которые подкреплялись рядом противоречий. Самое частое возражение против нее заключается в том, что количество амилоидных отложений в мозге плохо коррелирует со степенью когнитивных нарушений пациента [7], [12]. Показано, что накопление может происходить без сопутствующей потери синапсов, но и потеря синапсов может происходить в областях без Aβ, хотя вблизи него потеря усиливается. Более того, отложение амилоидных бляшек вообще может происходить и у людей без когнитивных нарушений. Также было обнаружено, что мутации в генах пресенилинов не всегда увеличивают количество Aβ. Все эти доводы сводятся к тому, что нельзя однозначно назвать накопление Aβ главным виновником разрушения синапсов при болезни Альцгеймера у людей. Из-за выдвигаемых возражений амилоидная гипотеза пересматривается и претерпевает изменения, но все же бета-амилоид и гиперфосфорилирование белка 𝜏2 по-прежнему остаются одной из главных причин когнитивных нарушений.
Накопление Aβ и многие другие патологические изменения в мозге, происходящие в процессе прогрессирования заболевания, находят свое отражение в структурных и функциональных изменениях мозга, и поэтому могут быть выявлены с помощью современных методов нейровизуализации.
Заглянуть внутрь мозга
Облучая структуры радиоволнами разной частоты, можно наблюдать, как их ядра откликаются на эти сигналы, меняя свое положение в магнитном поле. Характер их отклика зависит от типа атомов, их расположения в молекулах и окружения. Такое явление называется ядерный магнитный резонанс (ЯМР) [13]. Именно оно лежит в основе магнитно-резонансной томографии (МРТ), которая позволяет изучать внутренние структуры всего организма, включая и головной мозг.
МРТ идеально подходит для визуализации нейродегенеративных заболеваний. Благодаря ей можно заметить явное расширение и углубление борозд и желудочков головного мозга по мере прогрессирования деменции [14]. Накопления нейрофибриллярных клубков в гиппокампе и коре обонятельной области медиальной височной доли хорошо визуализируются на снимке, что позволяет диагностировать болезнь Альцгеймера на ранней стадии [15]. Именно на основе видимых на МРТ нейроанатомических изменений можно делать прогнозы по поводу дальнейшего течения заболевания. Но есть проблема: взаимное наложение пораженных областей мозга часто затрудняет описание нейродегенеративного профиля человека. С этой проблемой легко справляется искусственный интеллект, который может анализировать визуальную информацию в больших количествах и делать более объективные прогнозы. Как же нейросети учат работать с данными, в том числе медицинскими?
Подходы к обучению нейросетей
Обучение нейросетей может осуществляться разными методами с использованием различных алгоритмов (рис. 4). Это может быть так называемое обучение с учителем или без него, с частичным привлечением учителя, многозадачное, многовариантное и т.д.
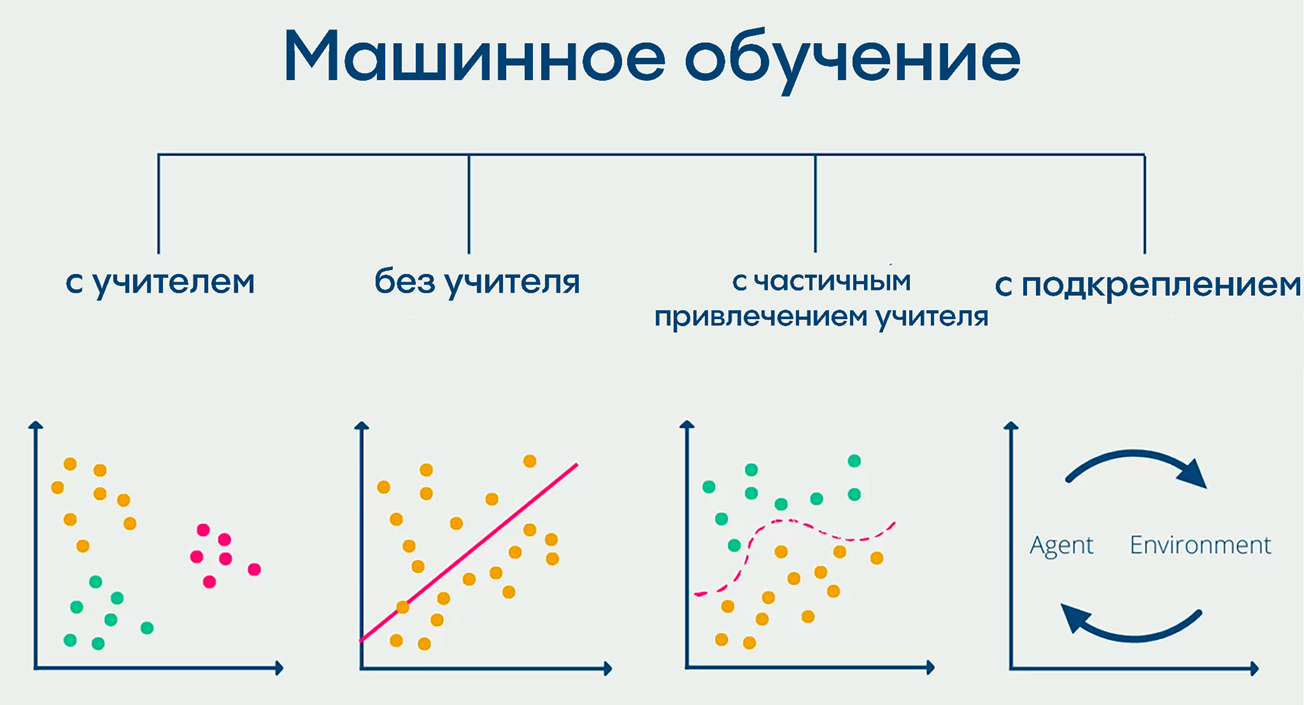
Рисунок 4. Схема, демонстрирующая четыре основных подхода к машинному обучению. Слева направо: с учителем, где модель обучается на размеченных данных (используется в основном для классификации и определения категорий объектов); обучение без учителя, которое анализирует неразмеченные данные для выявления закономерностей, например, кластеризации (группировки объектов по сходству); обучение с частичным привлечением учителя, когда модель в обучении используются размеченные данные для направленного обучения и неразмеченные для улучшения обобщающей способности; и обучение с подкреплением, где модель использует данные из окружающей среды для оптимизации своих действий.
адаптировано из Data Base Camp
Для понимания концепции машинного обучения давайте сначала обсудим, как работает самый простой вариант обучения — обучение с учителем. При таком алгоритме модель тренируется на основе размеченных данных. То есть имеются входные данные, которые предлагаются модели, и заранее известно, какими должны быть выходные, то есть что она должна ответить [16]. Человек выступает в роли учителя — он и отмечает данные. В результате нейросеть должна научиться получать ответ, соответствующий каждому данному ей примеру.
Рисунок 5. Как работает компьютерное зрение — пример машинного обучения с учителем. Распознавание нейросетью объектов на картинке происходит по визуальным признакам этих объектов: по цвету, границам или фактуре.
адаптировано из Innovatiana

Рисунок 6. Один из примеров reCAPTCHA. Ее задача — защищать сайты от ботов, проверяя, может ли пользователь правильно распознать объекты на изображениях. Подобранные изображения выглядят очень похоже, так что решение reCAPTCHA иногда может вызывать трудности.
Деятельность организации Meta запрещена на территории РФ
Так, например, можно обучить нейросеть распознавать объекты на изображениях. Каждый из нас сталкивался с reCAPTCHA в сервисах Google — тестом, в котором нужно выбрать изображение со светофором, велосипедом или любым другим объектом среди остальных. Среди предлагаемых картинок есть хотя бы одно уже распознанное, а остальные предназначены для обучения системы. Миллионы людей выбирают все картинки со светофорами среди перечисленных, и в результате Google добавляет выбираемые людьми изображения в свою базу данных. Такая система используется корпорацией и для улучшения Google Maps, и тренировки ИИ для распознавания других картинок и текстов.
Другой алгоритм — обучение без учителя. При таком подходе модели для обучения дается набор входных данных и не дается обозначенных выходных данных, и нет человека для корректировки интерпретации. Таким образом нейросеть анализирует предоставленную информацию и учится получать более глубокое представление о ней, самостоятельно ищет какие-либо закономерности [16]. Извлеченные признаки нейросеть использует для кластеризации анализируемых данных. Используя подобные нейросети, компании разделяют своих клиентов по группам, чтобы предлагать им более персонализированные предложения.
Обучение с частичным привлечением учителя (semi-supervised learning) представляет собой что-то среднее между двумя уже упомянутыми типами: модели дается набор данных, часть которых помечена, а часть нет, и обучение может производиться под наблюдением или без него. В условиях обучения без контроля могут быть выявлены скрытые закономерности и структуры входного набора данных. А методы обучения с контролем используют неотмеченные данные для повторного ранжирования и прогнозирования на основе уже установленных закономерностей [16]. Этот алгоритм уже давно используется в классификации белков по классам на основе функций и их структуры, а также для обучения, например, Surreal-GAN — нейросети, используемой в исследованиях нейродегенеративных заболеваний.
Что такое Surreal-GAN
Surreal-GAN — нейросеть, обучаемая по принципу частичного привлечения учителя и разработанная научными группами из США, Германии, Австралии и Кореи. Ее цель — выявление неоднородностей среди данных от выборки пациентов. В основном эта модель применяется для оценки МРТ-снимков пациентов. Surreal-GAN способна оценивать пространственную и временную гетерогенность нейродегенеративного заболевания по изображению, то есть учитывать анатомическое расположение патологий мозга и оценивать прогрессирование заболеваний в течение длительного периода. Многомерные комплексные оценки позволяют биологически приближенно проанализировать уровень выраженности разных форм атрофии головного мозга у одного и того же пациента.
В процессе обучения Surreal-GAN обрабатывает массив данных о пациентах с различными нейродегенеративными патологиями для выявления каких-либо закономерностей. В итоге получается функция преобразования f, которая принимает входные данные (снимки МРТ, истории болезни, данные с полногеномного секвенирования), а в качестве выходных выдает возможные патологии, распределение которых, как оказалось, совпадает с распределением патологий в реальных клинических данных. Совместно с функцией f обучается и обратная ей функция g (рис. 7). Она выдает R-индексы, которые количественно отражают тяжесть заболевания по разным критериям.

Рисунок 7. Общая архитектура модели Surreal-GAN. Домен CN — данные референсной, здоровой группы. Домен PT — данные таргетной группы пациентов. LAT — latent домен, множество скрытых переменных Z, определяющих комбинации паттернов заболевания и его серьезность. Полуконтролируемое обучение осуществляется путем преобразования данных из домена CN X в домен PT Y (функция f). Обратная функция g, напрямую восстанавливающая выборочный z из синтезированного PT, будет использоваться для вывода R-индексов. Дискриминатор D — вероятность того, что Y исходит из реальных данных, а не из функции преобразования; он должен отличить синтезированные данные PT от реальных данных.
адаптировано из openreview.net
В исследовании 2023 года [17] Surreal-GAN применялась к группе из 49 482 пациентов из консорциума iSTAGING (Imaging-based coordinate SysTem for AGing and NeurodeGenerative diseases, Система координат старения и нейродегенеративных заболеваний на основе визуализации). В рамках iSTAGING систематизируются и статистически обрабатываются данные визуализации головного мозга для изучения старения в целом и болезни Альцгеймера в частности. Данные для этого консорциума собирают среди представителей разных этнических групп и содержат информацию о людях всех возрастов.
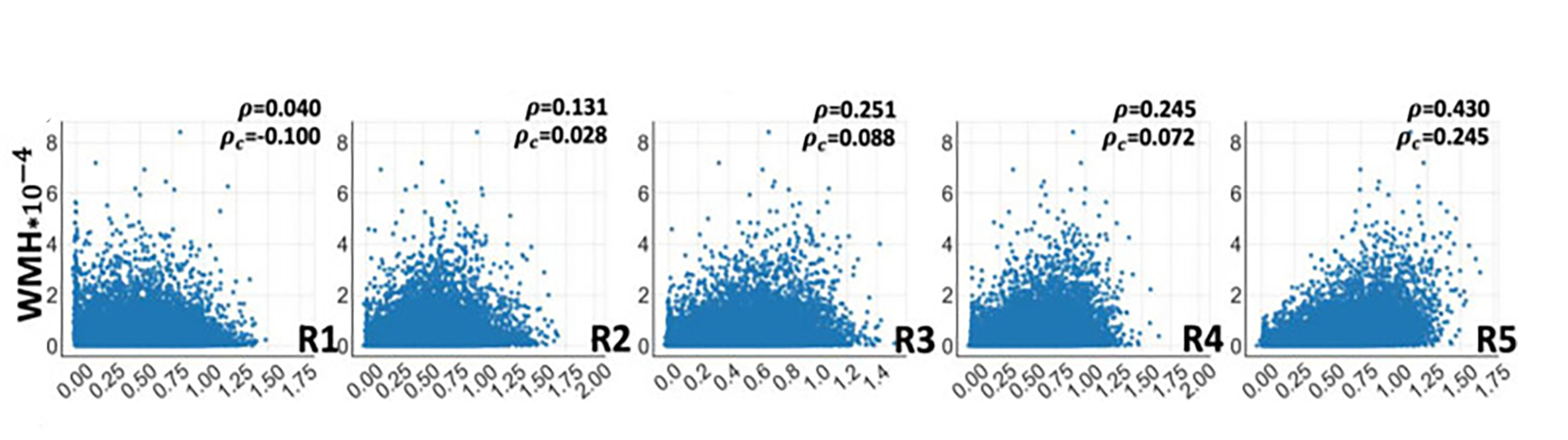
Выделили две группы пациентов: в первую, REF (reference), включили здоровых участников в возрасте младше 50 лет, а лица старше 50 лет с легкими когнитивными нарушениями или деменцией были определены в группу TAR (target group). Surreal-GAN, анализируя переход от популяции REF к популяции TAR, смог выделить 5 основных параметров старения мозга, каждому из которых назначил свой R-индекс (R1-R5):
- подкорковая атрофия;
- атрофия средней височной доли;
- атрофия теменной и височной долей;
- диффузная атрофия коры головного мозга;
- атрофия области, окружающей боковую борозду головного мозга (перисильвиева область).
Результатом стало то, что Surreal-GAN получилось создать математически обоснованное представление о доминирующих аспектах нейроанатомического старения мозга у изученной группы пациентов. Модель связала выделенные параметры с когнитивными, клиническими, генетическими показателями и с образом жизни пациентов. Выделение пяти R-индексов показывает, что разные области мозга и их изменения могут по-разному отражать процессы старения (рис. 8).
Некоторые R-индексы могут быть ранними биомаркерами риска нейродегенеративных заболеваний, например, болезни Альцгеймера. Понимание того, какие факторы ускоряют или замедляют изменения в различных R-индексах, может привести к разработке персонализированных стратегий профилактики.
Новые горизонты
В недавнем исследовании, опубликованном в октябре 2024 [18], модель Surreal-GAN анализировала 3 группы людей без симптомов (участники со здоровым старением или другими заболеваниями, кроме деменции) и одну симптоматическую группу. Перед исследованием пациентов Surreal-GAN предварительно обучили. Итогом стало выявление двух параметров атрофии мозга у пациентов с когнитивными нарушениями и болезнью Альцгеймера: R1 — обширная атрофия мозга, R2 — очаговая атрофия медиальной височной доли. Уже обученная модель применялась к новым данным.
Для анализа групп пациентов понадобились изображения и клинические данные из вышеупомянутого консорциума iSTAGING, а также взяли данные полногеномного секвенирования из исследований ADNI (Alzheimer’s Disease Neuroimaging Initiative study). Кроме iSTAGING и ADNI, привлекли и другие банки; все эти данные использовались для учета различий при оценке фенотипа для обобщения ранних исследований.
Все МРТ-изображения скорректировали с учетом неоднородности интенсивности магнитного поля и статистически согласовали с помощью метода ComBat [19]. Он применяется для гармонизации данных, полученных из разных источников. ComBat выявляет систематические различия, моделирует их как смещение и масштабирование данных, а затем корректирует каждый снимок, приводя к общей шкале. Это позволяет объединять данные, собранные в разных условиях, в единый набор.
На снимках изучали 119 анатомических областей интереса в сером, белом веществе и желудочках мозга. Каждую область каждого пациента проанализировали для построения линейных регрессий и поиска корреляций с параметрами R1 и R2. Также при этом анализе учитывали возраст и пол пациентов, а размер выборок был одинаков.
Генетический анализ проводился с помощью статистического метода GTCA-GREML. Он использует геномные данные и определяет вклад общих генетических вариаций в наследуемость сложных признаков или заболеваний. Так можно оценить генетическую схожесть между родственно не связанными людьми и сделать вывод о влиянии генов на какой-либо признак. Вместе с тем, осуществляли аннотирование и картирование генов, проводили построение логистической регрессии на основе полигенных индексов риска (PRS) с учетом возраста и пола.
Все эти оценки показали, что оба типа атрофии (R1 — диффузная и R2 — очаговая в медиальной височной доле) встречаются не только у пациентов с симптомами болезни Альцгеймера, но и у когнитивно нормальных людей в общей популяции. Это значит, что такие изменения могут наблюдаться и при здоровом старении, хотя их выраженность и последствия могут различаться.
Анализ R1 и R2 помог выявить многие факторы, влияющие на развитие болезни Альцгеймера, которые не связаны с амилоидной гипотезой. Например, обнаружили связь обеих типов атрофий с генами, вовлеченными в развитие рака молочной железы и других форм онкологии. Установили связи R2 с геном APOE, повышающим риск развития Альцгеймера (кодирует белок, регулирующий метаболизм липидов). Кстати, APOE может участвовать в прогрессировании БА и амилоид-зависимым путем, способствуя отложению Aβ [20], [21]. Стало известно, что R1 и R2 ассоциированы с 77 генами, связанными с регуляцией работы мозга и других органов (печени, сердца, поджелудочной железы и др.) (рис.9). Всё это позволяет говорить о системном и, вероятно, наследственном характере этих типов атрофии.
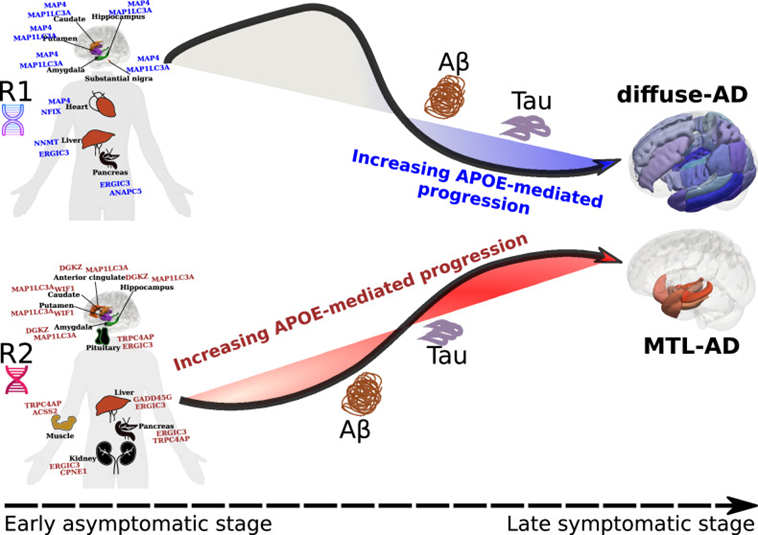
Рисунок 9. Схема развития Альцгеймера с участием APOE, амилоида (Aβ) и тау-белка (Tau), приводящих к диффузному (R1) или медиальному височному поражению (R2). Оба пути характеризуются увеличением APOE-опосредованной прогрессии. Помимо общих закономерностей, выявлено, что R1 связан с генами гиппокампа, миндалевидного тела, базальных ядер, черной субстанции, сердца, печени и поджелудочной железы, а R2 — с генами гипофиза, гиппокампа, мышц, печени, поджелудочной железы и почек.
Признаки, выявленные Surreal-GAN, открывают новые направления для исследований и поиска терапевтических подходов к болезни Альцгеймера. Эти новые данные не опровергают амилоидную гипотезу, они позволяют нам лишь убедиться в том, что БА развивается по разным сценариям, поэтому так важно искать новые подходы к изучению заболевания. Использование ИИ поможет нам лучше понять течение болезни, а значит, и разработать различные варианты ее лечения (о достижениях в разработке современных средств терапии Альцгеймера можно прочитать в этой статье) [21].
Заключение
Нейросети уже сейчас помогают нам проводить фундаментальные медицинские исследования. Анализируя огромные массивы данных, включая результаты МРТ, генетические данные и информацию о когнитивных тестах, ИИ выявляет ранее неизвестные закономерности развития Альцгеймера, которые можно учитывать в диагностике и лечении. Конечно, искусственный интеллект порой ошибается, но с нашей, человеческой, стороны требуется правильно обучить, контролировать и с умом интерпретировать те данные, которые мы можем от него получить. Именно с таким подходом мы сделаем ИИ полезным помощником в борьбе с Альцгеймером и другими заболеваниями.
Литература
- Старение — плата за подавление раковых опухолей?;
- Зачем клетки стареют;
- Как и почему искусственный интеллект биологический возраст определял;
- Carlos López-Otín, Maria A. Blasco, Linda Partridge, Manuel Serrano, Guido Kroemer. (2023). Hallmarks of aging: An expanding universe. Cell. 186, 243-278;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Julia Skokowa, Gunnar Cario, Murat Uenalan, Axel Schambach, Manuela Germeshausen, et. al.. (2006). LEF-1 is crucial for neutrophil granulocytopoiesis and its expression is severely reduced in congenital neutropenia. Nat Med. 12, 1191-1197;
- Gary P Morris, Ian A Clark, Bryce Vissel. (2014). Inconsistencies and Controversies Surrounding the Amyloid Hypothesis of Alzheimer's Disease. acta neuropathol commun. 2;
- J. Hardy. (2002). The Amyloid Hypothesis of Alzheimer's Disease: Progress and Problems on the Road to Therapeutics. Science. 297, 353-356;
- F. Baumkotter, N. Schmidt, C. Vargas, S. Schilling, R. Weber, et. al.. (2014). Amyloid Precursor Protein Dimerization and Synaptogenic Function Depend on Copper Binding to the Growth Factor-Like Domain. Journal of Neuroscience. 34, 11159-11172;
- Bart De Strooper, Paul Saftig, Katleen Craessaerts, Hugo Vanderstichele, Gundula Guhde, et. al.. (1998). Deficiency of presenilin-1 inhibits the normal cleavage of amyloid precursor protein. Nature. 391, 387-390;
- Petra, E. Spies. (2012). Reviewing reasons for the decreased CSF Abeta42 concentration in Alzheimer. Front Biosci. 17, 2024;
- Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен;
- Магниты, радио, электроны и ядра;
- Zhaomin Yao, Hongyu Wang, Wencheng Yan, Zheling Wang, Wenwen Zhang, et. al.. (2023). Artificial intelligence-based diagnosis of Alzheimer's disease with brain MRI images. European Journal of Radiology. 165, 110934;
- R. Ylikoski, O. Salonen, R. Mantyla, A. Ylikoski, P. Keskivaara, et. al.. (2000). Hippocampal and temporal lobe atrophy and age-related decline in memory. Acta Neurol Scand. 101, 273-278;
- Mohammad Mustafa Taye. (2023). Understanding of Machine Learning with Deep Learning: Architectures, Workflow, Applications and Future Directions. Computers. 12, 91;
- Zhijian Yang, Junhao Wen, Guray Erus, Sindhuja T. Govindarajan, Randa Melhem, et. al.. (2024). Brain aging patterns in a large and diverse cohort of 49,482 individuals. Nat Med. 30, 3015-3026;
- Junhao Wen, Zhijian Yang, Ilya M. Nasrallah, Yuhan Cui, Guray Erus, et. al.. (2024). Genetic and clinical correlates of two neuroanatomical AI dimensions in the Alzheimer’s disease continuum. Transl Psychiatry. 14;
- Raymond Pomponio, Guray Erus, Mohamad Habes, Jimit Doshi, Dhivya Srinivasan, et. al.. (2020). Harmonization of large MRI datasets for the analysis of brain imaging patterns throughout the lifespan. NeuroImage. 208, 116450;
- Болезнь Альцгеймера: ген, от которого я без ума;
- На руинах памяти: настоящее и будущее болезни Альцгеймера.