
Как происходит дозовая компенсация у птиц
10 сентября 2025
Как происходит дозовая компенсация у птиц
- 280
- 0
- 7
У птиц, и кур в том числе, пол определяется по ZW-системе, где самка гетерогаметна и имеет две половые хромосомы — Z и W, а самец гомогаметен и имеет две Z-хромосомы. Куры также имеют 76 аутосом.
Рисунок в полном размере.
рисунок из «Википедии»
-
Автор
-
Редакторы
Темы
Проблема дозовой компенсации (уравнивания уровня экспрессии генов, локализованных на половых хромосомах, между полами) остро стоит перед всеми организмами, у которых представители одного пола гетерогаметны, а другого — гомогаметны. Если млекопитающие с XY-системой определения пола решают этот вопрос путем полной инактивации второй X-хромосомы у самок, то механизм дозовой компенсации у птиц, у которых гомогаметны не самки, а самцы, долгое время был неясен. Как показало новое исследование, результаты которого представлены в Nature, птицы выравнивают уровни экспрессии генов с половых хромосом у представителей обоих полов с помощью специальной микроРНК.
Определение пола — одна из самых захватывающих областей генетики. Даже у близкородственных видов определение пола может идти по разным механизмам. И все же в распространении разных путей определения пола можно увидеть некоторые закономерности. Так, в подавляющем большинстве случаев определение пола у млекопитающих идет по XY-механизму, и самки имеют генотип XX, а самцы — XY. У птиц ситуация обратная: в ZW-системе, которая распространена среди них, самцы гомогаметны (ZZ), а самки гетерогаметны (ZW) .
Об определении пола у человека и других животных, а также многих других аспектах формирования и функционирования половой системы читайте в статьях раздела «Вопросы пола» на «Биомолекуле». В этой рубрике вы найдете статьи о том, что такое пол вообще, как он определяется у человека [1] и других животных [2], [3].
Системы определения пола у млекопитающих и птиц объединяет одна проблема: у представителей гомогаметного пола X- или Z-хромосома представлена двумя копиями, следовательно, и экспрессия генов, расположенных на ней, будет в два раза выше, чем у представителей гетерогаметного пола. Поскольку и X-, и Z-хромосома содержат немало генов, двукратное повышение уровня их экспрессии может быть фатальным. Как быть? Путь выравнивания уровня экспрессии между половыми хромосомами называют дозовой компенсацией.
Млекопитающие избрали радикальный путь дозовой компенсации, который включает полную инактивацию «лишней» X-хромосомы в клетках самок. Центральную роль в этом процессе играет некодирующая РНК Xist, которая связывается с X-хромосомой и привлекает к ней разные белки, вносящие репрессивные эпигенетические метки. В конечном итоге вся X-хромосома практически полностью инактивируется . То, какая именно X-хромосома подлежит инактивации, определяется, по всей видимости, случайным образом.
Подробнее о Xist и инактивации X-хромосомы читайте в статье «Загадочное путешествие некодирующей РНК Xist по X-хромосоме» [4].
А что же с птицами? До недавнего момента четкого ответа на вопрос о том, как достигается дозовая компенсация у птиц, не было. Авторы новой работы, опубликованной в Nature, показали, что ключевую роль тут играет тоже некодирующая РНК, но из группы микроРНК [5]. Но обо всем по порядку.
Предыдущие исследования показали, что есть особая микроРНК, miR-2954, экспрессия которой у самцов примерно в 5–10 раз активнее, чем у самок. miR-2954 кодируется интроном, локализованном в гене XPA, который располагается на Z-хромосоме. Ранее с помощью методов биоинформатики было предсказано, что среди мишеней miR-2954 есть гены, которые локализованы на Z-хромосоме и дозочувствительны (дозочувствительные гены отличаются тем, что для их нормальной работы строго необходимо правильное количество копий — две копии). Теперь же исследователи решили изучить функции miR-2954 на реальной модели.
Чтобы изучить функции этой микроРНК на уровне половых клеток, ученые с помощью системы CRISPR-Cas9 удалили оба локуса, кодирующих miR-2954, в мужских примордиальных зародышевых клетках. Это клетки, от которых потом происходят гаметы. Примордиальные зародышевые клетки были получены из клеток мужских эмбрионов (из которых развиваются птицы мужского пола). Далее отредактированные клетки были введены в мужские эмбрионы, у которых удалили собственные примордиальные половые клетки. В итоге были получены петухи, ничем не отличавшиеся от петухов дикого типа, за исключением нулевой экспрессии miR-2954 в зародышевых клетках.
Нокаутных петухов скрестили с курицами дикого типа и получили, помимо гетерозиготных нокаутных самцов, еще и нокаутных самок. Скрещивание гетерозиготных нокаутных петухов и нокаутных самок дало зародышей четырех видов: женский зародыш (который дает начало птице женского пола) дикого типа, нокаутный женский зародыш и два нокаутных мужских зародыша — гомозиготный и гетерозиготный. Гомозиготные нокаутные мужские зародыши рано (на эмбриональный день E7) погибали, что свидетельствует о том, что miR-2954 необходима для развития мужских эмбрионов. А вот для развития женских эмбрионов miR-2954, по-видимому, не нужна: выживаемость нокаутных женских зародышей не уступала таковой у женских зародышей дикого типа. Примерно ту же выживаемость демонстрировали мужские гетерозиготные нокаутные эмбрионы. Таким образом, экспрессия miR-2954 строго необходима для развития мужских зародышей. Примечательно, что, помимо miR-2954, среди всех организмов неизвестны другие микроРНК, которые были бы необходимы для развития организмов только одного пола [5].
Что происходит в нокаутных зародышах на уровне Z-хромосом? Вообще, микроРНК могут действовать на двух уровнях: на уровне трансляции, блокируя доступ рибосомы и белков к транскрипту, а также на уровне деградации транскрипта, связываясь с его 3’-нетранслируемой областью и привлекая к ней нуклеазу группы Argonaute. Чтобы выяснить, на каком уровне действует miR-2954, ученые провели секвенирование РНК в клетках петухов, куриц, а также единичных клеток мужских зародышей возрастом в E3 и E5 эмбриональных дней, причем во всех случаях в анализ были включены и дикий тип, и нокаут. У нокаутных особей и зародышей уровень экспрессии транскриптов-мишеней miR-2954 был значимо выше, чем у дикого типа. В то же время рибосомное профилирование, с помощью которого оценивают интенсивность трансляции РНК, показало, что miR-2954 на трансляцию не влияет. Таким образом, miR-2954 влияет на стабильность РНК-мишеней [5].
У гетерозиготных нокаутных самцов, в сравнении с еще живыми гомозиготными нокаутными мужскими зародышами, «выключение» miR-2954 на одной из Z-хромосом действительно приводит к повышению уровня экспрессии мишеней miR-2954, хотя и в меньшей степени, чем у гомозиготных зародышей — все-таки у них miR-2954 еще экспрессируется с одной нетронутой Z-хромосомы. По-видимому, частичная репрессия генов-мишеней miR-2954 у нокаутных гетерозиготных самцов позволяет им выживать. У нокаутных куриц по сравнению с курицами дикого типа повышена экспрессия генов-мишеней miR-2954. Впрочем, эффект от такого повышения был существенно менее выражен, чем в случае петухов, и нокаутные курицы фенотипически не отличаются от куриц дикого типа [5].
Стоит отметить, что miR-2954 косвенно регулирует и свою собственную экспрессию! Исследования птиц как с нокаутом, так и с нокдауном miR-2954 показали, что экспрессия гена XPA, кодирующего miR-2954, повышается при снижении уровня miR-2954. Возможно, что экспрессию XPA запускает некоторый транскрипционный активатор, который, в свою очередь, является мишенью miR-2954 [5].
Следующим этапом работы стало изучение дозочувствительных генов-мишеней miR-2954, повышение экспрессии которых, как отмечалось выше, может давать летальный фенотип. Используя специальные метрики, исследователи подтвердили, что большинство мишеней miR-2954 действительно являются дозозависимыми, как и предполагалось. Среди этих генов есть те, что задействованы в различных сигнальных путях, таких как JAK-STAT, PI3K-Akt, Rap1 и других. На более высоком уровне многие гены-мишени участвуют в развитии нервной системы, регуляции пролиферации клеток, апоптоза, организации комплекса Гольджи и адгезии клеток. Авторы работы отмечают, что нарушения, затрагивающие перечисленные моменты, вполне согласуются с тем, какой фенотип имеют нокаутные гомозиготные мужские зародыши: до дня E7 у них замедлено развитие и рост, маленький мозг и глаза, и многие зародыши на более поздних этапах развития просто разрушаются. Интересно, что зародыши мышей с двойным нокаутом Xist погибают примерно в то же время, что и двойные нокаутные по miR-2954 мужские зародыши кур [5].
Полученные данные позволили авторам работы понять примерный механизм дозовой компенсации у птиц (рис. 1). При дифференцировке половых хромосом W-хромосома утратила множество генов, причем для нормальной работы части из них критически важно количество их копий. Из-за этого женским организмам пришлось вдвое повысить экспрессию единственных копий дозочувствительных генов на своей одной Z-хромосоме. У самцов, видимо, тоже произошло удвоение уровня экспрессии дозочувствительных генов на Z-хромосоме, и перед ними встала другая проблема: уровень экспрессии этих генов на Z-хромосоме, в том числе ключевых для развития, удвоился, что привело к появлению летального фенотипа. Фактором, подавляющим экспрессию множества генов на Z-хромосоме, стала микроРНК miR-2954, которая также кодируется геном, локализованным на Z-хромосоме. Однако описанный сценарий еще требовал дополнительной проверки. Для этого авторы исследования подтвердили, что гены-мишени miR-2954, которые в ходе эволюции предположительно стали экспрессироваться у мужских организмов на повышенном уровне, также на повышенном уровне экспрессируются и у женских организмов. Таким образом, предложенный сценарий получил полное подтверждение [5].
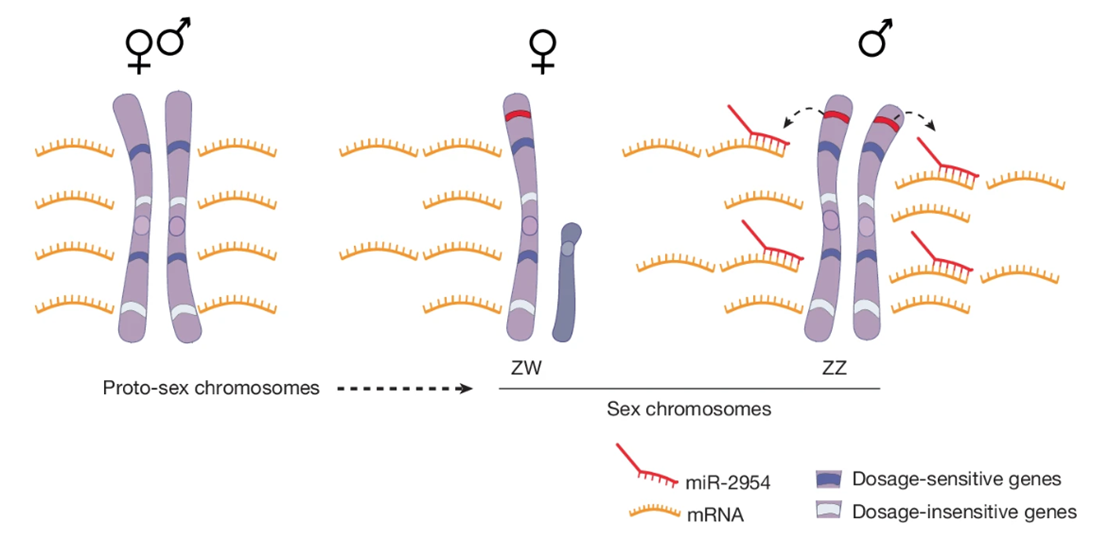
Рисунок 1. Механизм дозовой компенсации у птиц. В ходе дифференцировки из хромосом-предшественников половая хромосома W потеряла множество генов, и у самок эти гены остались в единственной копии на Z-хромосоме. Для части из них количество копий критически важно (дозочувствительные гены). Чтобы восстановить нормальный уровень экспрессии этих генов, их активность удваивается. То же самое происходит у самцов, имеющих две Z-хромосомы. Чтобы восстановить нормальный уровень экспрессии дозочувствительных генов, они уменьшают его с помощью микроРНК miR-2954.
Еще один аспект, затронутый в исследовании, — эволюция дозовой компенсации, опосредованной miR-2954. Оказалось, что локус, кодирующий miR-2954, есть у всех птиц, но отсутствует у всех остальных амниот, включая крокодилов — ближайших ныне живущих родственников птиц. Так что miR-2954 — чисто птичья микроРНК. Интересно, что последовательность как самой miR-2954, так и транскрипта-предшественника идентична у 351 из 363 видов птиц, включенных в анализ. Было также установлено, что опосредованный miR-2954 механизм дозовой компенсации появился у птиц в то же время, когда произошла дифференцировка половых хромосом на Z- и W-хромосомы — примерно 108–245 миллионов лет назад. И этот механизм сохранился у всех ныне живущих птиц [5].
Литература
- Что такое пол?;
- Могут ли условия жизни птиц влиять на пол потомства?;
- Тайна зеленой черепахи: высокая температура делает черепах самками;
- Загадочное путешествие некодирующей РНК Xist по X-хромосоме;
- Amir Fallahshahroudi, Sara Yousefi Taemeh, Leticia Rodríguez-Montes, Nils Trost, Dana Frank, et. al.. (2025). A male-essential miRNA is key for avian sex chromosome dosage compensation. Nature. 645, 148-157.





