Загадочное путешествие некодирующей РНК Xist по X-хромосоме
21 октября 2013
Загадочное путешествие некодирующей РНК Xist по X-хромосоме
- 4496
- 0
- 6
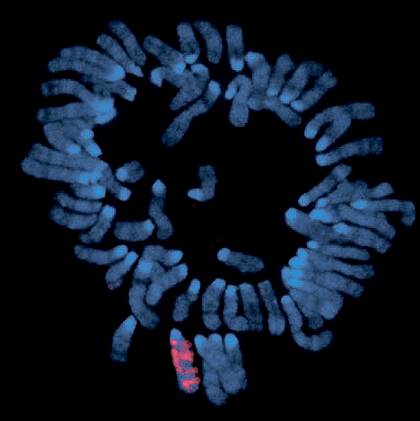
Xist «облепляет» Х-хромосому, с которой транскрибируется. ДНК на фотографии покрашена синим; места, где есть транскрипты Xist, светятся розовым.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Многие длинные некодирующие РНК участвуют во включении и выключении генов, но как они физически «пробираются» к нужным участкам ДНК по клеточному ядру, мы знаем плохо. И вот недавно группа американских ученых решила полюбопытствовать, в каких местах Х-хромосомы оказывается длинная некодирующая РНК Xist перед тем, как Х-хромосома инактивируется, и её гены перестают читаться. Оказалось, что Xist постепенно «пробирается» от участка своей транскрипции к дальним местам хромосомы. И что интересно, участки ДНК, возле которых молекулы этой РНК собираются перед распространением по всей хромосоме, не отличаются специфическими последовательностями нуклеотидов. Скорее, сами молекулы Xist «исследуют» трёхмерную архитектуру хромосомы и постепенно облепляют её, в то же время инактивируя с привлечением специальных белков.
Конкурс «био/мол/текст»-2013
 Эта работа заняла первое место в номинации «Лучшее новостное сообщение» конкурса «био/мол/текст»-2013.
Эта работа заняла первое место в номинации «Лучшее новостное сообщение» конкурса «био/мол/текст»-2013.
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Как устроены хромосомы и экспрессируются гены?
Бóльшая часть нашего генома существует в клеточном ядре в виде хромосом. Одна хромосома — это длинная-предлинная молекула ДНК, «намотанная» на глобулы из белков-гистонов (подобно бусинам на нитке, рис. 1), и вместе с другими белками и РНК способная собираться в очень компактную структуру. Всё вещество хромосом (ДНК с белками и РНК) называют хроматином.
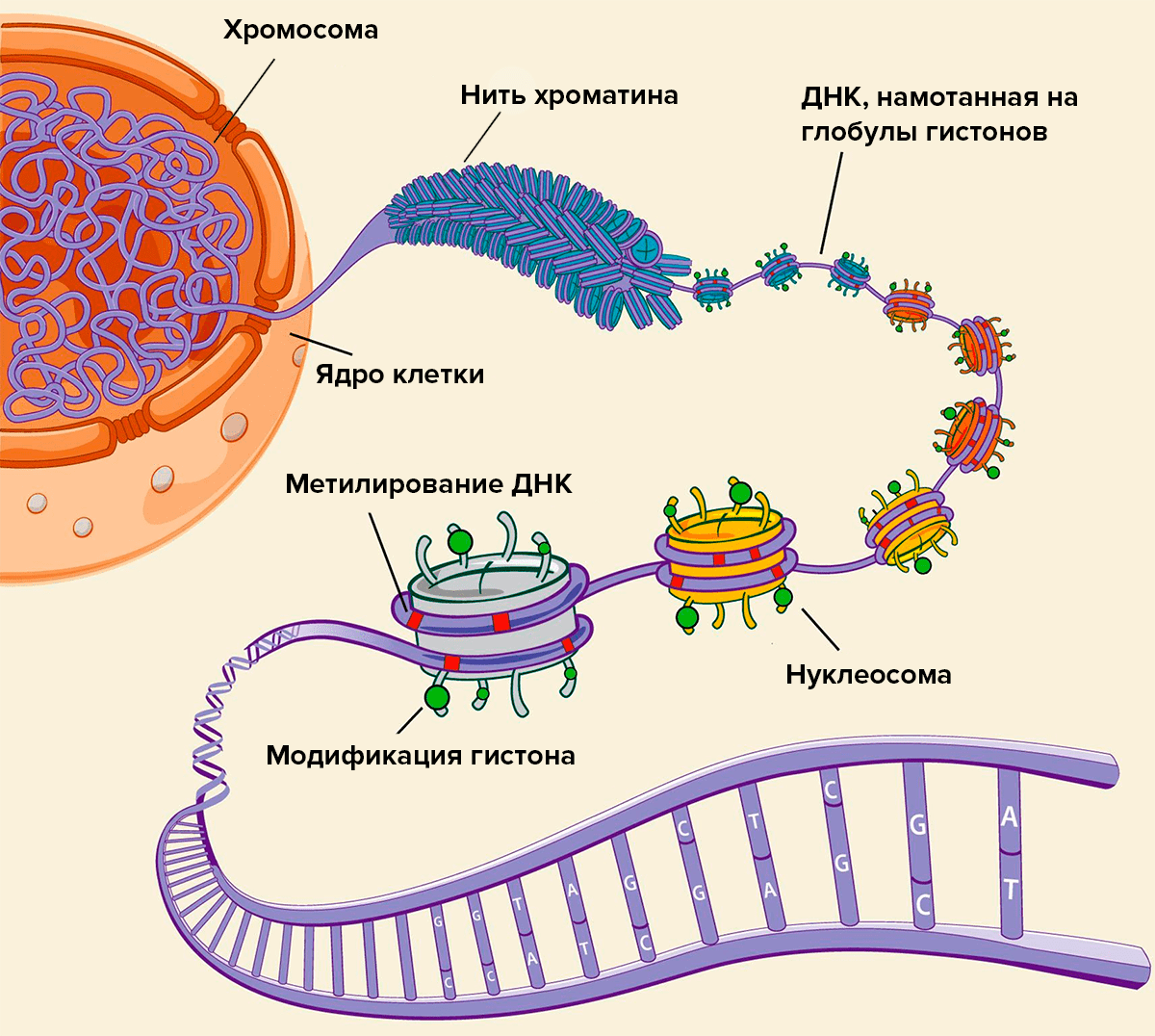
Рисунок 1. ДНК в клетке «намотана» на белки-гистоны, и в таком виде может быть уложена в очень компактную структуру.
Когда клетка не делится, целые хромосомы не бывают абсолютно «свёрнутыми», а абсолютно «развёрнутыми» хромосомы не бывают никогда — «развёрнутыми» могут быть только их части. Чаще всего «развёрнутые» участки доступны для транскрипции — синтеза с участка ДНК комплементарной молекулы РНК. И если эта РНК является кодирующей, то в цитоплазме на больших комплексах из РНК и белка — рибосомах — с неё синтезируется белок: происходит трансляция. Транскрипцию для РНК, которая не кодирует белок, и транскрипцию с трансляцией для кодирующей РНК называют экспрессией гена.
Х-хромосома и система дозовой компенсации
У многих животных, в том числе и млекопитающих, и даже некоторых растений особи мужского пола наследуют одну Х-хромосому, а женского — две. Чтобы гены Х-хромосом у особей разных полов экспрессировались в одинаковых количествах, при наличии в клетке двух Х-хромосом одна «выключается», и её гены не работают. Такой процесс носит название инактивации Х-хромосомы, а то, как специальные молекулы «выключают» хромосому, именуется системой дозовой компенсации.
В «выключении» одной из двух Х-хромосом у млекопитающих участвует длинная некодирующая РНК по имени Xist (от англ. X-inactive specific transcript, дословно «Х-неактивный специфический транскрипт») — молекула рибонуклеиновой кислоты из целых 17 тысяч нуклеотидных остатков. В молекуле можно выделить несколько характерных участков — доменов [3–6], [14].
Постепенно у РНК, исходно считавшейся лишь молекулой-мессенджером на пути реализации генетической программы клетки, открывают все новые и новые функции. «Биомолекула» уже писала о многих из них: «Обо всех РНК на свете, больших и малых» [20], «РНК у истоков жизни?» [21], «Большие дела небольших молекул: как малые РНК дирижируют генами бактерий» [22], «Белки против РНК — кто первым придумал сплайсинг?» [23], «Как избавиться от РНК за несколько минут» [24]. — Ред.
Распространяясь по хромосоме, эта РНК одним из своих доменов взаимодействует с белковым комплексом по имени PRC2 (от англ. Polycomb repressive complex 2), «подтаскивая» его к тем местам, где нужно выключить гены. Комплекс, в свою очередь, специальным образом модифицирует гистоны: пришивает к ним в определённых местах метильные группы. ДНК, намотанная на такие гистоны, неактивна, и гены «выключенной» Х-хромосомы не читаются (рис. 2) [7–10], [15].
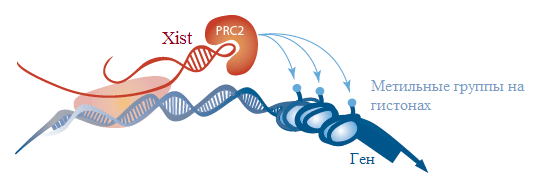
Рисунок 2. Xist выключает гены, привлекая модифицирующий гистоны комплекс белков PRC2
С начала 2000-х годов появилось несколько работ, показывающих, что для распространения по Х-хромосоме Xist использует несколько разных доменов [14–16]. Ещё, как обнаружилось, для распространения нужно, чтобы эта РНК взаимодействовала с белками, ассоциированными с ядерным матриксом — очень динамичной пронизывающей ядро сеточкой из белков [11–13]. Но каким именно путём РНК распространяется по хромосоме, никто не понимал.
Бабка за дедку, дедка за репку: принцип из русской сказки в биохимическом методе
И вот большая группа американских учёных под руководством Митчелла Гуттмана (Mitchell Guttman) придумала, как можно проследить за путешествием Xist по Х-хромосоме [1]. Исследователи слегка модифицировали протокол метода, который до них успешно использовали для выяснения того, в каких местах генома оказываются разные некодирующие РНК. Свою версию метода они назвали комплементарным выделением РНК (RAP — RNA antisense purification). Суть метода представляет собой биохимический вариант русской народной сказки про репку и заключается в следующем (рис. 3 и 4):
- Сначала клетки фиксируют формальдегидом, и при этом все соседствующие в клетках крупные молекулы химически склеиваются — сшиваются.
- Затем клетки лизируют (делают так, что все клеточные мембраны лопаются, и содержимое клеток и органелл «вытекает») и дробят хроматин на маленькие кусочки ультразвуком и ДНКазой — ферментом, который режет двуцепочечную ДНК.
- К лизату «проклеенных» формальдегидом дроблёных клеток с порезанным хроматином добавляют смесь молекул РНК, комплементарных разным частям РНК Xist и химически пришитых к биотину — небольшой молекуле, которая очень прочно связывается с белком стрептавидином. При этом транскрипты Xist, пришитые к тем частям хроматина, где они локализуются, спариваются с комплементарными кусочками РНК с биотином: образуются участки двуцепочечной РНК.
- К раствору добавляют магнитные шарики с пришитым на них стрептавидином, который «цепляется» за биотин с кусочками РНК, комплементарными Xist. Они, как мы помним, в свою очередь комплементарно связаны с РНК Xist, пришитой к кусочку хроматина.
- Магнитные шарики со всем, что прицепилось к ним за стрептавидин, вытаскивают из раствора магнитом, и кусочки хроматина отделяют от шариков. Дальше из таких кусочков выделяется ДНК и секвенируется — определяется последовательность участка хромосомы, возле которого в живой клетке находилась изучаемая РНК.
О современных методиках секвенирования можно прочесть в статьях «454-секвенирование (высокопроизводительное пиросеквенирование ДНК)» [25], «Код жизни: прочесть не значит понять» [26], «Важнейшие методы молекулярной биологии и генной инженерии» [27], «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [28]. — Ред.

Рисунок 3. В известной русской сказке репку удалось вытащить только тогда, когда за держащегося за неё дедку взялась бабка, за бабку взялась внучка, за внучку — Жучка, за Жучку — Кошка, а за Кошку — Мышка. В нашем случае вытаскиваемая «репка» — это участки ДНК, возле которых находится РНК Xist. За РНК Xist цепляются комплементарные кусочки РНК с биотином, а биотин взаимодействует со стрептавидином на магнитных шариках, которые мы вытаскиваем из раствора специальным магнитом.
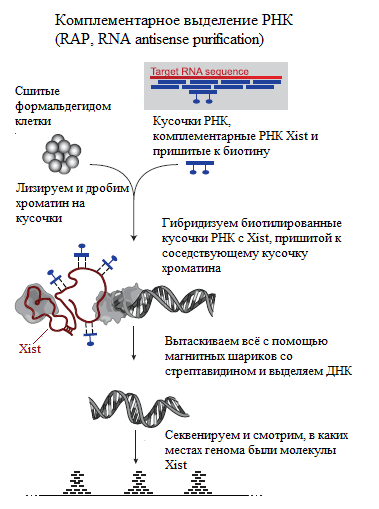
Рисунок 4. Как узнать, в каких местах генома находятся транскрипты Xist? Схема метода RAP.
Вокруг хромосомы за шесть часов
Используя этот метод, исследователи сначала решили посмотреть, в каких местах Х-хромосомы оказывается Xist, когда хромосома инактивируется. Что же оказалось? Во-первых: Xist физически распределена по всей Х-хромосоме, кроме генов, работающих при её инактивации. Во-вторых, в участках нахождения Xist есть следы работы белкового комплекса, который, как мы знаем, Xist «подтаскивает» за собой для выключения генов: по-особому метилированые гистоны.
Каким же путём РНК распределяется по хромосоме? Чтобы ответить на этот вопрос, сначала учёные гибридизовали изучаемую РНК в клетках с комплементарной молекулой РНК, содержащей флуоресцентную метку. При введении в клетку такой флуоресцентно меченной РНК две молекулы комплементарно спариваются, и на фотографии, сделанной на конфокальном микроскопе, светится только то место в клетке, где находится изучаемый транскрипт. И вот как молекулы РНК Xist «разбегаются» по хромосоме через некоторое время после начала транскрипции (рис. 5а): через час мы видим группу молекул в области гена Xist, через три часа молекулы оказываются распределены уже по большей площади Х-хромосомы, и, наконец, через шесть часов они окутывают хромосому почти целиком. Причём, как выяснилось посредством метода RAP, через какое-то время после начала транскрипции большая часть молекул Xist сосредотачивается в определённых местах хромосомы, накапливаясь там перед тем, как уже оттуда распространиться по всей хромосоме (рис. 5б).
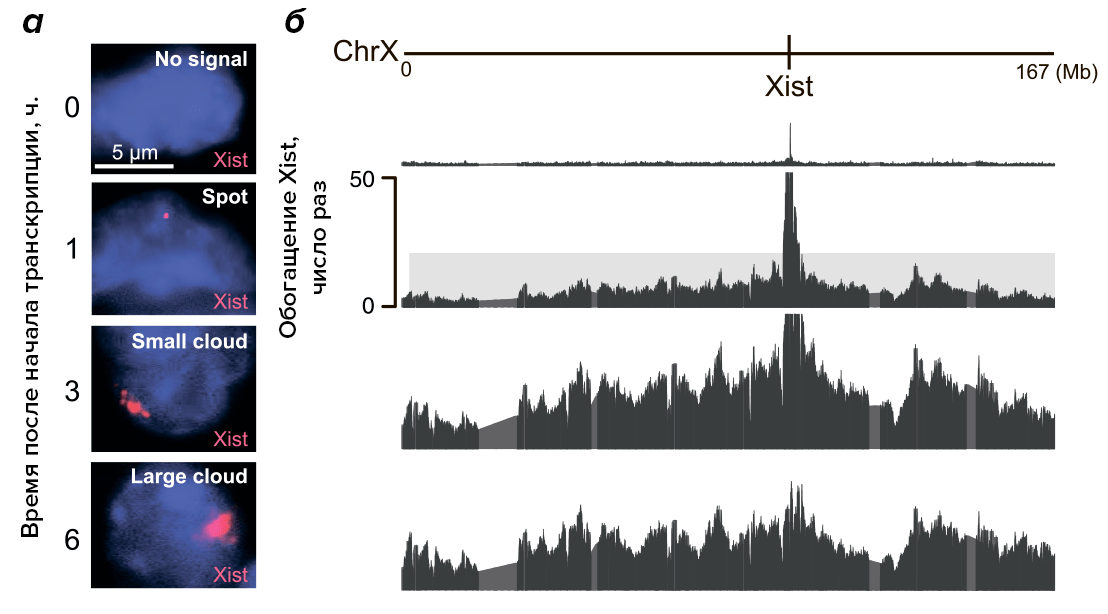
Рисунок 5. Распространение Xist по ДНК. а — Наблюдение за распространением молекул Xist методом флуоресцентной гибридизации (приведены четыре момента времени после начала транскрипции). Синим покрашена ДНК, розовым светятся места локализации Xist. б — Обогащение молекулами Xist разных участков Х-хромосомы через разное время после начала транскрипции этой РНК. Высота пика на каждом участке соответствует степени обогащения. Выделяющиеся на общем фоне пики повыше — это места, где Xist обнаруживается сначала.
Почему же Xist оказывается сначала именно в этих местах, а не где-то ещё? Тут есть две логические возможности: или в этих местах есть молекулы, взаимодействующие с Xist и «собирающие» туда РНК, или Xist оказывается в этих местах потому, что они очень близко расположены к её гену, и, распространяясь от места своей транскрипции, Xist в первую очередь в эти места и попадает. Эти две гипотезы и проверяли ученые.
Сначала они сравнили места раннего местонахождения Xist и опубликованные последовательности ДНК использованных в эксперименте клеток: а не выделяются ли эти места какой-нибудь особенной последовательностью, которая представлена в основном в них и могла бы прямо или через другие молекулы взаимодействовать с Xist? Нет, увы, таких мест не нашлось.
Тогда взялись за проверку второй гипотезы. Для этого использовали опубликованные данные, полученные с помощью продвинутой версии метода фиксации конформации хромосом (Chromosome Conformation Capture, сокращённо 3C) — Hi-C, который позволяет смотреть, с какой частотой небольшие участки ДНК располагаются в ядре близко друг к другу и, упрощённо говоря, восстановить по этим частотам трёхмерную хромосомную «карту». Оказалось, что частоты встречаемости РНК Xist на участках ДНК, удалённых от места её транскрипции, сильно коррелируют с частотами контактов этих участков с участком транскрипции Xist по данным Hi-C (рис. 6а). Вероятно, РНК Xist сначала сосредотачивается недалеко от места своей транскрипции (рис. 6б). Чтобы окончательно убедиться в этом, исследователи вставили ген Xist в другое место хромосомы. И через какое-то время после начала транскрипции РНК Xist снова оказалась в местах недалеко от своего нового участка транскрипции: вторая гипотеза оказалась верна.
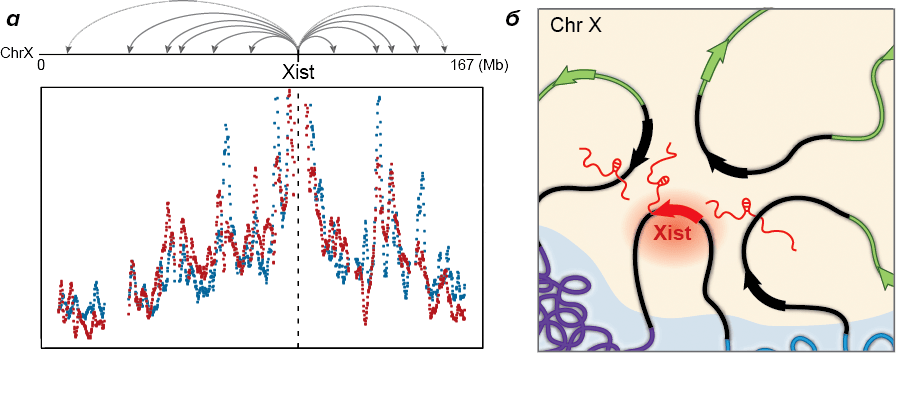
Рисунок 6. Локализация транскриптов Xist на X-хромосоме. а — Частоты ранней локализации транскриптов Xist на участках X-хромосомы (показаны красным) коррелируют с частотами контактов участков X-хромосомы с геном Xist по данным модифицированного метода 3C (показаны синим). б — Молекулы Xist от места своей транскрипции сначала распространяются к ближайшим в пространстве участкам.
Пропуск в зону активных генов
Но при сравнении частот локализации Xist на разных участках ДНК с данными Hi-С выяснилась одна вещь: в участках Х-хромосомы с активно работающими генами молекул Xist сначала было меньше, чем можно было бы предположить по данным Hi-С, но потом РНК добиралась и в эти места. То есть что-то в этих активно транскрибируемых участках поначалу отталкивало Xist, но потом она пробиралась и в них. Ученые предположили, что дело тут именно в домене РНК, которым она взаимодействует с PRC2. Они вырезали этот домен из гена Xist и посмотрели: будет ли РНК, неспособная взаимодействовать с белками-выключателями, также пробираться в активные генные районы? Оказалось, что нет, не будет, а будет только подбираться к ним и располагаться вокруг (рис. 7). Таким образом, способность Xist распространяться к активным генам зависит от её способности эти гены выключать.

Рисунок 7. РНК Xist дикого типа (WT Xist, слева), имеющая специальный участок для взаимодействия с PRC2, может распространяться в зону активных генов, а РНК Xist без этого участка (ΔA Xist, справа) — не может.
Собирая всё воедино...
На основе результатов этих экспериментов можно представить себе распространение Xist по хромосоме следующим образом (рис. 8). Давайте схематично представим себе клеточное ядро и Х-хромосому в нём. Вот РНК начинает «исследовать» структуру хромосомы, распространяясь от места транскрипции (вероятно, через взаимодействие с белками ядерного матрикса). Поначалу её молекулы накапливаются в ближайших участках с активными генами, а потом выключают гены, вместе с белковыми комплексами модифицируя структуру хроматина в зоне досягаемости и «подсворачивая» хромосому. После компактизации и выключения ближайших активных генов (чёрные на рисунке) другие активные гены (зелёные на рисунке) оказываются физически ближе к месту транскрипции Xist, чем были до этого, и молекулы РНК могут от места транскрипции добраться уже и до них и окончательно «свернуть» и «выключить» хромосому.
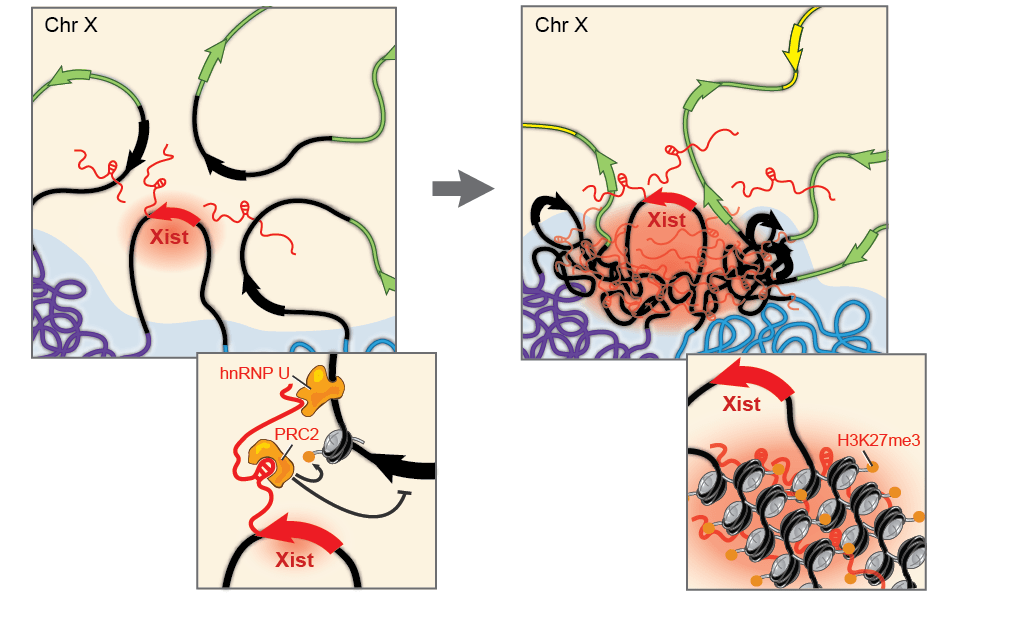
Рисунок 8. Предложенная учеными модель распространения Xist по Х-хромосоме и постепенного выключения этой хромосомы. Пояснения в тексте. hnRNP U внизу слева — белок ядерного матрикса. H3K27me3 внизу справа —метильные группы, которые пришивает к гистонам PRC2.
Каков же, спросите вы, механизм распространения РНК от места транскрипции: диффундируют ли молекулы Xist на какое-то расстояние, или хромосома сама по себе очень динамична, и недалёкие от транскрипционного локуса Xist активные гены иногда оказываются совсем близко к локусу? Этого мы пока не знаем. Не знаем мы и того, добираются ли к генам-мишеням другие известные нам некодирующие РНК так же, как это делает Xist [19]. Но с сегодняшним арсеналом доступных методов и возрастающим интересом учёных к некодирующим РНК узнаем, наверное, уже совсем скоро.
Литература
- J. M. Engreitz, A. Pandya-Jones, P. McDonel, A. Shishkin, K. Sirokman, et. al.. (2013). The Xist lncRNA Exploits Three-Dimensional Genome Architecture to Spread Across the X Chromosome. Science. 341, 1237973-1237973;
- Karen Ng, Dieter Pullirsch, Martin Leeb, Anton Wutz. (2007). Xist and the order of silencing. EMBO Rep. 8, 34-39;
- Carolyn J. Brown, Andrea Ballabio, James L. Rupert, Ronald G. Lafreniere, Markus Grompe, et. al.. (1991). A gene from the region of the human X inactivation centre is expressed exclusively from the inactive X chromosome. Nature. 349, 38-44;
- Carolyn J. Brown, Brian D. Hendrich, Jim L. Rupert, Ronald G. Lafrenière, Yigong Xing, et. al.. (1992). The human XIST gene: Analysis of a 17 kb inactive X-specific RNA that contains conserved repeats and is highly localized within the nucleus. Cell. 71, 527-542;
- Neil Brockdorff, Alan Ashworth, Graham F. Kay, Veronica M. McCabe, Dominic P. Norris, et. al.. (1992). The product of the mouse Xist gene is a 15 kb inactive X-specific transcript containing no conserved ORF and located in the nucleus. Cell. 71, 515-526;
- Graeme D. Penny, Graham F. Kay, Steven A. Sheardown, Sohaila Rastan, Neil Brockdorff. (1996). Requirement for Xist in X chromosome inactivation. Nature. 379, 131-137;
- C. M. Clemson. (1996). XIST RNA paints the inactive X chromosome at interphase: evidence for a novel RNA involved in nuclear/chromosome structure. The Journal of Cell Biology. 132, 259-275;
- K. Plath. (2003). Role of Histone H3 Lysine 27 Methylation in X Inactivation. Science. 300, 131-135;
- Jose Silva, Winifred Mak, Ilona Zvetkova, Ruth Appanah, Tatyana B Nesterova, et. al.. (2003). Establishment of Histone H3 Methylation on the Inactive X Chromosome Requires Transient Recruitment of Eed-Enx1 Polycomb Group Complexes. Developmental Cell. 4, 481-495;
- J. Zhao, B. K. Sun, J. A. Erwin, J.-J. Song, J. T. Lee. (2008). Polycomb Proteins Targeted by a Short Repeat RNA to the Mouse X Chromosome. Science. 322, 750-756;
- Ruben Agrelo, Abdallah Souabni, Maria Novatchkova, Christian Haslinger, Martin Leeb, et. al.. (2009). SATB1 Defines the Developmental Context for Gene Silencing by Xist in Lymphoma and Embryonic Cells. Developmental Cell. 16, 507-516;
- D. Pullirsch, R. Hartel, H. Kishimoto, M. Leeb, G. Steiner, A. Wutz. (2010). The Trithorax group protein Ash2l and Saf-A are recruited to the inactive X chromosome at the onset of stable X inactivation. Development. 137, 935-943;
- Yuko Hasegawa, Neil Brockdorff, Shinji Kawano, Kimiko Tsutui, Ken Tsutui, Shinichi Nakagawa. (2010). The Matrix Protein hnRNP U Is Required for Chromosomal Localization of Xist RNA. Developmental Cell. 19, 469-476;
- A. Beletskii, Y.-K. Hong, J. Pehrson, M. Egholm, W. M. Strauss. (2001). PNA interference mapping demonstrates functional domains in the noncoding RNA Xist. Proceedings of the National Academy of Sciences. 98, 9215-9220;
- Anton Wutz, Theodore P. Rasmussen, Rudolf Jaenisch. (2002). Chromosomal silencing and localization are mediated by different domains of Xist RNA. Nat Genet. 30, 167-174;
- C. E. Senner, T. B. Nesterova, S. Norton, H. Dewchand, J. Godwin, et. al.. (2011). Disruption of a conserved region of Xist exon 1 impairs Xist RNA localisation and X-linked gene silencing during random and imprinted X chromosome inactivation. Development. 138, 1541-1550;
- J. T. Lee. (2012). Epigenetic Regulation by Long Noncoding RNAs. Science. 338, 1435-1439;
- Jun Jiang, Yuanchun Jing, Gregory J. Cost, Jen-Chieh Chiang, Heather J. Kolpa, et. al.. (2013). Translating dosage compensation to trisomy 21. Nature. 500, 296-300;
- A. Dimond, P. Fraser. (2013). Long Noncoding RNAs Xist in Three Dimensions. Science. 341, 720-721;
- Обо всех РНК на свете, больших и малых;
- РНК у истоков жизни?;
- Большие дела небольших молекул: как малые РНК дирижируют генами бактерий;
- Белки против РНК — кто первым придумал сплайсинг?;
- Как избавиться от РНК за несколько минут;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Код жизни: прочесть не значит понять;
- Важнейшие методы молекулярной биологии и генной инженерии;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники.