
Косметика и генетика: что общего?
26 февраля 2008
Косметика и генетика: что общего?
- 2421
- 2
- 5
Фрагмент обложки номера журнала «Косметика & медицина», в котором первоначально была опубликована эта статья
-
Автор
-
Редакторы
Косметическая промышленность, свободная от предубеждений, связанных с корректностью использования научных терминов, давно уже жонглирует такими словами, как «ДНК», «гены», «сигнальные молекулы», «генетический код» и другими. Однако тонкие механизмы генной регуляции — увы — ещё слишком плохо поняты даже на уровне экспериментов «в пробирке», не говоря уже о том, чтобы использоваться в реальных косметических препаратах, которыми будут пользоваться миллионы людей. В этой статье подобрано несколько примеров, иллюстрирующих всю сложность механизмов, участвующих в регуляции процессов жизнедеятельности.
Начнем с того, чем на самом деле следовало бы закончить эту статью: косметика, которая была бы в состоянии «разумно» влиять на генетические механизмы клеток кожи, пока еще так же далека от реального воплощения, как и генная терапия заболеваний. Конечно, прогресс в области молекулярной биологии очевиден, и ученые за последнее десятилетие продвинулись далеко вперед в плане понимания тончайших механизмов генной регуляции. Но каждый шаг вперед приоткрывает все новые горизонты, и становится понятно, что процесс познания бесконечен, как бесконечна сама природа.
Если отвлечься от философской лирики и, опираясь на уже имеющиеся факты, представить себе, насколько сложен механизм генного контроля, становится ясно, что во многих случаях мы все еще не можем осознанно в него вмешиваться. Но пока медицина делает первые робкие шаги в этом направлении, подстраховываясь и даже перестраховываясь, не скованная жёсткими законодательными рамками косметическая промышленность уже свободно жонглирует такими словами, как «ДНК», «гены», «сигнальные молекулы», «генетический код» и т. п.
Мое личное к этому отношение проистекает из базового биологического образования, которые, увы, накладывает отпечаток на мировоззрение и не позволяет присоединиться к всеобщей эйфории. Приведу всего несколько примеров — наглядных иллюстраций того, насколько сложен вопрос регуляции генной активности.
Фибробласт фибробласту рознь
В июле 2006 года в журнале PLoS Genetics были опубликованы результаты исследования, проведенного группой ученых с медицинского факультета Стэнфорда [1]. В качестве объекта изучения были взяты фибробласты — основные клетки соединительной ткани, у которых определяли активность 337 генов. Было изучено 47 популяций фибробластов с 43 участков тела (рис. 1). Оказалось, что гены проявляют себя по-разному в зависимости от локализации клеток в организме. Но если разница между фибробластом, находящимся в соединительнотканной перегородке альвеол в легких, и фибробластом кожи не вызывает удивления, то разница в генной активности между дермальными фибробластами, расположенными на разных участках (например, предплечье (синие кружки) и голень (бирюзовые кружки)), заставляет призадуматься. В свете этих исследований стоит по-новому взглянуть на проблему создания дерматотропных препаратов с сигнальной активностью для кожи на разных частях нашего тела.
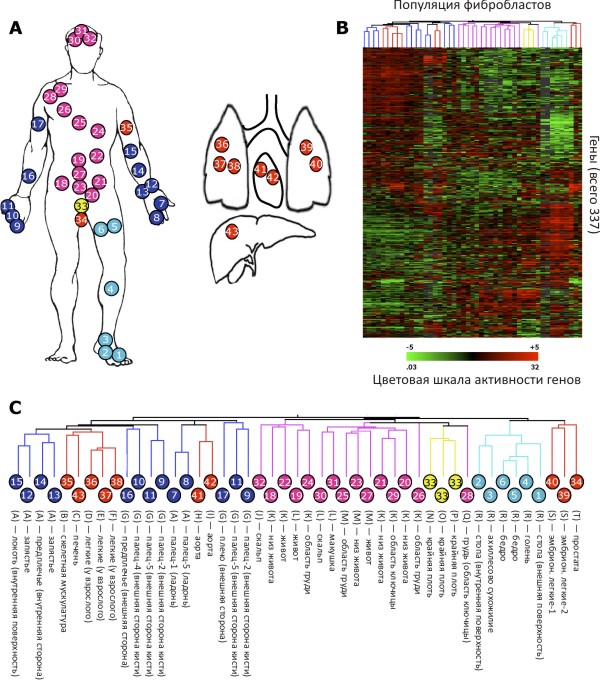
Рисунок 1. Различия в экспрессии генов у человеческих фибробластов. A — 47 первичных популяций фибробластов из 43 разных участков тела. Популяции пронумерованы, соответствующие номера стоят в кружочках разных цветов. Дермальные фибробласты: предплечье (синий), голень (бирюзовый), область живота, груди и лица (розовый), крайняя плоть (желтый); фибробласты внутренних органов (красный). Клетки получены из 20 аутопсийных (трупных) материалов (буква А) или из образцов тканей, удаленных в результате хирургического вмешательства (буквы В-Т). В — Разнообразие программ генной экспрессии в 47 популяциях фибробластов. Каждая строка представляет один ген, каждая колонка соответствует одной популяции фибробластов. Уровень экспрессии каждого гена отображен цветом относительно среднего уровня активности: зеленый — ниже среднего, красный — выше среднего, черный — средняя величина. С — Сходство между разными популяциями человеческих фибробластов. Популяции (кружочки с номерами), сходные с точки зрения экспрессии генов, образуют кластеры.
Регулировать регулирующих
Следующий пример говорит о том, что система генного контроля состоит из многих уровней. В этом плане представляют интерес ферменты из группы сиртуинов, которые осуществляют контроль над белками-регуляторами клеточной активности. Сиртуины — ферменты, найденные как в прокариотических (бактерии), так и эукариотических (животные, растения) клетках. Они влияют на жизнь клетки через экспрессию определенных генов. Например, сиртуин Sirt-1 регулирует транскрипцию генов, отвечающих за синтез следующих белков:
- FoxO1, Fox03 и Fox04 — факторы транскрипции генов, вовлеченных в механизмы клеточной защиты и метаболизм глюкозы;
- H3, H4 и H1 — белки-гистоны, необходимы для упаковки ДНК в хромосоме;
- Ku70 — фактор транскрипции, стимулирующий репарацию ДНК и повышающий жизнестойкость клеток;
- MyoD — фактор транскрипции, стимулирующий развитие мышечных клеток и восстановление ткани;
- NcoR — регулятор многих генов, в том числе и тех, которые вовлечены в жировой обмен, воспалительные процессы и в работу других регуляторов, таких, как белок PGC-1a;
- P300 — регулятор, отвечающий за адгезию ацетильных групп к гистонам;
- p53 — фактор транскрипции, инициирующий запрограммированную смерть поврежденной клетки;
- PGC-1a — белок-регулятор, контролирующий клеточное дыхание и, по всей видимости, играющий определенную роль в развитии мускулатуры;
- NF-κB — фактор транскрипции, контролирующий воспалительный процесс и выживание растущих клеток.
«Регуляторы регуляторов» — сиртуины, — по всей вероятности, способны контролировать возрастные патологические процессы, такие, как старение, ожирение, метаболический синдром, диабет II типа, болезнь Паркинсона. В норме активность сиртуинов ингибируется никотинамидом (производным витамина В3), известным также как ниацин. Лекарства, которые конкурируют с никотинамидом за место связывания с рецептором, активируют сиртуины. Известно, что подобным свойством обладает резвератрол, обнаруженный в красном вине [2]. Однако его содержание в вине намного ниже, чем терапевтическая доза, необходимая для активации сиртуинов. Так что использование резвератрола в составе этого замечательного природного источника с целью влияния на сиртуины, к сожалению, к желаемому эффекту не приведёт. Сегодня в ряде лабораторий мира ведется разработка лекарственных агентов и препаратов, которые специфически блокируют место связывания никотинамида с рецептором и тем самым повышают активность сиртуинов. Возможно, действующие подобным образом вещества окажутся полезными в лечении дегенеративных заболеваний, таких, как диабет, атеросклероз и подагра [3]. Не исключено, что в будущем будут созданы и дерматотропные препараты, селективно влияющие на активность сиртуинов в клетках кожи.
Проблема питания
Еще один вопрос, который активно дискутируется в последнее время, касается питания кожи. Следует иметь в виду, что все, что мы «впускаем» в наш организм вместе с пищей, может повлиять на активность генов и направить её в ту или иную сторону. Вещества, всосавшиеся через стенку кишечника в кровь, проходят через «фильтр» — печень, — затем разносятся по всему телу, выходят из кровеносного русла в межклеточную жидкость и только потом добираются до клеток. Эти вещества могут быть для клетки энергетическим и/или метаболическим субстратом. Первые представляют собой «топливо», которое «сжигается» в клеточных «печах» — митохондриях — и снабжает клетку энергией. Вторые являются строительным материалом, из которого клетка строит необходимые ей структуры. Но есть еще одна категория веществ — это так называемые сигнальные молекулы, роль которых заключается в том, чтобы передать клетке команду к дальнейшим действиям. Некоторые из этих соединений реализуют свой сигнал на уровне генов, активируя или же, напротив, ингибируя их экспрессию.
Конечно, питание клеток кожи происходит так же, как и питание других клеток организма, т. е. через кровь. Однако вещества, нанесенные на кожу в составе дерматотропных средств и прошедшие через барьерные структуры рогового слоя, могут добраться до живых клеток и попасть внутрь. И здесь очень важно знать, как они поведут себя в клетке. Хрестоматийным стал пример аскорбиновой кислоты (витамин С), которая активирует гены фибробластов, отвечающие за синтез коллагена типов I и III [4]. Очень важным является вопрос дозировок, как, например, в случае с ретинолом (витамин А), который регулирует гены, отвечающие на пролиферацию и дифференцировку кератиноцитов. Проникновение в клетку токсичных веществ, напротив, может негативно сказываться на работе отлаженного механизма генной регуляции, и тогда клетка погибает или перерождается в злокачественную [5].
Эти и другие примеры подводят нас к тому, чтобы пересмотреть отношение к косметическим средствам, обозначаемым как «питательные».
Что же касается влияния пищи на гены, то серьезно об этом заговорили не так давно. Ученые связывают с этим направлением большие надежды. Очень вероятно, что в будущем составление индивидуального пищевого рациона с целью коррекции механизмов генной регуляции станет частью генной терапии ряда заболеваний [6]. Однако это тема для отдельного разговора.
Приведенные примеры — лишь отдельные фрагменты, но и по ним можно представить, насколько на самом деле сложна проблема генной регуляции. Работа в этой области активно ведется во многих лабораториях мира. С каждым годом инструменты и методы исследований становятся все более совершенными и точными, и это расширяет возможности молекулярных биологов и генетиков в плане познания жизни клеток [7]. Не исключено, что уже через несколько лет станет возможным разработка дерматотропных средств, которые реально смогут работать на уровне генетического аппарата, а именно аккуратно и осмысленно вмешиваться в тонкие процессы регуляции клеточной жизнедеятельности и направлять их в нужную сторону. Если это случится, то тогда с полным правом можно будет говорить о новом поколении косметических средств — клеточной косметике. Но будет ли это действительно КОСМЕТИКА в том смысле, в котором мы понимаем ее сегодня? Этот вопрос остается открытым.
Литература
- John L. Rinn, Chanda Bondre, Hayes B. Gladstone, Patrick O. Brown, Howard Y. Chang. (2006). Anatomic Demarcation by Positional Variation in Fibroblast Gene Expression Programs. PLoS Genet. 2, e119;
- M. STEFANI, M. A. MARKUS, R. C. Y. LIN, M. PINESE, I. W. DAWES, B. J. MORRIS. (2007). The Effect of Resveratrol on a Cell Model of Human Aging. Annals of the New York Academy of Sciences. 1114, 407-418;
- Andrew J. Olaharski, Jasper Rine, Brett L. Marshall, Joshua Babiarz, Luoping Zhang, et. al.. (2005). The Flavoring Agent Dihydrocoumarin Reverses Epigenetic Silencing and Inhibits Sirtuin Deacetylases. PLoS Genet. 1, e77;
- Shingo Tajima, Sheldon R. Pinnell. (1996). Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11, 250-253;
- Markus Waldecker, Tanja Kautenburger, Heike Daumann, Cordula Busch, Dieter Schrenk. (2008). Inhibition of histone-deacetylase activity by short-chain fatty acids and some polyphenol metabolites formed in the colon. The Journal of Nutritional Biochemistry. 19, 587-593;
- M MATTSON. (2007). WITHDRAWN: Dietary Factors, Hormesis and Health. Ageing Research Reviews;
- Holtz R. and Vitz W. (2006). DNA Microarray: application to personal health care and cosmetic industries. Cosmet. Sci. Tech..





