Левозакрученная: загадочная Z-ДНК
28 мая 2021
Левозакрученная: загадочная Z-ДНК
- 5568
- 0
- 4
Левозакрученная форма ДНК известна как Z-ДНК
-
Автор
-
Редактор
Темы
Когда-то давно мне пришла в голову идея научно-фантастического романа о жизни на далекой планете, генетический материал которой представлен не правозакрученной, а левозакрученной ДНК. Впрочем, сценарий не такой уж фантастический: левозакрученная ДНК, она же Z-ДНК, есть и в простых земных клетках, хотя функциональное ее предназначение остается малопонятным. Что мы знаем об этой таинственной форме ДНК? Что она делает в живых клетках? Ответам на эти и другие вопросы и посвящен наш обзор.
Слово «ДНК» почти у всех, кто учил в школе биологию, прочно ассоциируется с аккуратной спиральной молекулой, состоящей из двух цепей, закрученных вправо относительно друг друга. Этот образ уже стал элементом массовой культуры: его активно используют в кино и книгах, помещают на логотипы медицинских лабораторий и наклейки на пищевых продуктах, сообщающие, что они «не содержат ГМО» (правда, чаще всего создатели таких логотипов забывают, что ДНК не строго симметрична относительно вертикальной оси, в ней есть большие и малые бороздки). В течение многих лет ученые полагали, что, в отличие от более гибкой РНК, ДНК в клетках представлена исключительно в виде стабильной правозакрученной двойной спирали. Однако исследования последних лет показали, что ДНК не так предсказуема, как кажется. Конечно, по разнообразию возможных пространственных структур до РНК ей далеко, однако в клетке существуют и неканонические формы ДНК: G-квадруплексы, i-мотивы, трехцепочечная ДНК и ряд других элементов, по топологии отличающихся от классической правозакрученной спирали. А еще, как оказалось, двойная спираль ДНК может быть закручена не только вправо, но и влево! Такая левозакрученная ДНК называется Z-ДНК. Несмотря на то, что впервые возможность существования левозакрученной ДНК показали еще в 1979 году [1], Z-ДНК до сих пор окутана ореолом тайны. Так что же мы знаем об этой таинственной форме ДНК?
Если вы откроете любой учебник по молекулярной биологии, то на первых его страницах наверняка увидите что-то вроде изображенного на рисунке 1:
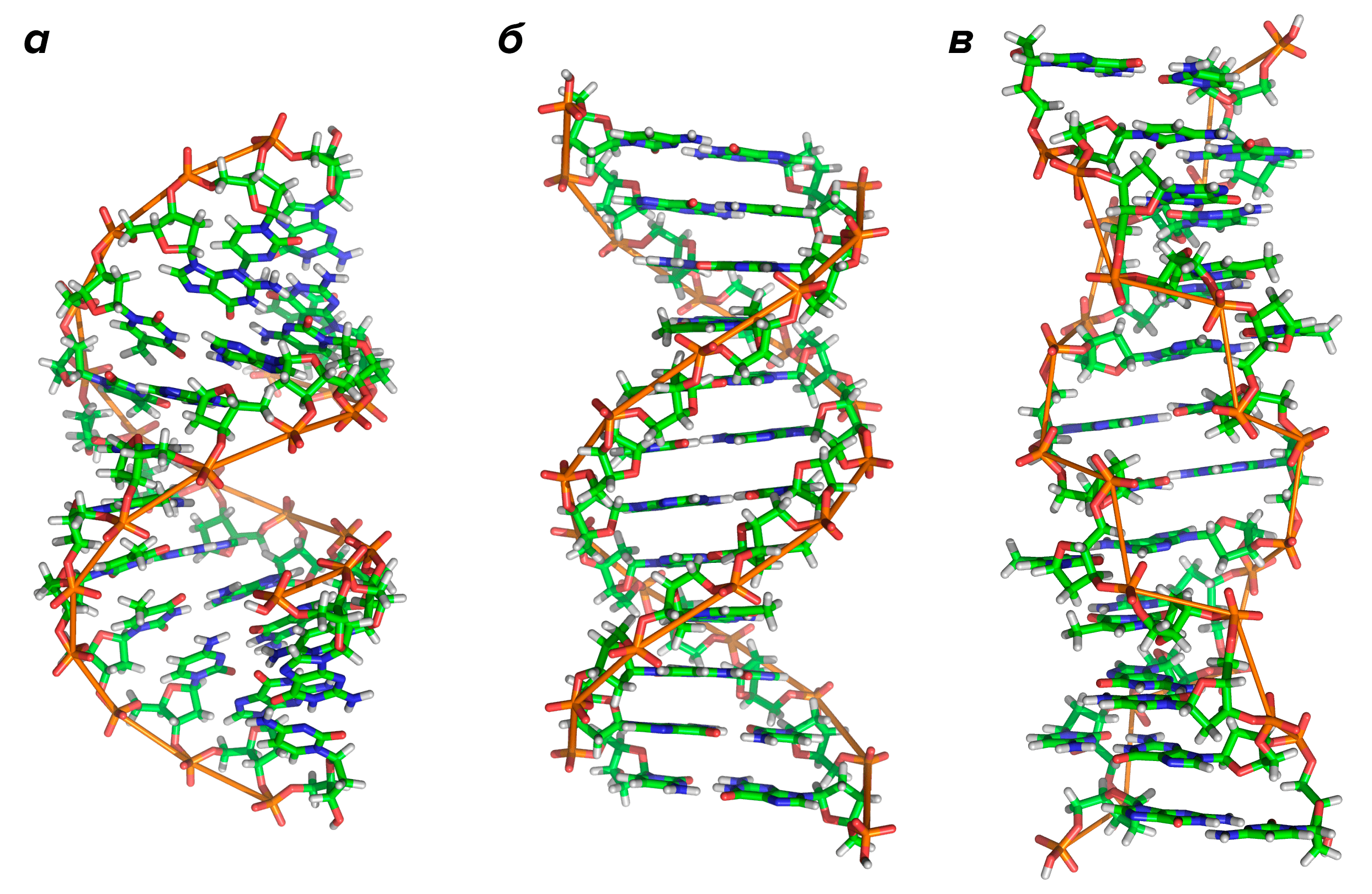
Рисунок 1. Три основные формы ДНК. а — A-ДНК; б — B-ДНК; в — Z-ДНК.
На этой схеме отображены три основные формы ДНК: A-форма, B-форма, которую мы обычно и имеем в виду, говоря о ДНК, и Z-форма — та самая левозакрученная ДНК. Эти формы отличаются друг от друга по множеству геометрических параметров, дотошно измеренных специалистами по кристаллографии и круговому дихроизму (значения этих параметров читатель легко найдет в «Википедии») .
О рентгеноструктурном анализе и других методах структурной биологии вы можете прочитать в нашей статье «12 методов в картинках: структурная биология» [2].
Основные различия между формами таковы: A- и B-ДНК закручены вправо, а Z-ДНК — влево; A-ДНК более «сплющена» по сравнению с B-ДНК, а азотистые основания в ней не перпендикулярны оси спирали, как в B-ДНК. Преобладающая форма, которой и представлен генетический материал живой клетки — B-ДНК, хотя две другие формы, по последним представлениям, также биологически активны. A-форму ДНК получила и описала сама Розалинд Франклин в 1953 году, которая показала, что ДНК переходит в A-форму при дегидратации [3]. В таких условиях геномная ДНК некоторых особо живучих бактерий переходит в A-форму, чтобы хоть как-то сохранить генетическую информацию. Кроме того, в A-форме находится ДНК некоторых вирусов гипертермофильных архей, когда упакована в вирион [4].
Z-ДНК была открыта позже A-ДНК и гораздо заметнее отличается от канонической B-формы. Ее впервые описала команда ученых под руководством Роберта Уэлса в 1970 году, когда исследовала полимер, состоящий из повторов инозин—цитозин [5]. Помимо левозакрученности, Z-ДНК отличается также расположением азотистых оснований: в B-форме они находятся в анти-конформации, а в Z-ДНК одно из комплементарных оснований находится в син-конформации, а другое — в анти- (рис. 2).
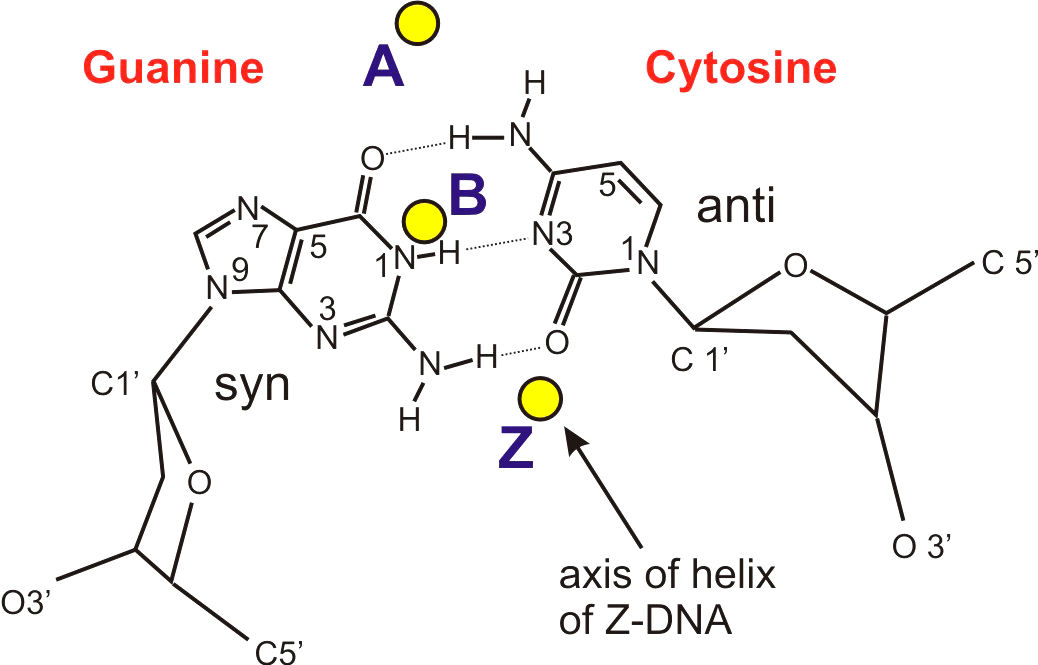
Рисунок 2. Строение одной пары оснований G:C в составе Z-ДНК. Стрелка указывает на место прохождения оси спирали.
За счет этого Z-ДНК выглядит более вытянутой, чем B-ДНК, поскольку расстояние между соседними парами оснований в ней больше, а сахарофосфатный остов по своей конформации напоминает зигзаг. Наконец, стоит отметить, что в Z-ДНК нет большой бороздки [1] (рис. 3).
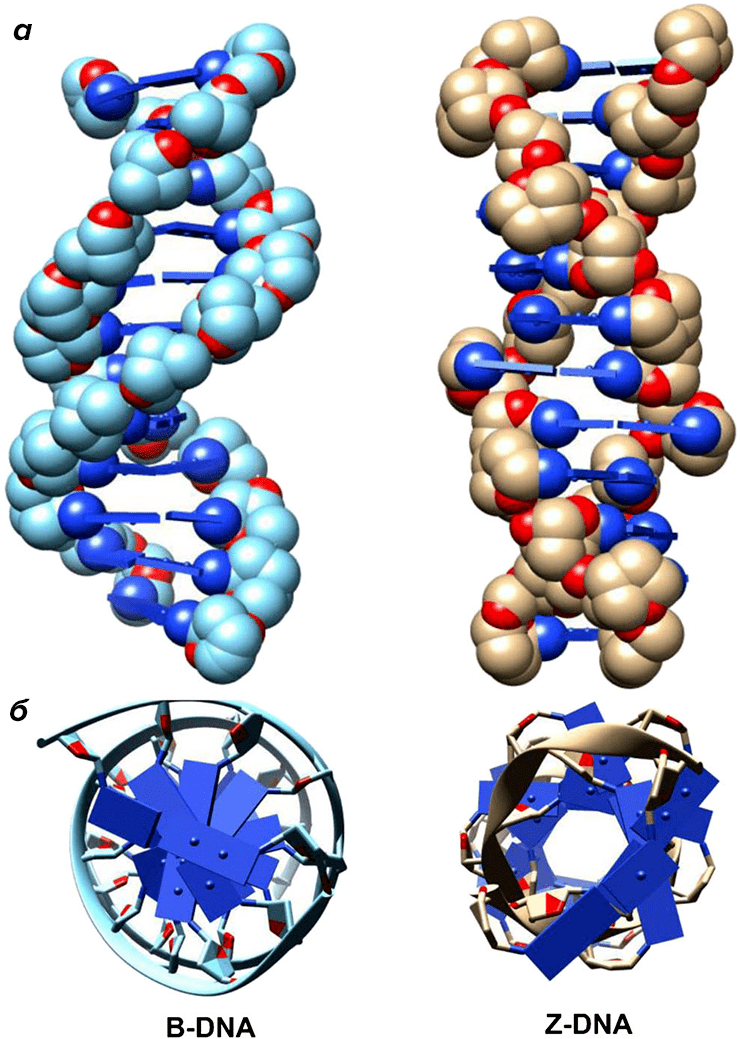
Рисунок 3. Сравнение B- и Z-ДНК. а — вид сбоку; б — вид сверху.
В отличие от B- и A-форм, которые может принимать ДНК любой нуклеотидной последовательности, Z-ДНК может сформироваться только там, где наблюдается чередование пуринов и пиримидинов. Наибольшая вероятность формирования Z-формы характерна для участков ДНК, состоящих из повторов вида GC, а в области повторов CA и TA существенно ниже. Первоначальные опыты по получению Z-формы ДНК в пробирке проводили в условиях очень высоких концентраций NaCl. Впоследствии оказалось, что искусственно вызвать формирование Z-ДНК можно, добавив в пробирку к B-ДНК комплексные соединения рутения, спермин, спермидин и некоторые другие вещества [1].
Но может ли Z-ДНК сформироваться в реальных физиологических условиях живой клетки? В 1983 году появилось сообщение, что левозакрученная ДНК присутствует в политенных хромосомах [6]. Кроме того, ранние эксперименты с плазмидной ДНК показали, что формированию Z-ДНК способствует их отрицательная суперскрученность, следовательно, для формирования Z-ДНК не обязательны запредельные концентрации хлорида натрия или другие экзотические соединения: она может сформироваться и в условиях живой клетки. Также выяснили, что образование Z-ДНК стимулируют некоторые белки и модификации оснований. Z-ДНК также может появляться в ходе ремоделирования хроматина при участии комплексов SWI/SNF. Последующие исследования показали, что в тех местах геномной ДНК, где появляется Z-ДНК, на ее границе с обычной B-ДНК образуются неканонические структуры, известные как BZ-соединения (рис. 4). Дело в том, что переход правозакрученной ДНК в левозакрученную — дело энергозатратное и, по большому счету, для клетки невыгодное, и BZ-соединения необходимы для того, чтобы снимать торсионное напряжение в ДНК и тем самым стабилизировать Z-ДНК [1].
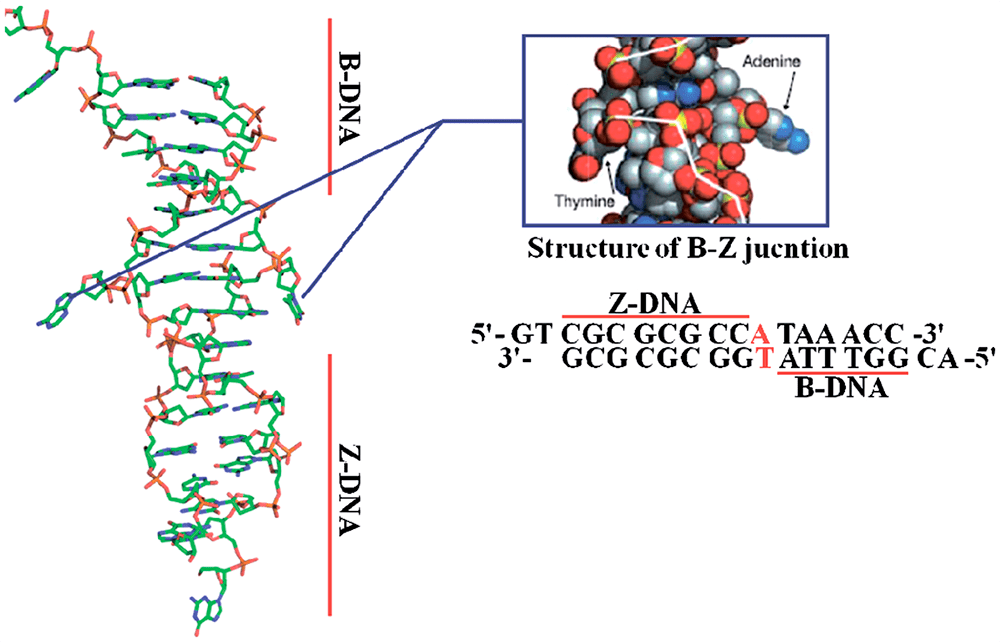
Рисунок 4. Структура BZ-соединения. Выпяченные основания на стыке двух конформаций вынесены в отдельное окно и покрашены красным.
Что же касается роли модификаций оснований в формировании Z-ДНК, то в условиях in vitro удалось показать, что метилирование цитозина и гуанина, а также дезаминирование аденина повышают стабильность Z-ДНК. Происходит ли так в реальной клетке — вопрос открытый. Есть наблюдение, что модификации гистонов также влияют на вероятность появления Z-формы ДНК, в частности, ацетилирование гистонов способствует переходу ДНК из B- в Z-форму [1].
Подробнее о модификациях гистонов и других эпигенетических модификациях вы можете прочитать в статьях нашего спецпроекта «Эпигенетика».
Еще один вопрос, не менее сложный и неоднозначный: что полезного Z-ДНК может делать в клетке? Самый очевидный ответ — она может выступать как физический барьер для белков, «ползающих» по ДНК, таких как ДНК- и РНК-полимеразы [1]. В действительности роль Z-ДНК в регуляции транскрипции оказалась не такой однозначной. В одном исследовании 2016 года с помощью иммунопреципитации хроматина с использованием антител к Z-ДНК в геноме человека удалось выявить 191 сайт, склонный к переходу в левозакрученную ДНК [1]. Оказалось, что большинство из этих сайтов находится в промоторах, где Z-ДНК может нивелировать отрицательные супервитки, которые накапливаются позади движущейся по ДНК полимеразы или при освобождении ДНК от нуклеосом. Например, для транскрипции гена, кодирующего колониестимулирующий фактор 1, Z-ДНК строго необходима в области промотора. Кроме того, поскольку Z-ДНК не взаимодействует с нуклеосомами, она остается свободным участком в промоторе, с которым могут связываться транскрипционные факторы. В то же время в случае гена, кодирующего ядрышковый белок нуклеолин, ситуация обратная: появление Z-ДНК в промоторе подавляет экспрессию. Но, пожалуй, наиболее странное наблюдение относительно функций Z-ДНК касается белка E3L вируса коровьей оспы, который летален для мышей. Если E3L успешно связывает Z-ДНК, инфекция идет полным ходом и мышь погибает; если связывание заблокировать, то мышь выздоравливает [7].
Стоит отметить, что исследования биологических функций Z-ДНК ведутся не очень активно, а некоторые ученые даже считают, что мы переоцениваем биологическое значение левозакрученной ДНК [8]. Работа с Z-ДНК вообще непроста ввиду ее нестабильности в физиологических условиях. В 2019 году китайские ученые предложили, как можно получить Z-ДНК, стабильную в реальных условиях организма. Если взять две замкнутые в кольцо цепи ДНК, комплементарные друг другу, и произвести их гибридизацию в присутствии 0,5 мМ хлорида магния, то получается химерное ZB-кольцо, часть которого будет представлена Z-ДНК, стабильной при физиологических условиях (рис. 5) [9].
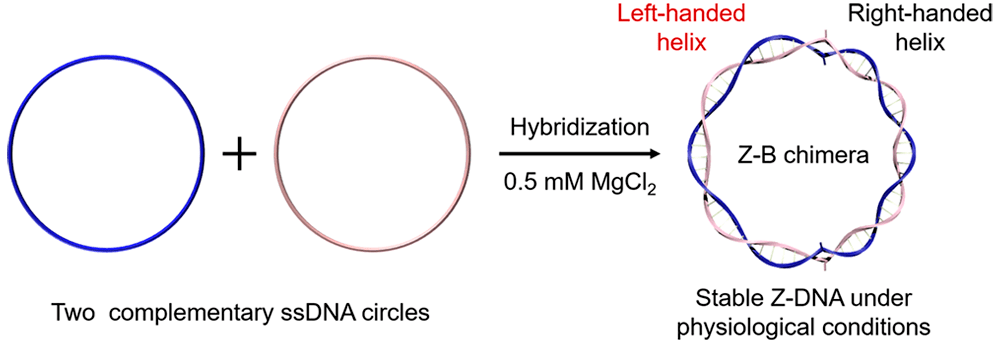
Рисунок 5. Схема получения Z-ДНК, стабильной в клеточных условиях. Две кольцевые комплементарные цепи ДНК гибридизуют в присутствии 0,5 мМ хлорида магния, в результате чего получается химерное двухцепочечное кольцо, одна часть которого закручена вправо, а другая — влево.
Еще один механизм формирования Z-ДНК связан с участием белков из группы Z-ДНК-связывающих белков (ZBP). К ним относятся, например, белок E3L вируса коровьей оспы и PKR-подобная протеинкиназа некоторых рыб. У млекопитающих идентифицированы два белка из группы ZBP: аденозиндезаминаза ADAR1 и ДНК-зависимый активатор факторов, регулируемых INF (DAI, также известен как ZBP1). ZBP отличает наличие консервативного домена, связывающего Z-ДНК (его обозначают Zα). Этот домен связывает Z-ДНК чисто за счет конформационного сродства, никаких специфических контактов между основаниями и аминокислотными остатками при этом не образуется. Оба ZBP млекопитающих активируются интерфероном, что указывает на их роль в иммунном ответе против чужеродной ДНК [1]. Как показали недавние исследования, некоторые биологические функции Z-ДНК тесно связаны с ZBP. Например, в 2020 году в Nature появилось сообщение, что распознавание эндогенных Z-нуклеиновых кислот (то есть не только Z-ДНК, но и Z-РНК) белком DAI при помощи Zα-домена запускает некроптоз и воспаление, что может лежать в основе хронических воспалительных заболеваний [10]. Еще одно исследование показало, что митохондриальная ДНК, сильно поврежденная в результате окислительного стресса, может выходить в цитоплазму, где связывается с белком DAI и активирует воспаление. Таким образом, Z-ДНК задействована в регуляции интерферонового ответа [11].
Как мы уже упоминали, в клетке присутствует не только левозакрученная ДНК, но и левозакрученная РНК (Z-РНК). Ее открыли в 1984 году, показав, что последовательность рибонуклеотидов вида поли-GC переходит в левозакрученную форму в условиях высокой ионной силы и при температуре выше 35 оС [12]. По своим структурным характеристикам Z-РНК близка к Z-ДНК [13]. Существование Z-РНК в живых клетках подтвердили с помощью окрашивания клеток протистов антителами к Z-РНК [14]. Как мы отмечали выше, Zα-домены белков семейства ZBP успешно распознают и Z-РНК тоже, что указывает на ее функциональную связь с белками ADAR1 и DAI [1].
Функциональная связь Z-ДНК с сигнальными путями интерферона свидетельствует, что Z-ДНК иметь отношение к развитию некоторых заболеваний, как минимум, воспалительного характера. Действительно, к настоящему моменту Z-ДНК уже смогли связать с рядом заболеваний человека. Сама по себе Z-ДНК иммунногенна, поэтому она может быть связана с развитием системной красной волчанки, болезни Крона, поликардионеврита и бокового амиотрофического склероза у пациентов, у которых спонтанно начинают образовываться антитела к Z-ДНК. Z-ДНК является фактором структурной нестабильности генома, поэтому она может лежать в основе онкологических заболеваний, особенно если геномные перестройки затрагивают такие гены, как BCL2, C-MYC и SCL. Z-ДНК может формироваться в области повторов CGG, связанных с синдромом ломкой X-хромосомы, и повторов GAC, которые связывают со скелетной дисплазией. Наконец, показано, что у пациентов с болезнью Альцгеймера в нейронах гиппокампа выявляется аномальное количество Z-ДНК, что связывает ее и с нейродегенеративными заболеваниями [1].
К сожалению, наши знания о биологии Z-ДНК и тем более Z-РНК весьма обрывочны и неполны. Остается надеяться, что новые исследования позволят нам узнать больше об этих таинственных молекулах. А может быть, когда-нибудь на полках магазинов появится научно-фантастический роман, посвященный жизни, основанной на левозакрученной ДНК...
Литература
- Subramaniyam Ravichandran, Vinod Kumar Subramani, Kyeong Kyu Kim. (2019). Z-DNA in the genome: from structure to disease. Biophys Rev. 11, 383-387;
- 12 методов в картинках: структурная биология;
- R. E. Franklin, R. G. Gosling. (1953). The structure of sodium thymonucleate fibres. I. The influence of water content. Acta Crystallogr. 6, 673-677;
- F. DiMaio, X. Yu, E. Rensen, M. Krupovic, D. Prangishvili, E. H. Egelman. (2015). A virus that infects a hyperthermophile encapsidates A-form DNA. Science. 348, 914-917;
- Y. MITSUI, R. LANGRIDGE, BARBARA E. SHORTLE, CHARLES R. CANTOR, ROBERT C. GRANT, et. al.. (1970). Physical and Enzymatic Studies on Poly d(I–C).Poly d(I–C), an Unusual Double-helical DNA. Nature. 228, 1166-1169;
- Michel Robert-Nicoud, Donna J. Arndt-Jovin, David A. Zarling, Thomas M. Jovin. (1983). LEFT-HANDED Z DNA IN POLYTENE CHROMOSOMES. Mobility and recognition in cell biology. 281-290;
- Sung Chul Ha, Ky Lowenhaupt, Alexander Rich, Yang-Gyun Kim, Kyeong Kyu Kim. (2005). Crystal structure of a junction between B-DNA and Z-DNA reveals two extruded bases. Nature. 437, 1183-1186;
- Alan Herbert. (2019). Z-DNA and Z-RNA in human disease. Commun Biol. 2;
- Yaping Zhang, Yixiao Cui, Ran An, Xingguo Liang, Qi Li, et. al.. (2019). Topologically Constrained Formation of Stable Z-DNA from Normal Sequence under Physiological Conditions. J. Am. Chem. Soc.. 141, 7758-7764;
- Huipeng Jiao, Laurens Wachsmuth, Snehlata Kumari, Robin Schwarzer, Juan Lin, et. al.. (2020). Z-nucleic-acid sensing triggers ZBP1-dependent necroptosis and inflammation. Nature. 580, 391-395;
- Bartosz Szczesny, Michela Marcatti, Akbar Ahmad, Mauro Montalbano, Attila Brunyánszki, et. al.. (2018). Mitochondrial DNA damage and subsequent activation of Z-DNA binding protein 1 links oxidative stress to inflammation in epithelial cells. Sci Rep. 8;
- Kathleen Hall, Phillip Cruz, Ignacio Tinoco, Thomas M. Jovin, Johan H. van de Sande. (1984). ‘Z-RNA’—a left-handed RNA double helix. Nature. 311, 584-586;
- M. Popenda. (2004). High salt solution structure of a left-handed RNA double helix. Nucleic Acids Research. 32, 4044-4054;
- D. A. Zarling, C. J. Calhoun, C. C. Hardin, A. H. Zarling. (1987). Cytoplasmic Z-RNA.. Proceedings of the National Academy of Sciences. 84, 6117-6121;
- Doyoun Kim, Sanjith Reddy, Dong Young Kim, Alexander Rich, Sangho Lee, et. al.. (2009). Base extrusion is found at helical junctions between right- and left-handed forms of DNA and RNA. Nucleic Acids Research. 37, 4353-4359.