
Лимфома Беркитта: как вирус Эпштейна — Барр гены сближал
26 февраля 2024
Лимфома Беркитта: как вирус Эпштейна — Барр гены сближал
- 1206
- 0
- 8
Вирус Эпштейна — Барр сближает гены MYC и IGH в ядре B-лимфоцитов.
иллюстрация создана с помощью искуственного интеллекта Bing, дата обращения 23.11.2023
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Девять из десяти человек в мире заражены вирусом Эпштейна — Барр (EBV). Этот вирус может никак не проявить себя в течение всей жизни, а может вызывать рост злокачественной опухоли. Одной из таких опухолей, связанных с EBV, является лимфома Беркитта — агрессивная опухоль из B-лимфоцитов. Она возникает в результате генетической перестройки, при которой участки двух разных хромосом по ошибке соединяются друг с другом. Подобные перестройки называют хромосомными транслокациями. В нашей недавней работе мы раскрыли, как EBV подталкивает B-лимфоциты к хромосомной транслокации, вызывающей лимфому Беркитта.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта статья участвовала в конкурсе «Био/Мол/Текст»-2023/2024 в номинации «Своя работа» и будет опубликована в журнале «Наука и жизнь».
Эта статья участвовала в конкурсе «Био/Мол/Текст»-2023/2024 в номинации «Своя работа» и будет опубликована в журнале «Наука и жизнь».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания «Хеликон»: — один из ведущих российских поставщиков продукции и услуг для молекулярно-биологических и клеточных лабораторий.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Современная планета Земля полна разных биологических систем, взаимодействие которых друг с другом и с окружающей средой определяет суть жизни. Но представьте, что вы родились в мире, где любой контакт с внешней средой может оказаться смертельно опасным. Такой была реальность для Дэвида Филлипа Веттера, рожденного в 1971 с тяжелым иммунодефицитом. Из-за генетической мутации, которая была раскрыта лишь спустя два десятилетия [1], у Дэвида полностью отсутствовали Т-лимфоциты и почти не работали В-лимфоциты — основные компоненты приобретенного иммунитета. Если коротко, то Т-лимфоциты отвечают клеточный компонент иммунитета: например, Т-киллеры могут распознавать и убивать клетки, зараженные вирусом; а В-лимфоциты составляют основу гуморального иммунитета — они производят антитела. С таким серьезным нарушением иммунной системы младенец был чрезвычайно уязвим для любых инфекций, что делало обычную жизнь невозможной. Опасаясь за жизнь Дэвида, родители вместе с врачами приняли трудное решение поместить его в стерильный пластиковый пузырь, чтобы защитить от опасных патогенов [2]. За уникальные условия жизни Дэвида прозвали «мальчик в пузыре». В своей стерильной камере мальчик почти не контактировал с внешним миром: внутрь попадали только стерильные вещи (еда, вода, одежда, игрушки), к Дэвиду прикасались исключительно через пластиковые перчатки, торчащие из стенок камеры, а приборы, необходимые для обмена воздуха внутри, работали настолько громко, что с мальчиком было трудно общаться. Заточение и постоянная угроза инфекций психологически тяжело сказывались на Дэвиде и его семье [3], и врачи неустанно искали способы лечения. В 1983 году, когда Дэвиду исполнилось 12 лет, врачи решили провести ему трансплантацию костного мозга — пересадку здоровых предшественников клеток крови — в попытке восстановить иммунитет. Донором стала старшая сестра Дэвида. Из-за неполной совместимости между ними врачи боялись острой реакции «трансплантата против хозяина», когда пересаженные чужие иммунные клетки начинают атаковать ткани нового хозяина. Несмотря на это, вначале после пересадки все шло хорошо [4]. Но примерно через 100 дней после пересадки у Дэвида развилась лихорадка, появились сильные боли в животе и кровавый стул. Врачи предположили, что в организме Дэвида все-таки начала развиваться реакция «трансплантата против хозяина», но лечение препаратами, подавляющими иммунную систему, не помогало [2]. Дэвид скончался на 124-й день после пересадки в возрасте 12 лет. Окончательный диагноз удалось установить только после вскрытия. При посмертном анализе нашли многочисленные опухоли из В-лимфоцитов, разбросанные по всему кишечнику и проникающие в соседние органы. В клетках этих В-лимфоцитов был обнаружен вирус Эпштейна — Барр (Epstein–Barr virus, EBV) [5]. Именно бесконтрольно делящиеся и вероятно злокачественные В-лимфоциты, содержащие EBV, стали причиной смерти Дэвида.
Кто этот вирус? EBV — это герпесвирус, который заражает В-лимфоциты и клетки эпителия [6]. При некоторых (до сих пор малопонятных) обстоятельствах зараженные клетки могут становиться опухолевыми, давая начало EBV-ассоциированным B-клеточным лимфомам (опухоли из B-лимфоцитов) и карциномам (опухоли из клеток эпителия). EBV — это опасный онкогенный вирус: почти 2% всех случаев смерти от злокачественных опухолей в мире связаны с инфекцией EBV [7]. Касается ли это вас, читатель? По разным оценкам, если вам до 5 лет, то с вероятностью 70% у вас будет EBV, если вам до 15 лет, вероятность возрастает до 80%, ну а если вы взрослый, то в 90-95% случаев вы заражены EBV [8], [9]. Так что вполне возможно, что и вы, дорогой читатель, когда-то заразились и теперь живете с EBV. Как это могло произойти? Дело в том, что первичная инфекция EBV обычно случается в детстве и проходит незаметно, не вызывая явных симптомов. Более взрослые люди могут заметить, что заразились EBV: у них острая инфекция часто осложняется лихорадкой, воспалением лимфоузлов, болями в горле, мышцах и слабостью. Такая острая инфекция EBV называется инфекционный мононуклеоз или «болезнь поцелуев», так как чаще всего вирус передается от человека к человеку через слюну. Мононуклеоз получил свое название из-за характерной картины мазка крови, в котором обнаруживается большое количество клеток, напоминающих моноциты, еще один тип иммунных клеток крови (рис. 1). Впоследствии стало ясно, что эти клетки на самом деле не моноциты, и даже не зараженные B-лимфоциты, a нетипичные T-лимфоциты — армия иммунитета, вышедшая на борьбу с EBV [10].
Активность первичной инфекции постепенно затухает, и инфекция EBV переходит в стадию хронической, избавиться от которой невозможно. Повторюсь, что примерно 90% взрослых людей являются пожизненными носителями вируса. Вирус находится в ядре B-лимфоцитов в виде отдельной кольцевой двухцепочечной ДНК, с которой могут считываться вирусные РНК; эти РНК, в свою очередь, служат матрицей для синтеза вирусных белков (здесь все работает как обычно, так же как у хозяина: ДНК → РНК → белок). EBV может проявлять себя в двух принципиально разных формах. В большинстве случаев у здоровых людей вирус существует в В-лимфоцитах в «спящей» форме, известной как латентность (или латентная инфекция). При латентной инфекции вирусная ДНК производит небольшое количество вирусных РНК и белков, но не производит новых вирусных частиц, а копирование (репликация) вирусной ДНК случается только при делении клетки, чтобы передать копии вирусного генома дочерним клеткам. Если совсем все усложнить, латентности тоже делятся на несколько форм (0, 1, 2, 3), где от латентности 0 до латентности 3 возрастает количество производимых вирусных белков. Именно в латентной форме 0 EBV прячется от иммунной системы в зараженных B-лимфоцитах, так как из-за малого количества вирусных продуктов, эти клетки не отличимы для иммунной системы от обычных B-лимфоцитов.
Жизненные факторы, такие как стресс, ухудшение иммунитета, воспаление или прием определенных препаратов, могут инициировать переход латентной инфекции в активную стадию: с вирусной ДНК начинает синтезироваться много вирусных РНК и белков, вирусная ДНК интенсивно копируется, и зараженная клетка начинает собирать множество вирусных частиц. Вновь образованные вирусные частицы высвобождаются из зараженной клетки, вызывая ее разрыв (или лизис), и заражают другие клетки, продолжая цикл инфекции. Такая форма инфекции EBV называется литический цикл (или еще реактивация). Зачастую все же реактивация EBV не доходит до настоящего литического цикла с разрывом клетки, полной вирусных частиц, а ограничивается синтезом белков литического цикла в больших количествах (так называемый абортивный литический цикл).
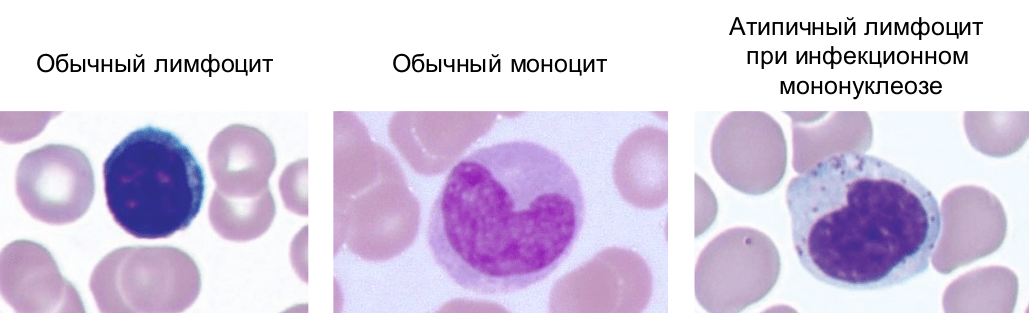
Рисунок 1. Мазки периферической крови, окрашенные по Райту.
Итак, что же случилось с Дэвидом? Трансплантация внесла в ослабленный организм Дэвида EBV, который был в клетках костного мозга его сестры [5]. На фоне отсутствия иммунитета EBV быстро захватил B-лимфоциты Дэвида и вызвал их бесконтрольное деление (пролиферацию). Почему же так произошло? Это состояние известно как пост-трансплантационное лимфопролиферативное расстройство [11]. После любой пересадки врачи подавляют иммунитет у пациента, чтобы избежать отторжения новых тканей или органов, у Дэвида и вовсе иммунитет почти отсутствовал. Иммунитет засыпает, просыпается EBV. Точнее, вирус изменяет форму латентности с полностью спящей (латентность 0) на чуть более оживленную, с синтезом ряда вирусных белков, стимулирующих деление B-лимфоцитов (латентность 3). В норме у здоровых людей синтез этих вирусных белков приводит к тому, что делящиеся B-лимфоциты быстро оказываются видны иммунной системе и становятся мишенью Т-киллеров. При иммунной супрессии этого не происходит, и B-лимфоциты продолжают делиться. Стоит отметить, что вначале ДНК таких B-лимфоцитов не изменяется, поэтому строго говоря они не являются опухолевыми клетками, а это состояние называется не лимфомой, а лимфопролиферативным расстройством. Из-за этой особенности EBV даже используется в лабораториях для создания «бессмертных» делящихся B-лимфоцитов in vitro, то есть «в пробирках». Предположительно, в случае Дэвида часть EBV-зараженных B-лимфоцитов могли стать более злокачественной лимфомой. Об этом свидетельствует обнаружение двух отдельных опухолей в легком и кишечнике. Каждая из этих опухолей состояла из клонов одного B-лимфоцита, в котором произошли изменения в регионе ДНК, кодирующем антитела (локус иммуноглобулинов) [5]. История Дэвида привлекла широкое внимание к изучению роли EBV в возникновении опухолей.
Несмотря на то, что механизмы, благодаря которым EBV стимулирует деление B-лимфоцитов, во многом изучены, как инфекция EBV приводит к изменению ДНК и возникновению лимфом у людей без серьезной иммунной супрессии остается во многом непонятным. Почти все В-клеточные лимфомы имеют характерные перестановки с вовлечением участков ДНК, в которых зашифрованы антитела. К примеру, лимфома Беркитта, которая является одной из наиболее агрессивных B-клеточных лимфом и тесно связана с EBV, характеризуется хромосомной транслокацией между хромосомой 8 и 14 (обозначается это так — t(8;14)) (рис. 2а) [12]. Хромосомные транслокации — это тип хромосомных перестроек, при котором происходит перенос участка с одной хромосомы на другую хромосому. Хромосомная транслокация t(8;14) приводит к тому, что ген MYC, расположенный на хромосоме 8, перемещается на хромосому 14, в область, где расположены гены, кодирующие иммуноглобулины (а именно, их тяжелую цепь, ImmunoGlobulin Heavy, IGH). Гены иммуноглобулинов высоко активны в В-лимфоцитах, они ответственны за синтез антител. Ген MYC контролирует деление клеток. Если этот ген слишком активен, клетка начинает делиться без контроля, поэтому MYC и подобные гены называют онкогенами. Как книга, которую достали из подсобки и поставили рядом с бестселлером, ген MYC после транслокации t(8;14) находится рядом с активным участком иммуноглобулинов и тоже начинает бурно считываться. Это приводит к тому, что клетка производит в больших количествах онкогенный белок Myc, который заставляет B-лимфоциты делиться. Это и становится отправной точкой злокачественной лимфомы Беркитта.
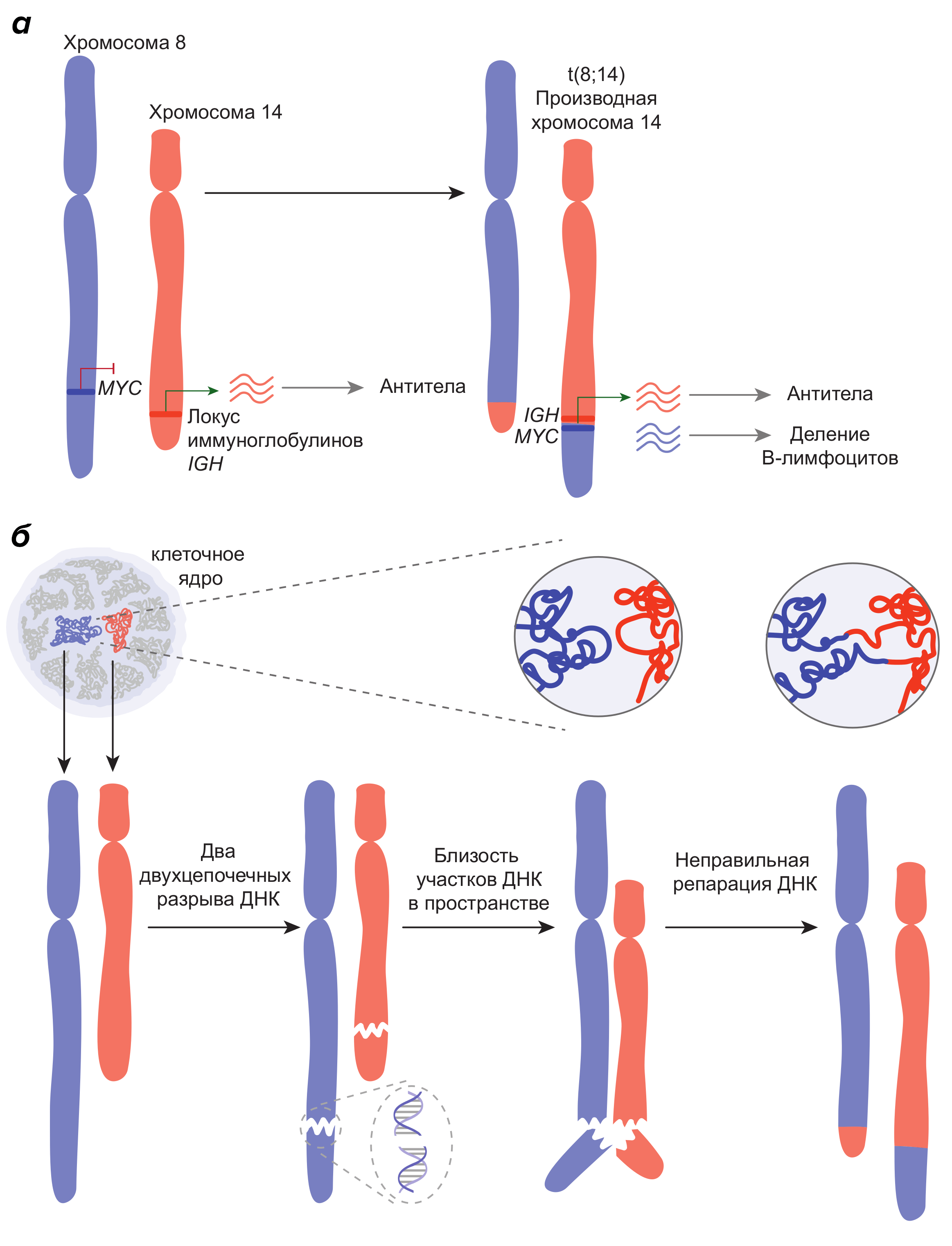
Рисунок 2. Хромосомные транслокации. (а) Хромосомная транслокация между хромосомой 8 и 14, характерная для лимфомы Беркитта, которая приводит к тому, что ген MYC, расположенный на хромосоме 8, перемещается на хромосому 14, в область, где расположены гены, кодирующие иммуноглобулины. (б) Механизм образования хромосомных транслокаций.
иллюстрация создана автором
EBV может стимулировать образование хромосомной транслокации t(8;14) в B-лимфоцитах, о чем говорит недавнее открытие нашей лабораторной группы под руководством Егора Васецкого в Институте Гюстава Русси (Франция) [13]. Но для начала разберемся, как возникают хромосомные транслокации. Представьте, что вы электрик, которого вызвали починить вдруг отключенное в доме электричество. Вы открываете главный электрический ящик с множеством одинаковых запутанных проводов и обнаруживаете два перерезанных провода. Если места разрыва проводов расположены далеко друг от друга, проблем нет — вы без труда определяете, как правильно соединить провода. Если же оба разрезанных провода оказались рядом, вам гораздо проще ошибиться и неправильно соединить один провод с другим, что может привести к непредвиденным последствиям. Поэтому для образования транслокации необходимо чтобы сошлись три фактора (рис. 2б) [14]. Во-первых, в клетке должны возникнуть минимум два двухцепочечных разрыва ДНК в двух участках на разных хромосомах. Двухцепочечный разрыв — это повреждение ДНК, при котором разрываются обе цепи двухцепочечной молекулы ДНК, что полностью разъединяет разорванные куски друг от друга. Во-вторых, разорванные концы ДНК разных хромосом должны быть близки друг к другу в пространстве клеточного ядра. И наконец, в-третьих, эти два двухцепочечных разрыва ДНК в двух участках на разных хромосомах должны быть неправильно соединены друг с другом в процессе репарации ДНК.
Такие двухцепочечные разрывы в ДНК могут возникать по разным причинам, как внешним, так и внутренним [14]. Внешние причины включают в себя воздействие ионизирующего излучения, химических веществ, вирусов. К внутренним причинам относятся, например, ошибки при удвоении ДНК или специальные ферменты, запрограммированные на разрыв ДНК. В случае B-лимфоцитов, двухцепочечные разрывы возникают естественно в процессе их развития. Дело в том, что для создания и созревания разнообразных антител необходимо, чтобы локус иммуноглобулинов (участок ДНК, кодирующий антитела) был порезан на разные фрагменты, которые будут затем соединены друг с другом. Локус иммуноглобулинов меняется под действием специальных клеточных ферментов, что приводит к возникновению двухцепочечных разрывов ДНК. Нередко, ферменты, режущие участок иммуноглобулинов, ошибаются и затрагивают и другие участки, например, участок MYC на другой хромосоме [15]. Это увеличивает риск хромосомной транслокации, так как возникает первый фактор — два разрыва ДНК. Тем не менее, как описано выше, для возникновения хромосомной транслокации необходим и второй фактор: разорванные участки разных хромосом должны быть пространственно близки друг к другу в ядре. В обычных B-лимфоцитах участки IGH и MYC (партнеры по транслокации при лимфоме Беркитта) расположены далеко друг от друга (рис. 3), что снижает риск транслокации [16].
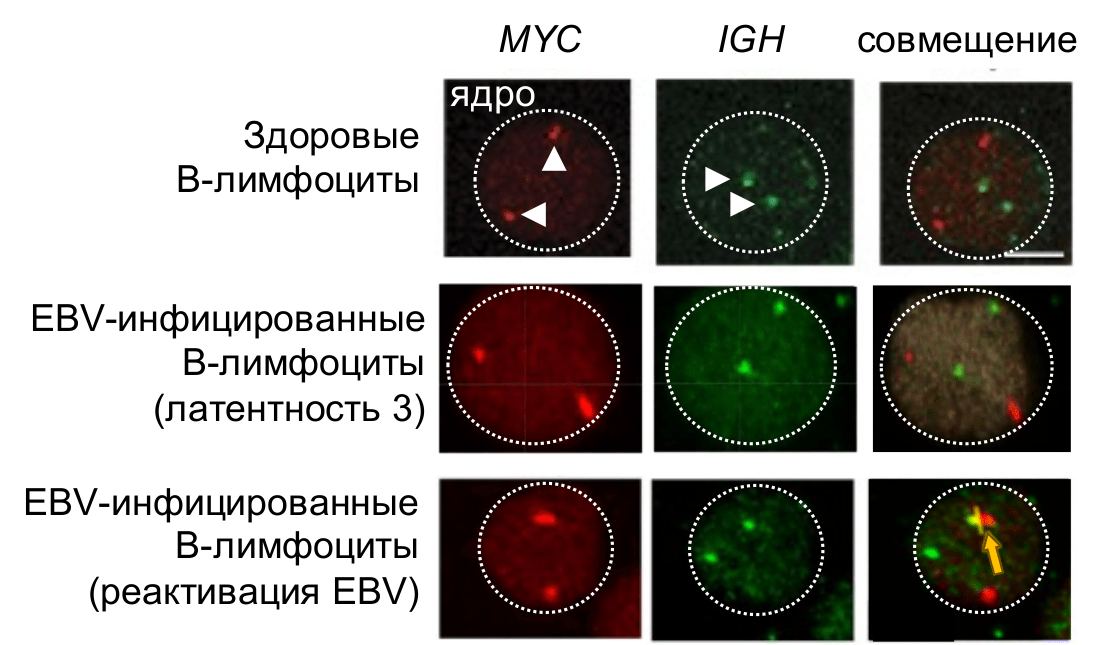
Рисунок 3. Расположение участков MYC (красный) и IGH (тяжелая цепь иммуноглобулинов, зеленый) в ядре В-лимфоцитов. Участки MYC и IGH помечены с помощью 3D-флуоресцентной гибридизации in situ (FISH). Белые стрелки указывают на участки MYC и IGH в В-лимфоцитах. Границы ядра обозначены белой пунктирной линией. Сближение участков MYC и IGH обозначено желтой стрелкой.
Влияет ли заражение B-лимфоцитов EBV на положение участков MYC и IGH относительно друг друга? Для ответа на этот вопрос мы применили метод 3D-флуоресцентной гибридизации in situ (FISH), позволяющий пометить определенные участки ДНК светящейся меткой и визуализировать их в ядре с точностью до 1 микрометра при помощи микроскопа. Причем мы использовали конфокальный микроскоп, работающий по принципу схожему с КТ или МРТ: мы делали несколько 2D изображений (оси x и y) последовательных срезов клетки по z-оси, которые далее объединяли в трехмерную картину клетки (оси x, y, z). Это позволило нам изучить расположение помеченных участков ДНК MYC и IGH в трехмерном пространстве ядра. Для анализа мы выбрали делящиеся B-лимфоциты с латентной инфекцией EBV (с латентностью 3, то есть похожие на те, которые возникают при посттрансплантационном лимфопролиферативном расстройстве). Оказалось, что и в этом случае положение участков не меняется: MYC и IGH все также далеко находятся друг от друга (рис. 3) [13]. Значит ли это, что инфекция EBV не влияет на риск неправильного соединения участков MYC и IGH при их разрыве? Латентная инфекция — не влияет. Но затем мы вспомнили, что в зараженных клетках может периодически происходить реактивация вируса, что сопровождается синтезом большого количества вирусных белков и может влиять на организацию ядра B-лимфоцитов. Мы решили проверить, изменяется ли положение участков MYC и IGH относительно друг друга при реактивации EBV. Мы нашли два способа реактивировать EBV в B-лимфоцитах с латентной инфекцией: ввести в клетки вирусный белок, который запускает литический цикл, или удалить с вирусной ДНК блокирующие (эпигенетические [18]) метки, что приводит к синтезу этого же самого белка и запуску литического цикла. И действительно, оказалось, что реактивация EBV приводит к сближению участков MYC и IGH в пространстве клеточного ядра (рис. 3) [13].
Однако достаточно ли этого сближения для увеличения риска неправильного соединения участков MYC и IGH при их разрыве и возникновения хромосомной транслокации? И как это можно проверить? Дело в том, что изучение хромосомных транслокаций в лабораторных условиях представляет собой сложную задачу. Спонтанные разрывы ДНК и внезапные хромосомные транслокации являются редкими событиями, которые трудно поймать в лабораторных условиях. Кроме того, точки разрыва в естественных транслокациях могут быть расположены в совершенно разных местах, что сильно затрудняет их поиск. Здесь нам на помощь приходит инструмент редактирования генома CRISPR/Cas9. Система CRISPR/Cas9 распознает определенную последовательность ДНК в клетке, и фермент Cas9 прицельно разрезает ДНК в этом месте (подробнее об этом можно прочитать, например, здесь [19]). Мы использовали разработанные в нашей лаборатории клетки, в которых можно по желанию «включить» синтез белка Cas9 и внести прицельные разрывы в участки MYC и IGH [20]. Это приводит к возникновению транслокации t(8;14). Используя эти клетки, мы исследовали, влияет ли реактивация EBV на частоту транслокаций t(8;14). Мы сначала реактивировали EBV, вызывая сближение участков MYC и IGH, а затем включали Cas9, вызывая двухцепочечные разрывы в участках MYC и IGH (рис. 4а). Наши результаты показали, что реактивация EBV значительно увеличивает уровень индуцированных транслокаций t(8;14) (рис. 4б). Это подтверждает, что реактивация EBV за счет сближения участков MYC и IGH может повышать риск возникновения хромосомной транслокации, и, соответственно, риск лимфомы.
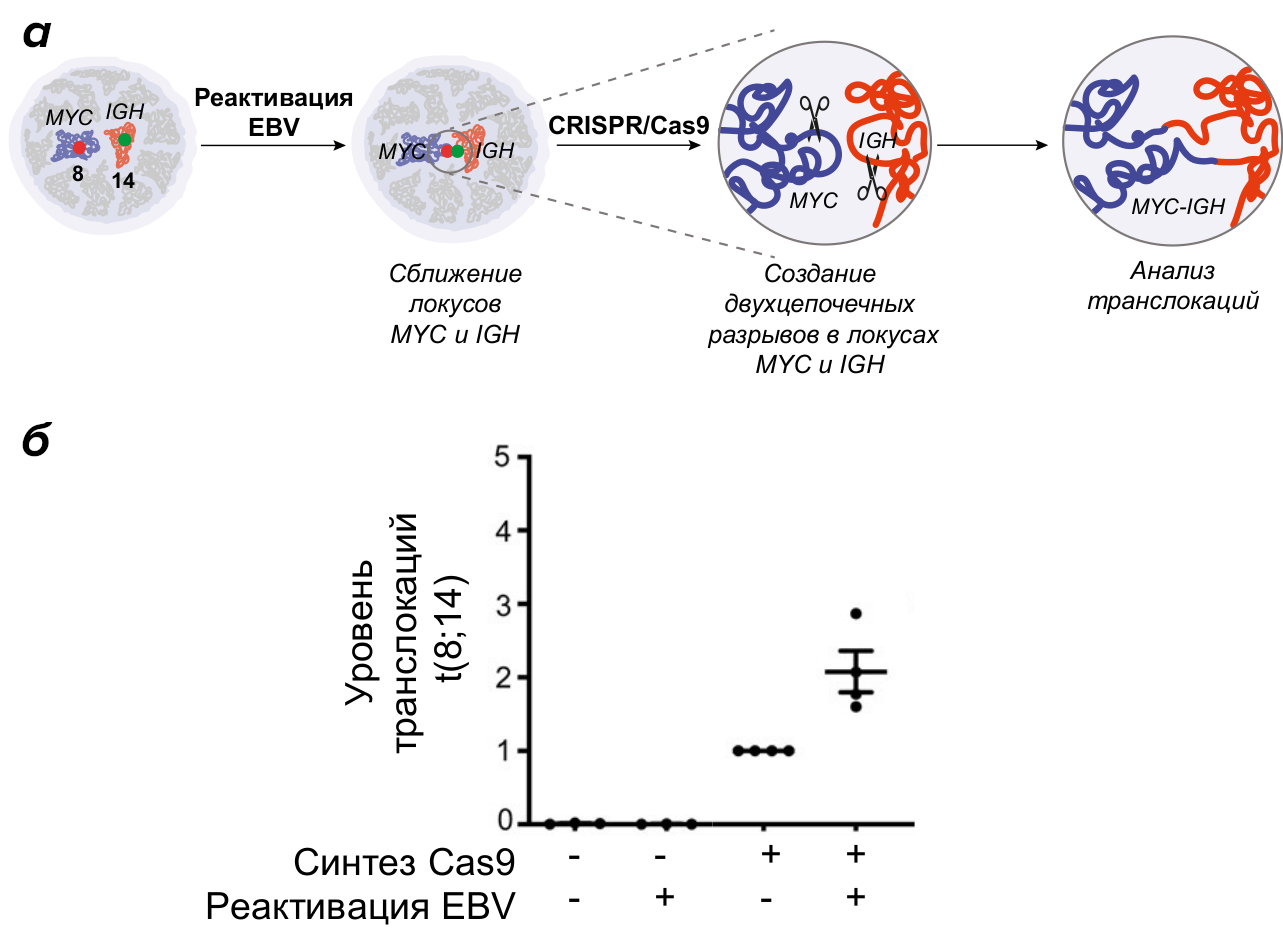
Рисунок 4. Реактивация EBV увеличивает частоту хромосомной транслокации t(8;14). (а) Схема эксперимента: мы сначала реактивировали EBV, вызывая сближение участков MYC и IGH, затем включали Cas9, вызывая двухцепочечные разрывы в участках MYC и IGH, и анализировали уровень транслокаций в популяции клеток. (б) Уровень хромосомных транслокаций в различных условиях: без (-) и с (+) предварительной реактивацией EBV; без (-) и с (+) включением синтеза фермента Cas9, вносящего разрывы в участки MYC и IGH. Каждая точка отражает независимый биологический повтор, горизонтальная линия указывает среднее значение, усы (工) указывают на стандартную ошибку среднего.
[13], с изменениями
И еще одно важное, заключительное доказательство нашей гипотезы мы нашли, когда обнаружили этот же феномен ex vivo, то есть на B-лимфоцитах крови, выделенных из живых пациентов. В частности, нам удалось получить образцы крови пациента, история которого походила на историю Дэвида. Это был пациент в возрасте 74 лет, который поступил в больницу через 4 месяца после пересадки почки в связи с ухудшением общего состояния, лихорадкой и увеличением лимфатических узлов. Донор почки был EBV-положительным, а реципиент (наш пациент 74 лет) в течение всей жизни до этого не заразился EBV. Как это бывает после пересадки, пациент принимал специальные лекарства, чтобы подавить иммунную систему. На фоне сниженного иммунитета у него развилась острая первичная инфекция EBV, а затем и реактивация EBV. Мы исследовали B-лимфоциты крови этого пациента и обнаружили, что в них по сравнению с B-лимфоцитами здоровых людей происходит сближение участков MYC и IGH, что совпадало с тем, что мы наблюдали ранее в линиях B-лимфоцитов in vitro (в пробирке) при реактивации EBV.
Ничего это, конечно, еще не доказывает, скажете вы, внимательный читатель. Как понять, что это сближение связано именно с реактивацией вируса? Увидеть реактивацию EBV нам помог метод иммунофлюоресцентного окрашивания. Метод основан на использовании светящихся антител, который специфично узнают какой-то определенный белок в клетке. Используя антитела, нацеленные против вирусного белка литического цикла, нам удалось пометить клетки, в которых происходит реактивация EBV. Оказалось, что сближение участков MYC и IGH наблюдалось не во всех B-лимфоцитах у пациента 74 лет, а именно в тех, в которых шел литический цикл EBV (рис. 5). Этот результат стал важным подтверждением нашей гипотезы о том, что реактивация EBV действительно сближает MYC и IGH в пространстве, способствуя таким образом возникновению транслокации t(8;14) и преобразованию обычных B-лимфоцитов в B-клеточную лимфому.
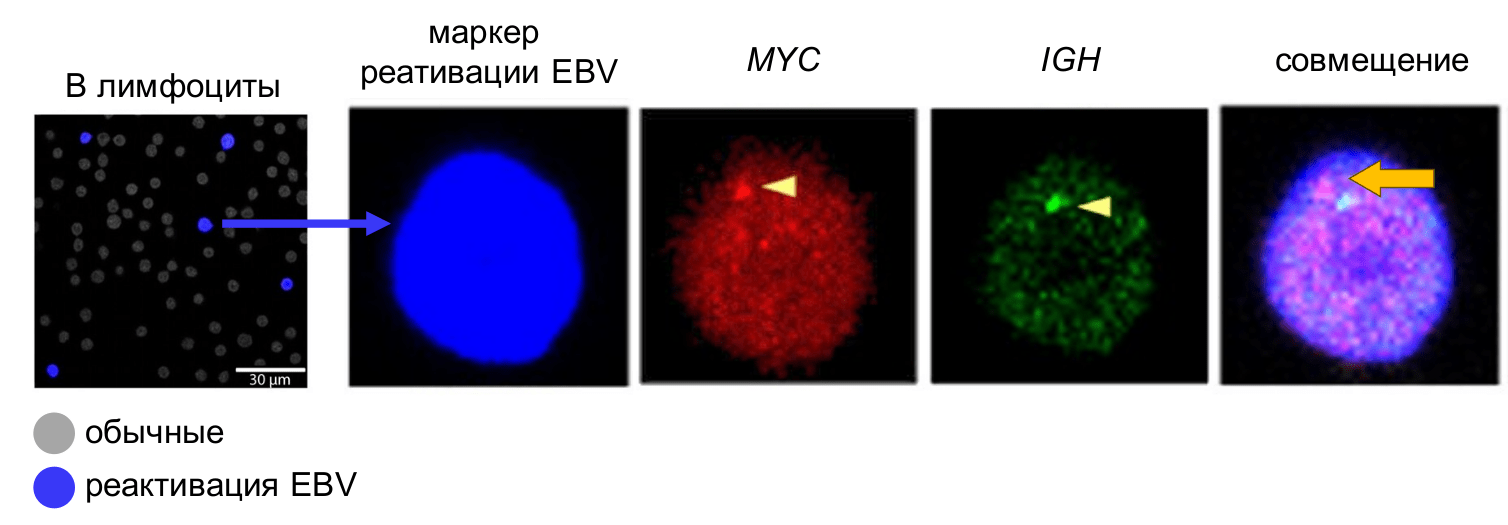
Рисунок 5. B-лимфоциты пациента 74 лет с первичной инфекцией EBV после пересадки почки. B-лимфоциты с реактивацией EBV помечены антителами против вирусного белка литического цикла (иммунофлуоресцентное окрашивание, синий). Участки MYC (красный) и IGH (зеленый) помечены с помощью 3D-флуоресцентной гибридизации in situ (FISH).
[13], с изменениями
Если подводить итог, в данном исследовании мы изучили влияние EBV на транслокацию MYC-IGH, которая является ключевым событием в развитии лимфомы Беркитта. Мы обнаружили, что процесс реактивации вируса из латентной инфекции сопровождается сближением участков MYC и IGH в пространстве клеточного ядра. Сближенные участки, при поломке и неправильном «ремонте», рискуют соединиться, что приводит к увеличению частоты хромосомной транслокаций MYC-IGH.
Благодарности. Автор благодарит Ивана Цимайло за полезные комментарии к статье.
Литература
- M Noguchi. (1993). Interleukin-2 receptor γ chain mutation results in X-linked severe combined immunodeficiency in humans. Cell. 73, 147-157;
- William T. Shearer, Carol Ann Demaret. (2014). David’s Story. Primary Immunodeficiency Disorders. 313-326;
- Raymond J. Lawrence. (1985). David the 'Bubble Boy' and the Boundaries of the Human. JAMA. 253, 74;
- Kathryn Simmons. (1983). 'Bubble boy' reacts well to marrow transplant. JAMA. 250, 2751;
- William T. Shearer, Jerome Ritz, Milton J. Finegold, I. Celine Guerra, Howard M. Rosenblatt, et. al.. (1985). Epstein–Barr Virus–Associated B-Cell Proliferations of Diverse Clonal Origins after Bone Marrow Transplantation in a 12-Year-Old Patient with Severe Combined Immunodeficiency. N Engl J Med. 312, 1151-1159;
- От поцелуя до лимфомы один вирус;
- Gulfaraz Khan, Muhammad Jawad Hashim. (2014). Global burden of deaths from Epstein-Barr virus attributable malignancies 1990-2010. Infect Agents Cancer. 9;
- Henry H. Balfour, Frangiscos Sifakis, Joseph A. Sliman, Jennifer A. Knight, David O. Schmeling, William Thomas. (2013). Age-Specific Prevalence of Epstein–Barr Virus Infection Among Individuals Aged 6–19 Years in the United States and Factors Affecting Its Acquisition. The Journal of Infectious Diseases. 208, 1286-1293;
- Ashvin Kuri, Benjamin Meir Jacobs, Nikki Vickaryous, Julia Pakpoor, Jaap Middeldorp, et. al.. (2020). Epidemiology of Epstein-Barr virus infection and infectious mononucleosis in the United Kingdom. BMC Public Health. 20;
- Henry M Feder, William N Rezuke. (2020). Infectious mononucleosis diagnosed by Downey cells: sometimes the old ways are better. The Lancet. 395, 225;
- Daan Dierickx, Thomas M. Habermann. (2018). Post-Transplantation Lymphoproliferative Disorders in Adults. N Engl J Med. 378, 549-562;
- Cristina López, Birgit Burkhardt, John K. C. Chan, Lorenzo Leoncini, Sam M. Mbulaiteye, et. al.. (2022). Burkitt lymphoma. Nat Rev Dis Primers. 8;
- Fatimata Bintou Sall, Anna Shmakova, Anna Karpukhina, Tatyana Tsfasman, Nikolai Lomov, et. al.. (2023). Epstein−Barr virus reactivation induces MYC‐IGH spatial proximity and t(8;14) in B cells. Journal of Medical Virology. 95;
- Reynand Jay Canoy, Anna Shmakova, Anna Karpukhina, Mikhail Shepelev, Diego Germini, Yegor Vassetzky. (2022). Factors That Affect the Formation of Chromosomal Translocations in Cells. Cancers. 14, 5110;
- Davide F. Robbiani, Anne Bothmer, Elsa Callen, Bernardo Reina-San-Martin, Yair Dorsett, et. al.. (2008). AID Is Required for the Chromosomal Breaks in c-myc that Lead to c-myc/IgH Translocations. Cell. 135, 1028-1038;
- D Germini, T Tsfasman, M Klibi, R El-Amine, A Pichugin, et. al.. (2017). HIV Tat induces a prolonged MYC relocalization next to IGH in circulating B-cells. Leukemia. 31, 2515-2522;
- Reynand Jay Canoy, Anna Shmakova, Anna Karpukhina, Nikolai Lomov, Eugenia Tiukacheva, et. al.. (2023). Specificity of cancer-related chromosomal translocations is linked to proximity after the DNA double-strand break and subsequent selection. NAR Cancer. 5;
- Наследование и эпигеном;
- Как CRISPR/Cas работает не по специальности;
- Anna Shmakova, Nikolai Lomov, Vladimir Viushkov, Tatyana Tsfasman, Yana Kozhevnikova, et. al.. (2023). Cell models with inducible oncogenic translocations allow to evaluate the potential of drugs to favor secondary translocations. Cancer Communications. 43, 154-158.







