Как CRISPR/Cas работает не по специальности
20 июля 2018
Как CRISPR/Cas работает не по специальности
- 2010
- 0
- 12
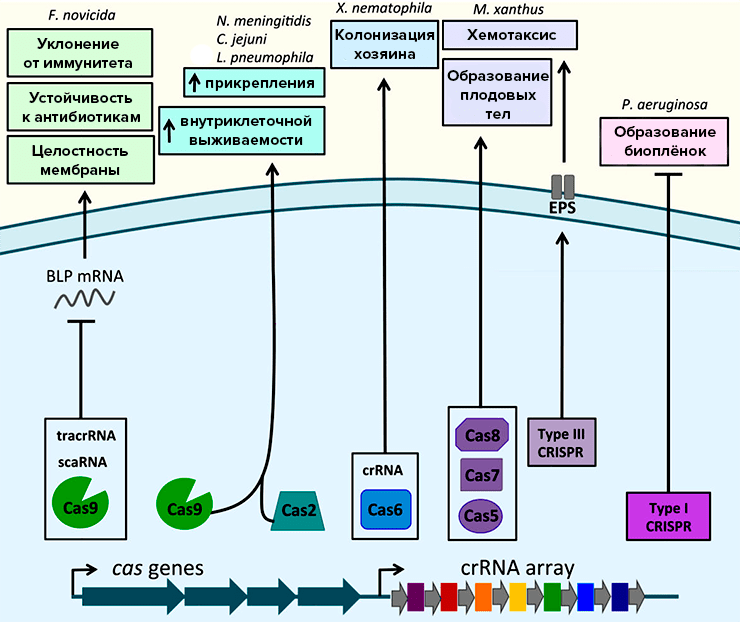
Некоторые примеры того, как CRISPR/Cas может влиять на множество процессов в бактериальной клетке: образование биопленок у Pseudomonas aeruginosa, хемотаксис и образование плодовых тел у Myxococcus xanthus, колонизацию тела хозяина у патогена нематод Xenorhabdus nematophila, выживание в организме хозяина у патогенных бактерий Neisseria meningitides, Campylobacter jejuni, Legionella pneumophila и Francisella novicida.
[9], рисунок адаптирован
-
Автор
-
Редактор
Как известно, система CRISPR/Cas служит мощнейшим средством защиты бактерий от мобильных генетических элементов (плазмид, транспозонов и, конечно, бактериофагов). За прошедшие несколько лет системы CRISPR/Cas обнаружены у большинства бактерий и архей. Однако накапливается все больше данных, свидетельствующих о том, что роль CRISPR/Cas не ограничивается адаптивным иммунитетом. Показано, что эти системы регулируют экспрессию многих бактериальных генов, влияя на вирулентность патогенных бактерий и групповое поведение, а также участвуют в репарации ДНК и ускоряют эволюцию геномов. Наш обзор посвящен неиммунным функциям систем CRISPR/Cas и их молекулярным механизмам.
Несмотря на то, что системы CRISPR/Cas открыты сравнительно недавно и изучены еще далеко не полностью, становится очевидным, что они принимают участие не только в обеспечении адаптивного иммунитета у бактерий и архей. Первые «звоночки» появились в 2009 году, когда установили, что один из типов системы CRISPR/Cas у кишечной палочки Esherichia coli эволюционирует во много раз медленнее, чем рабочий CRISPR/Cas, в который часто вставляются новые спейсеры [2]. Следовательно, эта система CRISPR/Cas служит для чего-то другого: если бы она была нефункциональным хламом, бактерии быстро избавились бы от нее как от ненужного груза. Более того, у некоторых видов бактерий CRISPR/Cas вообще перестают исполнять иммунную роль и занимаются совершенно другими делами. О них мы сейчас и поговорим.
Регуляция экспрессии генов бактерии
Чаще всего, помимо роли в адаптивном иммунитете, системы CRISPR/Cas участвуют в регуляции экспрессии генов. Примечательно, что, как правило, транскрипты CRISPR и белки Cas функционируют в этой роли независимо друг от друга, в то время как для адаптивного иммунитета необходима слаженная работа обоих компонентов [2].
Иногда CRISPR/Cas влияют на экспрессию генов, связанных с групповым поведением. Пожалуй, самым ярким примером такого влияния является Myxococcus xanthus — хищная почвенная бактерия, служащая модельным объектом для изучения образования плодовых тел и споруляции (рис. 2). Образование плодового тела — это многошаговый процесс, который запускается при нехватке питательных веществ. В ходе этого процесса отдельные клетки координированно движутся к одной точке и образуют скопление в виде холмика. Далее некоторые клетки превращаются в миксоспоры (этот процесс называется споруляцией), и холмик становится плодовым телом [3].
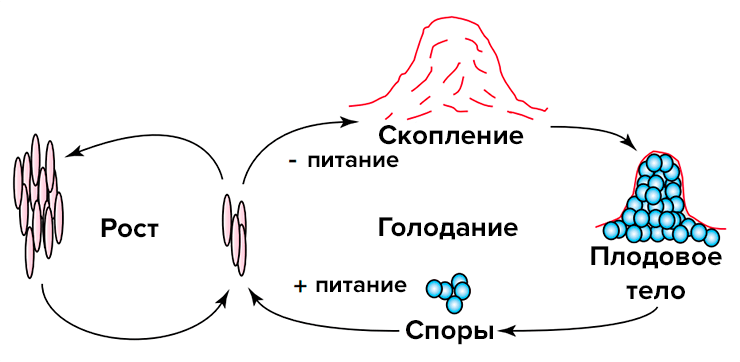
Рисунок 2. Жизненный цикл Myxococcus xanthus. При нехватке питательных веществ бактерии образуют скопления, которые превращаются в плодовые тела. Часть клеток при этом становится миксоспорами, которые покидают плодовое тело и прорастают в нормальных условиях. Рост бактерий продолжается до наступления недостатка пищи.
[3], рисунок адаптирован
Образование плодовых тел и споруляция жестко регулируются внешними сигналами, такими как чувство кворума (подробнее о котором можно почитать в статьях «Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение» [4] (у бактерий) и «„Бактериофаг-1 Бактериофагу-2, прием!“» [5] (у фагов)), и внутриклеточными сигнальными каскадами. Ключевую роль во внутриклеточной регуляции этих процессов играют два сигнала пептидной природы: А-сигнал и С-сигнал. А-сигнал представляет собой смесь аминокислот и пептидов, которые образуются при голодании, а С-сигнал — это вполне конкретный белок, который кодируется геном csgA. А-сигнал запускает экспрессию гена fruA, который кодирует важный регулятор образования плодового тела, а С-сигнал активирует этот белок. Кроме того, С-сигнал необходим для экспрессии генов cas: при нормальном росте, когда С-сигнал не синтезируется, белки Cas также не производятся. Некоторые Cas-белки непосредственно принимают участие в регуляции образования плодового тела и споруляции. Так, было показано, что отключение генов cas7 и cas5 приводит к значительному снижению споруляции. Более того, белки Cas выявляются только в клетках плодового тела, и даже периферические клетки лишены Cas. Один из белков Cas, Cas8c, запускает экспрессию fruA, продукт которого, FruA, связывается с регуляторными элементами генов cas, активируя их экспрессию; таким образом, здесь имеет место положительная обратная связь. Однако мы не знаем, участвует ли в регуляции спорообразования локус CRISPR [2].
CRISPR/Cas участвует в регуляции группового поведения (образования биопленок) у синегнойной палочки Pseudomonas aeruginosa. Бактерии, в ДНК которых вставлен геном фага DMS3, теряют способность к образованию биопленки, однако если у бактерий будут дополнительно отключены гены cas, то нормальный фенотип восстанавливается. Недавнее исследование показало, что для подавления группового поведения из всего генома DMS3 необходимы только протоспейсер (ген 42) и PAM [6]. Оказалось, что система CRISPR/Cas бактерий регулирует экспрессию этого гена 42 профага за счет связывания с его ДНК или мРНК частично комплементарной crРНК. Стоит отметить, что, если бы комплементарность была полной, то белки Cas внесли бы разрывы в ДНК профага, а следовательно, в геном бактерии (куда профаг встроен), что привело бы к гибели клетки. Непонятно, каким образом отключение гена 42 подавляет образование биопленок, так как удаление этого гена никак не сказалось на групповом поведении бактерий. Возможно, отключение гена 42 как-то влияет на экспрессию других 19 генов, входящих в состав его оперона, а они, в свою очередь, влияют на групповое поведение [2].
Штаммы Enterococcus faecalis, имеющие CRISPR/Cas, демонстрируют повышенную способность к формированию биопленок, благодаря чему быстрее колонизируют органы хозяина и быстрее приводят к его гибели [7].
У многих патогенных бактерий системы CRISPR/Cas влияют на вирулентность. Например, у патогена человека Campylobacter jejuni экспрессия белка Cas9 в клетках, лишенных локуса CRISPR, увеличивает вирулентность. Мутантные клетки, имеющие CRISPR, но лишенные Cas9, имеют пониженную цитотоксичность. Кроме того, в отсутствие Cas9 с поверхностью бактериальной клетки очень сильно связываются антитела. По всей видимости, Cas9 каким-то образом влияет на клеточные покровы [2].
У внутриклеточной паразитической бактерии Francisella novicida система CRISPR/Cas влияет на производство бактериального липопротеина (BLP) — поверхностного белка, вызывающего иммунный ответ хозяина. Собственно регуляцию осуществляет комплекс, состоящий из белка Cas9 и двух молекул РНК: трансактивирующей crРНК (tracrРНК) и малой CRISPR/Cas-ассоциированной РНК (scaРНК). Другие гены cas и локус CRISPR в этом процессе не участвуют. Комплекс, состоящий из Cas9, tracrРНК и scaРНК, связывается с транскриптом blp и каким-то образом вызывает его разрушение. Если транскрипт разрушается Cas9 (который, вообще-то, режет ДНК), то специфичность этого фермента находится под влиянием РНК, направляющих его к мишени. Возможно, комплекс привлекает к транскрипту РНКазы, однако никаких подтверждений в пользу этого сценария нет (рис. 3).
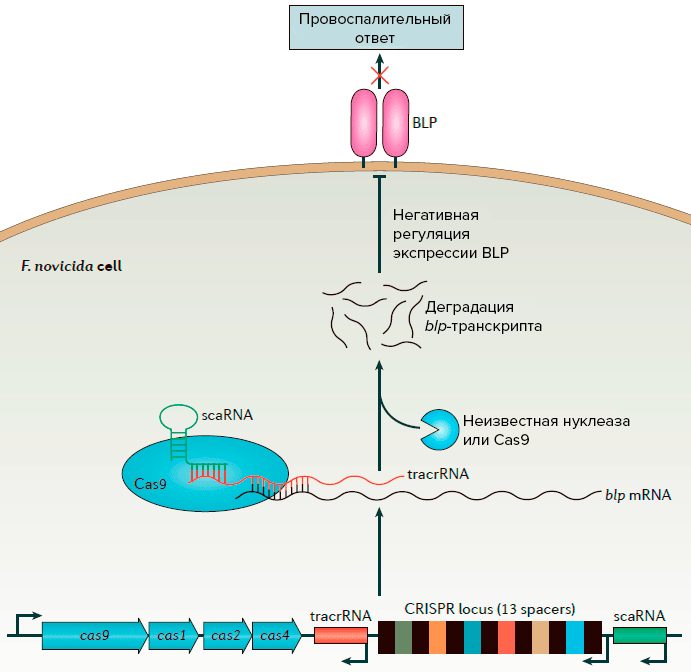
Рисунок 3. Регуляция вирулентности у Francisella novicida. Комплекс, состоящий из белка Cas9 и двух молекул РНК (tracrРНК и scaРНК), за счет комплементарности связывается с транскриптом blp. Далее транскрипт разрушается под действием Cas9 или другой, неизвестной нуклеазы. Снижение экспрессии BLP увеличивает вирулентность бактерии, так как подавляется иммунный ответ хозяина.
[2], рисунок адаптирован
Когда бактерия попадает в фагосому, то синтез Cas9, tracrРНК и scaРНК изменяется таким образом, что образование BLP временно подавляется. Мутантные клетки, лишенные хотя бы одного из трех компонентов, никогда не отключают экспрессию BLP и характеризуются пониженной вирулентностью. Любопытно, что у Neisseria meningitides Cas9 также способствует повышению вирулентности. У Legionella pneumophila, вызывающей легионеллез, вирулентность тоже регулирует только один из генов cas, но на этот раз cas2, а не cas9. Вероятно, РНКазная активность Cas2 влияет на уровень мРНК генов, связанных с вирулентностью [2].
CRISPR/Cas могут регулировать экспрессию генов, напрямую не связанных с вирулентностью. Так, у внутриклеточной патогенной бактерии Listeria monocytogenes транскрипт локуса CRISPR при сверхэкспрессии в два раза повышает уровень мРНК оперона, который кодирует переносчик ионов железа. Дальнейшее изучение показало, что штаммы, лишенные CRISPR, отличаются повышенной вирулентностью, что свидетельствует о роли транскрипта CRISPR в контроле вирулентности. При этом белки Cas для этого не нужны: у изучаемого штамма L. monocytogenes генов cas просто нет [2].
CRISPR/Cas могут регулировать экспрессию генов не только у бактерий, но и у архей. Например, у археи Pelobacter sp. в локусе CRISPR имеется спейсер, который соответствует гену, кодирующему гистидил-тРНК. Точный механизм регуляции экспрессии, а также роль генов сas в этом процессе неизвестны [8].
Взаимодействие патогена и хозяина
У некоторых патогенных бактерий системы CRISPR/Cas активируются в ответ на стресс, вызванный защитной реакцией хозяина, и регулируют взаимодействие патогена и хозяина. Например, N. meningitidis не может выживать в человеческих эпителиальных клетках без Cas9. Более того, Cas9 необходим для проникновения бактерии в эти клетки.
CRISPR/Cas участвует и в регуляции более сложных, мутуалистических отношений, которые могут включать не два, а три организма. Например, crРНК бактерии Xenorhabdus nematophila необходима для колонизации нематоды Steinemema, что ускоряет патогенез этих нематод в их хозяевах — насекомых [9].
Эволюция геномов
Имеется много свидетельств того, что CRISPR/Cas, нацеленные на последовательности в геноме самой бактериальной клетки, могут влиять на эволюцию геномов. Как правило, такие системы CRISPR/Cas приводят к гибели клетки, однако некоторые клетки все-таки выживают за счет мутаций. Мутации могут затрагивать гены cas, спейсеры, повторы и мишени CRISPR/Cas. Иногда происходят не точечные мутации, а масштабные геномные перестройки, обычно возникающие с помощью рекомбинации при репарации разрывов, внесенных в бактериальный геном белками Cas.
Например, у Pectobacterium atrosepticum может экспрессироваться crРНК, нацеленная на островок патогенности, необходимый для заражения растений. Как правило, экспрессия этой РНК приводит к смерти бактерии, однако у выживших клеток наблюдаются разнообразные делеции, в том числе полная утрата островка патогенности, несмотря на его длину (около 100 тысяч пар оснований) [2].
Вставка в CRISPR спейсера, соответствующего профагу, внедрившемуся в геном бактерии, приведет к гибели бактериальной клетки. Однако благодаря этому колония будет очищена от клеток, зараженных фагом. Подобный эффект показан, в частности, у бактерий Streptococcus pyogenes, Bifidobacterium spp. и P. aeruginosa [11].
Репарация ДНК
Показано, что CRISPR/Cas могут участвовать в репарации ДНК. Например, у E. coli белок Cas1 непосредственно взаимодействует со многими белками, участвующими в рекомбинации и репарации ДНК. При делеции cas1 или связанного с ним локуса CRISPR резко повышается чувствительность бактерий к агентам, повреждающим ДНК, и наблюдаются дефекты в разделении хромосом при делении клетки. Экспрессия cas у археи Pyrococcus furiosus повышает устойчивость клеток к γ-излучению [2].
Прочие функции
Системы CRISPR/Cas встречаются не только у бактерий. Иногда они обнаруживаются в мобильных генетических элементах (МГЭ) и участвуют в горизонтальном переносе МГЭ (о мобильных генетических элементах на «Биомолекуле» есть отдельная статья — «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [12]). Более того, МГЭ используют CRISPR/Cas для конкурентной борьбы друг с другом!
В некоторых случаях CRISPR/Cas, вероятно, обеспечивают защиту бактерий от фагов весьма необычным способом. В 2013 году высказали гипотезу, что Cas1 и Cas2 могут функционировать аналогично системе токсин—антитоксин, которая обеспечивает защиту колонии бактерий от фагов за счет гибели зараженных клеток. Cas2 функционирует как токсин, разрушающий мРНК клетки, а Cas1 выступает в роли антитоксина, который нейтрализует Cas2 за счет связывания. При заражении фагом комплекс Cas2 и Cas1 диссоциирует, и Cas2 вводит клетку в состояние покоя за счет разрушения мРНК, которое, однако, не столь значительно и не приводит к гибели клетки. Однако удвоение ДНК и клеточный цикл все же останавливаются, благодаря чему CRISPR/Cas получает возможность вставить в геном бактерии новый спейсер. Если же вставить спейсер не удалось, Cas2 вызывает гибель клетки, полностью разрушая мРНК всех ее белков. Однако у этой гипотезы есть и контраргументы. В частности, по некоторым данным, Cas2 не способен разрушать одноцепочечные РНК (в том числе мРНК). А кроме того, зачастую Cas1 и Cas2 сверхэкспрессируются независимо [2].
CRISPR/Cas также обеспечивают защиту от плазмид. Так, конъюгация Staphylococcus epidermidis становится в 104 раз менее эффективной, если плазмида несет протоспейсер, соответствующий одному из спейсеров в локусе CRISPR бактерии. Впрочем, у некоторых бактерий, например, Lactococcus lactis, сама рабочая система CRISPR/Cas, содержащая спейсеры, соответствующие фагам, находится не в геноме, а на плазмиде, которая может передаваться другим клеткам [13].
Эволюция функций CRISPR/Cas
Открытие дополнительных функций CRISPR/Cas вызвало немало вопросов касательно изначального предназначения этих систем. Являются ли дополнительные функции CRISPR/Cas результатом направленного отбора, или же они появились случайно, как побочные эффекты основного действия CRISPR/Cas? В некоторых случаях ответ на этот вопрос очевиден, в частности, это касается бактерии M. xanthus, у которой белки Cas вовлечены в один из важнейших процессов — образование плодовых тел и споруляции. Трудно представить себе, чтобы столь глубокое вовлечение CRISPR/Cas в клеточные процессы, не связанные с адаптивным иммунитетом, было результатом случайности. Другие дополнительные функции, вероятнее всего, представляют собой побочные процессы функционирования иммунитета. Например, у P. aeruginosa существует множество молекулярных каскадов, регулирующих образование биопленок, а участие CRISPR/Cas в этом процессе явно вторично. Основной же функцией CRISPR/Cas у этой бактерии является обеспечение адаптивного иммунитета. Геномные перестройки тоже, по всей вероятности, являются побочной стороной работы CRISPR/Cas в адаптивном иммунитете, поскольку в подавляющем большинстве случаев геномные перестройки приводят к гибели клетки [2].
Иногда отбор может влиять на обе стороны функционирования CRISPR/Cas: как связанную с адаптивным иммунитетом, так и не связанную с ним. Так, у M. xanthus, F. novicida и C. jejuni локусы CRISPR, скорее всего, работают в том числе и «по специальности», так как они содержат спейсеры, соответствующие геномам известных фагов. В некоторых случаях CRISPR/Cas полностью перестает участвовать в работе адаптивного иммунитета. Дело в том, что далеко не всегда вторжение МГЭ вредно для клетки. В некоторых условиях, например, в жесткой и быстро меняющейся окружающей среде приток чужеродной ДНК полезен для бактерий, так как он может случайно «подарить» бактериям гены, повышающие их приспособленность. Например, при наличии работающей системы CRISPR/Cas патогенные бактерии Enterococcus faecalis и Enterococcus faecium становятся чувствительными к антибиотикам, поскольку утрачивают способность эффективно приобретать ДНК (в том числе гены резистентности к антибиотикам) извне. Патогенная бактерия Streptococcus pneumoniae лишена CRISPR/Cas и активно поглощает ДНК извне (это явление называется трансформацией). Нередко благодаря этому у бактерии появляется капсула, значительно повышающая ее вирулентность. Если искусственно внедрить в ее геном систему CRISPR/Cas, нацеленную против генов, обеспечивающих образование капсулы, то трансформации не происходит, и бактерия не представляет для хозяина серьезной опасности. Патоген птиц Mycoplasma gallisepticum недавно «перепрыгнул» от кур на мексиканскую чечевицу, причем бактерии, заразившие нового хозяина, утратили гены cas и имеют значительно менее разнообразные спейсеры в локусе CRISPR, чем их сородичи, оставшиеся у кур [2], [13].
Другой вопрос, связанный с дополнительными функциями CRISPR/Cas, касается того, в каких отношениях изначально были локус CRISPR и гены cas? Возможны два сценария: CRISPR и Cas с самого начала появились как единая система и лишь потом приобрели особые функции, или же функции CRISPR и Cas различались с самого начала? Существуют свидетельства в пользу второго сценария, которые указывают, что белки Cas подвергались отбору, связанному с их участием в регуляции экспрессии генов, еще до связи с CRISPR [2].
Практически ежедневно появляются научные статьи, описывающие новые способы применения систем CRISPR/Cas в редактировании геномов, а фундаментальные аспекты функционирования этих замечательных механизмов остаются как бы в стороне. Будем надеяться, что мы еще не раз услышим о новых открытиях, касающихся биологии систем CRISPR/Cas и их роли в эволюции микробного мира.
Литература
- Просто о сложном: CRISPR/Cas;
- Edze R. Westra, Angus Buckling, Peter C. Fineran. (2014). CRISPR–Cas systems: beyond adaptive immunity. Nat Rev Micro. 12, 317-326;
- Heidi B Kaplan. (2003). Multicellular development and gliding motility in Myxococcus xanthus. Current Opinion in Microbiology. 6, 572-577;
- Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение;
- «Бактериофаг-1 Бактериофагу-2, приём!»;
- Gary E. Heussler, Kyle C. Cady, Katja Koeppen, Sabin Bhuju, Bruce A. Stanton, George A. O’Toole. (2015). Clustered Regularly Interspaced Short Palindromic Repeat-Dependent, Biofilm-Specific Death ofPseudomonas aeruginosaMediated by Increased Expression of Phage-Related Genes. mBio. 6, e00129-15;
- R. Louwen, R. H. J. Staals, H. P. Endtz, P. van Baarlen, J. van der Oost. (2014). The Role of CRISPR-Cas Systems in Virulence of Pathogenic Bacteria. Microbiology and Molecular Biology Reviews. 78, 74-88;
- Timothy R. Sampson, David S. Weiss. (2014). CRISPR-Cas systems: new players in gene regulation and bacterial physiology. Front. Cell. Infect. Microbiol.. 4;
- Hannah K. Ratner, Timothy R. Sampson, David S. Weiss. (2015). I can see CRISPR now, even when phage are gone. Current Opinion in Infectious Diseases. 28, 267-274;
- A. Plagens, B. Tjaden, A. Hagemann, L. Randau, R. Hensel. (2012). Characterization of the CRISPR/Cas Subtype I-A System of the Hyperthermophilic Crenarchaeon Thermoproteus tenax. Journal of Bacteriology. 194, 2491-2500;
- Gary E. Heussler, George A. O'Toole. (2016). Friendly Fire: Biological Functions and Consequences of Chromosomal Targeting by CRISPR-Cas Systems. J. Bacteriol.. 198, 1481-1486;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Joseph Bondy-Denomy, Alan R. Davidson. (2014). To acquire or resist: the complex biological effects of CRISPR–Cas systems. Trends in Microbiology. 22, 218-225.