Луч света в темном галле
14 февраля 2022
Луч света в темном галле
- 426
- 0
- 1
-
Авторы
-
Редакторы
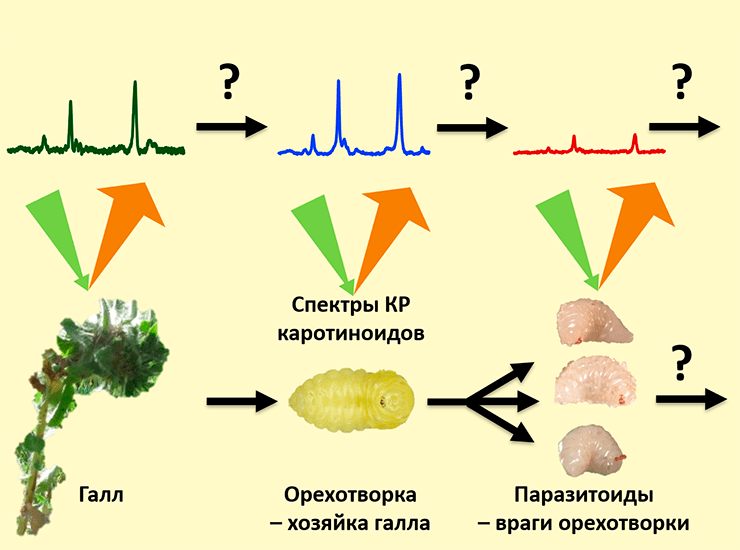
Статья на конкурс «Био/Мол/Текст»: «Берегись и остерегайся домашнего врага, ибо каждая стрела, выпущенная тетивой его коварства и луком его недоброжелательства, принесет гибель», — писал Мухаммед ас-Самарканди. Именно это послание хочется передать крошечному насекомому — орехотворке, когда она откладывает свои яйца в стебель ястребинки. В этот момент растение начинает само строить домик для ее крошечных деток. Этот домик называется галл. Внутри галла яйцам, а потом личинкам и куколкам орехотворки не страшны ни голод, ни морозы, ни хищники. Растение будет питать и укрывать их от всех напастей, пока они не станут взрослыми и не выпорхнут из галла. Казалось бы, что может омрачить такое райское существование? Оказывается, целая армия других насекомых попытается отложить яйца в этот галл, чтобы вылупившиеся из них личинки могли полакомиться хозяином дома — орехотворкой. Эти насекомые становятся «домашними врагами» орехотворки — паразитоидами. Впрочем, есть и те, кто выступают врагом врагов орехотворки, то есть становятся гиперпаразитоидами, своего рода друзьями орехотворки по принципу «Враг моего врага — мой друг». Но это еще не всё — так как домик-галл большой и просторный, в него могут подселяться и те насекомые, кому просто нужна своя комната, а до других сожителей вовсе нет дела, — это инквилины. Разобраться, кто кого ест, а кто просто мимо проходил, — очень непростая задача! Нужна какая-то метка, которая бы передавалась от растения к орехотворке (единственному травоядному в галле), а потом дальше по пищевой цепи. Для других насекомых были попытки использовать для этих целей пигмент каротиноид. С помощью спектроскопии комбинационного рассеяния мы проследили судьбу каротиноидов от тканей галла до паразитоида орехотворки и обнаружили, что орехотворки не так просты, как кажется!
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания Cytiva.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Кто такие орехотворки и где они живут
Насекомые могут по-разному взаимодействовать с растениями: есть пыльцу из цветков, грызть стебли и листья, откладывать на них свои личинки. Один из самых удивительных видов этого взаимодействия — образование галлов на растениях. Галл — это патологическое разрастание растительных тканей, этакая опухоль, в которой поселяются личинки насекомых. Насекомые, которые могут вызвать формирование галла, называются галлообразователями. Насекомые-галлообразователи научились настолько сильно менять метаболизм растения, что растение само строит для них «домик» из собственных тканей, а потом обеспечивает их всеми необходимыми питательными веществами [1]. Пожалуй, самый известный пример галлов — чернильные орешки на дубах (см. врезку ниже), сформированные личинками насекомых — микроскопических ос семейства Cynipidae. Из-за способности формировать такие округлые опухоли на листьях дуба — «орешки», эти насекомые получили название орехотворки. Орехотворки формируют галлы далеко не только на дубах. Многие годы мы изучали галлы, которые образуют личинки орехотворок вида Aulacidea hieracii на стебле растения ястребинки могучей Hieracium × robustum (рис. 1) [2–6].

Рисунок 1. Орехотворка и ястребинка. а — Орехотворка откладывает яйца в стебель ястребинки, что приведет к формированию галла. б — Ястребинки с галлами.
фото автора статьи
Полное развитие орехотворки от яйца до имаго (взрослой особи) происходит внутри галла, который снабжает этих насекомых всеми питательными веществами (рис. 2). Галл начинает формироваться после откладки яйца орехотворкой с мая по июнь и заканчивается в начале августа, когда насекомые готовы к диапаузе. В этот ключевой момент жизненного цикла личинка галлообразователя перестает питаться и производит дефекацию; на этой стадии она может зимовать внутри галла. Весной личинка окукливается и выходит из галла взрослой особью [2], [7]. Можно ли считать орехотворку паразитом ястребинки? Вопрос неоднозначный. Современная позиция энтомологов такова, что галлообразование не несет для растений никакой пользы [1]. Однако если наблюдать за практически одинаковыми ястребинками в конце апреля — начале мая, то можно заметить, как стебли, в которых поселились орехотворки, становятся толще и крепче, на них появляется больше листьев и цветков, поэтому называть орехотворку паразитом ястребинки было бы некорректно [2].
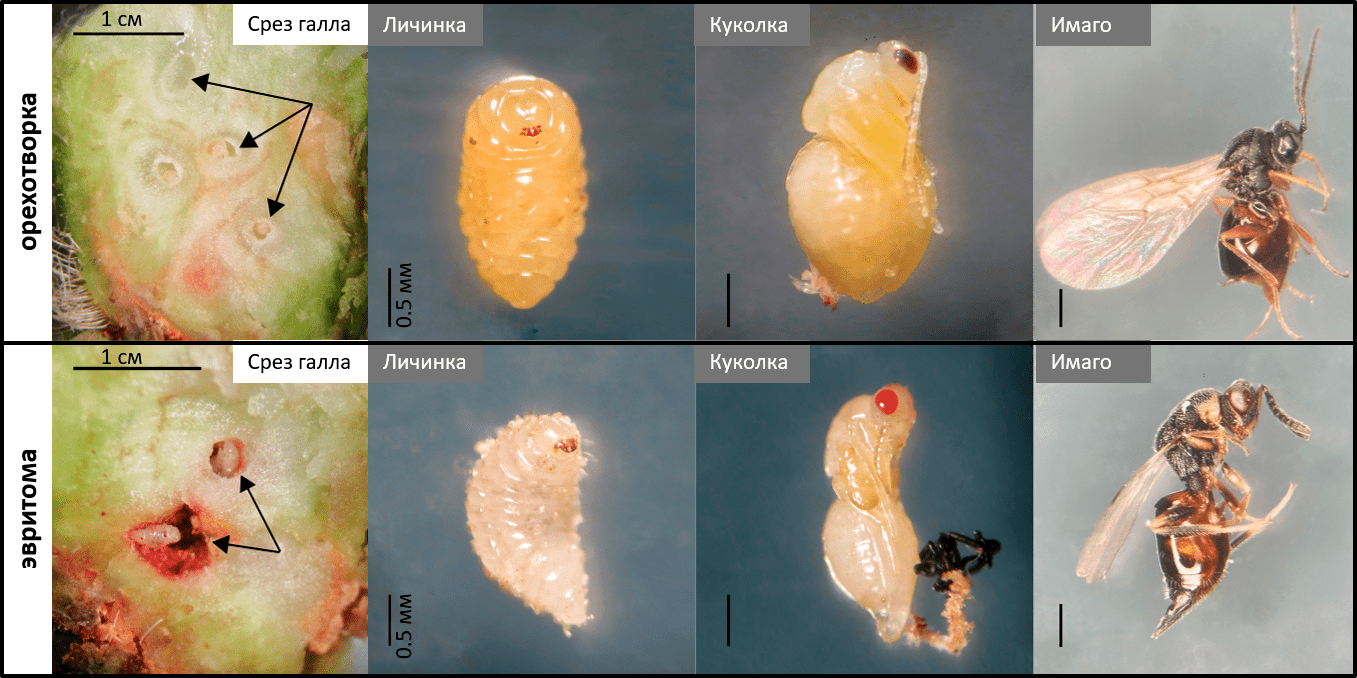
Рисунок 2. Галлы. Наверху: срез галла ястребинки, образованного орехотворками, с личинками орехотворки внутри (показаны стрелками). Метаморфозы орехотворки от личинки до имаго (взрослой особи). Внизу: срез галла на ястребинке с личинками паразитоида орехотворки — эвритомы (показаны стрелками). Метаморфозы эвритомы от личинки до имаго.
[8], рисунок адаптирован
Сколько врагов и друзей у орехотворок
Самое интересное в галлах на ястребинке то, что только чуть больше половины насекомых внутри галла — это собственно орехотворки, которые галл сформировали, точнее, «заставили» растение его сформировать для них [7]. А вторая половина — это всевозможные паразитоиды орехотворки (рис. 3). Причем, это могут быть как эктопаразитоиды, которые едят орехотворок снаружи, например, эвритома Eurytoma cynipsea (рис. 2), а могут быть эндопаразитоиды, разъедающие личинок изнутри, например, сикофила Sycophila submutica. Кроме этого, в галлах встречаются гиперпаразитоиды — паразиты паразитов, а также инквилины — сожители, которые просто занимают «комнатки» внутри галла или даже на его поверхности [9]. Таким образом, галл представляет собой что-то вроде Теремка, в который каждый так и норовит подселиться [10]. Это сложная мини-экосистема с разнообразными и не всегда очевидными трофическими связями между его жителями.
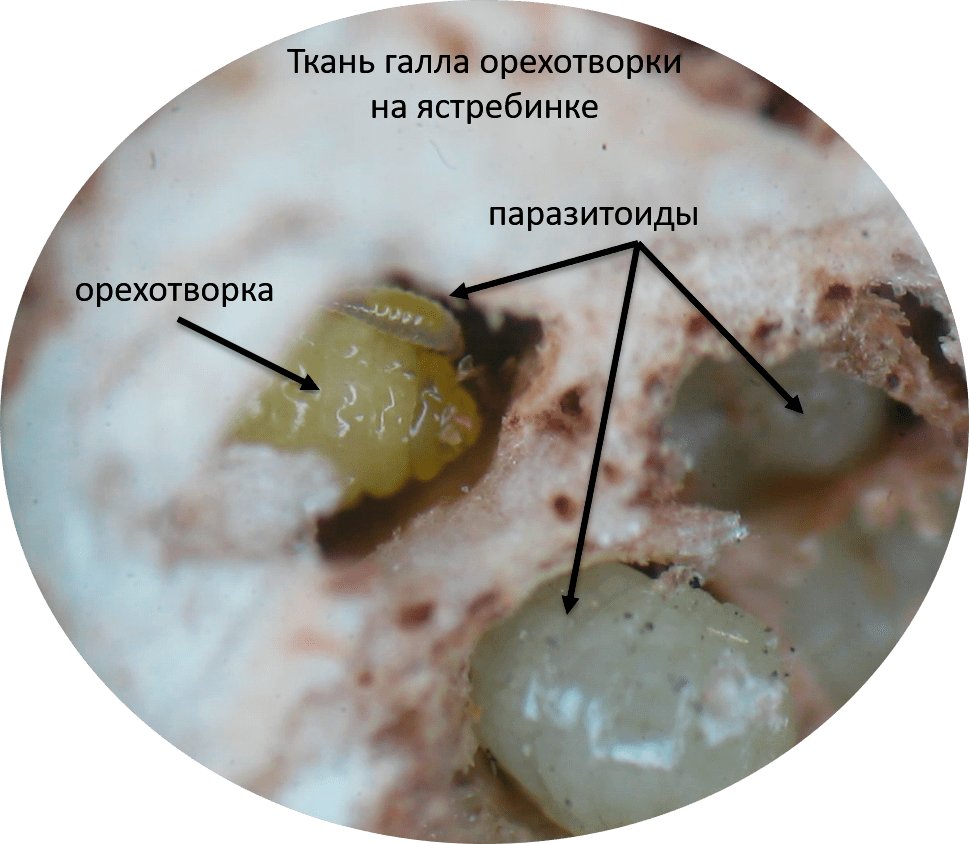
Рисунок 3. Множество паразитоидов атакует орехотворку внутри галла на ястребинке (фотография сделана под бинокулярным микроскопом)
фото автора статьи
Как же распутать этот сложный клубок взаимодействий и понять, кто кого ест, а кто просто мимо проходил? Было бы удобно иметь какую-то метку, маркер, который бы проходил по трофической цепи от растения к разным насекомым. Желательно, чтобы он был естественного происхождения, образовывался бы только в растениях, но не в животных, и практически не изменялся бы по мере движения по пищевой цепи, разве что количество его бы закономерно снижалось по закону экологической пирамиды. И такой маркер на самом деле существует — это каротиноиды [11], [12]!
Каротиноиды — это органические пигменты красно-оранжевого цвета. В насекомых они выполняют множество функций, включая окраску, защиту (так как являются антиоксидантами) и синтез витаминов [13]. Растения являются главным источником каротиноидов. Считается, что животные не способны синтезировать каротиноиды. Насекомые получают все каротиноиды из растений и могут разве что незначительно их модифицировать. В разных работах было показано, что каротиноиды отражают пищевую цепь от растений до хищников или до паразитоидов травоядных насекомых [11], [12], [14]. Мы решили исследовать, как каротиноиды передвигаются по пищевой цепи от галла ястребинки через орехотворку до ее главного паразитоида — эвритомы. Это помогло бы нам изучать более запутанные трофические цепи в галлах.
Как изучить каротиноиды в живых насекомых
Какой же выбрать метод изучения каротиноидов? В большинстве работ используют хроматографию с последующей масс-спектрометрией [14], [15] или спектрофотометрией [16]. Но для этого нужно убивать ценный живой материал в большом количестве и делать из него экстракты. К тому же наши насекомые орехотворки в ходе своего развития проходят полное превращение. Это значит, что из личинки образуется куколка, а из куколки — взрослая особь. К тому же сама личинка тоже меняется — она растет, развивается и в течение двух месяцев увеличивается в 5–6 раз! Если мы будем делать экстракты из личинок орехотворки, то мы не узнаем, что станет с их куколками. С паразитоидами все еще сложнее. Определить некоторых паразитоидов можно только по имаго, но не по личинке. Есть в галле и совсем родственные виды, например, мы изучали два очень близких вида эвпельмид [6]. Если мы будем выделять каротиноиды из личинок, то не будем уверены на 100%, с каким видом мы работаем. А ведь в этом весь смысл!
И тут на помощь нам пришла спектроскопия комбинационного рассеяния (КР), или Рамановская спектроскопия , [17], [18]. Это совершенно неинвазивный метод, который позволил нам работать с живыми личинками орехотворки и ее паразитоида эвритомы, которые после измерений спокойно превратились в куколок и стали имаго как ни в чем не бывало [8], [19–21]. Более того, так как личинки были живые, они могли двигаться! Метод КР позволил производить измерения за считанные секунды, поэтому мы успевали снять все спектры с личинок до того, как они уползут или перевернутся.
Спектроскопия комбинационного рассеяния (КР) позволяет исследовать колебания атомов в молекулах. Спектр КР молекулы представляет собой набор пиков с определенной интенсивностью и положением (частотным сдвигом, см–1), где каждый пик возникает в результате колебаний определенной группы атомов в молекуле. Так как все молекулы состоят из разных атомов и комбинаций связей между ними, спектры КР уникальны для каждой молекулы. Иными словами, набор пиков на спектрах КР фактически представляет собой «отпечатки пальцев» молекул. С помощью этого метода можно исследовать, какие молекулы и в каком количестве представлены в сложных смесях и даже в живых организмах.
Как проходил эксперимент? Сначала мы собирали галлы, потом везли их в лабораторию, где вскрывали, доставали личинку насекомого и помещали на предметный столик Рамановского микроскопа. Личинки и куколки насекомых, а также ткани галла освещали зеленым лазером и регистрировали спектры КР (рис. 4). Такие измерения проводили и летом, и зимой. Хотя личинка или куколка орехотворки и эвритомы очень мелкие (порядка 1–2 мм), под микроскопом были хорошо различимы их сегменты, с которых мы регистрировали спектры КР.

Рисунок 4. Измерения спектров КР живых личинок насекомых
фото Д.Н. Браташова
О чудо! Спектры КР личинок и куколок насекомых точно соответствовали спектрам каротиноидов (рис. 5)! В них были хорошо различимы 3 главных пика, характеризующие колебания двойных связей С=С (пик 1522 см–1), одинарных связей С—С (пик 1156 см–1) и метильных групп (пик 1004 см–1). Это типичный набор пиков КР, фактически «отпечаток пальцев», для молекул каротиноидов, например, бета-каротина [22]. Хотя каротиноидов огромное множество и в целом они все похожи, тем не менее спектры разных каротиноидов все же отличаются друг от друга положением пиков и соотношением интенсивности пиков КР. Кроме того, интенсивность КР пропорциональна количеству исследуемых молекул, в данном случае каротиноидов. Таким образом, по спектрам КР можно различить разные каротиноиды и оценить их количество.
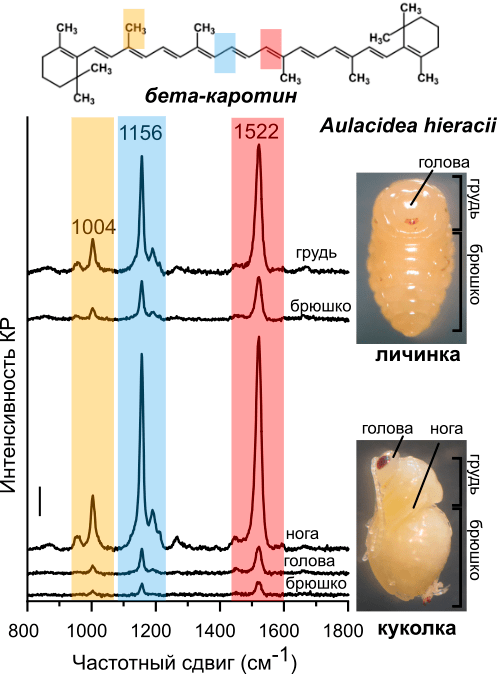
Рисунок 5. Спектры КР с разных структур личинки и куколки орехотворки. Сверху: формула бета-каротина — типичного каротиноида (для примера). Цветом показаны пики КР и соответствующие им связи в молекуле каротиноидов.
[8], рисунок адаптирован
Что скрывают орехотворки
Все казалось идеальным: теперь мы, наконец, проследим путь каротиноидов из растения прямо до паразитоида! Но не тут-то было…
Особенностью личинок орехотворки является то, что где-то в середине августа они совершают акт дефекации. Казалось бы, что в этом особенного? Однако это единственное испражнение в личиночной стадии насекомого, после которого их кишечник «закрывается», и питаться они перестают вплоть до взрослой стадии, в которую превратятся только весной. То есть как минимум восемь месяцев, включая зимние месяцы, личинка орехотворки, а потом и куколка, ничего не ест вообще. Разумеется, мы предполагали, что орехотворка хорошо напитается тканями и соками галла летом, запасет все необходимые для зимовки вещества, в том числе каротиноиды. А потом будет потихоньку их тратить.
Каково же было наше удивление, когда мы обнаружили, что в зимних непитающихся личинках орехотворки гораздо больше каротиноидов, чем в летних личинках перед испражнением (рис. 6). Откуда же они взялись? Уж точно не из пищи, которую они совершенно не потребляют. На этот вопрос пока сложно дать ответ. Уже известны два вида насекомых, которые могут сами синтезировать каротиноиды de novo — это тля [23] и галлицы (мухи-галлообразователи) [24]. Однако среди перепончатокрылых насекомых, к которым относятся орехотворки, такое никогда раньше не наблюдали. Да и вообще, животное, производящее каротиноиды, — это нечто крайне необычное. Конечно, нельзя списывать со счетов возможных «помощников» орехотворок, например, симбиотических бактерий, которые могут синтезировать каротиноиды. И мы даже нашли бактерии, которые обитают в галлах на ястребинке [25]. Но пока вопрос об увеличении количества каротиноидов в спящих непитающихся личинках орехотворки остается нерешенным.
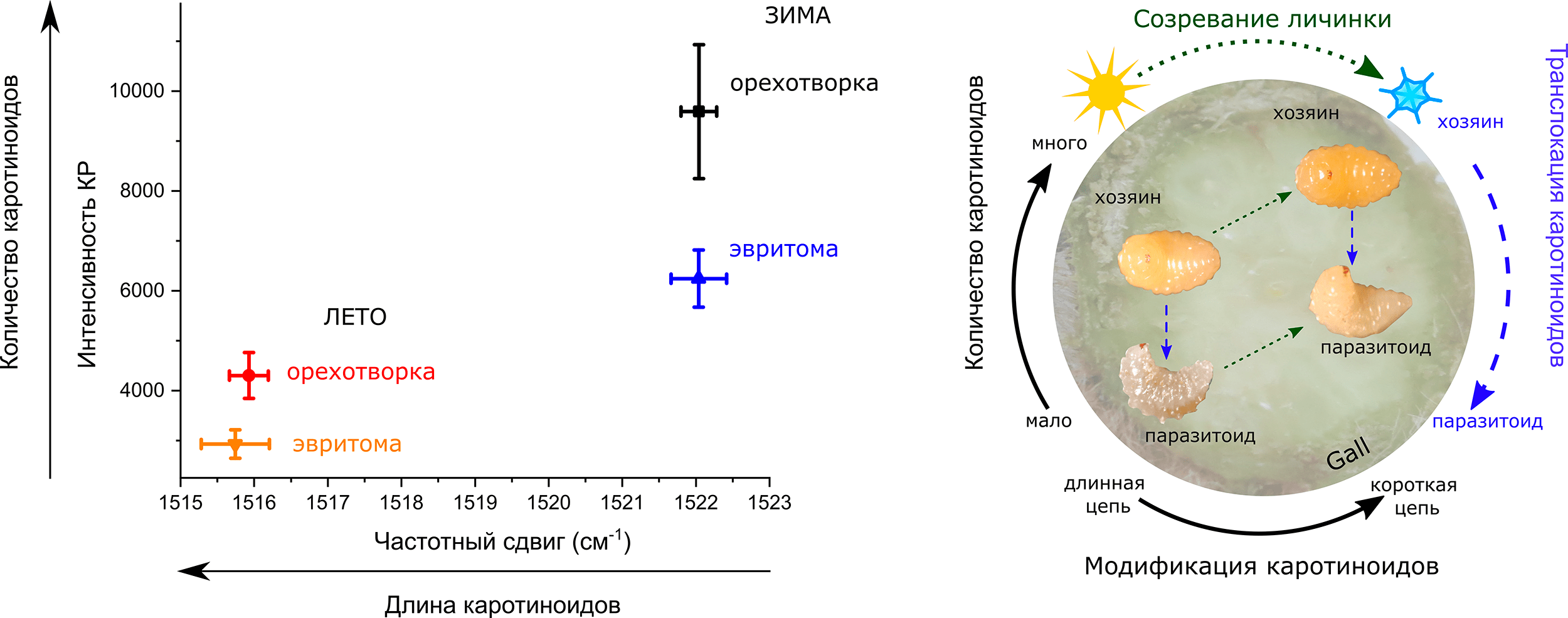
Рисунок 6. Изменение количества каротиноидов у орехотворки и эвритомы. Слева: Зависимость интенсивности пика 1516–1522 см–1, соответствующего колебаниям связи С=С (отражающего общее количество каротиноидов), от положения его максимума (обратно пропорционально зависящему от длины каротиноида) на спектрах КР летних и зимних форм галлообразователя орехотворки и ее паразитоида эвритомы. Данные представлены в виде средних значений и ошибок среднего. Справа: Схема судьбы каротиноидов у личиночных форм орехотворки (хозяина) и эвритомы (паразитоида) внутри галла на ястребинке. Пунктирные зеленые стрелки соответствуют созреванию личинок (от летних форм к зимним); пунктирные синие стрелки соответствуют перемещению каротиноидов от хозяина к паразитоиду. По мере созревания личинки количество каротиноидов увеличивается и происходит модификация каротиноидов (укорочение цепей), как показано черной стрелкой.
[8], рисунок адаптирован
Надо сказать, что у паразитоида орехотворки, эвритомы, количество каротиноидов зимой тоже выше, чем летом (рис. 6). Но это как раз можно объяснить тем, что она питается личинками орехотворок до поздней осени, после чего впадает в спячку. Если орехотворки постепенно синтезируют каротиноиды, то зимние эвритомы, успевшие напитаться богатыми каротиноидами осенними орехотворками, будут содержать ожидаемо больше каротиноидов, чем летние эвритомы, поевшие летних орехотворок с меньшим количеством каротиноидов. Причем количество каротиноидов в эвритомах всегда меньше, чем в их пище — орехотворках, что тоже закономерно с точки зрения экологии трофических цепей.
Тут надо сделать небольшую оговорку. Когда в научных статьях пишут о «количестве» каротиноидов в насекомых, подразумевают их общее количество, так как, как правило, исследуют их методами, предполагающими получение гомогената (проще говоря, кашицы) из насекомых (например, [14], [26]). В нашем случае мы регистрировали спектры КР с очень маленького участка (порядка 12,5 мкм в диаметре) на живых личинках и куколках насекомых. Это позволило нам судить о локальной концентрации каротиноидов в определенных сегментах насекомого. Сканируя личинки орехотворки, мы обнаружили, что каротиноиды распределены неравномерно по туловищу. В грудных сегментах их концентрация оказалась выше, чем в головных и брюшных. При этом в зимних личинках орехотворки во всех сегментах концентрация каротиноидов была выше, чем в летних. Но самое поразительное было то, что в куколке орехотворки максимальная концентрация каротиноидов была в ногах и зачатках крыльев! Это видно и под обычным бинокулярным микроскопом: зимние личинки более насыщенного желтого цвета, чем летние, а ноги и крылья куколки более желтые, чем остальные части тела (рис. 2 и 5). Любопытно, что такая неравномерность в распределении каротиноидов была характерна только для орехотворки, но не для эвритомы. Почему для одного насекомого это важно, а для другого нет? Какой в этом биологический смысл? На эти вопросы все еще предстоит ответить, а пока стоит внимательнее относиться к литературным данным, апеллирующим к общему количеству каротиноидов без учета их локализации в теле насекомого.
Так ли хороши каротиноиды для изучения пищевых цепей
Итак, мы выяснили, что орехотворки каким-то образом накапливают каротиноиды к зиме при полном отсутствии питания. Это уже значительно затрудняет использование каротиноидов как маркеров движения биомассы по трофическим цепям в галле. Но это еще не все! Набор и свойства каротиноидов в личинках орехотворки отличался от того, что было в растении, которым они питаются! Мы это поняли по положению пика КР, характеризующего колебания двойных связей С=С. Чем меньше значение частотного сдвига максимума этого пика, тем длиннее цепь молекулы каротиноида [22]. У тканей галла средняя длина каротиноидов оказалась меньше, чем у летних орехотворок, которые этими тканями питаются. Обратную зависимость еще можно было бы объяснить тем, что орехотворки содержат некие ферменты, расщепляющие каротиноиды. Такие ферменты уже были найдены у некоторых беспозвоночных животных [27]. Однако увеличение длины цепи каротиноида в насекомых по сравнению с растением объяснить гораздо сложнее... При этом, количество и средняя длина молекул каротиноидов в орехотворках и их паразитоидах хорошо соответствовала друг другу. По этому параметру каротиноиды вполне можно применять как биомаркер движения питательных веществ по пищевой цепи, что позволит распутать паутину взаимодействий хотя бы между насекомыми в галле (рис. 6).
Итоги и перспективы
Непросто изучать орехотворок, скрывающихся от любопытных глаз в своем уютном домике — галле. Но даже после вскрытия галла и измерений на самых современных приборах они все равно умудряются преподносить сюрпризы и трудноразрешимые загадки. Неужели они являются исключением из правил и могут сами синтезировать каротиноиды? И если да, то как? Зачем им каротиноиды в крыльях и ногах, когда другие насекомые обходятся без этого? Могут ли они защищать их от врагов? Помогают ли в развитии и зимовке? На все эти вопросы еще предстоит ответить. Если вы хотели бы присоединиться к разгадыванию тайн этой уникальной системы (а их еще очень много), мы с большим удовольствием приглашаем к сотрудничеству! 😊
Полный текст статьи Nikelshparg et al. 2021 в журнале Chemoecology [8] доступен бесплатного для просмотра по ссылке: rdcu.be/cycRq.
Авторы благодарят профессора В.В. Аникина и Д.Н. Браташова. Исследование выполнено при поддержке Междисциплинарной научно-образовательной школы Московского университета «Молекулярные технологии живых систем и синтетическая биология».
Литература
- Seiji Takeda, Tomoko Hirano, Issei Ohshima, Masa H. Sato. (2021). Recent Progress Regarding the Molecular Aspects of Insect Gall Formation. IJMS. 22, 9424;
- Аникин В.В. и Никельшпарг М.И. (2018). Эффект увеличения числа листьев на растениях Hieracium × robustum (Asteraceae) при их заселении галлобразователем Aulacidea hieracii (Hymenoptera: Cynipidae). «Бюллетень Ботанического сада Саратовского государственного университета». 4, 49–54;
- Никельшпарг М.И., Аникин В.В., Воронин М.Ю. (2018). Изменение температурного режима в галлах Aulacidea hieracii (Hymenoptera: Cynipidae) на растениях Hieracium robustum (Asteraceae) в зимний период. «Бюллетень Ботанического сада Саратовского государственного университета». 1, 60–66;
- Аникин В.В. и Никельшпарг М.И. (2017). Особенности паразитирования Eupelmus sp. (Hymenoptera: Eupelmidae) на орехотворке Aulacidea hieracii (Hymenoptera: Cynipidae) — галлообразователе на ястребинке Hieracium virosum. «Энтомологические и паразитологические исследования в Поволжье». 14;
- Крицкая Т.А., Кашин А.С., Аникин В.В. (2019). Генетический полиморфизм в популяциях Hieracium × robustum (Asteraceae) как результат деятельности фитофага-галлообразователя Aulacidea hieracii (Hymenoptera: Cynipidae). «Известия Саратовского университета. Новая серия. Серия Химия. Биология. Экология». 3, 357–363;
- Vladimir E. Gokhman, Matvey I. Nikelshparg. (2021). Eupelmus messene Walker, 1839 and E. microzonus Förster, 1860 as parasitoids of Aulacidea hieracii (Bouché, 1834) (Hymenoptera, Eupelmidae, Cynipidae). JHR. 84, 87-102;
- Аникин В.В., Никельшпарг М.И., Никельшпарг Э.И. (2017). Численность и фенология выхода орехотворки Aulacidea hieraci L., 1758 (Hymenoptera: Cynipidae) и ее паразитоидов из галлов на ястребинке могучей (Hieracium × robustum fr.). «Научные труды национального парка “Хвалынский”». 9, 241–244;
- Evelina I. Nikelshparg, Daniil N. Bratashov, Matvey I. Nikelshparg, Vasily V. Anikin. (2021). Fate of carotenoids in the closed living system of gall–gall wasp–parasitoid. Chemoecology;
- Никельшпарг М.И. и Аникин В.В. (2020). Развитие гусеницы пальцекрылки Oxyptilus chrysodactyla ([Denis and Schiffermuller], 1775) (Lepidoptera, Pterophoridae) на ястребинке Hieracium virosum Pall. «Энтомологические и паразитологические исследования в Поволжье». 17, 98–104;
- Жук — повелитель фотосинтеза;
- Takashi Maoka, Naoki Kawase, Tetsuyuki Ueda, Ritsuo Nishida. (2020). Carotenoids of dragonflies, from the perspective of comparative biochemical and chemical ecological studies. Biochemical Systematics and Ecology. 89, 104001;
- Takashi Maoka, Naoki Kawase, Mantaro Hironaka, Ritsuo Nishida. (2021). Carotenoids of hemipteran insects, from the perspective of chemo-systematic and chemical ecological studies. Biochemical Systematics and Ecology. 95, 104241;
- Manuel Rodriguez-Concepcion, Javier Avalos, M. Luisa Bonet, Albert Boronat, Lourdes Gomez-Gomez, et. al.. (2018). A global perspective on carotenoids: Metabolism, biotechnology, and benefits for nutrition and health. Progress in Lipid Research. 70, 62-93;
- Xin-Geng Wang, Christopher M. Wallis, Kent M. Daane. (2014). Tri-trophic movement of carotenoid pigments from host plant to the parasitoid of a caterpillar. Journal of Insect Physiology. 61, 58-65;
- Sol M. Rivera, Paul Christou, Ramon Canela-Garayoa. (2014). Identification of carotenoids using mass spectrometry. Mass Spec Rev. 33, 353-372;
- Eric Biehler, Frédéric Mayer, Lucien Hoffmann, Elmar Krause, Torsten Bohn. (2010). Comparison of 3 Spectrophotometric Methods for Carotenoid Determination in Frequently Consumed Fruits and Vegetables. Journal of Food Science. 75, C55-C61;
- Alexey V. Vlasov, Nina L. Maliar, Sergey V. Bazhenov, Evelina I. Nikelshparg, Nadezda A. Brazhe, et. al.. (2020). Raman Scattering: From Structural Biology to Medical Applications. Crystals. 10, 38;
- Спектроскопия КР: новые возможности старого метода;
- 13th EBSA congress, July 24–28, 2021, Vienna, Austria. (2021). Eur Biophys J. 50, 1-226;
- Evelina Nikelshparg, Daniil Bratashov, Matvey Nikelshparg, Vasily Anikin. (2021). Probing Carotenoids in the Gall Wasp Aulacidea hieracii in Vivo . Proceedings of The 1st International Electronic Conference on Entomology;
- Никельшпарг М.И., Никельшпарг Э.И., Аникин В.В., Браташов Д.Н. (2020). Неинвазивное исследование состава молекул в насекомых галообразователях методом комбинационного рассеяния света. «Проблемы оптической физики и биофотоники». 19–23;
- Yasushi Koyama, Ichiro Takatsuka, Munetaka Nakata, Mitsuo Tasumi. (1988). Raman and infrared spectra of the all-trans, 7-cis, 9-cis, 13-cis and 15-cis isomers of β-carotene: Key bands distinguishing stretched or terminal-bent configurations form central-bent configurations. J. Raman Spectrosc.. 19, 37-49;
- Nancy A. Moran, Tyler Jarvik. (2010). Lateral Transfer of Genes from Fungi Underlies Carotenoid Production in Aphids. Science. 328, 624-627;
- Cassidy Cobbs, Jeremy Heath, John O. Stireman, Patrick Abbot. (2013). Carotenoids in unexpected places: Gall midges, lateral gene transfer, and carotenoid biosynthesis in animals. Molecular Phylogenetics and Evolution. 68, 221-228;
- Никельшпарг М.И., Глинская Е.В., Аникин В.В., Никельшпарг Э.И. (2019). Видовой состав бактерий галлов, образованных на ястребинке могучей Hieracium robustum Fr. s. L., 1848 орехотворкой Aulacidea hieracii Bouche, 1834. IX Съезд общества физиологов растений России «Физиология растений — основа создания растений будущего». 533;
- Kieu-Oanh Nguyen, Sayma Al-Rashid, M Clarke Miller, J Tom Diggs, Evan C Lampert. (2019). Trichoplusia ni (Lepidoptera: Noctuidae) Qualitative and Quantitative Sequestration of Host Plant Carotenoids. Environmental Entomology. 48, 540-545;
- Astrid Bryon, Andre H. Kurlovs, Wannes Dermauw, Robert Greenhalgh, Maria Riga, et. al.. (2017). Disruption of a horizontally transferred phytoene desaturase abolishes carotenoid accumulation and diapause in Tetranychus urticae. Proc Natl Acad Sci USA. 114, E5871-E5880.