
Микробиота и опухоли: новый шаг к пониманию причин канцерогенеза
04 марта 2021
Микробиота и опухоли: новый шаг к пониманию причин канцерогенеза
- 6085
- 2
- 14
Бактерии (зелёного цвета) нашли убежище внутри раковых клеток и прижимаются к ядерной мембране.
Рисунок в полном размере.
сайт BeataScienceArt
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все разнообразие микроорганизмов, обитающих в нашем теле, называют микробиотой. Бактерии и вирусы, грибы и загадочные археи поселились не только в кишечнике, но и в самых разных уголках нашего организма. Поверить в тот факт, что они могут регулировать аппетит или менять образ мыслей — сложно. Но еще сложнее представить, что микробиота способна влиять на злокачественное перерождение клеток и развитие онкологических заболеваний. Связь микробиоты и опухолей так сложна, противоречива и запутанна, что загадок в ней не меньше, чем в сюжете самого захватывающего детектива. Но уже сейчас ученые смогли достаточно близко познакомиться с некоторыми представителями микробиоты и понять, кто нам друг, а кто — враг. Попробуем и мы в этом разобраться.
Конкурс «Био/Мол/Текст»-2020/2021
 Эта статья опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021 и заслужила второй приз зрительских симпатий.
Эта статья опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021 и заслужила второй приз зрительских симпатий.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Давно известно, что определенные микроорганизмы могут стать причиной злокачественного перерождения клеток. В 2018 году в мире было выявлено 2 200 000 новых случаев онкологических заболеваний, связанных с инфекционными агентами [1]. Примеров микроорганизмов, ассоциированных с канцерогенезом, немало: онкогенные типы вируса папилломы человека могут привести к раку шейки матки, вирусы гепатита В и С связаны с карциномой печени, а бактерия Helicobacter pylori — с раком желудка [2–4]. Их появление в организме с высокой долей вероятности приведёт к онкологическому заболеванию.
Но наша нормальная микробиота тоже не остается в стороне. Микроорганизмы, в норме населяющие наше тело, оказывают на опухоль множество независимых и разноплановых эффектов. И, хотя состав микробиоты разнообразен (это и вирусы, и бактерии, и археи), в данной статье будет рассмотрено влияние бактерий на злокачественное перерождение клеток.
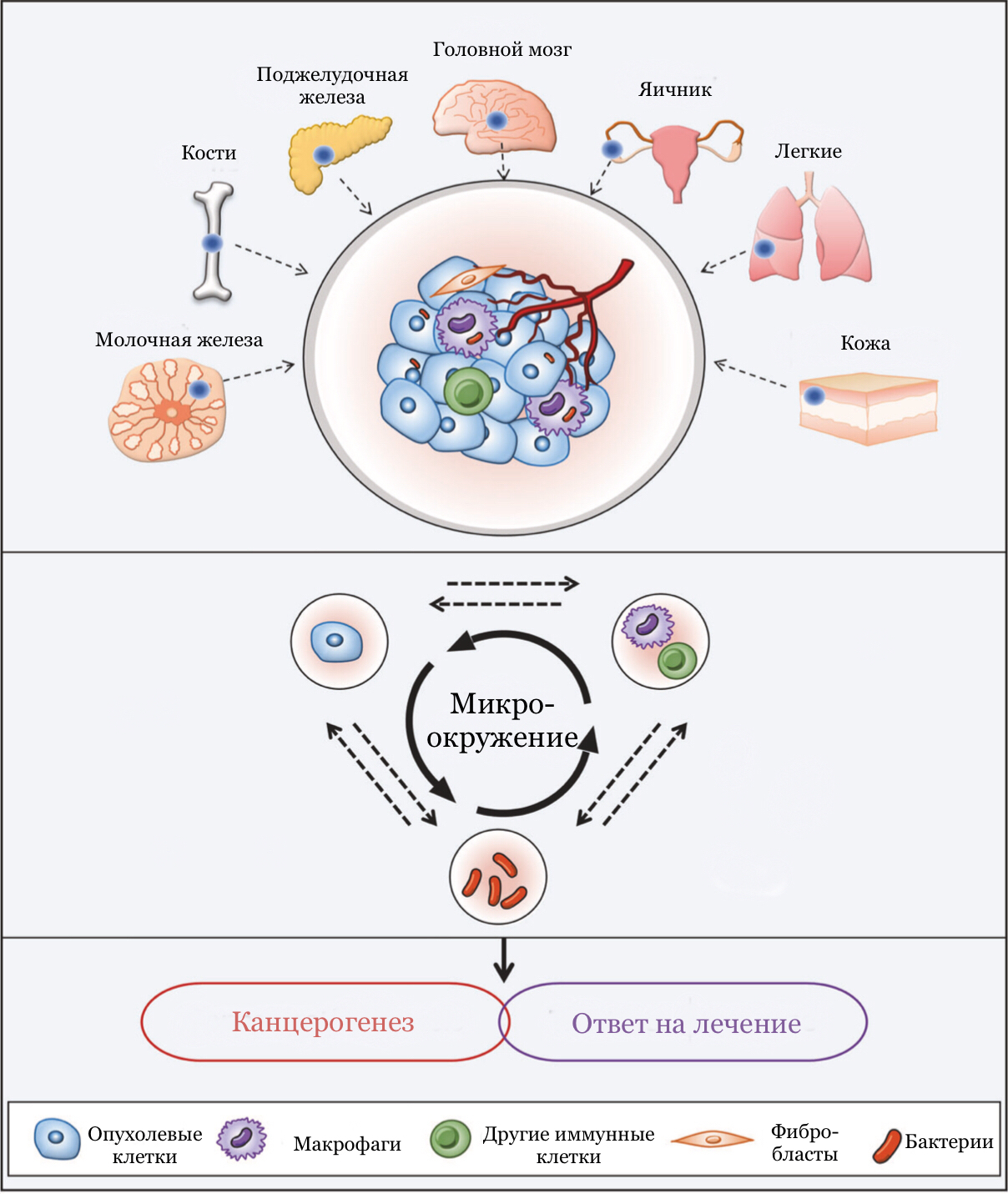
Рисунок 1. Микробиота как часть опухолевого микроокружения. Микробиом опухоли может активно участвовать в реконструкции микроокружения. Взаимодействие опухолевых клеток, бактерий, фибробластов, макрофагов и других иммунных клеток влияет на канцерогенез и результаты лечения.
Бактерии в организме селятся везде, где им вздумается. Больше всего крохотных жильцов обнаружено в толстой кишке — их численность составляет 1011 на мл содержимого кишечника. Количество бактерий на коже не менее внушительное — около 1011 на м2 [5]. При этом микробиота удивляет не только своей численностью, но и разнообразием. Ведь даже на роговице глаза удалось обнаружить около 221 видов различных бактерий [6].
Заселяя наше тело, микробиота защищает нас от патогенных микроорганизмов и участвует в поддержании гомеостаза. Помимо этого, бактерии способны аккомпанировать механизмам канцерогенеза. Одни микроорганизмы помогают опухоли выжить, другие, наоборот, с поличным выдают ее иммунным клеткам. Почему их влияние так важно? После того, как в клетке произойдут фатальные мутации и она приобретет «бессмертие», её дальнейшая судьба во многом зависит от микроокружения, в котором помимо нормальных клеток окружающей ткани, фибробластов и иммунных клеток, находятся и бактерии (рис. 1) [7]. Они составляют опухолевую микробиоту, которая, наряду с кишечной микробиотой, влияет на рост и развитие злокачественных клеток. Об этом мы и поговорим подробнее.
Клетки внутри клеток: бактерии, обитающие в опухолях
Внутриопухолевая микробиота
Бактерии являются частью опухолевого микроокружения, причем большинство из них расположено внутриклеточно. К такому выводу пришли ученые из Института Вейцмана в Израиле на основании исследования 1526 образцов 7 разных типов опухолей и окружающей их нормальной ткани [8]. Изучались образцы меланомы, глиобластомы, опухоли молочной железы, легких, яичников, толстого кишечника и поджелудочной железы.
Хотя набор микроорганизмов в каждой опухоли был разным и зависел от ее свойств (например, ответа на терапию или чувствительности к гормонам), были выявлены общие закономерности для каждого типа (рис. 2).
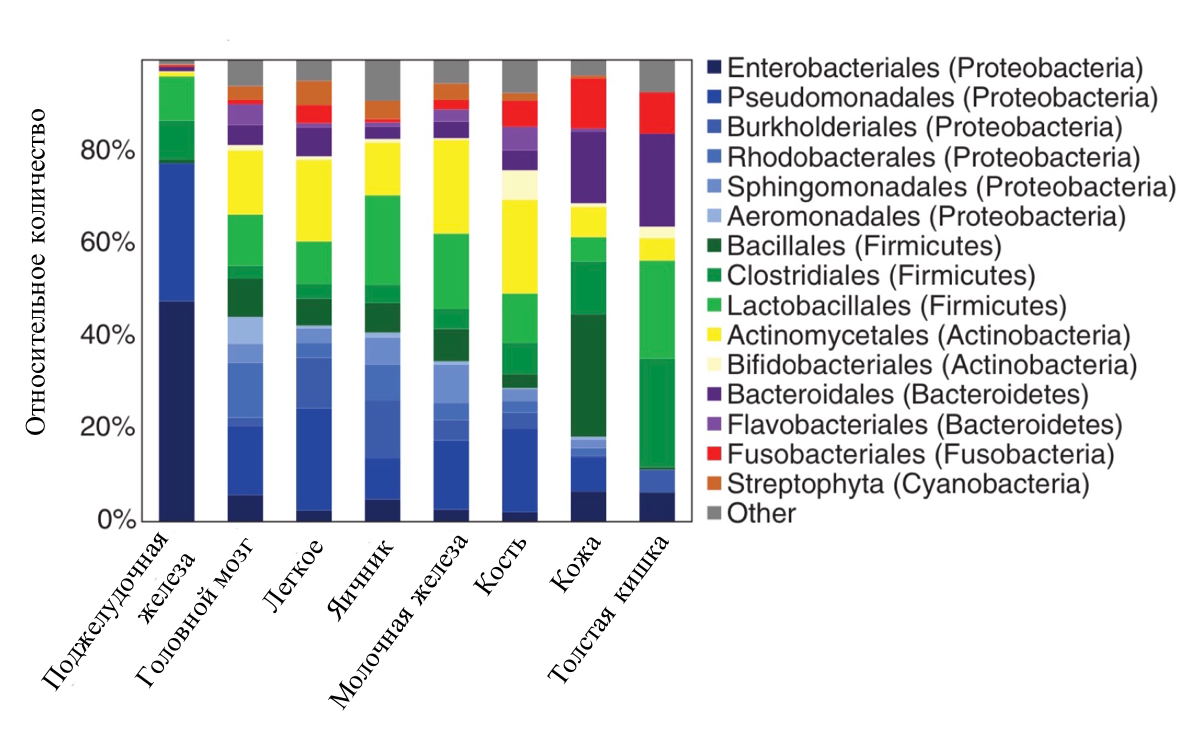
Рисунок 2. Различные типы опухолей имеют различный микробный состав. Для каждого типа опухоли характерен свой филотип. Снизу указан орган, в котором расположена опухоль, справа — филотипы микроорганизмов на уровне порядка.
Можно ли на основании этих данных сказать, что обнаруженные бактерии стали причиной развития опухоли? Нет. Вероятнее всего, микроорганизмы заселяли уже существующую опухоль. А создаваемые злокачественными клетками условия оказались привлекательной нишей для жизни микробов. Например, у курильщиков в опухолях легкого были обнаружены микроорганизмы, которые могут разлагать химические вещества табачного дыма (никотин, антранилат, толуол и фенол). Бактерии, способные на это, относятся к типам Proteobacteria, Actinobacteria и Cyanobacteria [9]. Обильное кровоснабжение опухоли (усиление ангиогенеза — один из ключевых признаков рака), низкая концентрация кислорода, иммуносупрессивная среда (позволяющая опухолевым клеткам ускользать от иммунного надзора), наличие субстрата для питания — все это, вероятно, делает опухоль неплохим местом для жизни микроорганизмов. Так почему бы бактериям не поселиться рядом с такими удобными соседями?
Как микробы попадают в опухоль?
Исследование образцов опухоли поджелудочной железы дает интересный ответ на вопрос, откуда в опухоли появляются бактерии. Оказалось, что микробиом опухоли примерно на 25% совпадает с микробиомом кишечника, около 20% бактерий совпадает с теми, что живут в прилегающей нормальной ткани, а остальные — уникальны [10]. Но на сегодняшний день нет точных данных, демонстрирующих, как именно бактерии мигрируют в опухоль. Однако это не мешает строить планы на будущее. Если связь кишечной и опухолевой микробиоты подтвердится, мы сможем управлять составом последней, подселяя новых жителей в кишечник. Нужно будет лишь подождать, пока микроорганизмы пройдут свой путь в поисках нового места жительства.
Влияние на исход лечения
Удивительно, но состав и разнообразие внутриопухолевого микробиома может влиять на продолжительность жизни пациента после лечения. В онкологическом центре им. М. Д. Андерсона Техасского университета обнаружили, что преобладание в опухолях представителей таксонов Pseudoxanthomonas, Saccharopolyspora и Streptomyces у пациентов с протоковой аденокарциномой поджелудочной железы ассоциировано с лучшим исходом после хирургического вмешательства. С чем это связано? Предполагается, что их присутствие положительно влияет на активацию иммунных клеток и инфильтрацию опухоли цитотоксическими CD8+ T-клетками [10]. Это те самые Т-лимфоциты, которые играют ключевую роль в противоопухолевой защите за счет способности непосредственно уничтожать злокачественные клетки [11].
Неожиданные связи: опухоль — кишечная микробиота
Мы помним, что часть внутриопухолевой микробиоты совпадает по составу с кишечной. Но на этом влияние кишечных бактерий на канцерогенез не заканчивается. Кишечная микробиота может оказывать как системный эффект, воздействуя на опухоли в отдаленных органах, так и на местный, влияя непосредственно на клетки кишечника. Помимо этого, от баланса кишечной микробиоты зависит работа иммунной системы, осуществляющей надзор за всеми клетками организма.
Начнем с простого и понятного утверждения: главная функция иммунной системы — защищать наш организм. Попадет в организм патогенная бактерия или очередной вирус — иммунитет должен дать отпор. Но как так вышло, что наш кишечник населяет целая армия бактерий, которая живет будто бы незамеченной и мирно сосуществует с хозяином? Совместная эволюция человека и его микробиоты привела к тому, что одни не могут существовать без других. Мы предоставляем микроорганизмам уютное место обитания и субстраты для питания, а они взамен выполняют множество непростых задач: синтезируют необходимые для нас витамины и даже некоторые нейромедиаторы, расширяют наш пищевой рацион, расщепляя волокна клетчатки, неперевариваемые в тонком кишечнике, и обеспечивают так называемую колонизационную резистентность — конкурируют с патогенными микроорганизмами и препятствуют их колонизации в кишечнике [12]. К тому же, от разнообразия состава кишечной микробиоты зависит баланс и адекватное развитие врожденного и приобретенного иммунитета [13].
Но возможность жить без подавления со стороны иммунитета микробиота получает только тогда, когда соблюдает четкие правила и не покидает пределы отведенного ей пространства — кишечника. Для поддержания столь тонкого баланса переговоры между микробиотой и иммунной системой ведутся не напрямую, а через кишечный барьер, который разделяет полость кишечника и внутреннюю среду организма. Он состоит из нескольких слоев: первый — слой слизи, в котором находятся антимикробные пептиды, гликопротеины и секреторный иммуноглобулин А (IgA); второй представлен одним слоем эпителиальных клеток (энтероцитов), которые соединены плотными межклеточными контактами; третий — субэпителиальный слой, в котором находятся клетки врожденного и адаптивного иммунитета, а также кровеносные сосуды [14].
Такая многоуровневая система необходима, чтобы микробиота могла существовать в кишечнике и при этом не вредить хозяину, а иммунные клетки могли отличать свое от чужого и не нападать на дружелюбных бактерий. Если баланс поддерживается, кишечные бактерии трудятся на благо человека и осуществляют противоопухолевую защиту в основном за счет синтеза короткоцепочечных жирных кислот и модулирования компонентов иммунной системы.
Проблемы начинаются тогда, когда баланс нарушается: возникает дисбактериоз, проницаемость кишечного барьера увеличивается. В таких условиях повышается вероятность того, что кишечная микробиота станет способствовать злокачественному перерождению клеток. Ее влияние на канцерогенез осуществляется через поддержание хронического воспаления, повреждение клеток и синтез метаболитов.
Кишечные бактерии и противоопухолевая защита
Короткоцепочечные жирные кислоты — одни из продуктов метаболизма анаэробной микробиоты кишечника, которые ответственны за поддержание гомеостаза слизистой оболочки толстой кишки. Столь важную функцию бутират, пропионат и ацетат осуществляют за счет способности модулировать местный иммунный ответ и поддерживать целостность кишечного барьера. Короткоцепочечные жирные кислоты стимулируют дифференцировку регуляторных T-клеток, экспрессию белков плотных контактов и секрецию муцина (MUC2) [15]. Помимо этого, они способны защищать слизистую кишечника благодаря влиянию на секрецию цитокинов.
Цитокины — это особые белковые молекулы, которые позволяют клеткам иммунитета «общаться» между собой и направлять действие друг друга. Среди них можно выделить провоспалительные цитокины, которые способствуют развитию воспалительной реакции, и противовоспалительные цитокины, которые сдерживают иммунный ответ. И те, и другие имеют важное значение в канцерогенезе, в чем мы убедимся далее [11].
Механизм защитного действия бутирата связан с усилением выработки противовоспалительного цитокина интерлейкина-18 (IL-18), что является результатом активации рецептора GPR109a на поверхности энтероцитов. Этот цитокин, влияя на секрецию IFN-γ, активирует клетки моноцитарно-макрофагального ряда, что усиливает антибактериальный и противоопухолевый иммунный ответ. Также IL-18 регулирует секрецию и доступность другого цитокина, IL-22, необходимого для регенерации слизистой оболочки кишечника [16]. Таким образом, бутират влияет на секрецию противовоспалительных цитокинов, необходимых для адекватной регенерации эпителия и поддержания целостности слизистой оболочки.
Метаболизм бутирата в нормальных и опухолевых клетках разный. В нормальных клетках бутират выполняет энергетическую функцию: он метаболизируется до ацетил-КоА и принимает участие в цикле трикарбоновых кислот. В опухолевых клетках, несмотря на аэробные условия, энергия добывается за счет гликолиза, в ходе которого глюкоза метаболизируется до лактата, а цикл трикарбоновых кислот практически не задействован (эффект Варбурга) [17].
Таким образом, в злокачественных клетках бутират остается неиспользованным. Накапливаясь внутри клеток, он действует как ингибитор гистоновой деацетилазы. Функция этого фермента — «отрезать» ацетильные радикалы от гистонов (белков, связанных с ДНК). Это приводит к изменению конформации хроматина: он переходит в конденсированное состояние; считывание информации с ДНК прекращается. Бутират, являясь ингибитором этого фермента, препятствует конденсации хроматина, регулируя экспрессию некоторых генов. Так, с помощью эпигенетических механизмов бутират контролирует гены, участвующие в пролиферации и апоптозе, подавляя рост опухолевых клеток [18], [19]. Роль бутирата в противоопухолевой защите представлена на рисунке 3.
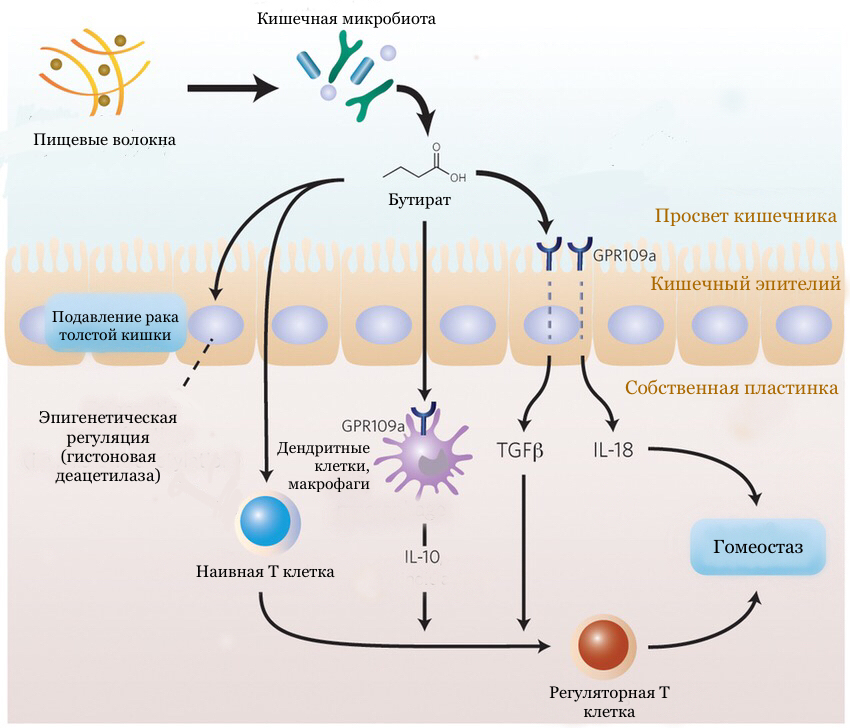
Рисунок 3. Участие бутирата в противоопухолевой защите. Короткоцепочечные жирные кислоты образуются в результате расщепления бактериями пищевых волокон. Бутират за счет ингибирования гистоновой деацетилазы способен подавлять пролиферацию опухолевых клеток (эпигенетическая регуляция). Также он способствует дифференцировке наивных CD4+ Т-клеток в регуляторные Т клетки. Бутират индуцирует секрецию эпителиальными клетками TGF-β. Связываясь с рецептором GPR109a на поверхности эпителиальных клеток, он стимулирует секрецию противовоспалительного цитокина — IL-18. Помимо этого, бутират стимулирует выработку IL-10 дендритными клетками и макрофагами.
Продуцировать бутират способны бактерии, относящиеся к роду Faecalibacterium и Roseburia. У пациентов с колоректальным раком количество этих бактерий снижено, что, по-видимому, влияет на проницаемость кишечного барьера и персистирование воспаления в слизистой оболочке кишки [15].
Наконец, кишечная микробиота способна активировать CD8+ T-клетки, которые играют ключевую роль в противоопухолевой защите. Ученым из Японии удалось идентифицировать 11 штаммов микроорганизмов, стимулирующих активацию IFN+ CD8+ Т-клеток. При этом количество цитотоксических Т-клеток увеличилось не только в кишечнике, но и в некоторых других органах. Этот системный эффект, вероятно, осуществляется за счёт циркуляции метаболитов (мевалонат и диметилглицерин), продуцируемых кишечной микробиотой [20]. Миграция CD8+ T-клеток из кишечника в удаленные органы маловероятна, так как фенотипически клетки, обнаруженные в кишечнике, и клетки, обнаруженные в других органах, отличаются [21].
Кишечные бактерии — участники канцерогенеза
Увеличение проницаемости кишечного барьера тесно связано с воспалением, которое может начаться как в самой кишке (в результате дисбаланса между вредными и полезными бактериями), так и в других органах, если микроорганизмы начнут путешествовать.
Транслокация микробиоты или связанных с ней липополисахаридов через кишечный барьер в другие органы, например, в поджелудочную железу, провоцирует воспаление и в конечном счете способствует развитию рака [22]. Первым звеном в запуске иммунной реакции является активация особых паттерн—распознающих рецепторов (PRR), отвечающих за узнавание молекулярных структур, характерных для микроорганизмов (например, липополисахаридов). К таким рецепторам относятся Toll-подобные рецепторы (TLR), Nod-подобные рецепторы (NLR) и другие. Наиболее изученными являются TLR [23]. Они экспонируются на мембранах клеток иммунитета, фибробластах, эпителиальных клетках и опухолевых клетках [24]. Запуск сигнала с TLR приводит к секреции провоспалительных цитокинов, основная функция которых — поддерживать воспаление. Провоспалительные цитокины — это ключевые игроки канцерогенеза, которые связаны с хроническим воспалением, усилением процессов ангиогенеза, созданием микросреды, способствующей инвазии и метастазированию опухолевых клеток [25]. Так, высокая экспрессия IL-11 в клетках рака почек связана с плохим прогнозом выживаемости пациентов [26].
Более подробный механизм влияния транслокации микробиоты на опухоль представлен на рисунке 4.
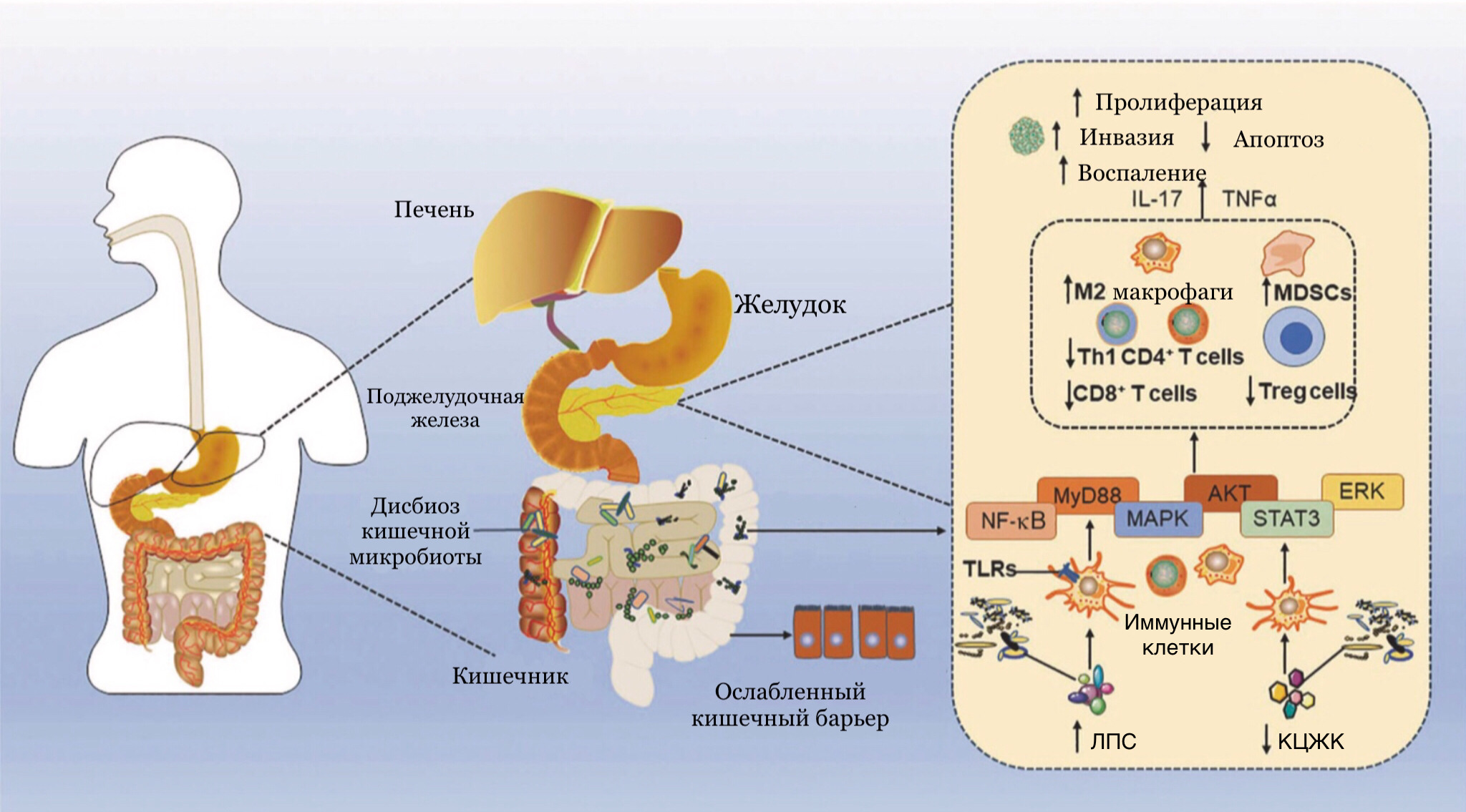
Рисунок 4. Предполагаемая связь между дисбактериозом кишечной микробиоты и раком поджелудочной железы.
Дисбактериоз кишечника связан с уменьшением количества короткоцепочечных жирных кислот и повышением проницаемости кишечного барьера, что может привести к транслокации кишечной микробиоты в поджелудочную железу. После взаимодействия Toll-подобных рецепторов с липополисахаридами бактерий возникает каскад реакций, приводящий к активации клеток врожденного иммунитета. Они начинают производить сигнальные молекулы цитокины, которые влияют на функционирование Т-лимфоцитов. В результате снижается количество T-регуляторных клеток (Treg), уменьшается рекрутирование Т-хелперов 1 (Th1) CD4+ T клеток и CD8+ T клеток. Поддерживается поляризация макрофагов М2 и активность супрессорных клеток миелоидного происхождения. В итоге в поджелудочной железе персистирует воспаление, увеличивается пролиферация опухолевых клеток и их способность к инвазии. Способность же опухолевых клеток к апоптозу уменьшается. (ЛПС — липополисахариды, КЦЖК — короткоцепочечные жирные кислоты).
Реакция воспаления опасна, потому что клетки, участвующие в этом процессе, секретируют факторы роста, проангиогенные факторы, активные формы кислорода и другие вещества, необходимые для существования опухолей.
Интересно, что взаимодействия микробиоты с Toll-подобными рецепторами может привести как к развитию опухоли, так и к ее регрессии. Это связано с тем, что результат активации TLR зависит от баланса поступающих сигналов и адекватности силы запущенного процесса. Поэтому активация одних и тех же молекул может привести к противоположным результатам. Так, стимуляция TLR 2,3,4,5,7/8,9 может способствовать противоопухолевой защите. В то же время, стимуляция TLR 2,4,7/8 может увеличить резистентность опухолей к химиотерапии и ускорить их пролиферацию [24].
Еще один ключевой фактор канцерогенеза — повреждение ДНК. Если клетке не удастся восстановить структуру ДНК, это повреждение сможет стать началом процесса злокачественного перерождения. Некоторые обитатели кишечника обладают генотоксичностью, то есть способностью повреждать генетический материал. Например, Escherichia coli и Klebsiella pneumonia продуцируют колибактин, который способен вызывать двухцепочечные разрывы в ДНК хозяина. Подобным эффектом обладает и токсин CDT, продуцируемый некоторыми Proteobacteria [27].
Другой путь влияния микроорганизмов на опухоли — воздействие продуктами метаболизма. Например, в опухолевых клетках колоректального рака усилена экспрессия фермента орнитиндекарбоксилазы, отвечающего за метаболизм полиаминов. Хотя полиамины необходимы для функционирования нормальных клеток, их повышенный синтез способствует канцерогенезу. Дифлуометилорнитин (DFMO) — препарат, способный ингибировать этот фермент [28]. Почему же его применение оказалось неэффективным в качестве монотерапии? После приема ингибиторов синтез эндогенных полиаминов действительно прекращался. Но оказалось, что их недостаток вполне восполняется экзогенными, то есть поступающими извне, соединениями. Бактерии, составляющие опухолевое микроокружение, тоже способны синтезировать полиамины [29]. Именно поэтому опухоль продолжала свой рост.
Опасны ли бактерии, живущие во рту?
Еще одним «густонаселенным» участком нашего тела, помимо кишечника, является ротовая полость. И самые щепетильные из нас не раз задумывались о том, сколько же бактерий находится в слюне... Задумались над этим и ученые. Установлено, что количество бактерий в ней достигает 109 [5]. Для систематизации микробиоты ротовой полости была создана специальная база данных — Human Oral Microbiome Database. На сегодняшний день в ней числится свыше 700 видов микроорганизмов. Есть среди них и те, кто участвуют в канцерогенезе опухолей головы и шеи, легких, толстой кишки и поджелудочной железы [30].
Механизмы, позволяющие бактериям полости рта влиять на канцерогенез, являются общими для микробиоты любой локализации. К ним относятся хроническое воспаление, подавление апоптоза и синтез канцерогенных веществ [31].
В ротовой полости за хроническое воспаление отвечают в основном анаэробные патогенные бактерии вида Porphyromonas, Prevotella, Fusobacterium. Их присутствие связано с высокой концентрацией цитокинов IL-1β, IL-6, IL-17, IL-23, TNF и матриксных металлопротеиназ MMP-8 и MMP-9 [31]. Все перечисленные цитокины относятся к провоспалительным, а, как мы помним, они способствуют поддержанию условий, необходимых для роста и развития опухолевых клеток.
Металлопротеиназы — это ферменты, которые играют важную роль в нормальных физиологических процессах, таких как эмбриональное развитие и морфогенез. Они способны расщеплять различные компоненты внеклеточного матрикса и базальной мембраны — коллаген, эластин, ламинин и другие. Опухолевые клетки также умеют использовать эти ферменты в своих целях: с помощью металлопротеиназ они разрушают компоненты базальной мембраны и отделяются от соседних клеток. Если опухолевые клетки ничем не сцеплены, мигрировать и проникать в соседние ткани им удается гораздо легче, то есть способность метастазировать увеличивается. Помимо этого, металлопротеиназы способны усиливать ангиогенез, что крайне важно для роста опухоли [32].
Одним из ключевых признаков рака является сопротивление клеточной гибели [9]. Апоптоз — одна из форм запрограммированной клеточной гибели, при которой клетка, которая уже накопила вредные мутации и не может выполнять свои функции, самоуничтожается без неприятных последствий для организма. Но опухолевые клетки в процессе злокачественного перерождения приобретают способность становиться нечувствительными к сигналам гибели. В этом им помогает бактерия Porphyromonas gingivalis, которая может заражать опухолевые клетки и стимулировать передачу противоапоптотических сигналов по пути Jak1/Akt/Stat3 [20]. Кроме того, бактерия вырабатывает цистеиновые протеиназы — гингипаины, которые активируют матриксную металлопротеиназу-9 [33]. Активация этого фермента приводит к деградации структур базальной мембраны, в результате чего клетки приобретают способность к миграции. Механизм влияния P. gingivalis на опухоль представлен на рисунке 5.
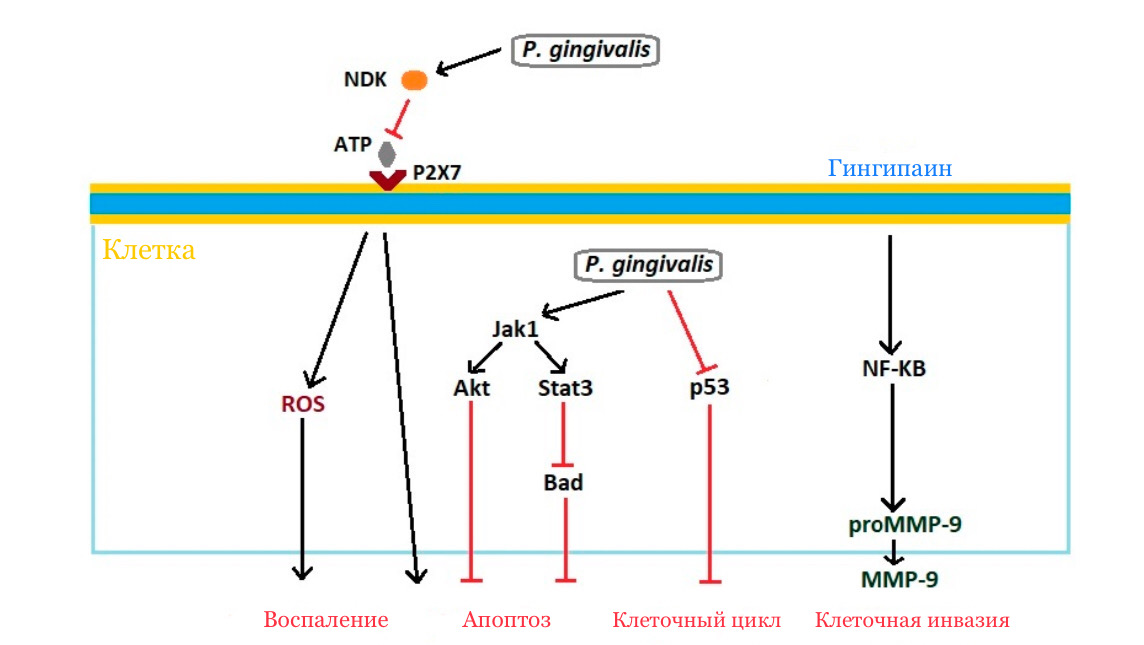
Рисунок 5. Влияние Porphyromonas gingivalis на канцерогенез.
P. gingivalis секретирует фермент — нуклеозид дифосфат киназу (NDK), который расщепляет АТФ (ATP) и предотвращает активацию проапоптотического рецептора P2X7. Также фермент моделирует активные формы кислорода ROS и инициирует воспаление. Бактерия активирует антиапоптотический путь Jak1/Akt/Stat3 и уменьшает уровень белка p53, отвечающего за противоопухолевую защиту. Гингипаин через ядерный фактор κB (NF-κB) расщепляет профермент MMP-9 до активной формы.
Вряд ли кто-нибудь из нас откажет себе в удовольствии «что-нибудь пожевать». Поэтому и микробы в ротовой полости всегда найдут чем поживиться. Они не сидят без дела, а активно метаболизируют. Что? Например, алкоголь. За счет фермента алкогольдегидрогеназы микроорганизмы превращают алкоголь в ацетальдегид, который является химическим канцерогеном. На это способны некоторые виды стрептококков — S. gordonii, S. mitis, S. oralis, S. salivarius, S. sanguinis, грибы рода Candida и бактерии рода Neisseria [34], [35].
От истории к новым открытиям
Особый интерес к микробиоте появился в 2007 году, когда Национальный институт здравоохранения США запустил проект «Микробиом человека». В ходе проекта выяснилось, что количество генов микроорганизмов в нашем теле превышает количество генов, принадлежащих человеку, примерно в 100 раз. То есть мы лишь на 1% состоим из собственных генов. Стало очевидным, что микроорганизмы влияют на нас гораздо больше, чем мы думаем. Однако понимание того, какую роль играют микроорганизмы в развитии той или иной опухоли, остается еще неполным. Мы уже успели разобрать общие механизмы влияния бактерий различных частей тела на злокачественное перерождение клеток. Далее мы разберем, как бактерии влияют на конкретные опухоли. В качестве примера привожу две наиболее изученные опухоли: колоректальный рак и рак молочной железы.
Колоректальный рак
Колоректальный рак занимает четвертое место среди причин смертности от онкологических заболеваний в мире [36]. При этом у 45% больных колоректальный рак ассоциируется с наличием в кишечнике бактерии F. nucleatum [37].
Fusobacterium nucleatum — анаэробная грамотрицательная бактерия, которая является комменсальным жителем ротовой полости. Ее относят к микроорганизмам, связанным с различными формами пародонтита. Помимо этого, она известна своей способностью покидать ротовую полость и по кровеносной системе достигать различных отдаленных органов. F. nucleatum обнаруживают в опухолях молочной железы, поджелудочной железы и толстой кишки, где она, по всей видимости, играет не последнюю роль в канцерогенезе [38], [39]. Также F. nucleatum обладает уникальными факторами вирулентности — адгезином FadA, Fap2 и RadD. Путешествовать по кровеносной системе ей удается за счет адгезина FadA, который позволяет бактерии прикрепляться к эпителиальным клеткам сосудов. Рецептором для FadA является сосудистый эндотелиальным кадгерин (VE) — молекула межклеточного взаимодействия, скрепляющая клетки вместе. FadA связывается с VE-кадгерином, вызывая его перемещение, в результате чего проницаемость эндотелия увеличивается, и бактерия проникает в кровоток [40]. Путешествуя по кровеносной системе, F. nucleatum попадает в кишечник, где способствует развитию колоректального рака за счет нескольких механизмов — инвазии, колонизации и секреции провоспалительных цитокинов.
Белок FadA, помимо адгезии к эндотелиальным клеткам, позволяет бактерии прикрепляться как к нормальным эпителиальным клеткам кишечника, так и к опухолевым клеткам. F. nucleatum связывается с эпителиальным кадгерином (или Е-кадгерином), белком, который пронизывает клеточную мембрану и позволяет клеткам удерживаться вместе [41]. Благодаря этому активируется путь Wnt/β-катенин, который в норме регулирует пролиферацию и дифференцировку клеток, генетическую стабильность и апоптоз. [42]. Аберрантная активация этого пути приводит к накоплению β-катенина в ядре и способствует активации онкогенов, таких как c-Myc и циклин D1 (рис. 6). Помимо этого, за счет активации провоспалительных генов создается микроокружение, способствующее развитию колоректального рака.
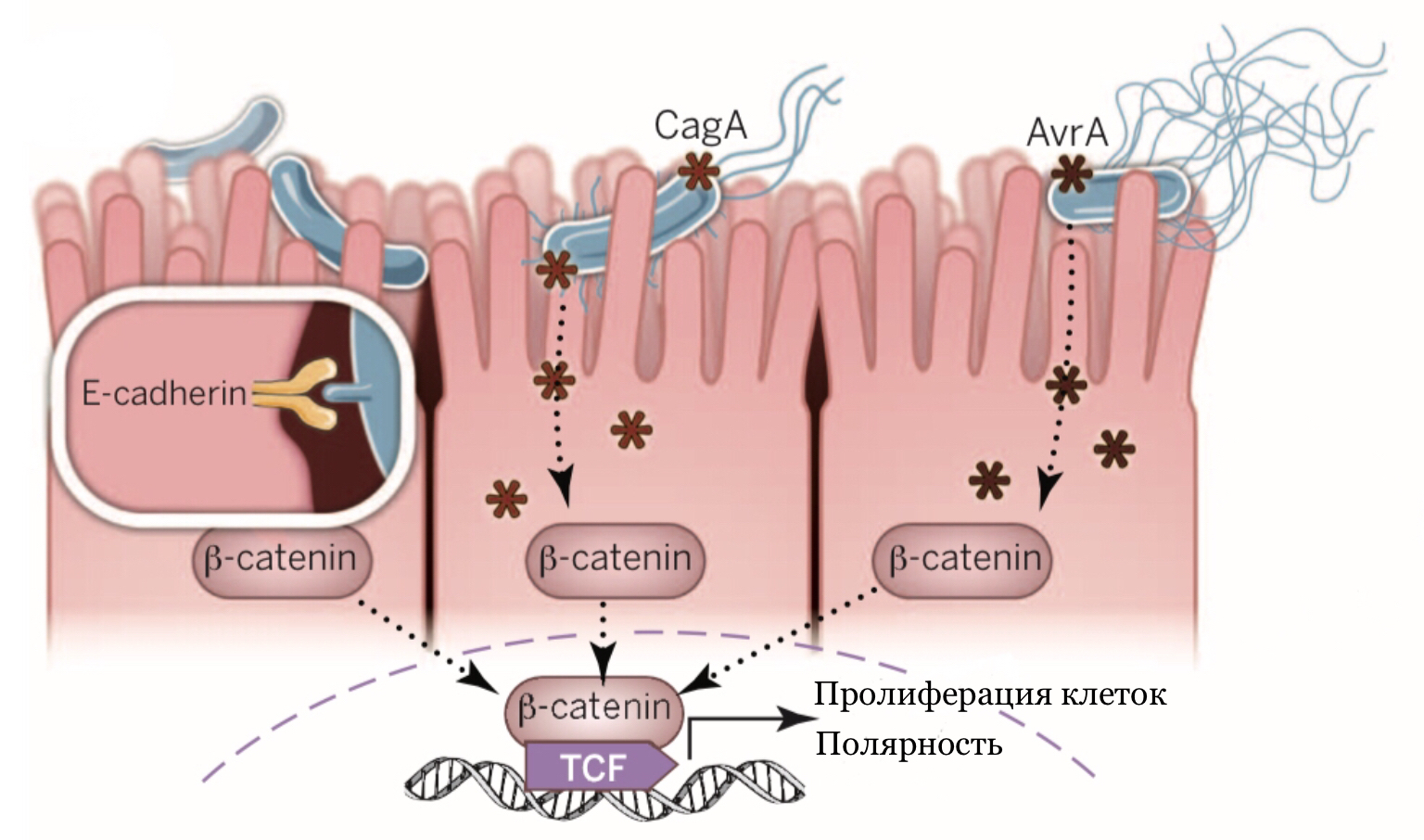
Рисунок 6. Механизмы активации пути Wnt/β-катенин бактериями.
F. nucleatum взаимодействует с Е-кадгерином посредством адгезина FadA (белая рамка). Через него активируется путь Wnt/ β-катенин, происходит транслокация β-катенина в ядро и изменяется экспрессия провоспалительных генов, генов Wnt, онкогенов C-Myc и циклина D1. Также указан механизм активации пути через эффекторы CagA или AvrA, которые активируют передачу сигналов β-катенина.
Другой белок внешней мембраны — Fap2 — относится к лектинам, то есть белкам, способным связываться с углеводами на поверхности клеток. С помощью него F. nucleatum прикрепляется к полисахариду Gal-GalNAc, который сверхэкспрессируется на поверхности клеток колоректального рака. Этим объясняется то, что бактерии как бы собираются вокруг опухоли и колонизируют ее значительно активнее, чем окружающую нормальную ткань [43]. Помимо этого, адгезин Fap2 позволяет F. nucleatum стимулировать в опухолевых клетках выработку провоспалительных цитокинов — IL-8 (хемокин и активатор нейтрофилов), а также CXCL1 (хемокин) [44]. За счет этого вокруг опухоли создаются условия, усиливающие процесс метастазирования (рис. 7).
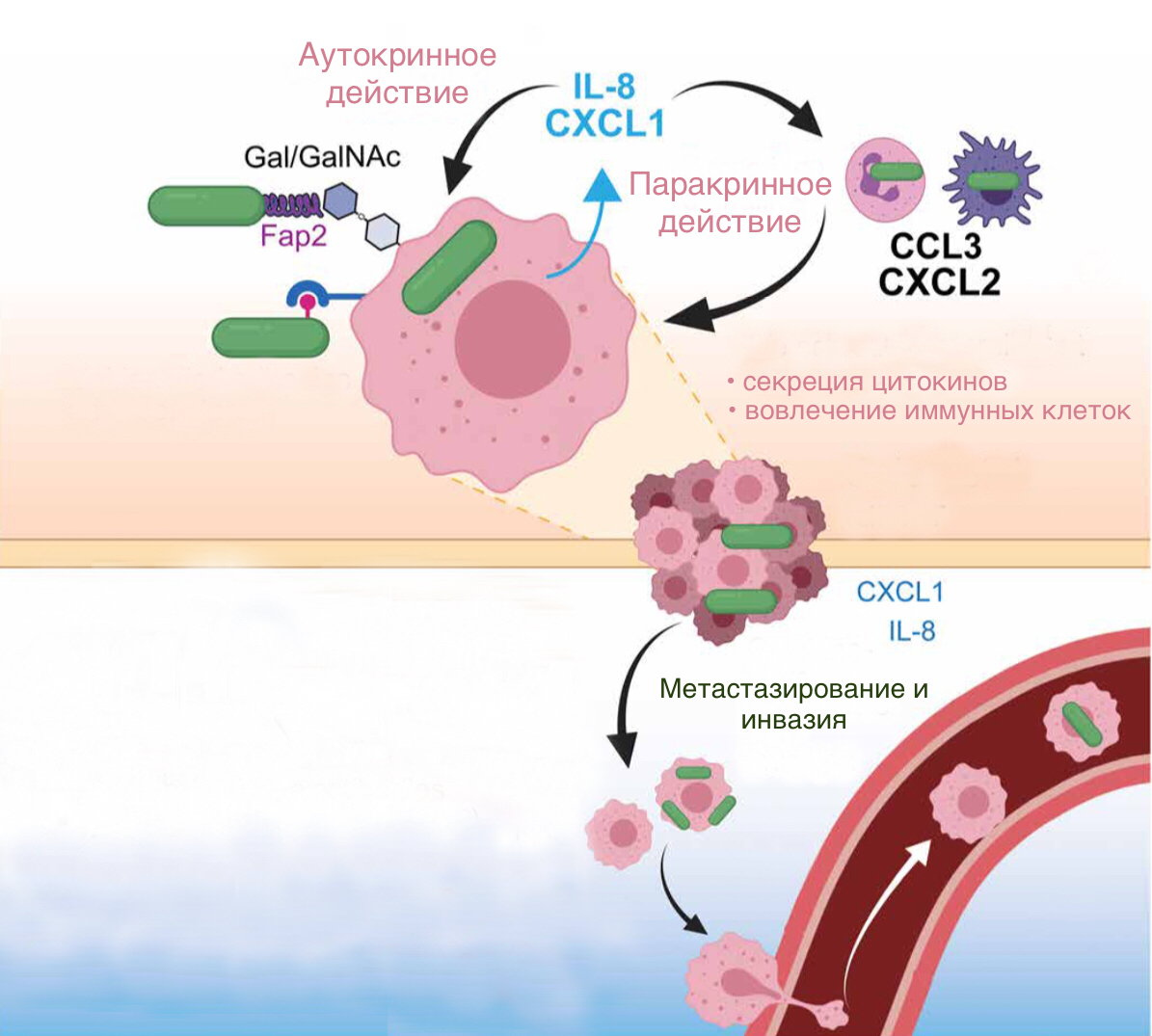
Рисунок 7. Модель влияния F. nucleatum на метастазирование через передачу сигналов цитокинов. После связывания адгезина Fap2 с полисахаридом Gal-GalNAc, опухолевая клетка начинает секретировать два цитокина — IL—8 и CXCL1. Оба цитокина способны проявлять аутокринное действие, то есть воздействовать на рецепторы, расположенные на поверхности той же клетке, что их секретирует. Также они оказывают паракринное действие — влияют на соседние иммунные клетки и стимулируют их вырабатывать собственные цитокины, влияющие на метастазировании опухоли — CXCL2, CCL3 и TNF.
Находясь в кишечнике, F. nucleatum взаимодействует и с другими микроорганизмами, окружающими опухоль. Белок RadD может выступать посредником в общении между F. nucleatum и другими бактериями, что способствует образованию многовидовых биопленок [45]. В результате формируются условия, благоприятные для колонизации F. nucleatum.
Наличие F. nucleatum в опухолях толстой кишки ассоциировано с плохим прогнозом выживаемости пациентов [46]. Это наводит на мысль о том, что в ходе лечения пациентов с колоректальным раком необходимо учитывать состав кишечной микробиоты и более подробно изучать ее влияние на течение заболевания.
Рак молочной железы
Молочная железа обладает собственной микробиотой, причем развитие онкологического заболевания приводит к значительному изменению её состава (рис. 8) [47].
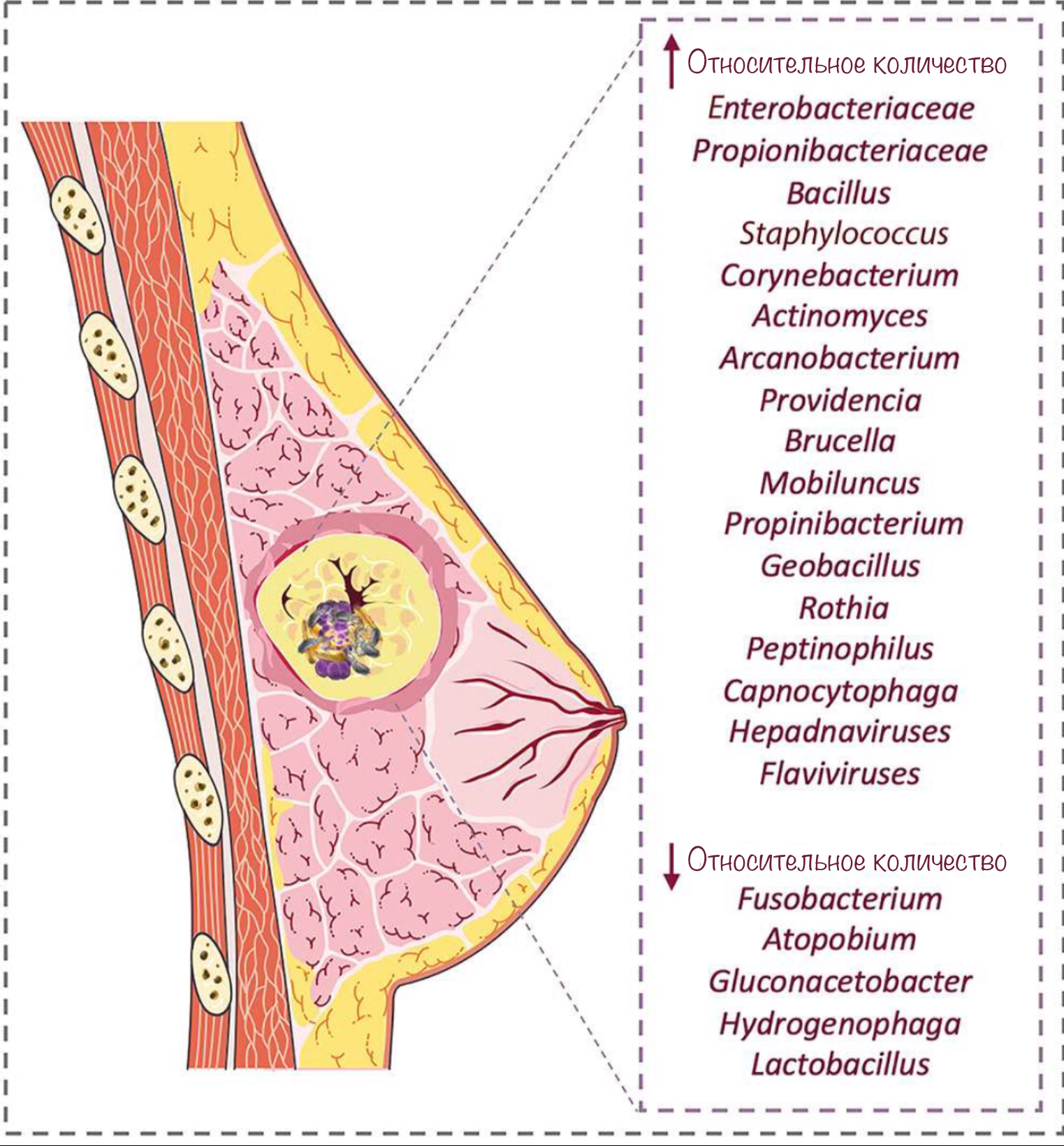
Рисунок 8. Изменение состава микробиоты молочной железы в опухолевой ткани в сравнении с нормальной.
В среднем, каждая восьмая женщина в мире сталкивается с раком молочной железы. Это коварное заболевание нередко связано с наследственной предрасположенностью (мутациями в генах BRCA1 и BRCA2) и с гормональным фоном — воздействием на организм женщины эстрогена [48]. Вклад в риск развития рака молочной железы вносит и кишечная микробиота.
Кишечный эстроболом — это совокупность кишечных бактериальных генов, продукты которых способны метаболизировать эстроген [49]. Бактерии, обладающие этими генами, способны влиять на уровень эстрогена в крови.
В организме человека метаболизм эстрогена осуществляется в печени, где происходит реакция конъюгации, то есть присоединение к гормону серной кислоты (сульфатирование) или глюкозы (гликозилирование). Этот процесс позволяет превратить эстроген в менее активное и более полярное соединение, которое может быть выведено из организма. Конъюгированный эстроген попадает вместе с желчью в кишечник.
Диета, богатая сахарами и жирами, но скудная по содержанию клетчатки, способствует увеличению в кишечнике бактерий, обладающих ферментом β-глюкуронидазой. Этот фермент, помимо расщепления сахаров, отвечает за деконъюгацию эстрогена, что делает возможным его обратное всасывание и возвращение в кровоток. К бактериям кишечной микробиоты, обладающим β-глюкуронидазой, относятся представители рода Collinsella, Edwardsiella, Alistipes, Bacterioides [50].
Здоровая же диета, богатая растительной пищей, клетчаткой и цельнозерновыми продуктами, наоборот, способствует росту «правильной» микробиоты. Бактерии типов Firmicutes, Bacteroidetes и Actinobacteria способны усиливать метаболизм эстрогена, снижая его содержание в организме [51]. Так, регулируя пищевой рацион, можно влиять на состав микробиоты и снижать риск рака молочной железы.
Еще один способ борьбы с раком
На сегодняшний день нет сомнений, что микробиота оказывает множество разносторонних эффектов на опухоли. Данные различных экспериментов дополняют друг друга и постепенно выстраиваются в общую картину. Но путь в понимании того, как управлять микробиотой во благо человека, только начался. Во-первых, необходимо определить, какие таксоны микроорганизмов связаны с положительными эффектами и возможно ли их использование в терапевтических целях. Во-вторых, нужно понять, какие методы позволят эффективно менять состав микробиоты. На сегодняшний день используется метод трансплантации фекальной микробиоты, в ходе которого в кишечник пациента вводится стул здорового донора. Этот метод уже применяется в онкогематологии для нормализации кишечной микробиоты у пациентов после трансплантации костного мозга [52]. Но будет ли он эффективен в качестве терапии онкологических заболеваний — это еще предстоит выяснить. Другой путь — придерживаться диеты с высоким содержанием клетчатки, чтобы создать в кишечнике условия, необходимые для размножения полезной микробиоты. Этот вариант может рассматриваться в качестве профилактики не только онкологических, но и многих других заболеваний, связанных с микробиотой. Поиск новых методов изменения состава микробиоты не прекращается: использование фрагментов клеточной стенки бактерий или отдельных метаболитов, которые способны оказывать благоприятный эффект, сможет сделать процедуру более доступной и эффективной.
Возможно, в будущем изменение состава микробиоты сможет стать шестым способом борьбы с онкологическими заболеваниями, наряду с хирургическим лечением, химиотерапией, лучевой терапией, таргетной терапией и иммунотерапией.
Литература
- Catherine de Martel, Damien Georges, Freddie Bray, Jacques Ferlay, Gary M Clifford. (2020). Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis. The Lancet Global Health. 8, e180-e190;
- Beatriz Serrano, María Brotons, Francesc Xavier Bosch, Laia Bruni. (2018). Epidemiology and burden of HPV-related disease. Best Practice & Research Clinical Obstetrics & Gynaecology. 47, 14-26;
- Alla Arzumanyan, Helena M. G. P. V. Reis, Mark A. Feitelson. (2013). Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma. Nat Rev Cancer. 13, 123-135;
- Eric Van Cutsem, Xavier Sagaert, Baki Topal, Karin Haustermans, Hans Prenen. (2016). Gastric cancer. The Lancet. 388, 2654-2664;
- Ron Sender, Shai Fuchs, Ron Milo. (2016). Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 14, e1002533;
- Qunfeng Dong, Jennifer M. Brulc, Alfonso Iovieno, Brandon Bates, Aaron Garoutte, et. al.. (2011). Diversity of Bacteria at Healthy Human Conjunctiva. Invest. Ophthalmol. Vis. Sci.. 52, 5408;
- Kunming Zhao, Ying Hu. (2020). Microbiome harbored within tumors: a new chance to revisit our understanding of cancer pathogenesis and treatment. Sig Transduct Target Ther. 5;
- Deborah Nejman, Ilana Livyatan, Garold Fuks, Nancy Gavert, Yaara Zwang, et. al.. (2020). The human tumor microbiome is composed of tumor type–specific intracellular bacteria. Science. 368, 973-980;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Erick Riquelme, Yu Zhang, Liangliang Zhang, Maria Montiel, Michelle Zoltan, et. al.. (2019). Tumor Microbiome Diversity and Composition Influence Pancreatic Cancer Outcomes. Cell. 178, 795-806.e12;
- Иммунитет: борьба с чужими и… своими;
- Новые функции кишечной микрофлоры;
- Микробиом кишечника: мир внутри нас;
- A. L. Kovaleva, E. A. Poluektova, O. S. Shifrin. (2020). Intestinal Barrier, Permeability and Nonspecific Inflammation in Functional Gastrointestinal Disorders. Rossijskij žurnal gastroènterologii, gepatologii, koloproktologii. 30, 52-59;
- Xinqiang Wu, Yuanbing Wu, Liangmei He, Longhuo Wu, Xiangcai Wang, Zhiping Liu. (2018). Effects of the intestinal microbial metabolite butyrate on the development of colorectal cancer. J. Cancer. 9, 2510-2517;
- Lidia Sánchez-Alcoholado, Bruno Ramos-Molina, Ana Otero, Aurora Laborda-Illanes, Rafael Ordóñez, et. al.. (2020). The Role of the Gut Microbiome in Colorectal Cancer Development and Therapy Response. Cancers. 12, 1406;
- Wissam Zam, Imtissal Ahmed, Haneen Yousef. (2020). Warburg effects on cancer cells survival: the role of sugar starvation in cancer therapy. CCP. 15;
- Dallas R. Donohoe, Leonard B. Collins, Aminah Wali, Rebecca Bigler, Wei Sun, Scott J. Bultman. (2012). The Warburg Effect Dictates the Mechanism of Butyrate-Mediated Histone Acetylation and Cell Proliferation. Molecular Cell. 48, 612-626;
- Won-Jae Lee, Koji Hase. (2014). Gut microbiota–generated metabolites in animal health and disease. Nat Chem Biol. 10, 416-424;
- Takeshi Tanoue, Satoru Morita, Damian R. Plichta, Ashwin N. Skelly, Wataru Suda, et. al.. (2019). A defined commensal consortium elicits CD8 T cells and anti-cancer immunity. Nature. 565, 600-605;
- B. Brett Finlay, Romina Goldszmid, Kenya Honda, Giorgio Trinchieri, Jennifer Wargo, Laurence Zitvogel. (2020). Can we harness the microbiota to enhance the efficacy of cancer immunotherapy?. Nat Rev Immunol. 20, 522-528;
- Li-long Pan, Bin-bin Li, Xiao-hua Pan, Jia Sun. (2020). Gut microbiota in pancreatic diseases: possible new therapeutic strategies. Acta Pharmacol Sin;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Zuzanna Urban-Wojciuk, Mohd M. Khan, Benjamin L. Oyler, Robin Fåhraeus, Natalia Marek-Trzonkowska, et. al.. (2019). The Role of TLRs in Anti-cancer Immunity and Tumor Rejection. Front. Immunol.. 10;
- Giovanni Germano, Paola Allavena, Alberto Mantovani. (2008). Cytokines as a key component of cancer-related inflammation. Cytokine. 43, 374-379;
- Deng Pan, Le Xu, Haiou Liu, Weijuan Zhang, Weisi Liu, et. al.. (2015). High expression of interleukin‐11 is an independent indicator of poor prognosis in clear‐cell renal cell carcinoma. Cancer Sci. 106, 592-597;
- Aadra P. Bhatt, Matthew R. Redinbo, Scott J. Bultman. (2017). The role of the microbiome in cancer development and therapy. CA: A Cancer Journal for Clinicians. 67, 326-344;
- K P Raj, J A Zell, C L Rock, C E McLaren, C Zoumas-Morse, et. al.. (2013). Role of dietary polyamines in a phase III clinical trial of difluoromethylornithine (DFMO) and sulindac for prevention of sporadic colorectal adenomas. Br J Cancer. 108, 512-518;
- Rosanna Tofalo, Simone Cocchi, Giovanna Suzzi. (2019). Polyamines and Gut Microbiota. Front. Nutr.. 6;
- F.R.F. Teles, F. Alawi, R.M. Castilho, Y. Wang. (2020). Association or Causation? Exploring the Oral Microbiome and Cancer Links. J Dent Res. 99, 1411-1424;
- Tomasz Karpiński. (2019). Role of Oral Microbiota in Cancer Development. Microorganisms. 7, 20;
- Elena I. Deryugina, James P. Quigley. (2006). Matrix metalloproteinases and tumor metastasis. Cancer Metastasis Rev. 25, 9-34;
- Hiroaki Inaba, Hideyuki Sugita, Masae Kuboniwa, Soichi Iwai, Masakazu Hamada, et. al.. (2014). Porphyromonas gingivalispromotes invasion of oral squamous cell carcinoma through induction of proMMP9 and its activation. Cell Microbiol. 16, 131-145;
- Sylvia I. Pavlova, Ling Jin, Stephen R. Gasparovich, Lin Tao. (2013). Multiple alcohol dehydrogenases but no functional acetaldehyde dehydrogenase causing excessive acetaldehyde production from ethanol by oral streptococci. Microbiology. 159, 1437-1446;
- Elizabeth A. Mazzio, Bruce Smith, Karam F. A. Soliman. (2010). Evaluation of endogenous acidic metabolic products associated with carbohydrate metabolism in tumor cells. Cell Biol Toxicol. 26, 177-188;
- Evelien Dekker, Pieter J Tanis, Jasper L A Vleugels, Pashtoon M Kasi, Michael B Wallace. (2019). Colorectal cancer. The Lancet. 394, 1467-1480;
- Kensuke Yamamura, Yoshifumi Baba, Keisuke Miyake, Kenichi Nakamura, Hironobu Shigaki, et. al.. (2017). Fusobacterium nucleatum in gastroenterological cancer: Evaluation of measurement methods using quantitative polymerase chain reaction and a literature review. Oncol Lett;
- Lishay Parhi, Tamar Alon-Maimon, Asaf Sol, Deborah Nejman, Amjad Shhadeh, et. al.. (2020). Breast cancer colonization by Fusobacterium nucleatum accelerates tumor growth and metastatic progression. Nat Commun. 11;
- Kei Mitsuhashi, Katsuhiko Nosho, Yasutaka Sukawa, Yasutaka Matsunaga, Miki Ito, et. al.. (2015). Association ofFusobacteriumspecies in pancreatic cancer tissues with molecular features and prognosis. Oncotarget. 6, 7209-7220;
- Yann Fardini, Xiaowei Wang, Stéphanie Témoin, Stanley Nithianantham, David Lee, et. al.. (2011). Fusobacterium nucleatum adhesin FadA binds vascular endothelial cadherin and alters endothelial integrity. Molecular Microbiology. 82, 1468-1480;
- Wendy S. Garrett. (2015). Cancer and the microbiota. Science. 348, 80-86;
- Sachin Gopalkrishna Pai, Benedito A. Carneiro, Jose Mauricio Mota, Ricardo Costa, Caio Abner Leite, et. al.. (2017). Wnt/beta-catenin pathway: modulating anticancer immune response. J Hematol Oncol. 10;
- Jawad Abed, Johanna E.M. Emgård, Gideon Zamir, Mouhammad Faroja, Gideon Almogy, et. al.. (2016). Fap2 Mediates Fusobacterium nucleatum Colorectal Adenocarcinoma Enrichment by Binding to Tumor-Expressed Gal-GalNAc. Cell Host & Microbe. 20, 215-225;
- Michael A. Casasanta, Christopher C. Yoo, Barath Udayasuryan, Blake E. Sanders, Ariana Umaña, et. al.. (2020). Fusobacterium nucleatum host-cell binding and invasion induces IL-8 and CXCL1 secretion that drives colorectal cancer cell migration. Sci. Signal.. 13, eaba9157;
- Christopher W. Kaplan, Renate Lux, Susan Kinder Haake, Wenyuan Shi. (2009). TheFusobacterium nucleatumouter membrane protein RadD is an arginine-inhibitable adhesin required for inter-species adherence and the structured architecture of multispecies biofilm. Molecular Microbiology. 71, 35-47;
- Kosuke Mima, Reiko Nishihara, Zhi Rong Qian, Yin Cao, Yasutaka Sukawa, et. al.. (2016). Fusobacterium nucleatumin colorectal carcinoma tissue and patient prognosis. Gut. 65, 1973-1980;
- Zahra Eslami-S, Keivan Majidzadeh-A, Sina Halvaei, Fatemeh Babapirali, Rezvan Esmaeili. (2020). Microbiome and Breast Cancer: New Role for an Ancient Population. Front. Oncol.. 10;
- Рак молочной железы с семейной историей;
- Claudia S. Plottel, Martin J. Blaser. (2011). Microbiome and Malignancy. Cell Host & Microbe. 10, 324-335;
- Maryann Kwa, Claudia S. Plottel, Martin J. Blaser, Sylvia Adams. (2016). The Intestinal Microbiome and Estrogen Receptor–Positive Female Breast Cancer. JNCI: Journal of the National Cancer Institute;
- Balazs Bodai. (2020). Breast Cancer: Lifestyle, the Human Gut Microbiota/Microbiome, and Survivorship. TPJ. 24;
- O. V. GOLOSHCHAPOV, Pavlov First St.Petersburg State Medical University, D. V. CHURAKINA, M. А. KUCHER, R. V. KLEMENTEVA, et. al.. (2019). FECAL MICROBIOTA TRANSPLANTATION IN CRITICAL CONDITION PATIENTS IN HEMATOLOGICAL PRACTICE. VAIR. 16, 63-73.






