
Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года
13 января 2012
Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года
- 7042
- 0
- 10
Чарльз Джейнуэй-младший (1943–2003) (слева) и Руслан Меджитов, профессор иммунологии в Йельском университете, исследователь Медицинского института Говарда Хьюза (справа)
-
Автор
-
Редакторы
Осенью прошлого года я была ошеломлена, когда не увидела имени Руслана Меджитова среди лауреатов Нобелевской премии по физиологии и медицине 2011 года. Его вклад в открытие толл-подобных рецепторов широко признан: в 2010 году он разделил с Жюлем Хоффманом Премию Розенстила за разъяснение механизмов врождённого иммунитета и был среди лауреатов премии Шао в 2011-м. Чарльз Джейнуэй предложил революционную идею: толл-подобные рецепторы врождённого иммунитета активируют адаптивный иммунный ответ. Руслан Меджитов первым открыл толл-подобный рецептор позвоночных и подтвердил идею Джейнуэя экспериментально. Протест против решения Нобелевского комитета, который не упоминает о вкладе Чарльза Джейнуэя и Руслана Меджитова, уже выразили и известные иммунологи, и студенты.
В 80-х годах прошлого столетия в центре внимания иммунологов была адаптивная (или специфическая) иммунная система. Специфический иммунный ответ (например, продукция антител против конкретного вируса) адаптируется к разнообразию патогенов, с которыми организм сталкивается в течение жизни, и формирует иммунологическую память. Большинство иммунологов изучало молекулярные детали рецепторов Т- и В-лимфоцитов и эффекторных механизмов адаптивного иммунитета (таких как антитела и лимфоциты-киллеры). Было известно, что репертуар рецепторов на поверхности лимфоцитов до встречи с антигеном не лимитирован и способен узнать практически любую молекулу [1].
Чтобы успешно бороться с инфекцией, не нанося вреда организму, иммунная система должна отличать патогены от клеток своего организма, — то есть «своё от не своего», как сформулировал еще в конце 1950-х австралийский вирусолог Бернет (M. Burnet), создатель клонально-селекционной теории адаптивного иммунитета [1]. Предполагалось, что рецепторы Т- и В-лимфоцитов, которые узнают «своё», заранее исключаются из участия в иммунном ответе.
Механизмы врождённого иммунитета (например, функции макрофагов и нейтрофилов) также изучались, но их рассматривали отдельно от адаптивного иммунитета, не предполагая существования связи между ними. Рецепторы клеток врождённого иммунитета генетически закодированы и неизменны в течение жизни.
Революционная идея Чарльза Джейнуэя
Некоторые экспериментальные факты, известные к тому времени, нельзя было объяснить, если рассматривать адаптивный иммунитет изолированно.
- Во-первых, для активации Т- и В-лимфоцитов необходимо два сигнала: стимуляция рецептора Т- или В-клетки и второй, костимулирующий сигнал, на который впервые указали Бретчер (P. Bretscher) и Кон (M. Cohn) в 1970 году [2]. Было известно, что этот «второй» сигнал передаётся Т-лимфоцитам костимулирующими молекулами B7 (гликопротеины из семейства иммуноглобулинов), расположенными на поверхности антиген-презентирующих клеток, и что именно этот сигнал определяет, будет ли индуцирован иммунный ответ при взаимодействии Т-клеточного рецептора со своим лигандом. Если взаимодействие Т-клеточного рецептора с лигандом происходит в отсутствии «второго» сигнала, то лимфоциты не активируются. Что определяет наличие «второго» сигнала, оставалось загадкой.
- Во-вторых, антитела на очищенные белки нельзя получить без адъюванта, в состав которого входят инактивированные микробы или их компоненты.
- Кроме того, было известно, что некоторые компоненты микробов (например, липополисахарид (ЛПС) грамотрицательных бактерий) активируют макрофаги, индуцируя секрецию воспалительных цитокинов, и стимулируют деление В-клеток.
В 1989 году Ч. Джейнуэй (Charles Janeway) написал во введении к материалам симпозиума в лаборатории в Колд Спринг Харбор: «...наше понимание распознавания иммунной системой приближается к своего рода асимптоте, где будущие эксперименты очевидны, технически сложновыполнимы и нацелены на достижение большей степени точности, чем на революционные изменения в понимании ... однако я уверен, что существует огромная пропасть между этой асимптотой и полным пониманием того, как индуцируется иммунный ответ» [3].
Джейнуэй предположил, что существуют рецепторы, которые распознают определенные молекулярные паттерны, характерные для микробов и отсутствующие в организме хозяина [3]. Он назвал их «паттерн-распознающими рецепторами» и предположил, что активация именно этих рецепторов индуцирует костимулирующие молекулы на поверхности антиген-презентирующих клеток и способность передавать «второй» сигнал. Этот сигнал от рецепторов врождённого иммунитета сообщает, что лиганд, взаимодействующий с рецепторами адаптивного иммунитета, — «чужой», и что необходимо активировать иммунный ответ.
Паттерн-распознающие рецепторы передают сигнал о присутствии патогенов в организме. Джейнуэй предположил, что эти рецепторы генетически закодированы и должны узнавать жизненно важные для микробов молекулы, которые не могут быть изменены в результате одной мутации. Возможные кандидаты — сложные углеводы клеточной стенки или липопротеины. Такие молекулы входят в состав адъювантов, механизм действия которых до этого был совершенно непонятен. Теория Джейнуэя объясняла, что молекулы микробов, входящие в состав адъювантов, взаимодействуют с паттерн-распознающими рецепторами, имитируя таким образом инфекцию и активируя антиген-презентирующие клетки.
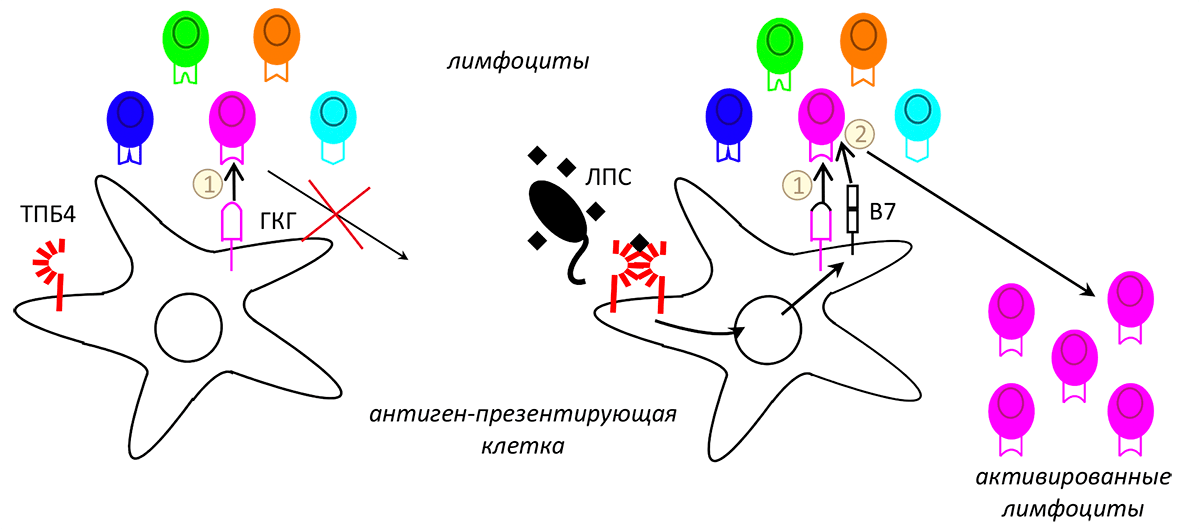
Рисунок 1. Адаптивный иммунный ответ не индуцируется, когда нет костимулирующего сигнала (слева). Липополисахарид микробов (ЛПС) активирует толл-подобные рецепторы (ТПБ-4) и индуцирует сигнал 2 (справа), вызывая размножение лимфоцитов. В этом случае белки главного комплекса гистосовместимости (ГКГ) презентируют пептиды рецепторам Т- и B-лимфоцитов (сигнал 1) при участии костимулирующей молекулы B7.
Джейнуэй провёл параллели между эффекторными механизмами врождённой и адаптивной иммунных систем. Он предположил, что паттерн-распознающие рецепторы существовали задолго до возникновения адаптивного иммунитета и активировали неспецифический иммунный ответ у беспозвоночных, у которых адаптивный иммунитет отсутствует [3]. В рамках теории Джейнуэя адаптивная иммунная система стала рассматриваться как дополнение, обеспечивающее специфичность распознавания, к эволюционно более древней врождённой иммунной системе.
Гипотеза в статье Джейнуэя была ясно изложена, объясняла механизмы действия адъювантов и индукции адаптивного иммунного ответа, эволюцию иммунной системы и открывала новые перспективы для исследования микробного распознавания. Несмотря на все это, статья осталась малозамеченной, так как такие рецепторы были неизвестны, и как их искать экспериментальным путём, было неясно. «Это привело к периоду в моей жизни, полному неудовлетворённости, — вспоминал Джейнуэй в своей автобиографии, — когда много работы проводилось по адаптивному иммунитету и относительно немного — по врожденному» [4].
Поиск паттерн-распознающих рецепторов
Все изменилось, когда в Москве Руслан Меджитов прочитал статью Джейнуэя. Аспирант без специального иммунологического образования понял, что необходимо было найти паттерн-распознающие рецепторы, и был полон решимости это сделать. Он написал Джейнуэю о своём желании работать над этой темой, однако тот далеко не сразу принял его в свою лабораторию. Несмотря на это, Джейнуэй впоследствии так отзывался о нем: «Хотя я обучил много отличных аспирантов и постдоков, Руслан Меджитов стал первой настоящей суперзвездой, работавшей в моей лаборатории, и я получал большое удовольствие от общения с ним» [4]. («Биомолекула» уже публиковала рассказ о жизни Руслана Меджитова и интервью с ним: «Интервью с профессором Йельского университета Русланом Меджитовым» [5].)
Руслан Меджитов в лаборатории Чарльза Джейнуэя сконцентрировался на поиске рецепторов на поверхности антиген-презентирующих клеток, которые способны распознавать микробные молекулярные паттерны (чаще всего это углеводы) и активировать костимуляторные молекулы [6]. Внеклеточный домен таких рецепторов должен узнавать углеводы. Белки, высокоспецифично связывающие углеводные остатки, называются лектинами; наиболее изученный иммунологами представитель этого семейства — лектин, связывающий маннозу. Его лектиновый домен типа C (кальций (Cа)-зависимый) был наиболее вероятным внеклеточным доменом нового рецептора [6]. Внутриклеточный домен нового рецептора должен передавать сигнал для активации костимулирующих молекул и воспалительных цитокинов. Рецептор, узнающий липополисахарид, был неизвестен, но было ясно, что он активирует сигнальный путь, ведущий к транскрипционному фактору NF-κB. Этот транскрипционный фактор является ключевым сигнальным компонентом врождённого иммунитета, вероятно также необходимым для активации костимулирующих молекул. Один из хорошо изученных рецепторов, активирующих NF-κB (рецептор интерлейкина 1), содержит внутриклеточный TIR домен, гомологичный такому же домену толл-рецептора дрозофилы. Предположение Руслана Меджитова, что новый рецептор также может содержать внутриклеточный TIR домен [6], впоследствии окажется верным. Итак, Р. Меджитов искал новый трансмембранный белок, содержащий внеклеточный лектиновый домен и внутриклеточный TIR домен [6].
Название толл-рецептора происходит от восклицания “Das ist ja Toll!” («Это удивительно!») Кристианы Нюссляйн-Фольхард, открывшей роль гена, кодирующего толл-рецептор, в эмбриогенезе дрозофилы. Немецкое слово Toll означает «прекрасно, удивительно».
В начале 1996 года он нашёл в базе данных экспрессируемых последовательностей ДНК последовательность, кодирующую белок, который имел сходство с TIR доменом; внеклеточный домен этого белка также имел сходство с толл-рецептором дрозофилы и не содержал лектинового домена. Теперь этот белок известен как толл-подобный рецептор 4.
Толл-рецептор дрозофилы

Рисунок 2. Жюль Хоффманн, руководитель научно-исследовательских работ французского Национального центра научных исследований в Страсбурге, президент Французской Академии наук
Отсутствие лектинового внеклеточного домена у толл-подобного рецептора 4 и его гомология с внеклеточным доменом толл-рецептора дрозофилы сначала вызвали разочарование. Дело в том, что известный лиганд толл-рецептора был эндогенным и никак не был связан с распознаванием микробов. Толл-рецептор, открытый в 1988 году [7], активируется во время эмбриогенеза, и его роль в иммунной системе была неизвестна.
В том же 1996 году Жюль Хоффманн (J. Hoffmann) опубликовал своё открытие: сигнальный путь толл-рецептора необходим для защиты дрозофилы от грибковых инфекций [8].
Профессора Хоффманна интересовало, как активируется экспрессия антимикробных пептидов [20] (одного из эффекторных механизмов врождённого иммунитета) у дрозофилы. Он заметил поразительное сходство между транскрипционным фактором NF-κB позвоночных и морфогенным транскрипционным фактором Dorsal у дрозофилы [8]. Dorsal активен во время эмбрионального развития, но сигнальный путь, ведущий к его активации, очень похож на сигнальный каскад, активный во время воспалительного ответа у позвоночных.
Жюль Хоффманн и его коллеги показали, что дрозофилы с мутацией в сигнальном пути толл-рецептора подвержены грибковым инфекциям, и что этот рецептор необходим для индукции противогрибкового пептида [8].
Это известие укрепило предположение Руслана Меджитова, что открытый им человеческий толл-подобный рецептор 4 и есть новый паттерн-распознающий рецептор, который активирует адаптивный иммунный ответ.
Экспериментальное подтверждение теории Джейнуэя
Чтобы подтвердить своё предположение экспериментально, Руслан Меджитов создал мутантный толл-подобный рецептор 4, находящийся в активированном состоянии постоянно (поскольку его природный лиганд был неизвестен). Клонирование человеческого толл-рецептора было описано в блестящей статье в Nature в 1997 году [9]. Этот рецептор индуцировал экспрессию костимулирующей молекулы В7 и воспалительных цитокинов, которые необходимы для активации наивных Т-лимфоцитов [9].
Эксперименты, описанные в этой статье, доказывали существование паттерн-распознающих рецепторов у позвоночных, активация которых приводит к инициации адаптивного иммунного ответа. Основное положение теории Джейнуэя было подтверждено экспериментально [10]. Это открытие привело к взрыву интереса иммунологов к врождённому иммунитету и заложило основу для интерпретации последующих экспериментов.
Дальнейшее развитие: лиганды для толл-подобных рецепторов
В течение последующих нескольких лет стало ясно, что толл-подобные рецепторы позвоночных узнают микробные компоненты непосредственно (в отличие от толл рецептора дрозофилы). Годовский (P.J. Godowsky) и коллеги первыми показали, что экстракт ЛПС, содержащий бактериальные липопротеины, активирует толл-подобный рецептор 2 [11]. Сейчас известно, что именно липопротеины являются лигандами этого рецептора.
В распознавании ЛПС участвует не один, а несколько белков, и поэтому выяснение этого механизма было нелёгким. Ещё с 1960-х годов известны линии мышей, нечувствительных к ЛПС. В 1998 году Джерард (C. Gerard) обратил внимание, что ген, кодирующий толл-подобный рецептор 4, находится в локусе, мутированном у мышей, нечувствительных к ЛПС [12]. Бётлер (B. Beutler) в 1998 году [13] и Мало (D. Malo) в 1999 году [14] методом позиционного клонирования подтвердили, что мутации именно в открытом Русланом Меджитовым гене, кодирующем толл-подобный рецептор 4, вызывают у этих мышей нечувствительность к ЛПС. Мияке (K. Miyake) и коллеги открыли недостающий компонент рецептора к ЛПС — МД-2 в 1999 году [15].
В настоящее время известно несколько классов паттерн-распознающих рецепторов, как мембранных, так и цитоплазматических [16].
Нобелевская премия по физиологии и медицине 2011 года
Концепция активации адаптивного иммунитета сигналами от иммунитета врождённого, созданная Ч. Джейнуэем и экспериментально подтверждённая Р. Меджитовым, является общепризнанной и входит в современные учебники по иммунологии. Несмотря на то, что их имена не упоминаются в официальном пресс-релизе Нобелевского комитета («Биомолекула» публиковала статью по материалам этого пресс-релиза: «Иммунологическая Нобелевская премия (2011)» [17]), по мнению многих известных иммунологов [18], [19], первооткрыватели толл-подобных рецепторов Чарльз Джейнуэй и Руслан Меджитов заслуживают признания Нобелевского комитета.
Литература
- Burnet M. The clonal selection theory of acquired Immunity. Cambridge, 1959;
- P. Bretscher, M. Cohn. (1970). A Theory of Self-Nonself Discrimination: Paralysis and induction involve the recognition of one and two determinants on an antigen, respectively. Science. 169, 1042-1049;
- C.A. Janeway. (1989). Approaching the Asymptote? Evolution and Revolution in Immunology. Cold Spring Harbor Symposia on Quantitative Biology. 54, 1-13;
- Charles A. Janeway. (2002). A TRIP THROUGH MY LIFE WITH AN IMMUNOLOGICAL THEME. Annu. Rev. Immunol.. 20, 1-28;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Ruslan Medzhitov. (2009). Approaching the Asymptote: 20 Years Later. Immunity. 30, 766-775;
- Carl Hashimoto, Kathy L. Hudson, Kathryn V. Anderson. (1988). The Toll gene of drosophila, required for dorsal-ventral embryonic polarity, appears to encode a transmembrane protein. Cell. 52, 269-279;
- Bruno Lemaitre, Emmanuelle Nicolas, Lydia Michaut, Jean-Marc Reichhart, Jules A Hoffmann. (1996). The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 86, 973-983;
- Ruslan Medzhitov, Paula Preston-Hurlburt, Charles A. Janeway. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 388, 394-397;
- Ruslan Medzhitov, Charles A Janeway. (1997). Innate Immunity: The Virtues of a Nonclonal System of Recognition. Cell. 91, 295-298;
- Ruey-Bing Yang, Melanie R. Mark, Alane Gray, Arthur Huang, Ming Hong Xie, et. al.. (1998). Toll-like receptor-2 mediates lipopolysaccharide-induced cellular signalling. Nature. 395, 284-288;
- Craig Gerard. (1998). For whom the bell tolls. Nature. 395, 217-219;
- A. Poltorak. (1998). Defective LPS Signaling in C3H/HeJ and C57BL/10ScCr Mice: Mutations in Tlr4 Gene. Science. 282, 2085-2088;
- Salman T. Qureshi, Line Larivière, Gary Leveque, Sophie Clermont, Karen J. Moore, et. al.. (1999). Endotoxin-tolerant Mice Have Mutations in Toll-like Receptor 4 (Tlr4). J Exp Med. 189, 615-625;
- Rintaro Shimazu, Sachiko Akashi, Hirotaka Ogata, Yoshinori Nagai, Kenji Fukudome, et. al.. (1999). MD-2, a Molecule that Confers Lipopolysaccharide Responsiveness on Toll-like Receptor 4. J Exp Med. 189, 1777-1782;
- Dominik Schenten, Ruslan Medzhitov. (2011). The Control of Adaptive Immune Responses by the Innate Immune System. Advances in Immunology. 87-124;
- Иммунологическая Нобелевская премия (2011);
- James P. Allison, Christophe Benoist, Alexander V. Chervonsky. (2011). Nobels: Toll pioneers deserve recognition. Nature. 479, 178-178;
- A bitter sweet Nobel — Beutler, Janeway, and the dawn of innate immunity. (2011). Science Blogs;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам.





