Многоликий молекулярно-генетический портрет диффузной В-крупноклеточной лимфомы, или в поисках новых терапевтических подходов
20 января 2022
Многоликий молекулярно-генетический портрет диффузной В-крупноклеточной лимфомы, или в поисках новых терапевтических подходов
- 2529
- 0
- 6
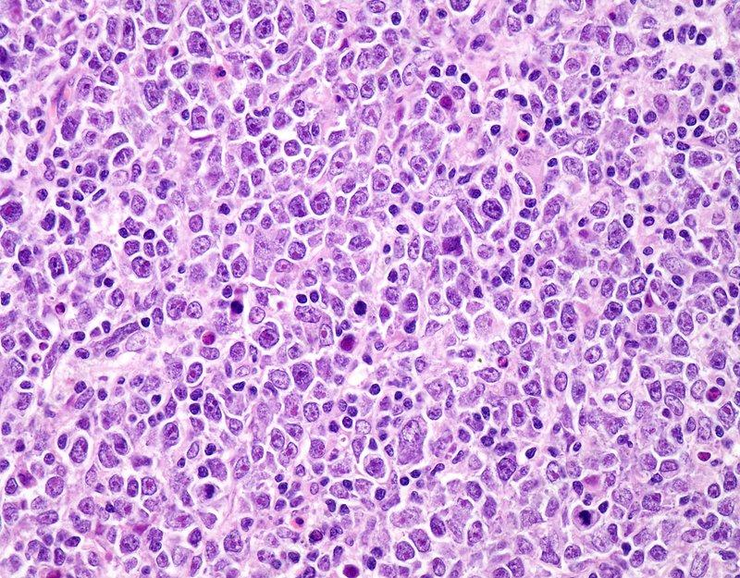
Светооптическая микроскопия ткани, пораженной диффузной В-клеточной крупноклеточной лимфомой.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Слово «лимфома» означает опухоль, происходящую из особых клеток иммунной системы — лимфоцитов. Эта опухоль представляет собой скопления злокачественных клеток в организме, предшественниками которых могут быть Т- или В-лимфоциты. В данном обзоре предпринята попытка сконцентрировать наиболее актуальную научную информацию о молекулярной и генетической неоднородности одного из самых распространенных и агрессивных типов лимфом — диффузной В-клеточной крупноклеточной лимфомы, с рассмотрением перспективы персонализированной медицины для данного заболевания.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение
В онкогематологии все лимфомы классифицируют на два больших класса: лимфома Ходжкина, которая из-за своих уникальных биологических особенностей стоит особняком, и неходжкинские лимфомы. Составляя приблизительно 30% от всех случаев неходжкинских лимфом, диффузная В-клеточная крупноклеточная лимфома (сокращенно ДВККЛ) является одной из самых частых и агрессивных лимфом в мире [1]. На сегодняшний день стандартом первой линии терапии ДВККЛ является режим R-CHOP (читается как «эр-чоп»), в состав которого входят препараты: циклофосфамид, доксорубицин, винкристин и преднизолон с добавлением терапевтического моноклонального антитела ритуксимаб. К сожалению, достигнутыми результатами такой терапии в виде 60% успешного лечения пациентов нельзя удовлетвориться [1]. Остальные 40% больных либо сразу не отвечают на режим R-CHOP, либо довольно быстро рецидивируют, и такие случаи довольно трудно поддаются дальнейшему лечению [1]. Для большего понимания всей драматичности ситуации стоит подчеркнуть, что достижение даже частичной ремиссии по окончании первой линии терапии не является залогом успешного лечения. Именно отсюда такая потребность в поиске новых, альтернативных и перспективных методов в лечении.
Что ж, теперь я хочу пригласить вас в удивительный и сложный мир молекулярного и генетического разнообразия лимфомы. Уверяю вас, что биология рака — как огромный океан: себя можно представить в небольшом батискафе в бездонном морском пространстве; здесь много неизвестного, ты порой не понимаешь, как оценить весь масштаб происходящего, ощущаешь себя мелкой крупицей. Все это пугает и завораживает одновременно. Готовы к погружению?
Такая разная лимфома
Два паттерна экспрессии генов ДВККЛ определяют клинический прогноз
Диффузная В-клеточная крупноклеточная лимфома неспецифицированная (DLBCL, NOS — diffuse large B-cell lymphoma not otherwise specified) представляет собой отдельное заболевание в системе классификации ВОЗ 2017 года [2]. Однако пациенты по-разному отвечают на режим R-CHOP и имеют разный прогноз в отношении выживаемости, что свидетельствует о биологической неоднородности опухоли. Конечно, можно говорить о клинической «разношерстности» пациентов с неодинаковым возрастом, сопутствующей патологией, стадией заболевания на момент постановки диагноза, однако все эти факторы не решают фундаментальной проблемы опухолевой гетерогенности и не дают возможности построения дальнейшей лечебной тактики, основанной на персонализированном подходе.
Наверняка причины опухолевой гетерогенности скрываются в молекулярно-биологических особенностях лимфом. Так, более 20 лет назад была опубликована работа, в которой на основе анализа экспрессии генов методом ДНК-микрочипов исследователи Alizadeh A. и соавторы (2000) выявили три молекулярных подтипа диффузной В-клеточной крупноклеточной лимфомы: GCB- и ABC-подтип, а также неклассифицированный вариант, отличающиеся качественным составом матричной РНК в клетках [3]. GCB-подтип (germinal center B-cell like subtype) ДВККЛ имеет профиль экспрессии генов, соответствующий таковому у B-лимфоцитов герминативного центра лимфатического фолликула (это особенная зона в лимфатическом узле, где В-лимфоцит «обучается» отвечать и реагировать на тот или иной антиген). Стоит полагать, что GCB-подтип лимфомы возникает непосредственно из В-клетки герминативного центра. При злокачественной трансформации этих же клеток может возникать и другой гистологический вариант лимфомы — фолликулярная лимфома, которая характеризуется относительно вялым или, как еще говорят, индолентным течением. Пациенты с фолликулярной лимфомой не всегда требуют начала лечения на момент постановки диагноза, за ними можно просто наблюдать, и в целом фолликулярная лимфома характеризуется более благоприятным прогнозом в сравнении с ДВККЛ.
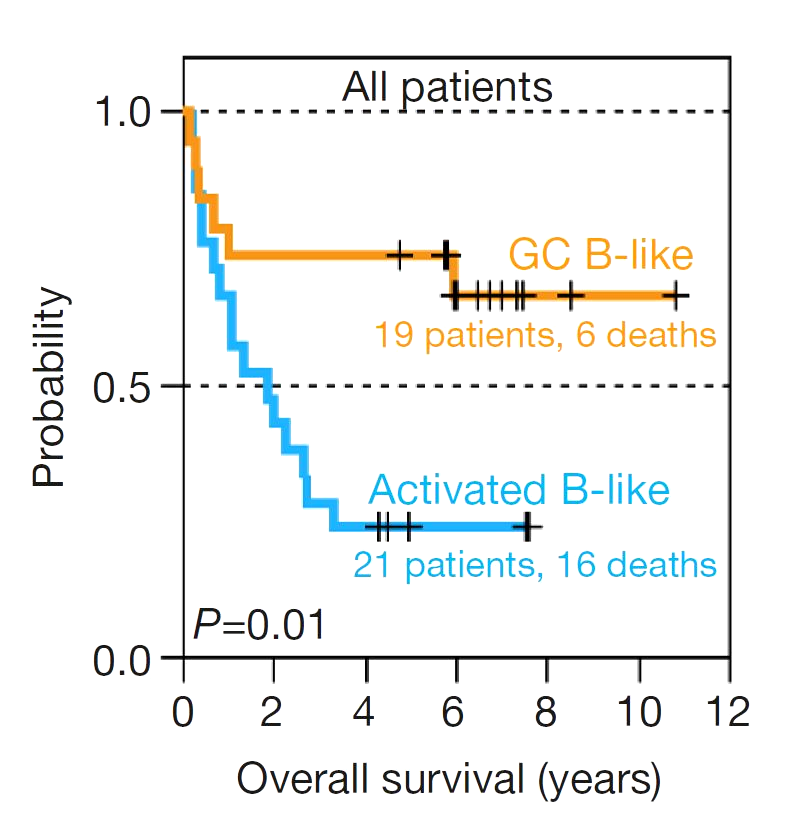
Рисунок 1. Кривые общей выживаемости больных диффузной В-крупноклеточной лимфомой в зависимости от молекулярного подтипа.
Возможно, именно различия в экспрессии генов лежат в основе различного исхода пациентов? Авторы этого же исследования проанализировали общую выживаемость больных, которые получали сопоставимые схемы лечения. Оказалось, что пациенты с GCB-подтипом ДВККЛ имели статистически значимые различия в выживаемости в сравнении с АВС-подтипом (activated B-cell like subtype) ДВККЛ: в среднем общая пятилетняя выживаемость для всех пациентов составила 52%, однако 76% пациентов с GCB-подтипом по достижении пятилетнего рубежа были все еще живы, в то время как только 16% пациентов с ABC-подтипом остались в живых [3]. Исследовательская группа предоставила данные по выживаемости в виде кривых выживаемости Каплана—Мейера (рис. 1). Эти кривые имеют ступенчатый вид и очень часто используются в клинических исследованиях для оценки выживаемости пациентов. В таких графиках каждая ступенька означает наступление неблагоприятного для пациента события: прогрессирование заболевания (при изучении выживаемости без прогрессирования) или летальный исход (при изучении общей выживаемости).
Таким образом, был получен окончательный вывод: диффузная В-клеточная крупноклеточная лимфома представляет собой не одно заболевание, а группу различных по молекулярному патогенезу заболеваний с неодинаковым клиническим прогнозом.
К большому сожалению, даже на сегодняшний день в рутинной онкогематологической практике использование методов анализа экспрессии генов невозможно из-за дороговизны и сложности метода. В качестве альтернативного метода определения молекулярного подтипа ДВККЛ в клинике врачами-патологоанатомами используется окрашивание ткани опухоли в исследовании, основанном на взаимодействии антитела с антигеном — иммуногистохимическая реакция по алгоритму Hans [4], [5]. Данный метод основан на оценке относительного уровня экспрессии всего трех маркеров: CD10, BCL6 и MUM1 (рис. 2). Хоть этот метод более доступен, он не так точен и не позволяет в чистом виде выделить АВС-подтип, поэтому в иммуногистохимическом алгоритме предусмотрено разделение ДВККЛ на GCB- и non-GCB-подтипы.
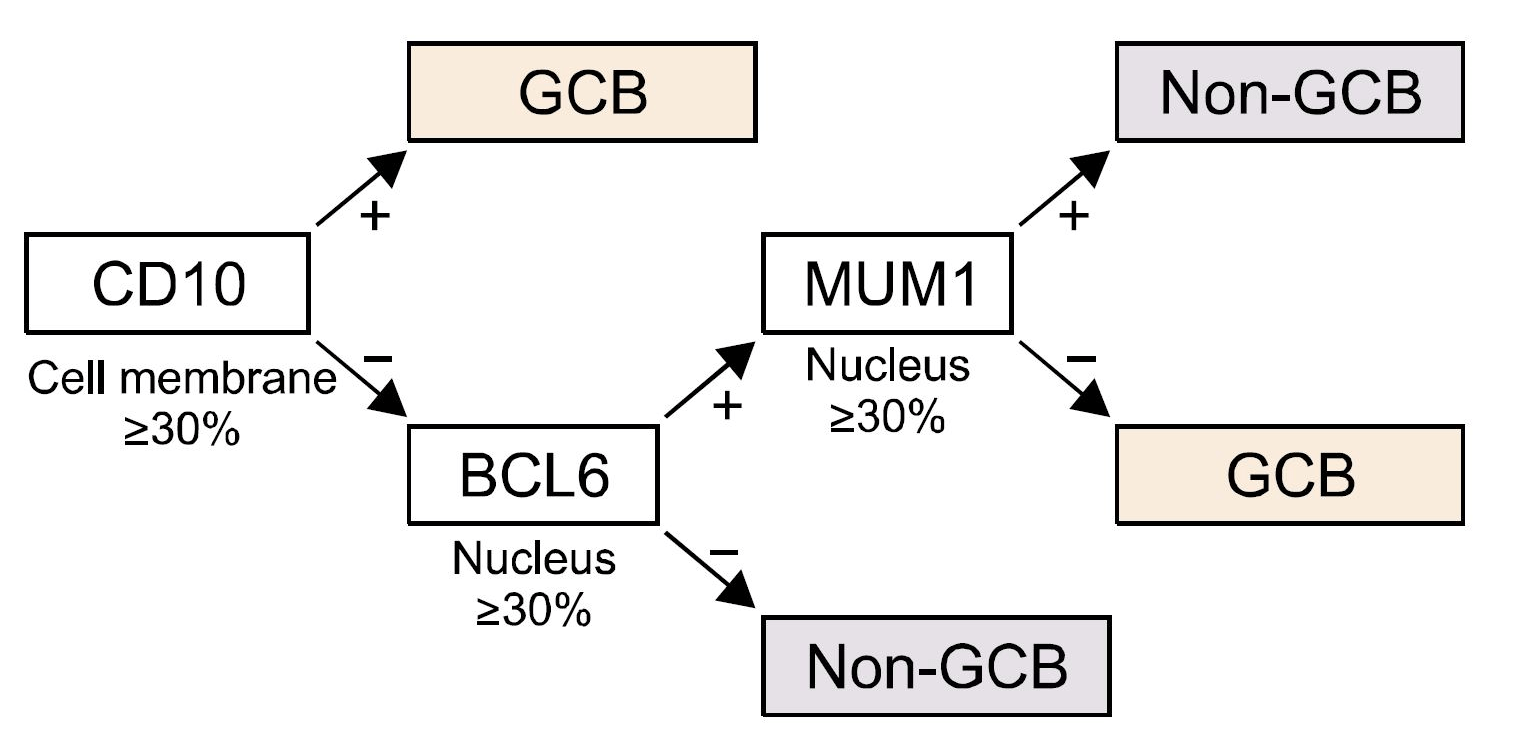
Рисунок 2. Алгоритм Hans для иммуногистохимической идентификации подтипов.
Молекулярные основы патогенеза ABC- и GCB-подтипов ДВККЛ
Генетические поломки, обуславливающие формирование злокачественных лимфом, возникают на определенном этапе нормального развития В-лимфоцита. Опухолевые В-лимфоциты неходжкинских лимфом имеют биологические особенности нормальных В-лимфоцитов, и они используют эти свойства для собственного выживания и размножения злокачественного клона. Это означает, что функционирование В-клеток лимфом в значительной степени определяется уровнем развития или дифференцировки В-лимфоцитов, из которых опухоль происходит. Обратите внимание на основные последовательные стадии дифференцировки В-лимфоцита (рис. 3), начиная от стволовой кроветворной клетки и заканчивая плазматической клеткой, основная функция которой — секреция защитных антител [6]. Это знание еще пригодится нам в дальнейшем.
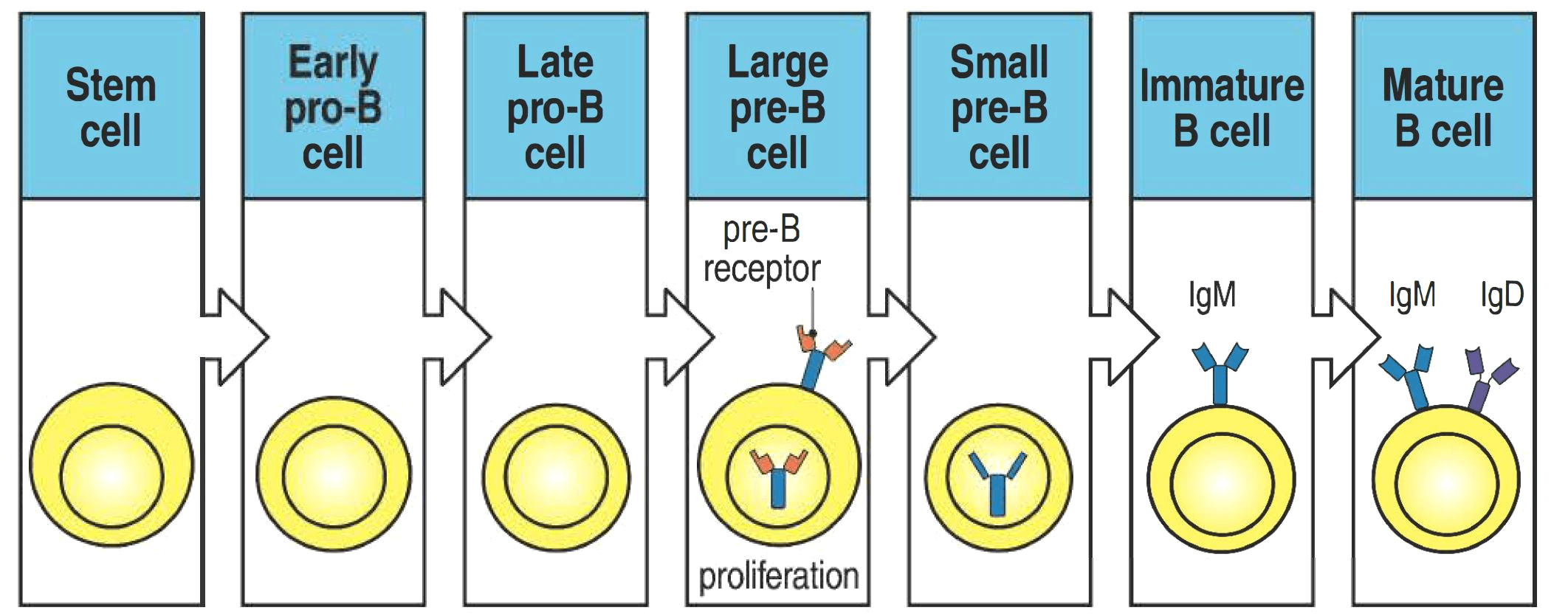
Рисунок 3. Последовательные этапы развития В-лимфоцита.
В костном мозге в процессе В-лимфопоэза (формирования В-лимфоцита из стволовой кроветворной клетки) происходит созревание В-клеточного рецептора лимфоцита — будущего специфичного антитела — за счет V(D)J-рекомбинации при участии ферментов RAG1 и RAG2, которые вносят разрывы в двухцепочечную молекулу ДНК, устраняемые простым соединением концов ДНК. Данное молекулярное событие может стать источником формирования хромосомных транслокаций (перестроек) и образования химерных генов, которые в нормальных клетках отсутствуют и гиперэкспрессия которых значима в патогенезе лимфом. Другим потенциальным источником возникновения генетических поломок является герминативный центр лимфатического фолликула, о котором мы уже говорили ранее. Именно здесь происходят события, связанные с модификацией ДНК, которые представляют собой еще один источник мутагенеза — соматическая гипермутация (накопление большего количества мутаций в генах иммуноглобулинов при участии цитозиндезаминазы AID), в процессе которой происходит созревание аффинитета (сродства) В-клеточного рецептора к антигену, и переключение классов иммуноглобулинов. Таким образом, на определенных этапах нормального развития любого В-лимфоцита существуют молекулярные механизмы, которые создают предпосылки к возникновению генетических поломок и, как следствие, — к развитию лимфом. Возникновение той или иной генетической поломки в В-лимфоците носит вероятностный характер.
Мы не будем далее подробно рассматривать все сложные молекулярные механизмы, лежащие в основе развития В-клеточного звена иммунитета. Все, что сейчас достаточно понимать, так это то, что В-лимфоцит берет свое начало в костном мозге от стволовой кроветворной клетки. Далее В-клетка с током крови мигрирует в лимфатические узлы, где образует герминативый центр — своего рода «школу», где происходит отбор и дополнительное созревание, а также «обучение» распознаванию антигена, после чего успешно окончивший «образовательную программу» В-лимфоцит превращается в плазмоцит, готовый синтезировать специфические антитела, или в В-клетку памяти. Давайте подробнее остановимся только на молекулярных характеристиках В-клетки герминативного центра и плазматической клетки, так как это имеет прямое отношение к подтипам ДВККЛ. Целый набор транскрипционных факторов, то есть регуляторов транскрипции генов — BCL6, MTA3, SPIB, BACH2, OCT2, OCAB, IRF8 — формируют фенотип В-клетки герминативного центра (рис. 4) [7]. Эти клетки экспрессируют BCL6, представляющий собой репрессор (то есть подавитель, угнетатель) транскрипции. Белок BCL6 подавляет многие гены, вовлеченные в дифференцировку плазматических клеток, клеточный цикл, ответ на повреждение ДНК и программируемую клеточную смерть. Но как только В-лимфоцит герминативного центра начинает дифференцироваться в плазматическую клетку, повышение уровня экспрессии плазмоклеточных маркеров IRF4 и Blimp-1 угнетает BCL6, тем самым продвигая клетку к конечному, терминальному этапу дифференцировки — плазмоциту.
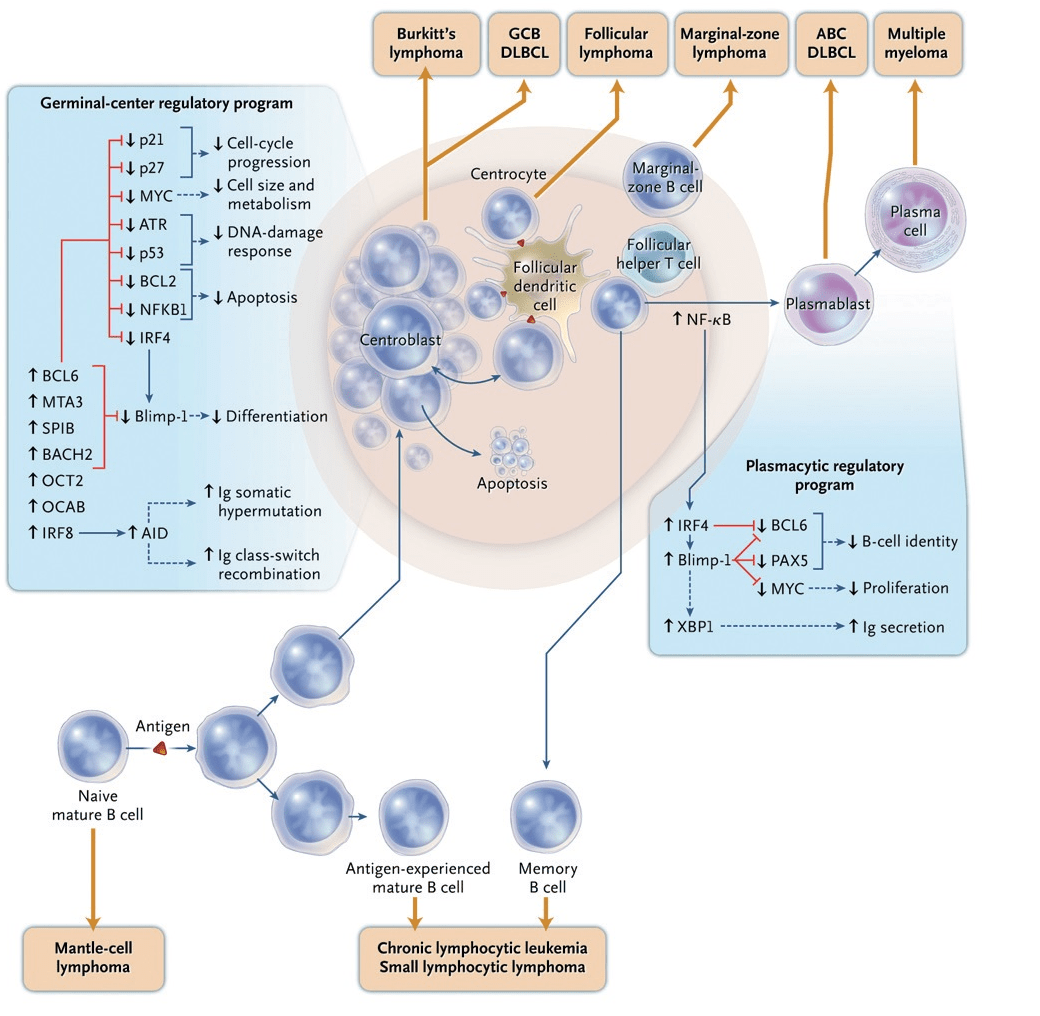
Рисунок 4. В-клеточная дифференцировка, лимфомагенез и профиль экспрессии генов на различных этапах созревания В-лимфоцита. Злокачественные лимфомы могут возникнуть на разных этапах нормального развития В-лимфоцита. По мере созревания В-лимфоцита его генетическая регуляторная программа переключается с профиля В-лимфоцита герминативного центра на плазмоцитоидный профиль.
Наконец, мы добрались до кульминационной части данного раздела. В случае прогностически более благоприятного варианта — GCB-подтипа ДВККЛ — экспрессионный профиль генов таков, что он соответствует профилю В-лимфоцита герминативного центра, при этом активность молекулярного сигнального пути NF-kB (nuclear factor kappa-B) в таких клетках снижена [7]. Наоборот, в случае клинически неблагоприятного АВС-подтипа ДВККЛ активность NF-kB высока, что может служить одним из механизмов избегания программируемой клеточной гибели — апоптоза. Такие опухолевые клетки экспрессируют маркеры, характерные для плазматических клеток, включая IRF4 и транскрипционный фактор XBP1 — регулятор секреции иммуноглобулинов. Однако при этом полное развитие В-лимфоцитов АВС-подтипа лимфомы в нормальный плазмоцит невозможно из-за блока дифференцировки [7].
Роль активации NF-kB и сигнального пути В-клеточного рецептора в АВС-подтипе ДВККЛ
Как уже было отмечено ранее, успешная стратегия выживания опухолевого В-лимфоцита может объясняться высокой зависимостью от NF-kB для АВС-подтипа ДВККЛ, но не для GCB-подтипа. А также известно о том, что каскадный внутриклеточный сигнальный путь В-клеточного рецептора в случае АВС-подтипа находится в состоянии хронической гиперактивации [7]. Существует довольно несложный способ продемонстрировать, что эти сигнальные пути являются жизненно важными для опухолевых клеток. Для этого достаточно их заблокировать или выключить. На клеточных линиях, являющихся моделями АВС-подтипа ДВККЛ, исследователи Davis R.E. и соавторы (2010) с помощью явления РНК-интерференции продемонстрировали нежизнеспособность опухолевого клона при подавлении экспрессии одного из ключевых посредников сигнала от В-клеточного рецептора — Брутоновской тирозинкиназы [8]. С другой стороны, Lam L.T. и соавторы (2005) успешно подтвердили токсический эффект блокатора IKK, который связан с путем NF-kB в В-лимфоцитах АВС-подтипа [9].
Что, если результаты этих исследований использовать в терапевтических целях? Сложная система внутриклеточных молекул-посредников злокачественного В-лимфоцита АВС-подтипа ДВККЛ может стать интересным объектом терапевтического воздействия (рис. 5). В фармакологической тяжелой артиллерии врача-гематолога уже сегодня имеются блокаторы В-клеточного рецепторного каскада (ибрутиниб — ингибитор Брутоновской тирозинкиназы, дувелисиб — ингибитор PI3K, полатузумаб ведотин — связывает CD79b) и протеасомные ингибиторы (бортезомиб), которые, косвенно воздействуя на NF-kB, предотвращают его проникновение в клеточное ядро и реализацию программы выживания. Более интересной терапевтической мишенью для лечения ДВККЛ могут стать компоненты комплекса CARD11/BCL10/MALT1 (рис. 5). Приблизительно 10% всех АВС-подтипов лимфом имеют активационную мутацию в CARD11, которая обуславливает автономное формирование внутрицитоплазматических белковых агрегатов CARD11/BCL10/MALT1/TRAF6, что приводит к активации IKK, а в последующем — к запуску NF-kB [7]. Причем такая мутация делает независимым сигнальный путь NF-kB от посредников (мессенджеров) сигнала от В-клеточного рецептора, стоящих выше CARD11.
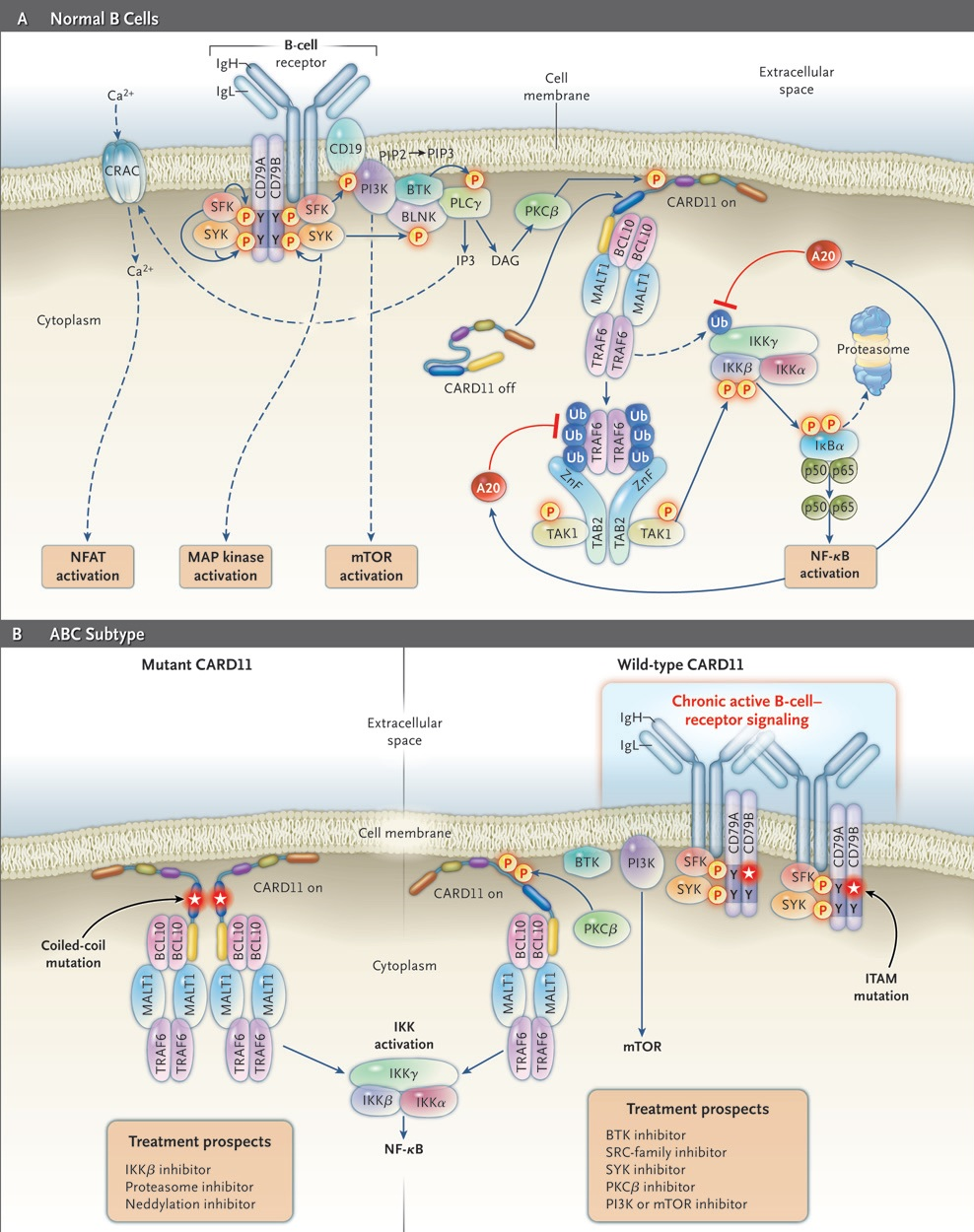
Рисунок 5. Функционирование внутриклеточного сигнального каскада В-клеточного рецептора для нормального В-лимфоцита (А) и в случае В-лимфоцита АВС-подтипа ДВККЛ с мутантным и диким вариантами CARD11 (B).
Использование таргетных препаратов, упомянутых выше, уже одобрено для лечения многих гематологических заболеваний, но в случае с ДВККЛ имеются нюансы, о которых мы подробнее поговорим с вами в разделе «Несменяемый монарх „Сэр“-чоп».
Повторяющиеся мутационные паттерны ДВККЛ отражают профиль экспрессии генов
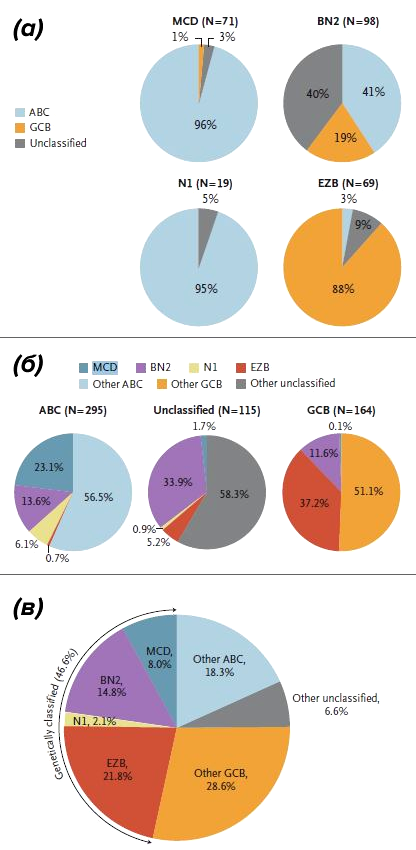
Рисунок 6. Секторальные диаграммы, отражающие относительное представительство молекулярного подтипа ДВККЛ на основе профиля экспрессии генов одному из четырех генетических подтипов, и наоборот.
(а) — доля молекулярных подтипов ДВККЛ (АВC-подтип, GCB-подтип и неклассифицируемый) среди генетических вариантов ДВККЛ (MCD, BN2, N1, EZB).
(б) — доля генетических подтипов ДВККЛ (MCD, BN2, N1, EZB) среди молекулярных подтипов ДВККЛ (АВC-подтип, GCB-подтип и неклассифицируемый). (в) — общая доля всех генетических подтипов ДВККЛ среди всех случаев.
Не так давно представления о разнообразии ДВККЛ несколько усложнились. Schmitz et al. (2018) провели секвенирование экзома [10] и транскриптомный анализ RNA-seq 574 образцов ДВККЛ и выявили группы повторяющихся от случая к случаю мутаций в опухолевой ДНК, которые ассоциированы с одним из молекулярных подтипов [11]. Исследовательской группе удалось выделить четыре генетических типа ДВККЛ: MCD (сосуществующие мутации MYD88 и CD79b в опухоли), BN2 (транслокация BCL6 и мутация NOTCH2), N1 (мутация NOTCH1) и EZB (мутация EZH2 и транслокация BCL2) [11]. Только 46,6% случаев ДВККЛ удалось классифицировать по данным генетическим группам; оставшаяся часть лимфом не может быть отнесена ни к одному из подтипов и считается неклассифицированной. Нетрудно заметить (рис. 6), что подавляющее большинство молекулярных подтипов в случае MCD и N1 генетических вариантов соответствуют АВС-подтипу, а EZB вариант — GCB-подтипу [11]. Примечательно, что определение генетических групп, подобно молекулярным группам, имеет клиническое значение с точки зрения прогноза для пациента. Исследование безрецидивной и общей выживаемости пациентов в свете генетических подтипов позволяет сделать вывод о том, что прогностически более неблагоприятными вариантами можно считать N1 и MCD варианты (рис. 7).
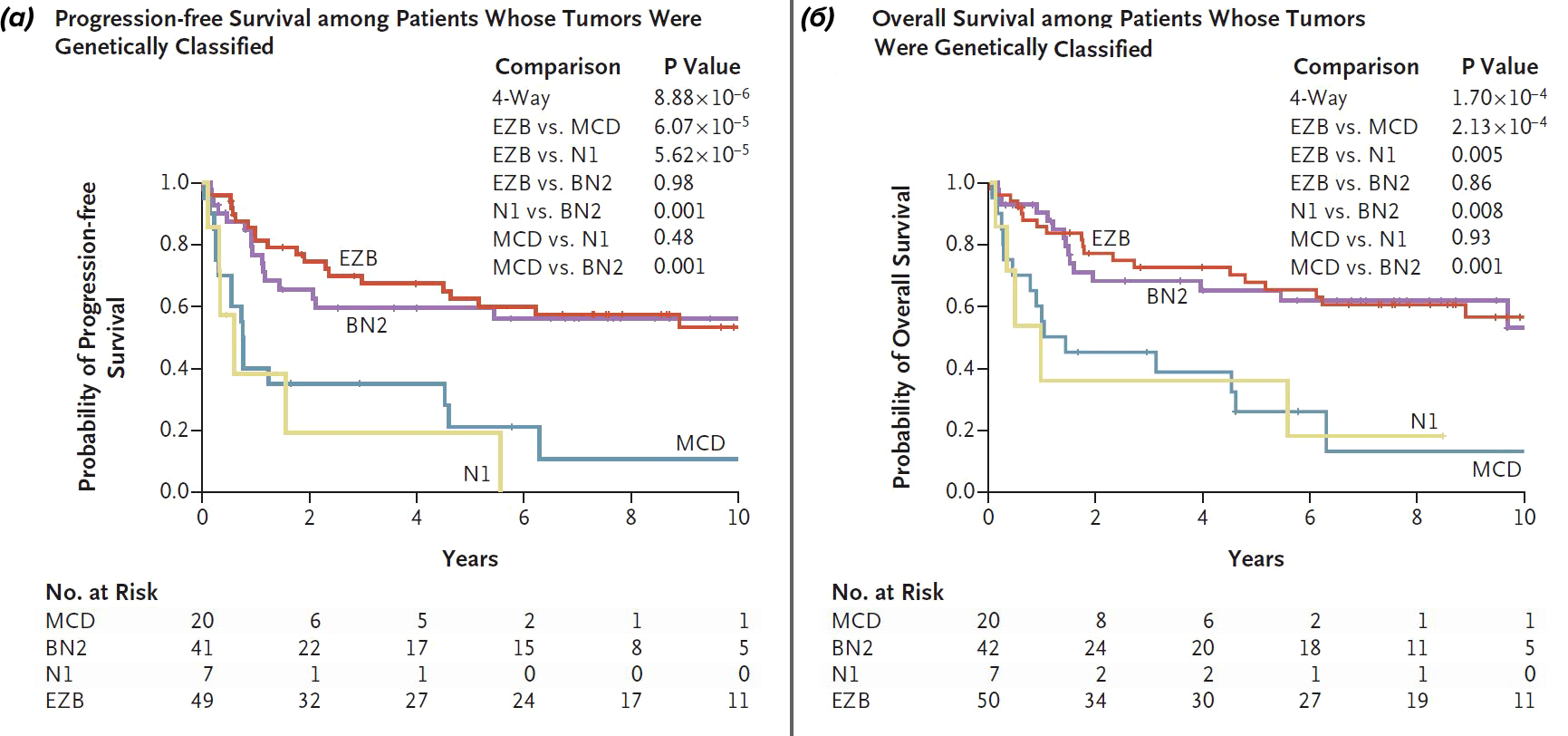
Рисунок 7. Кривые безрецидивной (а) и общей (б) выживаемости больных ДВККЛ различных генетических подтипов.
Современный многоликий молекулярно-генетический портрет ДВККЛ был «написан» только в 2020 году. Wright G.W. и соавторы (2020) предложили использовать алгоритм LymphGen для генетической классификации ДВККЛ, расширив уже имеющуюся классификацию двумя новыми вариантами, а именно ST2 и А53 (рис. 8), основываясь на повторяющихся сочетаниях мутаций в SGK1 плюс TET2 и анеуплоидии (т.е. явлении, при котором количество хромосом в клетке становится не кратно 23) с мутацией TP53, соответственно [12]. Таким образом, современный алгоритм LymphGen позволяет распределить по подтипам уже 63,1% случаев диффузной В-клеточной крупноклеточной лимфомы [12].
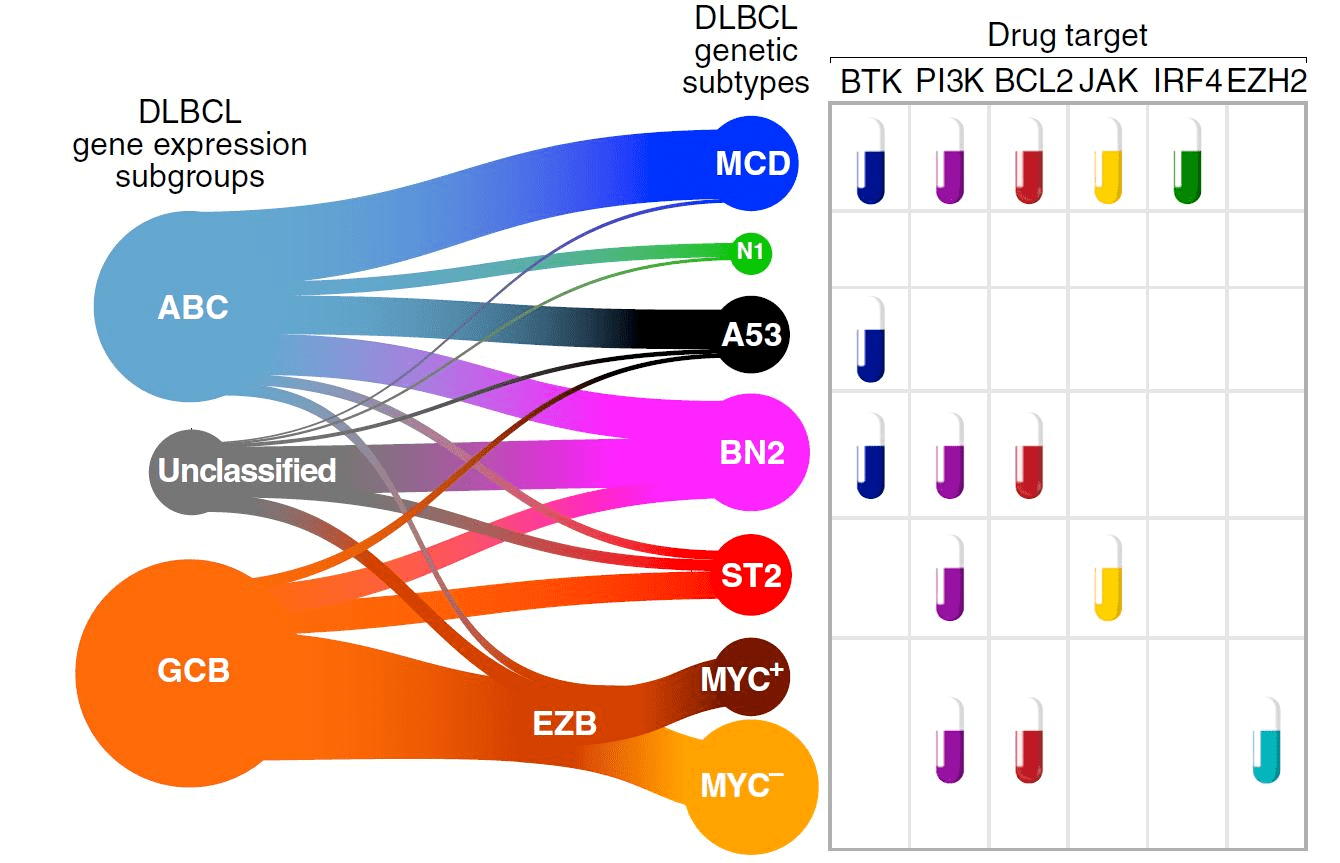
Рисунок 8. Интегральная схема, отражающая взаимоотношение молекулярных подтипов лимфомы на основе профиля экспрессии генов и генетических подтипов, а также потенциальные молекулярные мишени для терапевтических приложений для того или иного генетического типа.
Несменяемый монарх «Сэр»-чоп
Несмотря на очевидный прогресс в понимании молекулярно-генетического разнообразия и патогенеза ДВККЛ и вопреки многообещающим результатам, полученным при исследовании токсического эффекта таргетных лекарственных препаратов на опухолевые клетки в экспериментальных моделях, на текущий момент в самых последних обновлениях американских клинических онкологических рекомендаций NCCN и в европейских рекомендациях медицинской онкологии ESMO альтернатив режиму R-CHOP в первой линии терапии нет [13].
Такие несоответствия обусловлены тем, что не всегда логичная и стройная идея об эффективности лекарственного препарата, подтвердившаяся в доклинических исследованиях, сможет оправдать себя в клинических исследованиях, в которых принимают участие живые больные люди. Более того, даже наличие статистически значимых различий между экспериментальным лечением и золотым стандартом или плацебо в пользу экспериментального лекарственного препарата не говорит о реальной клинической значимости, выраженной в количестве месяцев или лет жизни, прожитых пациентом в ремиссии в хорошем качестве. Уже имеющиеся результаты крупных клинических исследований II и III фаз по лечению пациентов с впервые выявленной ДВККЛ в попытке улучшить результаты лечения путем добавления ибрутиниба (исследование PHOENIX), леналидомида (исследования ROBUST и E1412) или бортезомиба (исследование REMoDL-B) к стандартному режиму терапии R-CHOP в первой линии, к сожалению, не увенчались успехом [14–17].
Вместо заключения. Зачем изучать такую сложную молекулярную биологию рака?
Если вы уже устали, дойдя до этого момента, из-за всех сложных биологических концепций разнообразия ДВККЛ, то я поспешу вас обрадовать тем, что в этом обзоре освещается лишь только один гистологический вариант лимфомы. Да, современные молекулярно-биологические представления опухолевого роста разнообразны и огромны. Одних внутриклеточных молекулярных посредников, участвующих в каскадных сигналах, существует сколько! А сколько мутаций во всех раковых генах! Весь этот массив информации в голове просто не удержать.
Сегодняшний рынок онкологического биофармацевтического производства представляет совокупность лекарственных препаратов, назначение которых основано на знаниях генетики рака, создавая тем самым возможность прицельного, направленного воздействия на опухоль. Да, да, вы, наверное, уже догадались, что я сейчас говорю именно о персонифицированной или персонализированной медицине в онкологии. Клиницисты сегодня знают довольно немало таких примеров: назначение эрлотиниба пациенту с аденокарциномой легкого при наличии мутации L858R в гене рецептора эпидермального фактора роста EGFR, вемурафениб для лечения распространенной меланомы при обнаруженной мутации в опухоли V600E в гене BRAF, иматиниб как блокатор BCR-ABL при терапии хронического миелолейкоза, мидостаурин в лечении острого миелоидного лейкоза при выявленной мутации в FLT3. Всего этого и многого чего другого просто не было, если бы не развивалась биомедицинская наука. От знаний в молекулярной биологии и генетики выигрывают абсолютно все: ученые удовлетворяют собственный научный интерес и любопытство, врачи принимают участие в клинических исследованиях, развивается фармацевтический рынок, появляются новые профессиональные кадры, а пациенты дольше живут, имея хорошее качество жизни.
Пусть сегодня успехи в выборе клинически эффективного таргетного лекарственного препарата на основе молекулярно-генетических характеристик ДВККЛ не так грандиозны, как хотелось бы, совершенно очевидно одно — дальнейшее усложнение наших представлений в отношении молекулярной генетики опухолей, особенно в условиях расширенной доступности технологий высокопроизводительного секвенирования непременно приведут к революционным терапевтическим подходам в не столь отдаленном будущем. В заключение стоит отметить, что попытка модифицировать схему R-CHOP предпринимается сейчас авторами исследования POLARIX, где они предлагают сравнить режим Pola-R-CHP (полатузумаб ведотин, ритуксимаб, циклофосфамид, доксорубицин, преднизолон) со стандартом, и уже получены результаты: 2-летняя выживаемость без прогрессирования у пациентов из группы лечения Pola-R-CHP составила 76,7% в сравнении с 70,2% у пациентов стандартной терапии R-CHOP. Более того, за последние два года появились возможности лечения рефрактерных или рецидивирующих форм ДВККЛ, такие как биспецифические моноклональные антитела (глофитамаб, мосунетузумаб, эпкоритимаб, одронекстамаб) и CAR-T клеточная терапия.
Литература
- Laurie H. Sehn, Gilles Salles. (2021). Diffuse Large B-Cell Lymphoma. N Engl J Med. 384, 842-858;
- Steven H. Swerdlow, Elias Campo, Stefano A. Pileri, Nancy Lee Harris, Harald Stein, et. al.. (2016). The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 127, 2375-2390;
- Ash A. Alizadeh, Michael B. Eisen, R. Eric Davis, Chi Ma, Izidore S. Lossos, et. al.. (2000). Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature. 403, 503-511;
- Hee Sang Hwang, Dok Hyun Yoon, Cheolwon Suh, Chan-Sik Park, Jooryung Huh. (2013). Prognostic value of immunohistochemical algorithms in gastrointestinal diffuse large B-cell lymphoma. Blood Res. 48, 266;
- 12 методов в картинках: иммунологические технологии;
- Poonam Gulati. (2009). Janeway's Immunobiology, 7th Edition by Kenneth Murphy, Paul Travers, and Mark Walport. Biochem. Mol. Biol. Educ.. 37, 134-134;
- Georg Lenz, Louis M. Staudt. (2010). Aggressive Lymphomas. N Engl J Med. 362, 1417-1429;
- R. Eric Davis, Vu N. Ngo, Georg Lenz, Pavel Tolar, Ryan M. Young, et. al.. (2010). Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma. Nature. 463, 88-92;
- Lam L. T., et al. (2005). Small molecule inhibitors of IκB kinase are selectively toxic for subgroups of diffuse large B-cell lymphoma defined by gene expression profiling. Clinical cancer research. 11,28–40;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Roland Schmitz, George W. Wright, Da Wei Huang, Calvin A. Johnson, James D. Phelan, et. al.. (2018). Genetics and Pathogenesis of Diffuse Large B-Cell Lymphoma. N Engl J Med. 378, 1396-1407;
- George W. Wright, Da Wei Huang, James D. Phelan, Zana A. Coulibaly, Sandrine Roulland, et. al.. (2020). A Probabilistic Classification Tool for Genetic Subtypes of Diffuse Large B Cell Lymphoma with Therapeutic Implications. Cancer Cell. 37, 551-568.e14;
- H. Tilly, M. Gomes da Silva, U. Vitolo, A. Jack, M. Meignan, et. al.. (2015). Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 26, v116-v125;
- Anas Younes, Laurie H. Sehn, Peter Johnson, Pier Luigi Zinzani, Xiaonan Hong, et. al.. (2019). Randomized Phase III Trial of Ibrutinib and Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone in Non–Germinal Center B-Cell Diffuse Large B-Cell Lymphoma. JCO. 37, 1285-1295;
- Grzegorz S. Nowakowski, Annalisa Chiappella, Randy D. Gascoyne, David W. Scott, Qingyuan Zhang, et. al.. (2021). ROBUST: A Phase III Study of Lenalidomide Plus R-CHOP Versus Placebo Plus R-CHOP in Previously Untreated Patients With ABC-Type Diffuse Large B-Cell Lymphoma. JCO. 39, 1317-1328;
- Grzegorz S. Nowakowski, Fangxin Hong, David W. Scott, William R. Macon, Rebecca L. King, et. al.. (2021). Addition of Lenalidomide to R-CHOP Improves Outcomes in Newly Diagnosed Diffuse Large B-Cell Lymphoma in a Randomized Phase II US Intergroup Study ECOG-ACRIN E1412. JCO. 39, 1329-1338;
- Andrew Davies, Thomas E Cummin, Sharon Barrans, Tom Maishman, Christoph Mamot, et. al.. (2019). Gene-expression profiling of bortezomib added to standard chemoimmunotherapy for diffuse large B-cell lymphoma (REMoDL-B): an open-label, randomised, phase 3 trial. The Lancet Oncology. 20, 649-662.