Молчание нейронов: шокирующая правда о диете глиальных клеток
30 января 2023
Молчание нейронов: шокирующая правда о диете глиальных клеток
- 2467
- 0
- 7
Аппетит глиальных клеток подобен аппетиту гения-людоеда Ганнибала Лектера в фильме «Молчание ягнят», 1990 г.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Глиальные клетки известны как «помощники нейронов», обеспечивающие их нормальное развитие и жизнедеятельность. Однако имеется множество доказательств каннибалической сущности нейроглии — она способна «отгрызать» синапсы, поглощать не только умирающие нейроны, но и целые стволовые нервные клетки, а также здоровые нейроны в условиях критического стресса. Аппетит глиальных клеток зависит от их местонахождения в ЦНС, текущих физиологических условий (гипоксия, опухоль или инфекция, сон или бодрствование). Глиальный каннибализм может быть и полезным, и вредным для организма.
Конкурс «Био/Мол/Текст»-2022/2023
 Эта статья опубликована в номинации «Нейробиология» конкурса «Био/Мол/Текст»-2022/2023 и заслужила спецприз «Огненный дебют».
Эта статья опубликована в номинации «Нейробиология» конкурса «Био/Мол/Текст»-2022/2023 и заслужила спецприз «Огненный дебют».
Партнер номинации — компания «Сесана»: — один из ведущих поставщиков оборудования и реагентов для полного цикла научного исследования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
«У меня сегодня на ужин будет старый друг»
Ганнибал Лектер
Глия — скользкий путь к славе и признанию
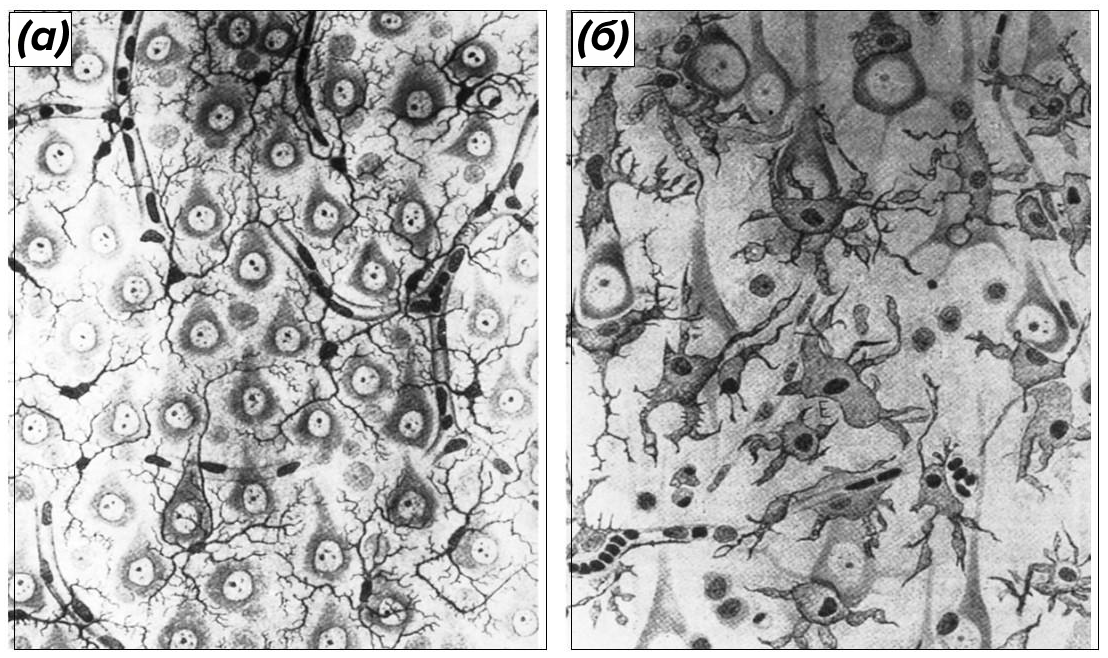
Давным-давно, когда нейроны красили нитратом серебра и зарисовывали их силуэты в альбомах, под микроскопом обнаружилась таинственная субстанция, скрепляющая нейроны в единую сеть, но малодоступная для окраски [1]. Рудольф Вирхов в 1846 году назвал эту субстанцию нейроглией («глия» по-гречески означает «клей»), подчеркнув ее безобидную «промежуточно-скрепляющую» функцию [2]. Спустя почти два десятилетия молодой врач-исследователь Отто Дейтерс впервые запечатлел на бумаге клетки нейроглии — вскоре он скончался от брюшного тифа, заразившись от своих пациентов, но глиальные клетки назывались в его честь вплоть до начала 20 века. Тогда Сантьяго Рамон-и-Кахаль [3] повысил ставки, покрасив нейроглию хлоридом золота — оказалось, что клетки Дейтерса, как и нейроны, имеют множественные отростки, многообразие форм, образуют множество связей друг с другом и с нейронами (рис. 1) [4]. С тех пор не утихал спор о клетках Дейтерса — одни утверждали, что они образуют подобие соединительной ткани, другие — что это модифицированный эпителий, в котором клетки слились в единую многоядерную сеть. И хотя многие сошлись во мнении, что глиальные клетки — это заботливые кормильцы и охранители нейронов, в 1896 году прозвучала пророческая мысль Георге Маринеску о том, что глия...не прочь полакомиться нейронятиной [5]!
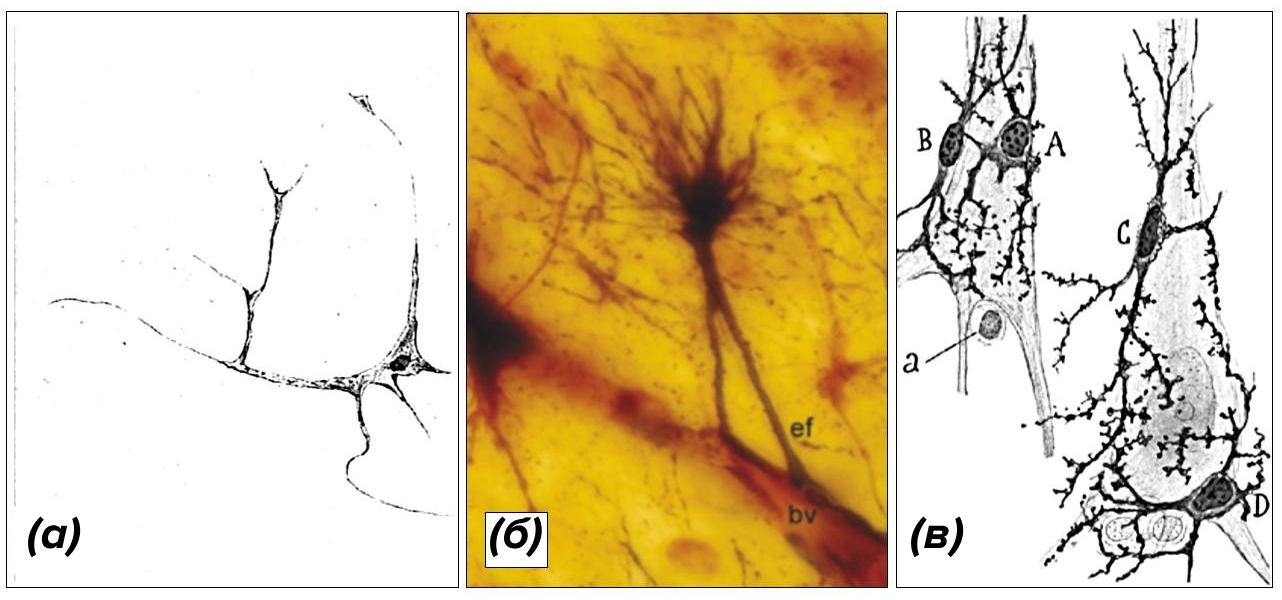
Рисунок 1.
(а) — первое изображение астроцита, рисунок Отто Дейтерса;
(б) — астроглия возле кровеносного сосуда — окраска хлоридом золота, препарат Сантьяго Рамон-и-Кахаля;
(в) — зарисовки астроглии вокруг пирамидальных нейронов гиппокампа, сделанные Сантьяго Рамон-и-Кахалем на основе препаратов, окрашенных хлоридом золота.
Пио дель Рио-Ортега, создатель первой морфофункциональной классификации глиальных клеток, писал: «У нервных клеток есть телохранители, чьи отростки простираются во всех направлениях и сдерживают любую угрозу. Однако, стоит ткани мозга воспалиться, как телохранители превращаются в ненасытных монстров и поедают на своем пути все вредное и бесполезное» [6]. Так началось большое расследование дела о глиальном каннибализме (рис. 2).
Досье на организованную глиальную группировку
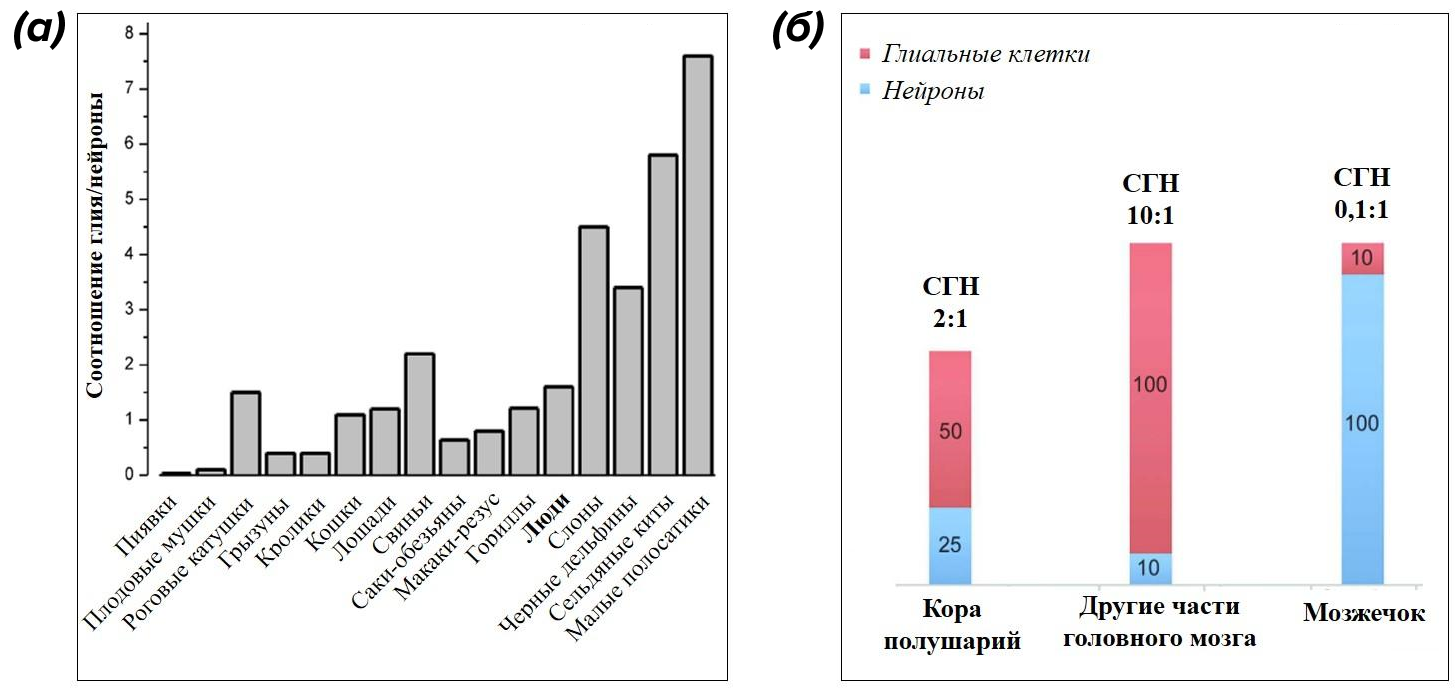
За прошедшие два столетия ученые собрали на нейроглию приличное досье — выяснилось, что она составляет до 40% объема человеческого мозга, а в гениальном мозге Альберта Эйнштейна и того больше, но это уже другая криминальная история [7], [8]. По разным подсчетам, число глиальных клеток равно числу нейронов или превышает его в 8–9 раз — в разных отделах ЦНС и у разных животных это соотношение может различаться (рис. 3) [9–11].
Среди участников «организованной группировки» нейроглии (рис. 4) были обнаружены:
- Эпендимоциты — клетки c ресничками, выстилающие желудочки мозга и продуцирующие специальную внутреннюю среду для центральной нервной системы — цереброспинальную жидкость, омывающую мозг снаружи и изнутри.
- Олигодендроциты и шванновские клетки, формирующие вокруг отростков нейронов электроизолирующую миелиновую оболочку для ускорения проведения электрических импульсов по нейронам.
- Астроциты — клетки звездчатой формы, с подозрительно большим количеством отростков и функций, среди которых формирование гематоэнцефалического барьера для избирательного транзита веществ из крови в мозговую ткань, поддержание ионного баланса вокруг нейросетей, а также архитектуры связей между нейронами — синаптических контактов.
- Микроглиальные клетки — легальные мигранты из эмбрионального желточного мешка, которым было предоставлено убежище в ЦНС в качестве иммунных клеток, следящих за внутренним порядком [12].
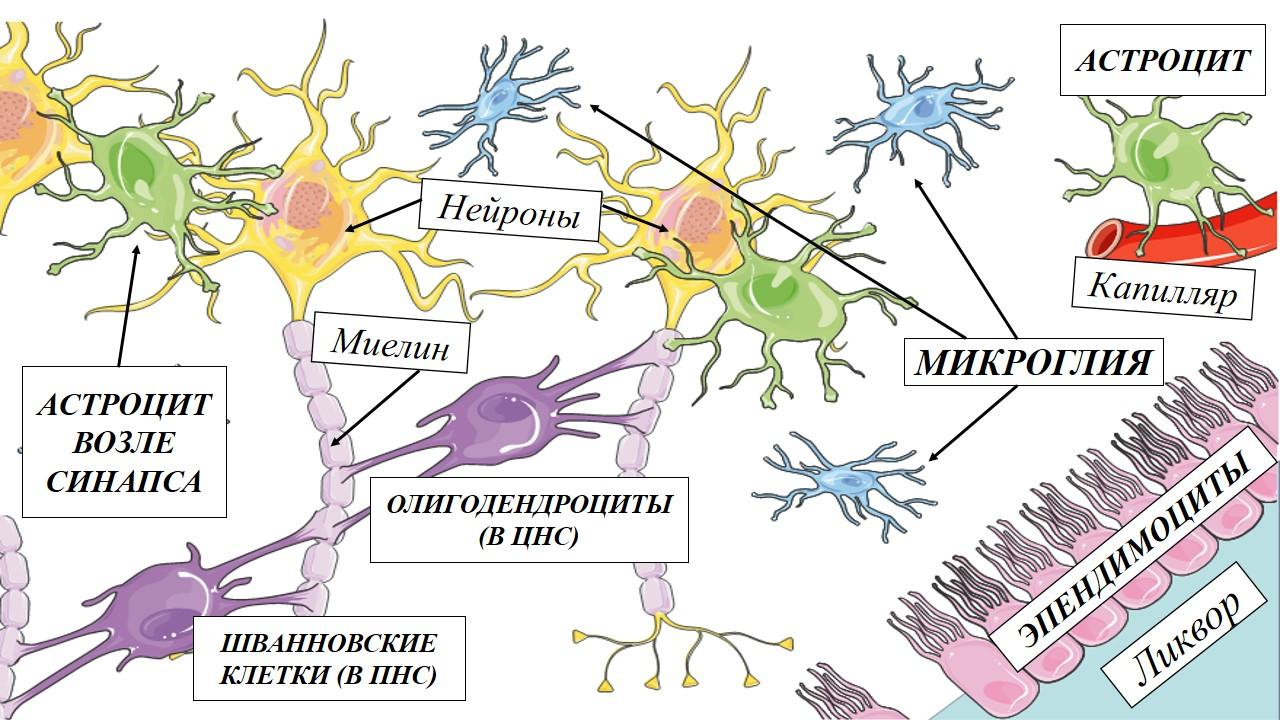
Рисунок 4. Основные морфофункциональные типы нейроглии: астроциты, олигодендроциты, шванновские клетки, микроглиальные клетки, эпендимальные клетки.
wizeprep, adapted from photo by Servier / CC BY
Глиальная сеть работает под надежным прикрытием: она имеет ближайшее родство с нейронами (все, кроме микроглии, развиваются в эмбриогенезе из нервной трубки), неоднократно зафиксировано внушающее доверие участие нейроглии в росте и дифференцировке нейронов, навигации их отростков, поддержании стабильности их синапсов. Для общения глиальные клетки используют древние и надежные средства связи — электрические синапсы, пуриновые рецепторы [13]. Глиальные клетки являются виртуозами маскировки — вытянутая радиальная глия эмбрионов превращается в звездчатые астроциты, сторожевая микроглия притворяется деревом с обгоревшими ветками, а олигодендроциты накручивают свои мембраны вокруг отростков нейронов в виде турецкого коврика (рис. 5) [14–16].
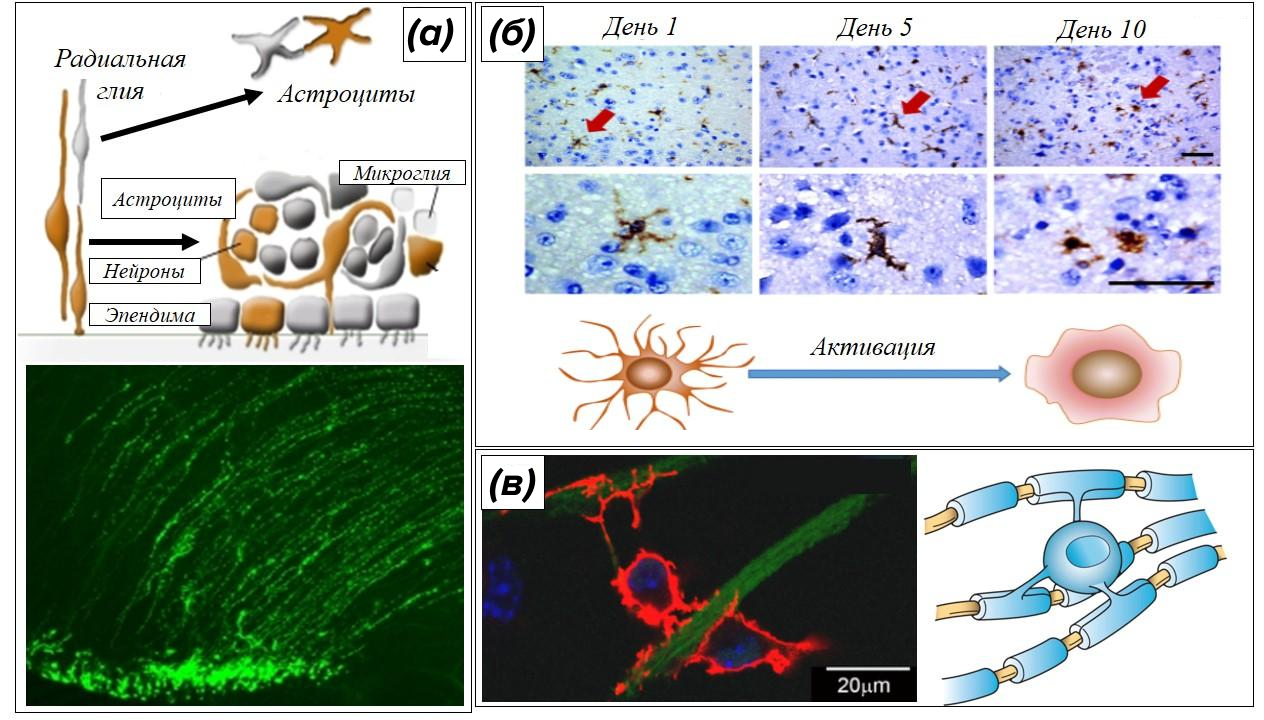
Рисунок 5. Примеры морфологической пластичности нейроглии.
(а) — превращение радиальной глии в астроциты в процессе созревания головного мозга;
(б) — активация неактивных микроглиальных клеток приводит к замене статичных отростков по типу «веток обгоревшего дерева» на подвижные псевдоподии, как у периферических макрофагов;
(в) — олигодендроцит заворачивает свои отростки вокруг аксонов нейронов с формированием миелиновой оболочки.
Именно среди этих работящих глиальных клеток — сиделок и нянь, уборщиков и таксистов, охранников и надсмотрщиков — с каждым годом обнаруживается всё больше явных и скрытых любителей нейронятины, умирающей и здоровой, старой и молодой!
Микроглия — маленькие клетки-иммигранты с большим аппетитом
Первой в каннибализме была уличена микроглия — при обыске внутри клеток были обнаружены множественные эндосомы, заполненные содержимым нейронов, на объективах микроскопа неоднократно фиксировались кадры группового поедания нейронов микроглиальными клетками [17].
Но не стоит думать, что микроглия неразборчива в своих вкусовых предпочтениях — она поедает только клетки, щедро приправленные опсонинами — белковыми метками, указывающими на сигналы «съешь меня» на поверхности нейронов. Клетки с большой тягой к жизни, особенно опухолевые, отгоняют от себя микроглию сигналами «не ешь меня» (рис. 6) [18].
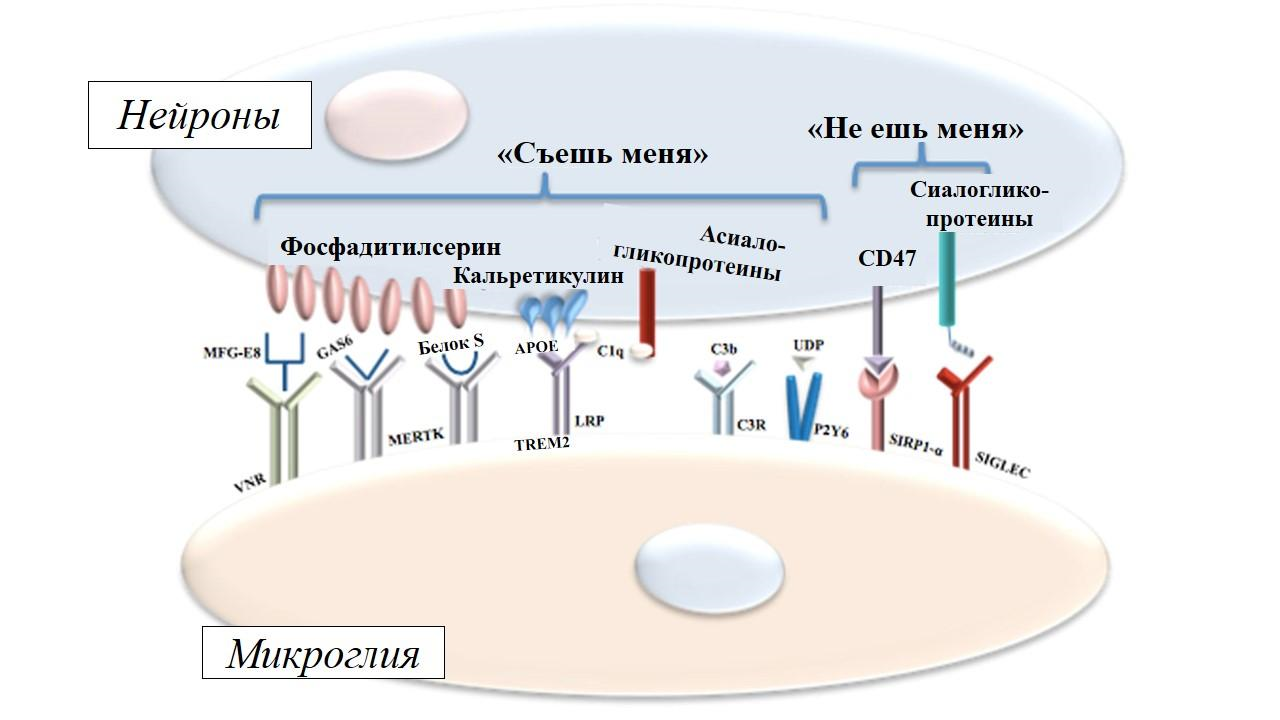
Рисунок 6. Микроглия с помощью своих рецепторов ищет добычу по сигналам «съешь меня» на поверхности клеток, помеченным белками-опсонинами. Отдельная группа микроглиальных рецепторов распознает сигналы «не ешь меня» и тормозит поедание клеток микроглией.
Поначалу ученые полагали, что микроглия поедает только нейроны, пораженные голодом и болезнями, отжившие свой век, смертельно перевозбудившиеся и истощенные — такие нейроны вынуждены претерпеть запрограммированную клеточную смерть (апоптоз). И если микроглия не успеет поглотить эти замолчавшие нейроны, то апоптоз трансформируется в некроз, умирающие клетки взорвутся, их содержимое покроет соседние клетки, и последние станут жертвами аутоиммунной агрессии [19]. Санитарная работа микроглии включает в себя также поглощение продуктов разрушения миелиновых оболочек, патологических белковых агрегатов и микроорганизмов, проникших в нервную систему. Эта черная работа заслужила эволюционное признание, так что до миграции микроглии из желточного мешка в нервную ткань подобную работу временно выполняют подвижные клетки нервного гребня, сформировавшиеся над нервной трубкой (рис. 7ж) [20].
При одной очень страшной и редкой болезни Насу-Хаколы (с очень страшным полным названием «поликистозная липомембранозная остеодисплазия со склерозирующей лейкоэнцефалопатией») мутация в одном из рецепторов микроглии, распознающем сигналы «съешь меня», вызывает развитие выраженного слабоумия уже в 30–40 лет! А всё потому, что микроглия не может эффективно очищать мозг от мусора, скопившегося после напряженной умственной работы [21].
Подробнее о том, как мозг избавляется от мусора, можно прочитать в статье «Промывка мозгов: как работает глимфатическая система» [22].
Однако микроглия была также уличена в поедании здоровых незрелых нейронов у эмбрионов и младенцев — если нейроны не определились вовремя с ориентацией своих отростков и не смогли установить крепкие синаптические связи с другими нейронами, то они запрограммированно отправляются в микроглиальную пасть. Иначе нервные контуры работают с очень низким полезным выходом и быстро истощаются из-за неадекватной инфраструктуры [23].
Беспощадность микроглиального каннибализма проявилась в поедании стволовых клеток зародышевой нервной трубки (рис. 7). Для контроля конечной численности нейронов в составе зрелого мозга, микроглия еще на этапе внутриутробного развития поглощает избыточные стволовые нервные клетки, не успевшие произвести на свет свое нервное потомство [24]. Чудовищность аппетита микроглиальных мигрантов зависит от воздействия половых гормонов, иммунного и токсического фона матери, поэтому все мы рождаемся с разным запасом нейронов в разных участках головного мозга [25].
Наконец, самой поразительной оказалась способность некоторых микроглиальных клеток съедать здоровые и зрелые нейроны с крепкими синаптическими связями «заживо» — при отсутствии пожирателей такие нейроны могут еще долго поддерживать свое автономное существование. Секрет жестокости заключается в неоднозначности сигнала «съешь меня» на поверхности нейрона — он появляется при развитии критических стрессовых условий, когда победить может не только смерть, но и своевременная адаптация. Для микроглиальных клеток фактическая победа нейрона над смертью ничего не значит — они никогда не остановятся перед заманчивым сигналом «съешь меня» [26].
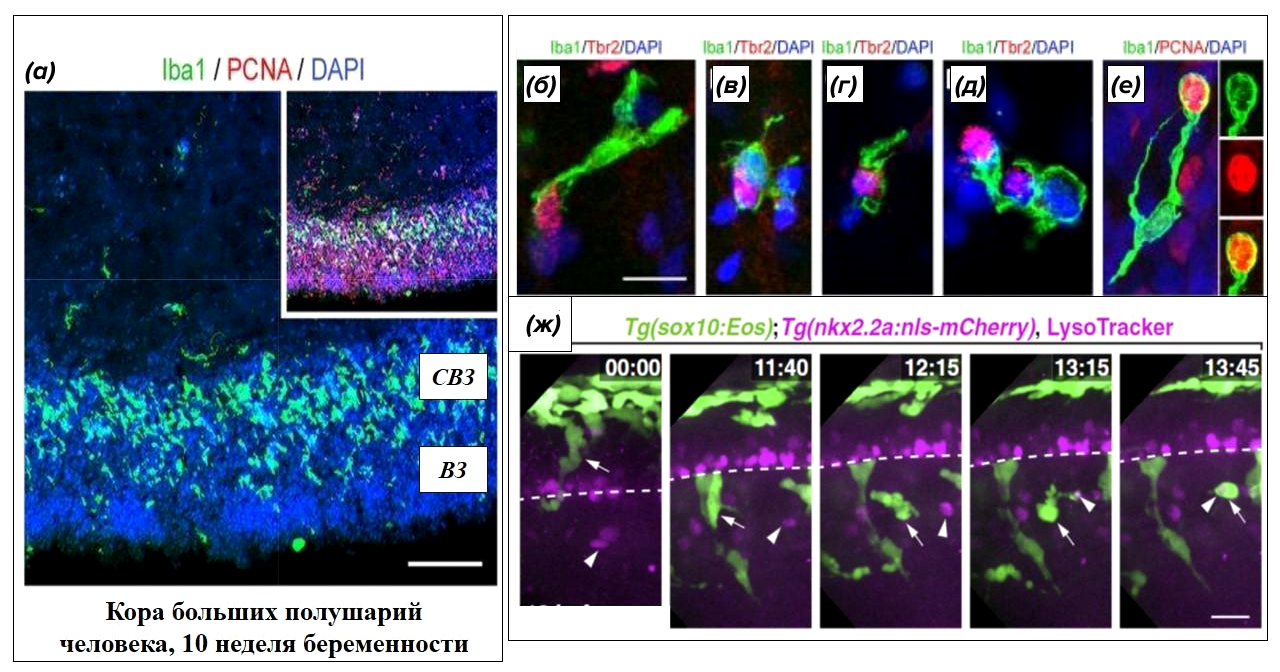
Рисунок 7. Глиальный фагоцитоз в развивающемся мозге эмбриона.
(а) — микроглия (специфически окрашена зелеными антителами) заселяет кору больших полушарий (клеточные ядра неспецифически окрашены в синий) из желточного мешка на 10 неделе беременности, пока большая часть стволовых нервных клеток (специфически окрашены в красный) сосредоточена в вентрикулярной (ВЗ) и субвентрикулярной (СВЗ) зоне.
(б—е) — этапы поглощения стволовых нервных клеток (специфически окрашены в красный) микроглией (специфически окрашена в зеленый цвет).
(ж) — клетки нервного гребня (окрашены в зеленый) мигрируют в нервную трубку и поглощают нейрональный клеточный дебрис (окрашен в сиреневый цвет).
Астроглия — неторопливые клетки-искусители
Спустя несколько лет запутанное дело о глиальном каннибализме приобрело неожиданный поворот, когда на поедании частей нейронов попались астроциты [27], [28]. Следствие зашло в тупик — как внутри одного мозга уживается сразу два клана каннибалов? Чем отличаются их вкусовые предпочтения (рис. 8)? За фигурантами дела были установлены средства слежения в виде молекулярных высокоспецифичных флуоресцентных меток — оказалось, что в зрелом мозге микроглия предпочитает тела нейронов, причем она поедает их крупными частями более 500 нм в диаметре (этот способ называется фагоцитозом), в то время как астроциты неторопливо смакуют отростками нейронов, откусывая маленькие кусочки менее 250 нм в диаметре (этот способ называется трогоцитозом) [17], [29]. Подобным образом от нейронов отгрызает кусочки «амеба, поедающая мозг» — amoeba Naegleria fowleri, которая из воды проникает в мозг через носовую полость и вызывает неизлечимое кровоточащее воспаление мозга и его оболочек с летальным исходом в течение нескольких недель [30].
И это не единственный пример разделения «сфер влияния» между двумя организованными группировками. При развитии кислородного голодания в нервной ткани формируется очаг ишемии: в центральной зоне, где нейроны безвозвратно погибли, пируют микроглиальные клетки, в то время как в прилегающей зоне пенумбры, где нейроны еще находятся на грани жизни и смерти, их покусывают астроциты. Вероятно, астроциты дают нейронам больше шансов на преодоление критического стресса [31].
При развитии крупных очагов гибели нервных клеток, а также при врожденных или приобретенных дефектах микроглии астроциты могут любезно согласиться доесть то, что не смогла поглотить микроглия, так как молекулярный набор «каннибалических столовых приборов» у них отчасти совпадает (рис. 8) [17], [19].
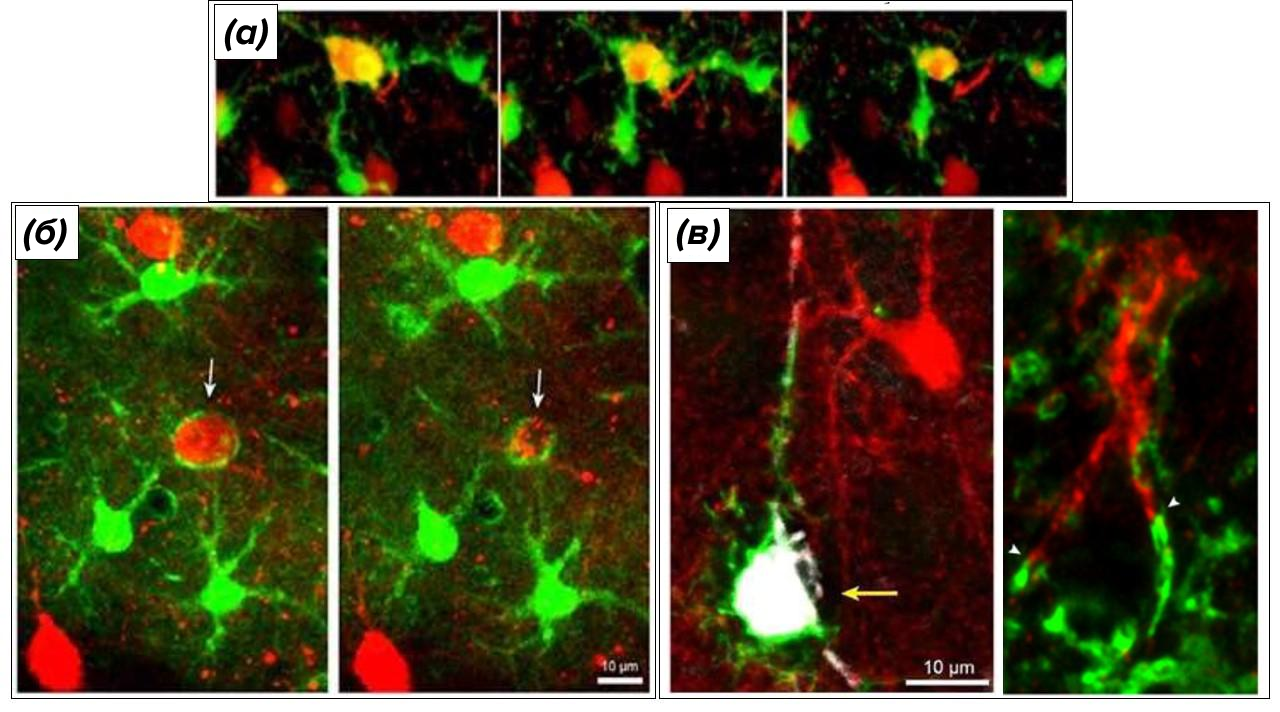
Рисунок 8.
(а) — микроглиальные клетки (зеленый цвет) соревнуются в поедании тел нейронов (красный цвет) – в итоге добыча достается самому быстрому.
(б) — при отстутствии активной микроглии астроциты (зеленый цвет) замещают ее, сообща фагоцитируя умирающие нейроны (красный цвет) с помощью своих множественнных отростков.
(в) — при совместной работе микроглия (зеленый цвет) поглощает тела нейронов, а астроциты (красный цвет) – отростки нейронов.
Интересно, что астроциты, как и микроглия, могут поедать клеточный и белковый дебрис, то есть элементы уже поврежденных и умирающих нейронов, однако делают это примерно в 2 раза медленнее, предположительно, из-за более низкой кислотности лизосом, чем у микроглии [32].
Вечеринка астроглии и микроглии в синаптической щели
Когда в развивающемся мозге наступает период синаптического прунинга, то есть удаления невыгодных синаптических связей в формирующихся нервных контурах, то в дело также вступают как астроциты, так и микроглиальные клетки [23], [33]. Это пиршество происходит не только в мозге младенца, но и в мозгах мышонка, личинки дрозофилы и других древних животных. Откусывая от нейронов кусочки отростков с неэффективными синапсами, они не только устраняют избыточные связи между нервными контурами, но и устанавливают основу топической организации (пространственного «разделения труда») в веществе головного мозга, например, ограничивают друг от друга участки глазодоминантности для правого и левого глаза в ядрах таламуса и в зрительной коре [26], [31].
Недостаточный синаптический прунинг повышает риск развития аутизма и эпилепсии, а избыточный синаптический прунинг — риск шизофрении, для этих заболеваний неоднократно было показано нарушение синаптической архитектуры и плотности [34], [35].
В зрелой и здоровой нервной ткани микроглия обычно принимает выжидательную позицию, становится менее подвижной и прожорливой (потому что мозг скуп на трату энергии, если это нецелесообразно), в то время как астроциты, пользуясь своим близким расположением к синапсам, продолжают их исподтишка покусывать: астроциты «отгрызают» кусочки нейронов с молчащими или слишком активными синапсами, а также со взрывоопасными митохондриями, которые нуждаются в утилизации [17]. Таким образом обеспечивается высокий уровень синаптической опыт-зависимой пластичности (то есть оперативного изменения количества и расположения синапсов на нейроне в зависимости от поступающей информации), особенно в гиппокампе, мозжечке, таламусе (рис. 9) [32]. Как истинные гурманы, астроциты пользуются своеобразными критериями идеального ужина: они предпочитают есть в ночное время, пока мозг спит, а на угрызение нейронов их вдохновляет направленное механическое воздействие — встречный поток межклеточной жидкости [32]. Астроцитарный трогоцитоз может принимать патологический характер при недостаточном сне и энергетическом голодании нервной ткани, повышая риск развития когнитивных нарушений [36], [37].
При развитии локальных стрессовых состояний (инфекция, гипоксия, повреждение) некоторые нейроны спасаются посредством «синаптического раздевания» — еще до активации микроглии астроциты успевают откусить большую часть их нестойких и возбуждающих синапсов, чтобы предотвратить перевозбуждение всего нервного контура и изолировать патологический процесс [38].
Глиальные клетки очень уважают территориальный суверенитет своих каннибалических группировок — каждая из них не только отличается по набору используемых «каннибалических» генов, но и занимает свою определенную территорию и не вмешивается в дела своих соседей, даже если эти соседи были уничтожены пытливой человеческой рукой во время эксперимента [39], [40]. Например, в разных слоях коры больших полушарий, в передней и задней части спинного мозга, в глубоком веществе возле желудочков головного мозга правила трапезы у нейроглии будут отличаться [41], [42].
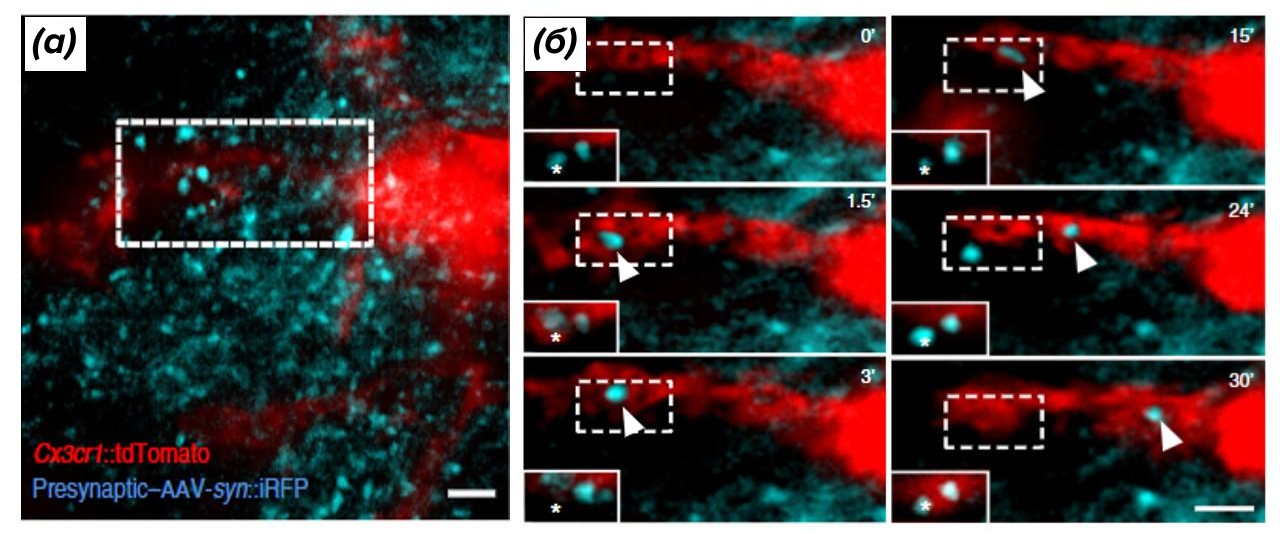
Рисунок 9. Этапы трогоцитоза пресинаптических участков живых нейронов (голубой цвет) клетками нейроглии (красный цвет).
Глиальные клетки — действительно скользкие типы
Зафиксированные случаи каннибализма среди нейроглии продолжают расти — шванновские клетки попались на поедании продуктов распада миелина и синапсов между нейронами и мышцами [43], а у микроглии зафиксировали высокий аппетит к здоровым миелиновым оболочкам нейронов, особенно в молодом растущем мозге [44], несанкционированное поедание здорового миелина проголодавшейся провоспалительной микроглией в спинном мозге может потенциально привести хроническому болевому синдрому [45], а откусывание ножек астроцитов — к чрезмерному повышению проницаемости гемато-энцефалического барьера [46]; а еще астроциты и микроглия не прочь съесть друг друга при наступлении апоптоза [32].
Так почему же нейроны молчат, позволяя поедать себя глиальным клеткам? Ответ на этот вопрос неоднозначен. С одной стороны, такова суровая жертва нервного племени — в живых остаются только лучшие нейроны, связанные крепкими синапсами, сливающиеся в стройную симфонию потенциалов действия. С возрастом астроциты и микроглия теряют свои каннибалические навыки — они уже неспособны быстро поедать остатки отработанного миелина, дефектные белки, медленнее переваривают ядра умирающих нейронов [17]. И мозг наполняется бессмысленным грузом — отжившие свой век нейроны лопаются, навевая воспалительный ужас на своих соседей, сверхстабильные белки возводят свои баррикады и агитируют рабочие белки присоединиться к забастовке.
Но с другой стороны — многие ученые группы указывают на избыточное поедание нейрональных отростков микроглией и астроцитами, особенно синапсов, в стареющем мозге [33]. Пожилые люди часто страдают нарушениями сна, из-за чего астроциты активнее поедают синапсы. Мутации в генах, регулирующих процесс поедания и переваривания клеток мозга нейроглией, ассоциированы с высоким риском развития нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, лобно-височная деменция, боковой амиотрофический склероз. Для всех этих нейродегенераций характерно начало патологических процессов с определенных территорий центральной нервной системы, и, как уже было сказано выше, активность глиальных клеток тоже имеет территориальную зависимость. После 60 лет мозг теряет до 1% своей массы каждый год, преимущественно за счет уменьшения количества миелина и синапсов, но не тел нейронов. При этом особенно часто страдает сигнализация «не ешь меня», в результате чего нейроглия начинает поедать жизнеспособные нейроны или их синапсы [38].
Поэтому в завершении хочется сказать в духе выдающегося писателя Павла Петровича Бажова: «Вот они значит какие, глиальные клетки! Худому с ними встретиться — горе, и доброму — радости мало».
Литература
- 12 методов в картинках: нейробиология;
- Почему помощники нейронов «ползают» и «прыгают»?;
- Сотворивший нейробиологию: Сантьяго Рамон-и-Кахаль;
- Virginia García-Marín, Pablo García-López, Miguel Freire. (2007). Cajal's contributions to glia research. Trends in Neurosciences. 30, 479-487;
- George G. Somjen. (1988). Nervenkitt: Notes on the history of the concept of neuroglia. Glia. 1, 2-9;
- PIO DEL RIO-HORTEGA. (1993). Art and artifice in the science of histology. Histopathology. 22, 515-525;
- Nicola J. Allen, David A. Lyons. (2018). Glia as architects of central nervous system formation and function. Science. 362, 181-185;
- Marian C. Diamond, Arnold B. Scheibel, Greer M. Murphy Jr., Thomas Harvey. (1985). On the brain of a scientist: Albert Einstein. Experimental Neurology. 88, 198-204;
- Alexei Verkhratsky, Arthur Butt. (2018). The History of the Decline and Fall of the Glial Numbers Legend. Neuroglia. 1, 188-192;
- Christopher S. von Bartheld, Jami Bahney, Suzana Herculano-Houzel. (2016). The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. J. Comp. Neurol.. 524, 3865-3895;
- Jami Bahney, Christopher S. von Bartheld. (2018). The Cellular Composition and Glia-Neuron Ratio in the Spinal Cord of a Human and a Nonhuman Primate: Comparison With Other Species and Brain Regions. Anat. Rec.. 301, 697-710;
- Микроглия: роль «иммунных» клеток центральной нервной системы в здоровом мозге и при нейродегенеративных заболеваниях;
- Helmut Kettenmann, Uwe-Karsten Hanisch, Mami Noda, Alexei Verkhratsky. (2011). Physiology of Microglia. Physiological Reviews. 91, 461-553;
- Lacar. (2010). Imaging and recording subventricular zone progenitor cells in live tissue of postnatal mice. Front. Neurosci.;
- Zhiyuan Vera Zheng, Hao Lyu, Sin Yu Erica Lam, Ping Kuen Lam, Wai Sang Poon, George Kwok Chu Wong. (2020). The Dynamics of Microglial Polarization Reveal the Resident Neuroinflammatory Responses After Subarachnoid Hemorrhage. Transl. Stroke Res.. 11, 433-449;
- Kalliopi Ioannidou, Kurt I. Anderson, David Strachan, Julia M. Edgar, Susan C. Barnett. (2012). Time-Lapse Imaging of the Dynamics of CNS Glial-Axonal Interactions In Vitro and Ex Vivo. PLoS ONE. 7, e30775;
- Eyiyemisi C. Damisah, Robert A. Hill, Anupama Rai, Fuyi Chen, Carla V. Rothlin, et. al.. (2020). Astrocytes and microglia play orchestrated roles and respect phagocytic territories during neuronal corpse removal in vivo. Sci. Adv.. 6;
- Cataldo Arcuri, Carmen Mecca, Roberta Bianchi, Ileana Giambanco, Rosario Donato. (2017). The Pathophysiological Role of Microglia in Dynamic Surveillance, Phagocytosis and Structural Remodeling of the Developing CNS. Front. Mol. Neurosci.. 10;
- Hiroyuki Konishi, Takayuki Okamoto, Yuichiro Hara, Okiru Komine, Hiromi Tamada, et. al.. (2020). Astrocytic phagocytosis is a compensatory mechanism for microglial dysfunction. EMBO J. 39;
- Yunlu Zhu, Samantha C. Crowley, Andrew J. Latimer, Gwendolyn M. Lewis, Rebecca Nash, Sarah Kucenas. (2019). Migratory Neural Crest Cells Phagocytose Dead Cells in the Developing Nervous System. Cell. 179, 74-89.e10;
- Juha Paloneva, Tuula Manninen, Grant Christman, Karine Hovanes, Jami Mandelin, et. al.. (2002). Mutations in Two Genes Encoding Different Subunits of a Receptor Signaling Complex Result in an Identical Disease Phenotype. The American Journal of Human Genetics. 71, 656-662;
- Промывка мозгов: как работает глимфатическая система;
- Rosa C. Paolicelli, Giulia Bolasco, Francesca Pagani, Laura Maggi, Maria Scianni, et. al.. (2011). Synaptic Pruning by Microglia Is Necessary for Normal Brain Development. Science. 333, 1456-1458;
- Jonathan W. VanRyzin, Ashley E. Marquardt, Kathryn J. Argue, Haley A. Vecchiarelli, Sydney E. Ashton, et. al.. (2019). Microglial Phagocytosis of Newborn Cells Is Induced by Endocannabinoids and Sculpts Sex Differences in Juvenile Rat Social Play. Neuron. 102, 435-449.e6;
- C. L. Cunningham, V. Martinez-Cerdeno, S. C. Noctor. (2013). Microglia Regulate the Number of Neural Precursor Cells in the Developing Cerebral Cortex. Journal of Neuroscience. 33, 4216-4233;
- Guy C. Brown, Jonas J. Neher. (2014). Microglial phagocytosis of live neurons. Nat Rev Neurosci. 15, 209-216;
- J. D. Cahoy, B. Emery, A. Kaushal, L. C. Foo, J. L. Zamanian, et. al.. (2008). A Transcriptome Database for Astrocytes, Neurons, and Oligodendrocytes: A New Resource for Understanding Brain Development and Function. Journal of Neuroscience. 28, 264-278;
- Naomi Habib, Cristin McCabe, Sedi Medina, Miriam Varshavsky, Daniel Kitsberg, et. al.. (2020). Disease-associated astrocytes in Alzheimer’s disease and aging. Nat Neurosci. 23, 701-706;
- Трогоцитоз: зачем клетки делают «кусь»?;
- T. Brown. (1979). OBSERVATIONS BY IMMUNOFLUORESCENCE MICROSCOPY AND ELECTRON MICROSCOPY ON THE CYTOPATHOGENICITY OF NAEGLERIA FOWLERI IN MOUSE EMBRYO-CELL CULTURES. Journal of Medical Microbiology. 12, 363-371;
- Yosuke M. Morizawa, Yuri Hirayama, Nobuhiko Ohno, Shinsuke Shibata, Eiji Shigetomi, et. al.. (2017). Reactive astrocytes function as phagocytes after brain ischemia via ABCA1-mediated pathway. Nat Commun. 8;
- Rena Kono, Yuji Ikegaya, Ryuta Koyama. (2021). Phagocytic Glial Cells in Brain Homeostasis. Cells. 10, 1348;
- Won-Suk Chung, Laura E. Clarke, Gordon X. Wang, Benjamin K. Stafford, Alexander Sher, et. al.. (2013). Astrocytes mediate synapse elimination through MEGF10 and MERTK pathways. Nature. 504, 394-400;
- Fabia Filipello, Raffaella Morini, Irene Corradini, Valerio Zerbi, Alice Canzi, et. al.. (2018). The Microglial Innate Immune Receptor TREM2 Is Required for Synapse Elimination and Normal Brain Connectivity. Immunity. 48, 979-991.e8;
- Carl M. Sellgren, Jessica Gracias, Bradley Watmuff, Jonathan D. Biag, Jessica M. Thanos, et. al.. (2019). Increased synapse elimination by microglia in schizophrenia patient-derived models of synaptic pruning. Nat Neurosci. 22, 374-385;
- Eileen Uribe-Querol, Carlos Rosales. (2021). The Multiple Roles of Trogocytosis in Immunity, the Nervous System, and Development. BioMed Research International. 2021, 1-16;
- Michele Bellesi, Luisa de Vivo, Mattia Chini, Francesca Gilli, Giulio Tononi, Chiara Cirelli. (2017). Sleep Loss Promotes Astrocytic Phagocytosis and Microglial Activation in Mouse Cerebral Cortex. J. Neurosci.. 37, 5263-5273;
- Anna Vilalta, Guy C. Brown. (2018). Neurophagy, the phagocytosis of live neurons and synapses by glia, contributes to brain development and disease. FEBS J. 285, 3566-3575;
- Hui-Hsin Tsai, Huiliang Li, Luis C. Fuentealba, Anna V. Molofsky, Raquel Taveira-Marques, et. al.. (2012). Regional Astrocyte Allocation Regulates CNS Synaptogenesis and Repair. Science. 337, 358-362;
- Anna V. Molofsky, Kevin W. Kelley, Hui-Hsin Tsai, Stephanie A. Redmond, Sandra M. Chang, et. al.. (2014). Astrocyte-encoded positional cues maintain sensorimotor circuit integrity. Nature. 509, 189-194;
- Marc R. Freeman, David H. Rowitch. (2013). Evolving Concepts of Gliogenesis: A Look Way Back and Ahead to the Next 25 Years. Neuron. 80, 613-623;
- Laetitia Weinhard, Giulia di Bartolomei, Giulia Bolasco, Pedro Machado, Nicole L. Schieber, et. al.. (2018). Microglia remodel synapses by presynaptic trogocytosis and spine head filopodia induction. Nat Commun. 9;
- I. W. Smith, M. Mikesh, Y. i. Lee, W. J. Thompson. (2013). Terminal Schwann Cells Participate in the Competition Underlying Neuromuscular Synapse Elimination. Journal of Neuroscience. 33, 17724-17736;
- Alexandria N. Hughes, Bruce Appel. (2020). Microglia phagocytose myelin sheaths to modify developmental myelination. Nat Neurosci. 23, 1055-1066;
- Mitsuyo Maeda, Makoto Tsuda, Hidetoshi Tozaki-Saitoh, Kazuhide Inoue, Hiroshi Kiyama. (2010). Nerve injury-activated microglia engulf myelinated axons in a P2Y12 signaling-dependent manner in the dorsal horn. Glia. 58, 1838-1846;
- Koichiro Haruwaka, Ako Ikegami, Yoshihisa Tachibana, Nobuhiko Ohno, Hiroyuki Konishi, et. al.. (2019). Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nat Commun. 10.