Почему помощники нейронов «ползают» и «прыгают»?
15 марта 2016
Почему помощники нейронов «ползают» и «прыгают»?
- 2597
- 0
- 4
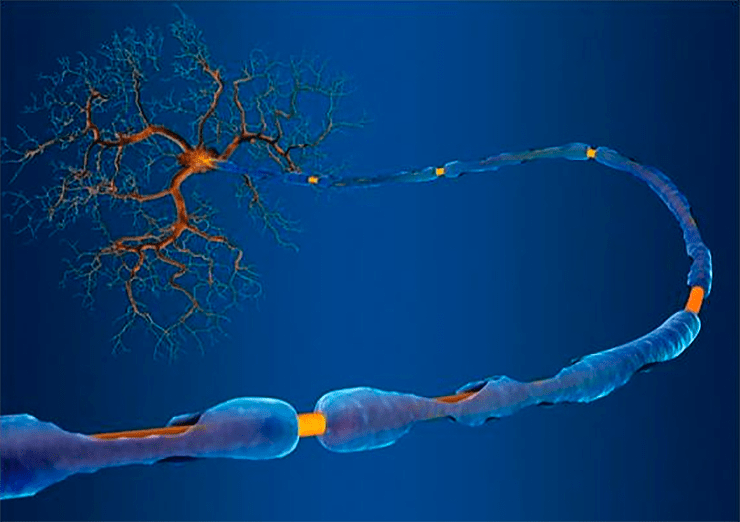
Если нервная система — это сигнальная сеть нашего организма, то длинные отростки нервных клеток — это кабели, транслирующие электрические стимулы. Для их успешной и долгой работы необходима изоляция — защитная миелиновая оболочка.
-
Автор
-
Редакторы
Когда мы думаем о мозге, то представляем себе сложные процессы высшей нервной деятельности — от сновидений до изучения иностранных языков. Однако за всеми этими глобальными вещами стоят обыкновенные клетки — нейроны. Благодаря построению сложных сетей они функционируют как огромный социум. И даже на самых ранних этапах развития клетки — предшественницы нервной ткани подчас отличаются «нестандартным поведением», которое в конечном счете обеспечивает сложную архитектуру связей мозга. Для того чтобы разобраться в этом, попробуем ответить на ряд вопросов.
Что такое нейроглия?
Большинству людей кажется очевидным, что вся сложная психическая деятельность обеспечивается исключительно нервными клетками, которые проводят импульсы, обусловливают эмоции и позволяют успешно взаимодействовать с окружающим миром. Однако правильная работа нейронов была бы невозможна без очень важного клеточного образования — нейроглии. Глиальные клетки формируют специфическое микроокружение для нейронов, обеспечивая условия для генерации и передачи нервных импульсов. Среди этих клеток наиболее многочисленна группа олигодендроцитов. Они «изолируют» длинные отростки нейронов — аксоны — для того, чтобы проводить сигналы с высокой скоростью. Изолирующее покрытие, окружающее нервные волокна, называется миелин, а сам процесс изоляции — миелинизация. Олигодендроциты поддерживают быструю нервную проводимость и защищают целостность аксонов в процессе их жизнедеятельности.
Как обеспечивается изоляция нервных волокон?
Каждый из олигодендроцитов образует несколько отростков-«ножек», которые оборачивают часть длинных отростков нейронов (рис. 1). В результате один олигодендроцит оказывается связанным сразу с несколькими нервными клетками. Считается, что самую мощную миелиновую изоляцию в мозге получают наиболее активные аксоны — это позволяет им работать еще эффективнее.
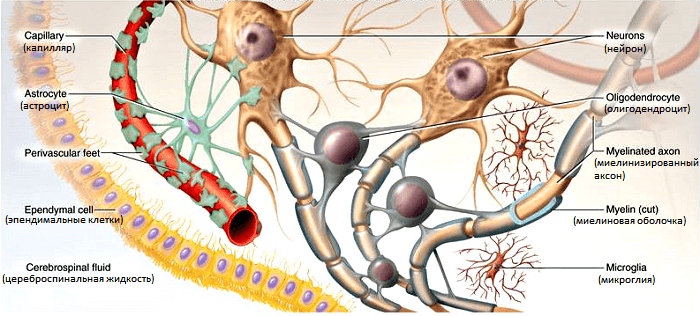
Рисунок 1. Образование миелиновой оболочки в центральной нервной системе. Оболочка формируется из плоских выростов олигодендроцитов, многократно оборачивающих аксон наподобие изоляционной ленты.
Можно ли избирательно управлять процессом миелинизации?
Не все нейроны требуют конструирования вокруг аксонов изоляционных оболочек — ведь тогда все клетки нашей нервной системы работали бы в суперинтенсивном режиме. Следствием стала бы сверхвозбудимость и в конечном счете гибель организма. Получается, что в процессе формирования нервной системы клетки как-то понимают, где необходимо строить миелиновые оболочки, а где — нет? Действительно, миелинизация аксонов начинается уже на ранних этапах развития организма, и в этом помогают клетки — предшественницы олигодендроцитов (oligodendrocyte precursor cells, OPCs). Для формирования «правильной» структуры нервных волокон эти клетки мигрируют в организме зародыша на протяжении его эмбрионального развития.
Область первичной миграции клеток нейроглии — это субвентрикулярная зона головного мозга; именно здесь в специальных доменах формируются OPCs. Отсюда клетки-предшественницы способны мигрировать на большие расстояния, обеспечивая равномерное распределение вещества в центральной нервной системе. В процессе развития нервной системы наиболее важны перемещения OPCs, происходящие на ранних этапах эмбрионального развития: несмотря на то, что миграции клеток после рождения тоже возможны, способность к ним сильно ограничена.
Результаты нового исследования, проведенного учеными из Калифорнийского университета в Сан-Франциско и Калифорнийского университета в Сан-Диего, показали, что для развития нервной системы нужна физическая опора, помогающая клеткам мигрировать [1], [2]. Таким «субстратом» в организме млекопитающих служит кровеносная система. Получается, что роль сосудов не ограничивается транспортировкой газов и питательных веществ. Последние наблюдения доказывают, что именно кровеносная сеть способствует нормальному развитию головного и спинного мозга.
Для построения первичной структуры мозга клеткам-предшественницам важно правильно распознавать путь своей миграции. Мобильность ОРСs регулируется специальными клеточными механизмами, а также полярностью и внеклеточными сигналами [1]. Важным активатором является особый рецептор — Gpr124 (G protein-coupled receptor 124), а регулятором взаимодействия между клетками-предшественницами и сосудистым эндотелием выступает Wnt-сигналинг [3].
Как изучали процессы перемещения клеток-предшественниц?
В первой серии экспериментов участвовали клетки мышиных зародышей. Оказалось, что в развивающемся переднем мозге мыши сначала «налаживается» сосудистая сеть, а уже затем появляются первые клетки — предшественницы олигодендроцитов. Для их дальнейшей миграции необходимо наладить контакт с поверхностью кровеносных сосудов, и это достигается благодаря «вторжению» эндотелиальных отростков в нейроэпителий (рис. 2).
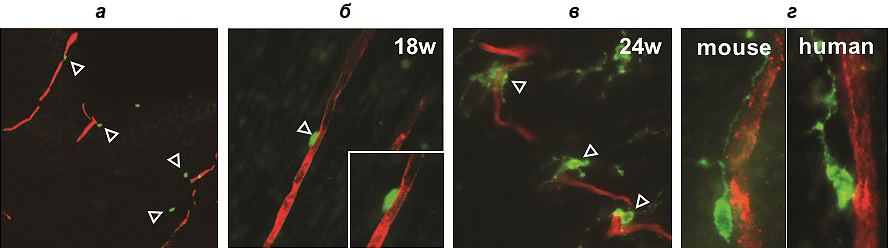
Рисунок 2. Конфокальные изображения, показывающие ассоциацию OPCs с кровеносными сосудами. а — Первые OPCs (выделены зеленым цветом, обозначены стрелками) «прибывают» из зародышевого мозга для прикрепления к сосудам (помечены красным цветом). б — Контакт OPCs с кровеносными сосудами на 18 неделе эмбрионального развития. в — Контакт на 24 неделе. г — Сходная морфологическая ассоциация кровеносных сосудов с клетками-предшественницами в организме мыши (слева) и человека (справа).
Дополнительную серию экспериментов провели с образцами мозгового вещества человека и показали, что в процессе развития наблюдается сходная ассоциация клеток-предшественниц с сосудами. Это позволяет предположить общность такой картины формирования нейроглии для всех млекопитающих.
Визуализация живых ОРСs зародыша с помощью флуоресцентного маркера Olig2-GFP выявила две основных модели поведения этих клеток: «ползание» и «перепрыгивание». Клетки, непосредственно соприкасающиеся с поверхностью кровеносного сосуда, в процессе своей миграции постепенно «переползают» вдоль него. Если же необходимо создать связь с новым сосудом, ОРСs вынуждены «прыгать», не контактируя непосредственно с эндотелием — так перемещение происходит быстрее. Нужно отметить, что ассоциация мигрирующих ОРСs с сосудами не ограничена пределами головного мозга зародыша: исследователи обнаружили ее на более поздних стадиях развития и в спинном мозге.
Конечно, для установления глобальной роли сосудистой системы в перемещениях клеток нейроглии предстоит провести еще не один эксперимент. Однако обсуждаемое исследование впервые раскрыло принципы миграций предшественников олигодендроцитов в развивающейся нервной системе. Оно впервые показало, что нормальное развитие нервной системы напрямую связано с кровеносной системой зародыша. Сейчас можно принять за установленный факт следующее: именно сосуды определяют дальнейшие пути формирования нервной системы. Если у зародыша есть нарушения в строении кровеносной системы, то и нервная вряд ли избежит патологии.
Что дает нам исследование миграций OPCs?
Несмотря на то, что способность к перемещениям клеток-предшественниц наиболее активно проявляется на ранних этапах эмбрионального развития, отклонения от нормы в этом периоде приводят к серьезным расстройствам организма во взрослом состоянии. Нарушение структуры миелиновых оболочек нейронов имеет решающее значение в патогенезе некоторых болезней человека — например, рассеянного склероза или гипоксических повреждений у новорожденных. Рассеянный склероз — это наиболее часто встречающееся неврологическое нарушение у молодых людей , а развивается оно вследствие повреждения миелиновой оболочки нервных клеток головного и спинного мозга аномальными иммунными клетками (рис. 3).
И поэтому способам лечения рассеянного склероза посвящено множество медицинских исследований, в том числе отечественных. Например, аутоиммунной нейродегенерацией — и именно с упором на рассеянный склероз — занимается лаборатория биокатализа ИБХ РАН «Лаборатория биокатализа ИБХ: дизайнерские ферменты и клоны-мятежники» [4]. — Ред.
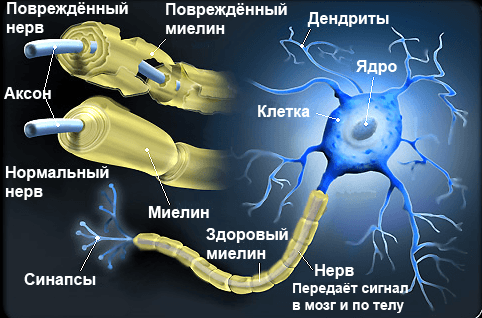
Рисунок 3. Демиелинизация нервных волокон — причина развития рассеянного склероза.
сайт is-med.com, рисунок адаптирован
Без миелина нервные импульсы не передаются должным образом, что со временем приводит к постепенному расстройству таких жизненно важных функций, как способность ходить, держать предметы и даже видеть. Часть современных методик лечения демиелинизации направлена на замедление дальнейшего разрушения миелина, часть — на активацию стволовых клеток нервной системы взрослого человека, которые вновь синтезируют миелин [5]. Однако калифорнийское исследование может открыть новые перспективы лечения рассеянного склероза. Вполне возможно, что ранняя диагностика состояния кровеносной системы зародыша позволит выявить нарушения в нервной системе, а значит — осуществить лечебное вмешательство уже в эмбриональном периоде развития. Изучение распределения предшественников олигодендроцитов в областях возможных повреждений зародыша поможет раскрыть, как дисфункция нервной и кровеносной систем влияет на манифестацию и прогрессирование неврологических расстройств в послеродовом периоде развития человека.
Литература
- Tsai H.H., Niu J., Munji R., Davalos D., Chang J., Zhang H. et al. (2016). Oligodendrocyte precursors migrate along vasculature in the developing nervous system. Science. 351, 379–384;
- Dejana E. and Betsholtz C. (2016). Oligodendrocytes follow blood vessel trails in the brain. Science. 351, 341–342;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Лаборатория биокатализа ИБХ: дизайнерские ферменты и клоны-мятежники;
- Najm F.J., Madhavan M., Zaremba A., Shick E., Karl R.T., Factor D.C. et al. (2015). Drug-based modulation of endogenous stem cells promotes functional remyelination in vivo. Nature. 522, 216–220.