Молекулярные машины: от создания искусственной модели к терапии рака
19 ноября 2019
Молекулярные машины: от создания искусственной модели к терапии рака
- 1793
- 0
- 5
Твое будущее в его руках ©
-
Авторы
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Для развития загадочного мира ДНК-технологий ученые черпали идеи своих изобретений, по-видимому, из мира научной фантастики, которые превратились из литературного вымысла в новую реальность. Пожалуй, именно поэтому при упоминании термина «наномашины», у большинства людей возникают образы серебристых микроскопических роботов с искусственным интеллектом. В фантастических романах они обычно пытаются подчинить человечество или наносят ущерб всему, с чем сталкиваются. Наши же ДНК-нанороботы вовсе не обладают такими ужасающими способностями. Более того, благодаря стремительному развитию нанотехнологий машины на основе ДНК обладают высоким потенциалом для терапии смертельных заболеваний. Однако можно ли их применять в реальных условиях человеческого организма? А главное, насколько эффективно применение ДНК-нанороботов в нашей жизни? На эти и многие другие вопросы вы найдете ответы в данной статье. Более того, статья расскажет читателям о последних разработках индустрии нанотехнологий и перспективах создания врачей-роботов будущего.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Партнер номинации — Российский научный фонд.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Почему рак, а не лобстер?
Рак как болезнь куда старше человечества: он известен у динозавров, живших в мезозойской эре примерно 240 млн лет назад [1]. Где возникает многоклеточная форма жизни, существует и шанс, что механизм управления клетками выйдет из строя и приведет к неконтролируемому росту и делению клеток. Подобный процесс был обнаружен и выделен в качестве отдельной болезни еще древними людьми [2].
Доподлинно известно, что греческий врач Гиппократ первым обнаружил у пациента опухоль, по форме напоминающую краба, впоследствии римский врач Авл Корнелий Цельс в I в. до н. э. перевел греческое слово καρκίνος на латынь (cancer — рак) [3], [4]. Можете себе представить, что первые методы лечения рака были особенно фантастическими: аптекари того времени запасались зубом кабана, легкими лисиц, настойками свинца, молотым белым кораллом и другими столь же нерезультативными средствами, в то время как хирурги иногда проводили подобие мастэктомии без анестезии в антисанитарных условиях [5], [6].
В конце XIX века ученые обратили внимание на возможность убивать злокачественные клетки с помощью лучевой терапии, несмотря на пагубное влияние излучения на здоровые ткани организма. Однако медицина идет вперед (рис. 1), некоторые виды рака уже излечимы в большинстве клинических случаев, благодаря созданию новейших препаратов и переходам к нестандартным методам лечения.
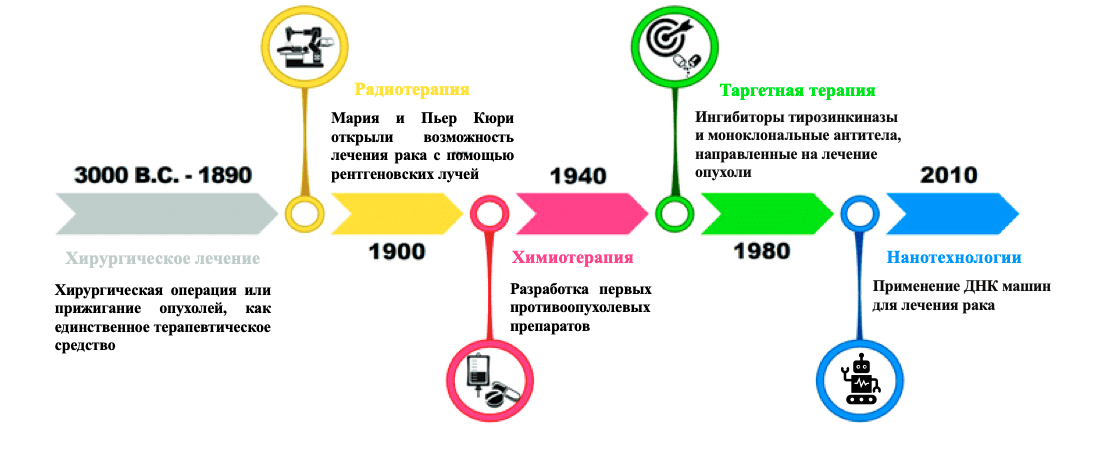
Рисунок 1. Хронология внедрения новых методов лечения злокачественных опухолей. После развития лучевой терапии в начале 1900 года, начался современный этап онкологии с появлением первых химиотерапевтических препаратов примерно в 1940 году. Впоследствии произошел прорыв в области медицинской онкологии с развитием таргетной терапии в 1980 году, что определило улучшение эффективности лечения рака. Последний поворот произошел в 2010 году с появлением ДНК наномашин, ведущих борьбу с биомаркерами раковых клеток.
[2], рисунок адаптирован
Например, большинство таргетных препаратов, которые успешно спасают жизни, направлены на белки. В основе целевой, или таргетной (англ. target — цель, мишень), терапии злокачественных опухолей лежит точечное воздействие на характерные молекулы, располагающиеся на поверхности клетки, транслирующие информационные сигналы напрямую в клеточное ядро.
Возникновение опухоли — это процесс накопления мутаций (ошибочных сигналов) под действием различных внешних и внутриклеточных факторов в клеточном геноме. Чем дольше происходит деление поврежденных клеток, тем выше вероятность злокачественного перерождения клетки под действием канцерогенов. Как результат — опухоль дает рецидив в связи с накоплением таких повреждений.
Наравне с таргетными лекарствами развивались прочие многообещающие механизмы борьбы с измененными клетками. Так, методы, основанные на нуклеиновых кислотах, давно привлекают внимание исследователей в качестве регуляторов канцерогенеза на молекулярном уровне.
В начале нашего тысячелетия ученые обратили внимание на особое направление лечения онкозаболеваний — метод генетических модификаций, нацеленный на подавление развития рака путем снижения экспрессии генов, участвующих в развитии онкологических заболеваний. Это становится возможным за счет использования технологий антисмысловых олигонуклеотидов, РНК-интерференции, рибозимов и/или дезоксирибозимов и CRISPR/Cas9. Большинство известных подходов не исключает пагубного влияния не только на раковые, но и на здоровые клетки, а также характеризуется низкой эффективностью, в связи с чем становится невозможным повсеместное уничтожение раковых клеток [7]. Альтернативой традиционным экспериментальным подходам к лечению онкологических заболеваний служат собранные ДНК-наномашины.
Составные части ДНК-наномашин
Окей, Google. Что такое ДНК-наномашины?
Наноархитекторы строят структуры ДНК, двигатели и цепи, используя тот же основной принцип, что и природа. Особенность сборки таких устройств заключается в способности нуклеиновых кислот образовывать двойную спираль в строго определенной конформации в соответствии с правилом комплементарности. Таким образом, различные последовательности ДНК могут быть запрограммированы на самосборку, компоновку друг с другом для формирования разнообразных 2D- и 3D-структур.
Самый простой пример создания конструкций на основе нуклеиновых кислот — это так называемые «молекулярные маяки» (molecular beacon, MB). Они представляют собой последовательности олигонуклеотидов в виде шпильки (рис. 2а), несущие флуорофор на одном из концов и гаситель флуоресценции на другом. В отсутствие мишени молекулярный маяк находится в стабильной шпильке, за счет чего флуорофор и гаситель пространственно сближены, соответственно, свечение отсутствует. При взаимодействии зонда с целевой мишенью образуется их комплекс, благодаря чему изменяется конформация зонда, и флуорофор отдаляется от гасителя, что приводит к появлению сигнала флуоресценции (рис. 2б).
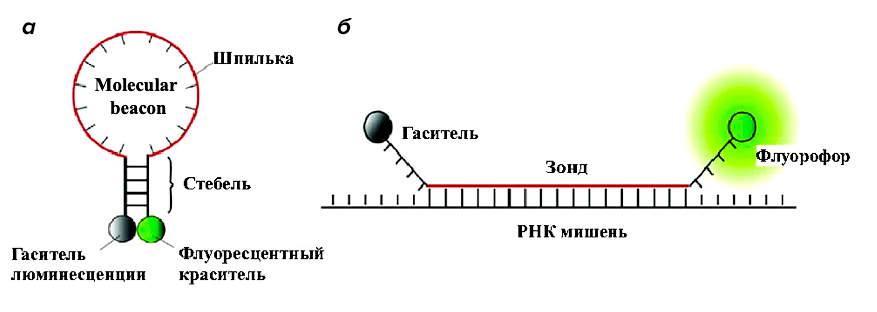
Рисунок 2. Принцип работы молекулярного маяка
[9], рисунок адаптирован
Появление в 1996 году такого молекулярного инструмента, как молекулярный зонд-маяк [8], [9] стало предпосылкой к созданию первых ДНК-машин [7], [10].
Последние 20 лет развития ДНК-технологий привели к синтезу большого количества различных ДНК-конструкций, структурными элементами которых выступают обычные двухцепочечные ДНК, структуры Холлидея, ДНК-оригами, а в качестве действующих частей могут быть i-мотивы, аптамеры и G-квадруплексы, а также дезоксирибозимы (рис. 3). Структурные части ДНК-машин служат их каркасом, к которому присоединяются функциональные, активные части ДНК-машин, которые открывают большой потенциал для их использования в диагностике (рис. 6), доставке лекарственных молекул (рис. 4) и генной терапии (рис. 8).
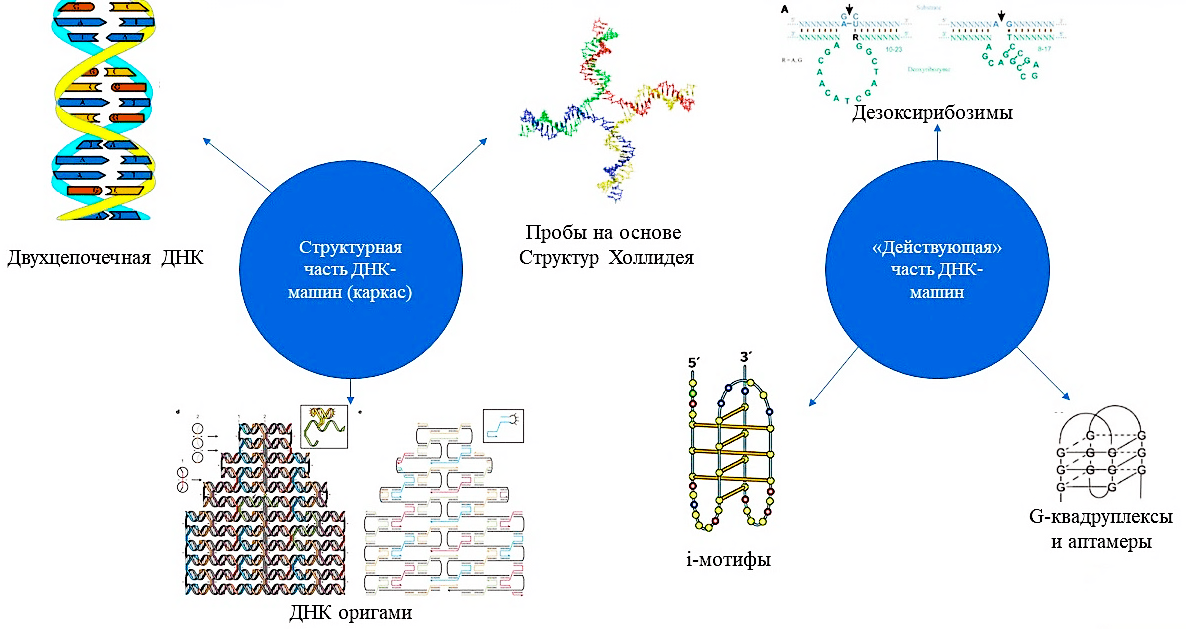
Рисунок 3. Схематичное представление различных составных частей ДНК-наномашин
Один из самых известных ДНК-нанороботов создан группой китайских ученых на основе методов ДНК-оригами и ДНК-аптамеров (рис. 4). Их конструкция позволила доставить тромбин — фермент, отвечающий за свертывание крови, — заключенный в трубчатую конструкцию ДНК-оригами, непосредственно в раковые клетки за счет использования ДНК-структур (аптамеров), которые раскручивали ДНК-робота только в присутствии особых белков, специфичных для раковых клеток. Именно этот фермент послужил основным орудием наноробота, который стимулировал свертывание крови внутри кровеносных сосудов и заблокировал кровоток, что в свою очередь привело к смерти тканей опухоли [11].
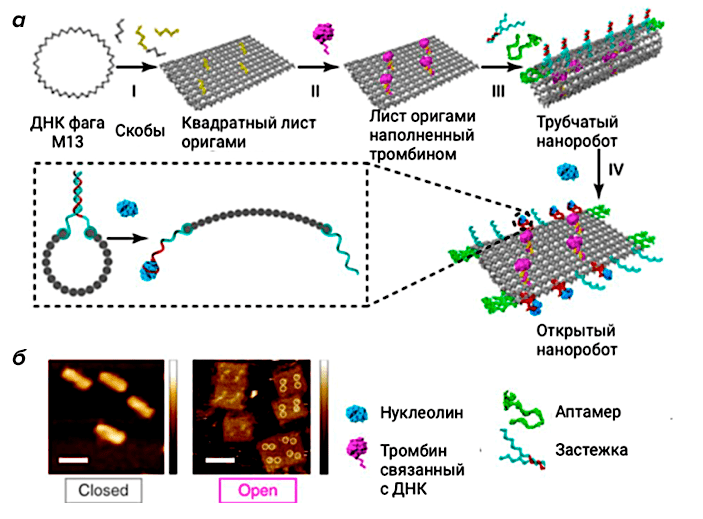
Рисунок 4. Схематичное изображение ДНК-наноробота для доставки терапевтических молекул (тромбина) в раковые клетки. а — Конструкция и механизм работы ДНК-наноробота. б — Изображения ДНК-конструкции в закрытой и открытой конформациях, полученные при помощи атомно-силовой микроскопии.
[11], рисунок адаптирован
В отличие от этой работы, другие исследования концентрируются на непосредственной способности ДНК-конструкций обеспечивать терапевтический эффект, а не только доставлять биологические агенты внутрь раковых клеток.
Терапевтическая функция ДНК-конструкций достигается за счет использования уникальных ДНК-молекул, обладающих каталитической активностью по расщеплению целевых РНК-мишеней, или иначе — дезоксирибозимов.
Дезоксирибозимы — каталитические молекулы ДНК
Они способны катализировать расщепление РНК за счет образования сложных структур (рис. 5) [12]. Впервые потенциал дезоксирибозимов (Dz) экспериментально продемонстрировали в 1994 году Р. Брикер и Г. Джойс [13], которые использовали селекцию in vitro (SELEX) для поиска специфичных последовательностей ДНК, способных катализировать расщепление фосфодиэфирной связи в РНК.
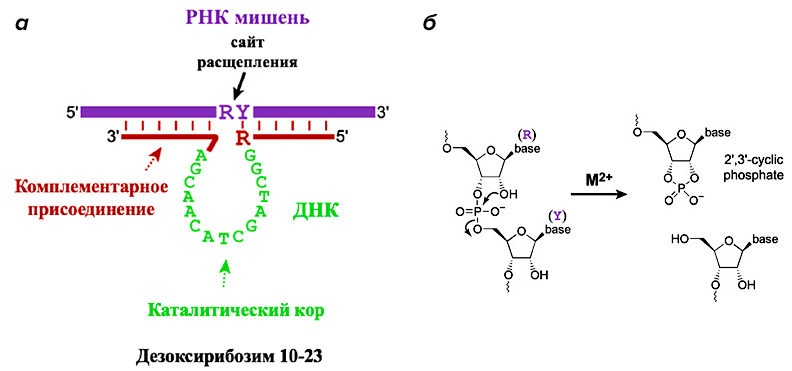
Рисунок 5. Работа РНК-расщепляющих дезоксирибозимов. а — Комплекс дезоксирибозима 10–23 (красного и зеленого цветов) и целевой РНК (синего цвета), образованный за счет принципа комплементарности, где R = пурин, Y = пиримидин. б — Химическая реакция расщепления РНК, где М2+ — ион металла, необходимый для стабилизации переходного состояния.
В отличие от каталитических белков (ферментов) и рибозимов, дезоксирибозимы не обнаружены в живых клетках, и для использования в практических целях их синтезируют искусственно. Вместе с тем они обладают большей химической стабильностью по сравнению с природными рибозимами, и их синтез обходится дешевле.
Использование дезоксирибозимов в диагностике заболеваний началось в 2008 году после создания бинарных дезоксирибозимных зондов (рис. 6а). Ранее мы описали способ обнаружения нуклеиновых кислот при помощи молекулярных маяков, но, учитывая низкую селективность в отношении появления несовпадений в последовательности и дорогостоящий синтез для новых целевых нуклеиновых кислот, данная технология требовала серьезной доработки. В результате были разработаны бинарные сплит-Dz-зонды (biDz), которые представляют собой дезоксирибозимы, разделенные на две части (DZa и DZb) [7]. Каждая их часть оборудована «руками», связывающими и расщепляющими флуоресцентный субстрат (F_sub), снабженный флуорофором и гасителем, а также фрагментом, комплементарным анализируемой ДНК или РНК. Расщепление F_sub с помощью бинарного Dz в присутствии целевой ДНК или РНК вызывает заметное увеличение флуоресценции в растворе, как в случае с молекулярным маяковым зондом [14]. Такие бинарные дезоксирибозимные зонды некоторое время применялись в диагностике. Со временем стало ясно, что их можно улучшить, включив в состав ДНК-машин (рис. 6б). Благодаря такому «апгрейду» зонд стал детектировать целевую последовательность, например, рибосомальную 16S рРНК, в концентрации почти 20 раз меньшей, чем детектировал исходный biDz.
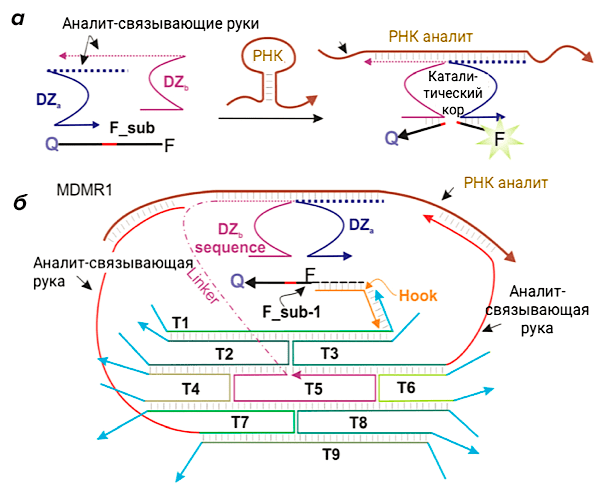
Рисунок 6. Конструкция ДНК-наномашины MDMR1 для диагностики. а — Механизм работы бинарного дезоксирибозима. Нити ДНК DZa и DZb комплементарно связываются с фрагментами РНК-аналита и образуют каталитический кор, который позволяет расщепить субстрат, меченный флуорофором (F) и гасителем (Q), вызывая при этом в ответ на разрезание флуоресцентный сигнал. б — Конструкция машины MDMR1.
[7], рисунок адаптирован
Инструкция по применению: как использовать дезоксирибозимы в ДНК-машине для терапии рака?
С точки зрения молекулярной биологии, основная причина развития рака — это необратимые нарушения в генетическом материале одной единственной клетки, которые приводят к ее бессмертию и безграничному делению. В конечном итоге накапливается большое количество «сломанных» клеток, и образуется опухоль, а в дальнейшем, если развитие заболевания не будет приостановлено, происходит и метастазирование. Сегодня известно огромное количество отличий в геномах раковых клеток от нормальных геномов. Эти отличия обеспечивают характерный для раковых клеток фенотип.
Основываясь на знаниях о геноме злокачественной опухоли, ученые неоднократно пытались применить дезоксирибозимы для расщепления матричных РНК онкогенов. Расщепление матричной РНК (мРНК) внутри живой клетки приводит к ее деградации и окончательному выключению синтеза целевого белка в соответствии с центральным правилом реализации генетической информации, из которого следует, что передача информации осуществляется от нуклеиновых кислот к белку, но не в обратном направлении.
Сегодня в литературе описано несколько десятков случаев использования расщепляющих РНК дезоксирибозимов для подавления экспрессии онкогенов [15–17]. Более того, было проведено несколько клинических испытаний дезоксирибозимов в терапии рака, как отдельно [18], так и в совокупности с лучевой терапией [19], которые показали низкую токсичность и высокую потенциальную эффективность дезоксирибозимов в терапии рака. Однако сегодня, к сожалению, неизвестно ни одного одобренного подхода терапии опухолей при помощи дезоксирибозимов. Это может быть связано с некоторыми проблемами их применения, например, с труднодоступностью целевых мРНК-мишеней в раковых клетках, ввиду их стабильной вторичной структуры, или с неспособностью этих средств полностью излечить рак. В ряде случаев подавление экспрессии онкогенов ведет лишь к подавлению роста опухоли, а не к гибели раковых клеток.
Для оптимизации лечения опухолей дезоксирибозимами перед нашей научной группой из лаборатории SCAMT (растворной химии передовых материалов и технологий) Университета ИТМО была поставлена цель создать ДНК-наномашину на основе РНК-расщепляющих дезоксирибозимов. Чтобы решить первую проблему, было достаточно добавить к дезоксирибозиму дополнительные РНК-расплетающие руки, такие же, как на рисунке 6б, и ДНК-каркас, который будет удерживать две функциональные группы вместе. Для решения второй проблемы было решено использовать в качестве мишени мРНК генов «домашнего хозяйства».
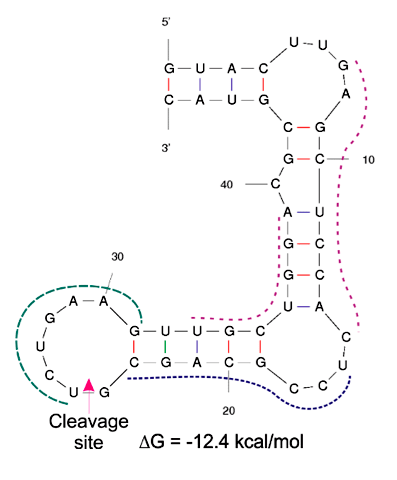
Рисунок 7. Пример вторичной структуры матричной РНК онкогена DAD1
Однако, скажете вы, нацелившись на ген «домашнего хозяйства», мы полностью лишимся избирательности метода, ведь в таком случае дезоксирибозим будет убивать все клетки на своем пути. Здесь на помощь нам пришла технология бинарных дезоксирибозимных зондов (рис. 6а), которая до этого применялась лишь в диагностике заболеваний, но ни разу не была применена в терапии. Таким образом, в качестве экспериментальной мишени мы взяли мРНК гена «домашнего хозяйства» вместо F_sub, а в качестве аналита для образования каталитического ядра избрали мРНК гена DAD1 (defender against cell death 1), отвечающего за апоптоз клетки с высоким уровнем экспрессии преимущественно в раковых клетках (рис. 7).
В результате была разработана ДНК-наномашина на основе бинарного дезоксирибозима DZ 10-23, разделенного на две части, благодаря чему ДНК конструкция обладала тремя основными свойствами:
- Способностью раскручивать вторичную структуру биологической РНК-мишени.
- Способностью с высокой избирательностью распознавать раковые биомаркерные последовательности.
- Способностью эффективно расщеплять выбранную мРНК-мишень, кодирующую ген «домашнего хозяйства», в физиологических условиях только в присутствии биомаркера (рис. 8).
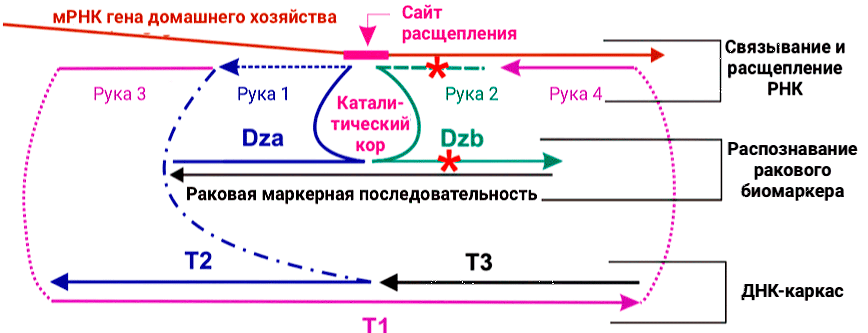
Рисунок 8. Дизайн ДНК-машины для расщепления РНК-мишеней на основе biDz. Часть бинарного дезоксирибозма DZa соединена линкерами (синяя пунктирная линия) с последовательностью T2, которая связывается с последовательностями T1 и T3, которые вместе образуют ДНК-каркас, обеспечивающий стабильность всей структуры. DZb должен связываться с остальной частью ДНК-машины и расщеплять целевую мРНК гена «домашнего хозяйства» только в присутствии онкомаркера. Красные звезды показывают места несовпадений.
Стоит отметить, что разработанный подход принципиально отличается от используемой ранее дезоксирибозимной технологии, в основном за счет использования в качестве мишени мРНК гена «домашнего хозяйства». Кроме того, этот факт обеспечивает нашу ДНК-платформу широкой универсальностью применения. В будущем предложенный подход позволит применять ДНК-наномашину для лечения любого типа рака благодаря подбору новых раковых биомаркеров и адаптации конструкции для активации расщепления целевой мРНК гена «домашнего хозяйства» новой биомаркерной последовательностью.
Мы провели большое количество модельных экспериментов на синтетической РНК и убедились в работоспособности нашей ДНК-наномашины in vitro. Показано, что она способна разрезать сложенные во вторичную структуру РНК-мишени только в присутствии полностью комплементарного ракового биомаркера и с большей эффективностью по сравнению с исходными дезоксирибозимами. Однако в клеточных экспериментах мы столкнулись с тем, что наша конструкция не обеспечивала смерть раковых клеток и даже не снижала уровень синтеза целевого белка. Данный факт может быть связан с неверным выбором способа внутриклеточной доставки разработанной ДНК-конструкции, низкой внутриклеточной стабильностью ДНК-наномашины или неудачным выбором целевого гена «домашнего хозяйства».
Несмотря на ряд технических проблем, разработанный нами подход был опубликован в высокорейтинговом научном журнале, а известные масс-медиа (в том числе «РИА Новости» и «Интерфакс») опубликовали статьи о создании «нанокиллеров» раковых клеток [20–22]. Пожалуй, это произошло потому, что повышение качества и продолжительности жизни человека — ключевые факторы развития российской экономики. Для повышения эффективности профилактики, диагностики и лечения социально значимых заболеваний, а также реабилитации пациентов необходимы технологические прорывы в области биомедицины. Они прежде всего связаны с созданием принципиально новых лекарств, продуктов для клеточной и генной терапии, инструментов высокоспецифичной молекулярной диагностики.
Сегодня все наши силы направлены на то, чтобы заставить созданную ДНК-конструкцию эффективно работать в клетках. Для этого мы:
- исследуем каталитическую активность конструкции на различных РНК-мишенях;
- подбираем оптимальный способ ее доставки внутрь клетки;
- выбираем оптимальные химические модификации для увеличения стабильности ДНК-наномашины в клетках.
Итак, использование разработанной ДНК-наномашины может открыть новые пути для терапии раковых заболеваний. Однако для его непосредственного применения в терапии на живом организме необходимо провести значительную доработку конструкции.
Машины для проведения диагностики и тераностики заболеваний
Наша научная группа занимается не только созданием ДНК-машин для терапии рака, но и созданием ДНК-конструкций, обладающих иными функциями. На рисунке 9а представлена созданная нашей научной группой ДНК-машина для диагностики вируса папилломы человека [23]. Созданная конструкция позволила детектировать ДНК вируса в пикомолярной концентрации, что существенно превышает предел обнаружения ранее разработанных подходов. Кроме того, при объединении в одной ДНК-платформе детектирующей и расщепляющей заданный участок РНК частей, открывается возможность использования ДНК-машин в терапии и диагностике различных заболеваний. Так на рисунке 9б представлена ДНК-наномашина для одновременной детекции и терапии вируса гриппа А. Результаты испытания этой ДНК-конструкции будут в ближайшее время опубликованы.
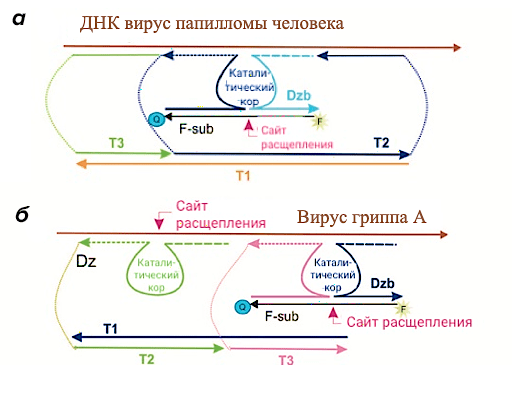
Рисунок 9. Варианты ДНК-машин для диагностики и тераностики заболеваний
To be continued...
Научные достижения сегодняшнего дня — основа для изменения привычного нам мира завтра. Мы рассмотрели современные тренды в области диагностики и динамики персонализированного лечения и представили, как они изменят мир в будущем.
Помимо того, с появлением новой стратегии в медицине — тераностики, объединяющей диагностику заболеваний и персонализированное лечение пациента с улучшенной эффективностью и безопасностью, — возникают более интенсивные подходы к исследованиям и лечению заболеваний на молекулярном уровне [14], [24–27].
Значительная часть новых ДНК-технологий еще находится на ранней стадии исследований и разработок. При этом стремительные темпы развития в направлении создания ДНК-наномашин, подобных разработанной нами конструкции, позволяют надеяться на скорое внедрение лекарств на основе таких наномашин в практическую медицину.
Литература
- Yara Haridy, Florian Witzmann, Patrick Asbach, Rainer R. Schoch, Nadia Fröbisch, Bruce M. Rothschild. (2019). Triassic Cancer—Osteosarcoma in a 240-Million-Year-Old Stem-Turtle. JAMA Oncol. 5, 425;
- Luca Falzone, Salvatore Salomone, Massimo Libra. (2018). Evolution of Cancer Pharmacological Treatments at the Turn of the Third Millennium. Front. Pharmacol.. 9;
- Porter R. The greatest benefit to mankind. London: Harper Collings, 1997. — 831 p.;
- Elliott J.S. Outlines of Greek and Roman medicine. Boston: Milford House, 1971. — 165 p.;
- Lindemann M. Medicine and society in early modern Europe. Cambridge: Cambridge University Press, 2010. — 314 p.;
- Schmeidler C. Historical survey of pharmacy in Great Britain. George Marshall & Co Ltd, 1944. — 91 p.;
- A. J. Cox, H. N. Bengtson, K. H. Rohde, D. M. Kolpashchikov. (2016). DNA nanotechnology for nucleic acid analysis: multifunctional molecular DNA machine for RNA detection. Chem. Commun.. 52, 14318-14321;
- Bernard Yurke, Andrew J. Turberfield, Allen P. Mills, Friedrich C. Simmel, Jennifer L. Neumann. (2000). A DNA-fuelled molecular machine made of DNA. Nature. 406, 605-608;
- Tairong Kuang, Lingqian Chang, Xiangfang Peng, Xianglong Hu, Daniel Gallego-Perez. (2017). Molecular Beacon Nano-Sensors for Probing Living Cancer Cells. Trends in Biotechnology. 35, 347-359;
- Jonathan Bath, Andrew J. Turberfield. (2007). DNA nanomachines. Nature Nanotech. 2, 275-284;
- Suping Li, Qiao Jiang, Shaoli Liu, Yinlong Zhang, Yanhua Tian, et. al.. (2018). A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo. Nat Biotechnol;
- Katrina Woolcock. (2016). Structure of a DNA enzyme. Nat Struct Mol Biol. 23, 97-97;
- Ronald R. Breaker, Gerald F. Joyce. (1994). A DNA enzyme that cleaves RNA. Chemistry & Biology. 1, 223-229;
- Dmitry M. Kolpashchikov. (2007). A Binary Deoxyribozyme for Nucleic Acid Analysis. ChemBioChem. 8, 2039-2042;
- Zhong-Xin Lu, Mao Ye, Guang-Rong Yan, Qun Li, Min Tang, et. al.. (2005). Effect of EBV LMP1 targeted DNAzymes on cell proliferation and apoptosis. Cancer Gene Ther. 12, 647-654;
- Majid Kabuli, John Ahman Liu Yin, Khalid Tobal. (2004). Targeting PML/RARα transcript with DNAzymes results in reduction of proliferation and induction of apoptosis in APL cells. Hematol J. 5, 426-433;
- G. Zhang, C. R. Dass, E. Sumithran, N. Di Girolamo, L.-Q. Sun, L. M. Khachigian. (2004). Effect of Deoxyribozymes Targeting c-Jun on Solid Tumor Growth and Angiogenesis in Rodents. JNCI Journal of the National Cancer Institute. 96, 683-696;
- Eun-Ae Cho, Fergal J Moloney, Hong Cai, Annie Au-Yeung, Carlos China, et. al.. (2013). Safety and tolerability of an intratumorally injected DNAzyme, Dz13, in patients with nodular basal-cell carcinoma: a phase 1 first-in-human trial (DISCOVER). The Lancet. 381, 1835-1843;
- Ya Cao, Lifang Yang, Wuzhong Jiang, Xiaoyi Wang, Weihua Liao, et. al.. (2014). Therapeutic Evaluation of Epstein-Barr Virus-encoded Latent Membrane Protein-1 Targeted DNAzyme for Treating of Nasopharyngeal Carcinomas. Molecular Therapy. 22, 371-377;
- Ортега И. (2019). В ИТМО предложили лечить рак наномашинами. До сих пор манипулирование с генами в борьбе с раком не давало хороших результатов. «ТАСС Наука»;
- Ученые из Санкт-Петербурга создали "нано-киллеров" раковых клеток. (2019). «РИА Наука»;
- В Университете ИТМО создали наномашины для лечения рака. (2019). «ИНТЕРФАКС»;
- Tatiana A. Lyalina, Ekaterina A. Goncharova, Nadezhda Y. Prokofeva, Ekaterina S. Voroshilina, Dmitry M. Kolpashchikov. (2019). A DNA minimachine for selective and sensitive detection of DNA. Analyst. 144, 416-420;
- Dmitry M. Kolpashchikov. (2006). A Binary DNA Probe for Highly Specific Nucleic Acid Recognition. J. Am. Chem. Soc.. 128, 10625-10628;
- Jeffrey Grimes, Yulia V. Gerasimova, Dmitry M. Kolpashchikov. (2010). Real-Time SNP Analysis in Secondary-Structure-Folded Nucleic Acids. Angewandte Chemie International Edition. 49, 8950-8953;
- Yulia V. Gerasimova, Evan Cornett, Dmitry M. Kolpashchikov. (2010). RNA-Cleaving Deoxyribozyme Sensor for Nucleic Acid Analysis: The Limit of Detection. ChemBioChem. 11, 811-817;
- Maria Stancescu, Tatiana A. Fedotova, Jef Hooyberghs, Alexander Balaeff, Dmitry M. Kolpashchikov. (2016). Nonequilibrium Hybridization Enables Discrimination of a Point Mutation within 5–40 °C. J. Am. Chem. Soc.. 138, 13465-13468;
- Scott K. Silverman. (2004). Deoxyribozymes: DNA catalysts for bioorganic chemistry. Org. Biomol. Chem.. 2, 2701.