
Морская звезда Patiria pectinifera поможет в борьбе с аллергией и раком
19 ноября 2014
Морская звезда Patiria pectinifera поможет в борьбе с аллергией и раком
- 909
- 2
- 2
Морская звезда Patiria pectinifera и структурные формулы астаксантина, лютеина и зеаксантина
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Онкологические и аллергические заболевания — одни из самых распространённых человеческих патологий. Большие надежды в их лечении возлагаются на каротиноиды — природные соединения, обладающие широким спектром фармакологической активности. Одним из самых известных и изученных на сегодняшний день каротиноидов является астаксантин (АК). Мы обнаружили доступный источник получения АК — смесь каротиноидов из морской звезды Patiria pectinifera. Наши исследования посвящены тому, чтобы найти применение этой смеси в лечении аллергических кожных заболеваний и в противоопухолевой терапии.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Своя работа».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
В настоящее время каротиноиды широко применяют в качестве природных биологически активных добавок (БАД). Многие исследователи проявляют интерес к астаксантину (АК) — пигменту, найденному в тканях различных морских животных и водорослей. Благодаря своей уникальной структуре, он получил звание короля каротиноидов. Молекула АК имеет удлиненную форму с полярными структурами на двух концах и с неполярной зоной посередине. Такая амфифильная конструкция молекулы АК создает условия для ее ориентации в полярно-неполярно-полярной среде клеточной мембраны, а присутствие дополнительных кетогрупп с обоих концов молекулы придает АК антиоксидантную активность. В результате этот каротиноид способен стабилизировать клеточную мембрану, располагаясь трансмембранно и защищая клетку одновременно и снаружи, и изнутри, а также оказывать антиоксидантное действие.
Было проведено уже множество клинических исследований, подтверждающих положительное влияние АК на организм человека. В Группе изучения биологически активных веществ Тихоокеанского института биоорганической химии ДВО РАН (г. Владивосток) мы использовали АК в составе препарата смеси каротиноидов (СК), выделенной из морской звезды Patiria pectinifera, которую мы каждое лето видим на морском побережье, так как она повсеместно обитает в морской прибрежной зоне Дальнего Востока России. В эту смесь входят каротиноиды подкласса ксантофиллов (АК, лютеин, зеаксантин; их структурные формулы представлены на заглавном рисунке). Наша цель состоит в том, чтобы расширить область применения АК в медицине и исследовать терапевтические свойства СК в лечении аллергических и онкологических заболеваний.
Противоаллергическая активность СК
Наша иммунная система зачастую преподносит нам неприятные «сюрпризы» в виде кожных аллергических реакций, которые возникают в результате слишком острой и неадекватной реакции этой системы на какие-либо внешние факторы. Для оценки терапевтического действия СК при кожных аллергических заболеваниях мы выбрали модель аллергического контактного дерматита. В качестве аллергена мы использовали 2,4-динитрофторбензол, который наносили на внешнюю и внутреннюю стороны уха экспериментальных животных [1]. СК применяли в составе 1%-мазей на основе ланолин-вазелина.
Аллергический контактный дерматит (АКД) — классическая форма реакции гиперчувствительности замедленного типа (ГТЗ), возникающая после непосредственного контакта аллергена с кожей. Аллергенами могут быть металлы в составе украшений, химические вещества в лекарственных препаратах, компонентах косметики, средствах бытовой химии, синтетических тканях, которые легко проникают в клетки кожи, вызывая аллергическую реакцию. При таком типе аллергии иммунное воспаление тканей организует субпопуляция Th-1 лимфоцитов, которые дифференцируются из CD4+ Т-клеток после контакта с аллергеном, а клетками-исполнителями являются активированные ими макрофаги. Развитие же ГЗТ зависит от целого ряда цитокинов — белков, участвующих в воспалительных процессах при подобных заболеваниях, которые вырабатываются активированными Тh-1 лимфоцитами и макрофагами, а также клетками эпидермиса и дермы, находящимися в поражённом участке [2].
Чтобы изучить влияние СК на течение воспалительного процесса при АКД, мы, используя метод иммуноферментного анализа, измерили в сыворотке крови уровень основных провоспалительных цитокинов, т.е. веществ, усиливающих воспалительные реакции, а также противовоспалительных цитокинов, подавляющих цитотоксический ответ организма.
На рис. 1 представлен цитокиновый спектр сыворотки крови экспериментальных групп животных. При развитии АКД почти в полтора раза повышается уровень главных провоспалительных цитокинов: гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF); фактора некроза опухоли (TNF), интерлейкина-2 (IL-2). Применение СК способствовало снижению их уровня в сыворотке крови эффективней коммерческого противовоспалительного препарата «Фуцидин», выбранного в качестве положительного контроля. Следует отметить, что в группе, пролеченной СК, было обнаружено резкое увеличение содержания IL-10 и IL-4. IL-10 — важнейший регулятор иммунного ответа, уменьшающий активность макрофагов и Th1-клеток. IL-4 сам по себе считается провоспалительным цитокином, но при ГТЗ он, наряду с IL-10, проявляет себя как противовоспалительный агент. Отмеченный факт может свидетельствовать об иммуномодулирующей активности компонентов СК, что очень важно для лечения аллергии.
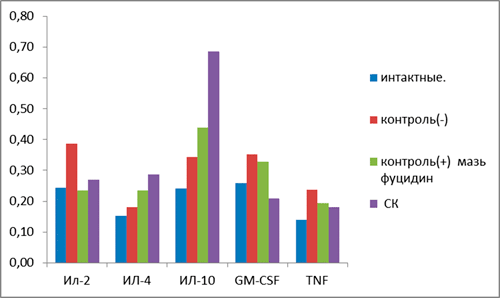
Рисунок 1. Цитокиновый спектр сыворотки крови. Интактные — здоровые мыши, контроль(−) — мыши с АКД без лечения, контроль(+) — коммерческий препарат фуцидин. По оси ординат — концентрация цитокинов в сыворотке крови, мг/л.
Формирование очага иммунного воспаления в поражённом аллергеном участке обусловливаются: ростом и развитием иммунных клеток под действием GM-CSF; пролиферацией и активацией Т-клеток под действием IL-2; хемотаксисом макрофагов и лимфоцитов в поражённую зону под действием TNF за счёт его способности увеличивать просвет кровеносных сосудов и продукцию молекул адгезии (преимущественно Е-селектина) клетками эндотелия; а также увеличением биосинтеза макрофагальных ферментов, генерирующих радикалы активных форм кислорода и нитроксильного радикала, поражающие собственные клетки организма [3]. Клинически это проявляется в виде покраснения, уплотнения поражённого участка, нередко возникают очаги некрозов.
По уровню эритемы (покраснение и уплотнение участка воспалённых тканей) мы оценивали влияние СК на степень патологического развития АКД. Результатом четырёхдневного лечения СК оказалось снижение площади эритемы в два раза. При этом в контрольной группе, леченной фуцидином, эритема уменьшилась менее, чем в полтора раза. Положительный эффект СК может быть связан с тем, что входящие в его состав липофильные компоненты растворяются в липидах и легко проникают внутрь клеточных мембран, стабилизируя, таким образом, их структуру и регулируя транспортные и биосинтетические функции. АК при этом отводится особая роль. Полярность и липофильность АК позволяет ему выступать в качестве скрепляющего мембрану материала. Кроме этого, АК, являясь одним из самых мощных природных антиоксидантов, может защищать мембраны клеток кожи от разрушения свободными радикалами при АКД [4], [5].
Есть сведения, что СК проявляет противовоспалительное действие благодаря способности АК ингибировать активность ядерного фактора транскрипции NF-κB, который оказывает влияние на экспрессию различных генов, принимающих участие в иммунологическом ответе, в том числе и TNF, IL-2, молекул адгезии (например, Е-селектина), играющих, как уже было отмечено, важную роль в патогенезе кожных заболеваний [6]. Свой вклад в действие препарата СК вносят входящие в его состав лютеин и зеаксантин, они также являются антиоксидантами с противовоспалительными и фотозащитными свойствами.
Эффективность комбинированной противоопухолевой терапии доксорубицина с СК
Кто сегодня не слышал про онкологические заболевания? Их называют чумой XXI века. Современные методы лечения и препараты не дают стопроцентного положительного результата, а кроме того, зачастую вызывают тяжелые побочные эффекты. В настоящее время известно много цитостатиков, применяемых в химиотерапии; один из самых известных таких препаратов — доксорубицин. Одной из главных причин неэффективности лечения подобными препаратами является развитие резистентности опухолевых клеток к препарату и приобретение способности «прятаться от иммунитета», объединяясь со здоровыми клетками (например, тромбоцитами) и прикрываясь слабыми антителами, а именно иммуноглобулинами IgG4, не способными спровоцировать нормальный иммунный ответ и мешающими нормальной опсонизации (облепливанию) опухолевых клеток нормальными IgG1. Под их прикрытием опухолевые клетки обманывают иммунитет и мешают нормальному течению иммунного ответа организма, направленного против опухолевого процесса [7]. В таком состоянии опухолевым клеткам ничто не мешает дождаться более благоприятного момента для возобновления пролиферации и роста.
Для оценки противоопухолевых свойств доксорубицина при совместном его введении с СК мы использовали экспериментальную асцитную модель аденокарциномы Эрлиха. Этот вариант опухоли изначально был получен путём трансплантации карциномы молочной железы, которая со временем утратила свою тканевую специфичность и в настоящее время состоит из недифференцированных клеток. При этой модели раковые клетки, полученные из брюшной полости мышей-опухоленосителей, вводятся в брюшную полость здоровых мышей, у которых через неделю наблюдается значительный прирост опухоли по всей брюшной полости.
На этой модели мы выяснили, что курс лечения доксорубицином способствовал 100%-подавлению роста опухоли и выживаемости экспериментальных мышей, однако на 20—30-е сутки рост опухоли возобновлялся.
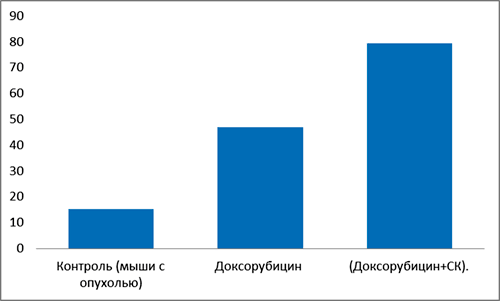
Рисунок 2. Средняя продолжительность жизни экспериментальных мышей-опухоленосителей в разных экспериментальных группах
Предварительные эксперименты по применению доксорубицина в комбинации с СК показали, что в сочетании с СК доксорубицин увеличивает выживаемость экспериментальных мышей приблизительно в два раза по сравнению с группой, пролеченной просто доксорубицином, а по сравнению с нелечеными животными практически в 7 раз. На рисунке 2 показано, что все мыши-опухоленосители в группе, не получавшей никакого лечения, погибли на 18 сутки; в группе, проходившей курс лечения доксорубицином с СК, средняя продолжительность жизни составила в среднем 70–80 суток, а при лечении просто доксорубицином — 30–45 суток.
Заключение
По-видимому, компоненты смеси каротиноидов из морской звезды при аллергических кожных заболеваниях эффективно защищают на молекулярном уровне активно функционирующие клетки кожи, прежде всего, их мембранные структуры и макромолекулы, от дестабилизирующего действия разнообразных вредных факторов физической, химической и биологической природы, а также обладают высокой цитокин-стимулирующей активностью, что позволяет им играть роль иммуномодуляторов. Поэтому можно предположить, что наружное применение препарата может улучшать состояние всех кожных слоев.
Механизм действия СК при опухолевых процессах нам ещё предстоит выяснить. Полученные результаты открывают перспективы для дальнейшего изучения активности этого препарата при совместном его применении с известными противоопухолевыми препаратами, что может повысить эффективность противоопухолевого действия и смягчить побочные эффекты.
А может и не повысить. Читателю стоит иметь в виду, что многочисленные исследования, направленные на поиск противораковой активности различных биологических веществ, часто сообщают лишь предварительные сведения или говорят об эффектах, которые в действительности не могут использоваться в реальном клиническом лечении. — Ред.
Таким образом, активные компоненты, входящие в состав СК, способны повышать сопротивляемость организма к широкому спектру вредных воздействий физической, химической и биологической природы.
Литература
- Попов А.М., Кривошапко О.Н., Цибульский А.В., Штода Ю.П., Климович А.А., Шнайдер К.Д., Артюхов А.А. (2014). Оценка лечебной активности различных природных соединений при моделировании аллергического контактного дерматита. «Биофармацевтический журнал». 6, 3–5;
- Лекция 17. Реакция гиперчувствительности. (2011). Кировская ГМА;
- Особенности взаимодействия лимфоцитов и макрофагов при индукции аллергических реакций // Инфекционный процесс. М.: «Академия естествознания», 2006;
- Satoru Goto, Kentaro Kogure, Kazutoyo Abe, Yukari Kimata, Katsuhiro Kitahama, et. al.. (2001). Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1512, 251-258;
- Попов А.M., Кривошапко О.Н., Артюхов А.А. (2013). Перспективы клинического применения астаксантина и других оксигенированных каротиноидов. «Биофармацевтический журнал». 5, 13–30;
- Marcelo Barros, Sandra Poppe, Eduardo Bondan. (2014). Neuroprotective Properties of the Marine Carotenoid Astaxanthin and Omega-3 Fatty Acids, and Perspectives for the Natural Combination of Both in Krill Oil. Nutrients. 6, 1293-1317;
- Рак кожи прячется от иммунитета, прикрываясь слабыми антителами. (2013). «Новостей.com».







