
На пути к безопасной химиотерапии
10 февраля 2021
На пути к безопасной химиотерапии
- 2621
- 0
- 6
«Доспехи» из чертополоха: новая стратегия защиты печени от побочных эффектов лекарств.
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: На протяжении последних 50 лет химиотерапия, несмотря на серьёзные побочные эффекты, остаётся главным способом лечения рака. Значительный урон при этом наносится клеткам печени — гепатоцитам, в связи с чем понятие «гепатотоксичность» до недавнего времени было практически неотделимо от химиотерапии. Результаты новых исследований указывают на возможность сменить эту парадигму и сделать лечение рака гораздо более безопасным. Рассказываем о новом подходе, предложенном в 2020 году коллективом российских и американских учёных.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.

Партнер номинации — Российский научный фонд.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Лекарства из «чёрного ящика»
Приём некоторых лекарственных препаратов, включая противораковые, нередко сопровождается тяжелыми побочными эффектами. Зачастую врачи вынуждены приостанавливать назначенный пациенту курс химиотерапии из-за серьёзной нагрузки на печень, что может в конечном итоге привести к непоправимым последствиям , [1–4].
Подробнее о терапии рака читайте в статьях «Таргетная терапия — прицельный удар по болезни» и «Генная терапия против рака» на «Биомолекуле» [5], [6]. — Ред.
Из-за отсутствия лучшей альтернативы приходится использовать лекарства, балансирующие на тонкой грани между терапевтическим эффектом и колоссальным ущербом для организма. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов FDA (Food and Drug Administration) выделило такие препараты в отдельный список под названием black box warning (англ. — предупреждение: «чёрный ящик»). Эта маркировка означает предельно допустимый риск, которому подвергается пациент при приёме лекарства. Препараты из «чёрного ящика» могут привести к значительным или даже опасным для жизни побочным эффектам. Среди таких лекарств — дакарбазин, флутамид и гемтузумаб, на которых присутствует маркировка FDA с предупреждением о гепатотоксичности , [7].
Лекарственная гепатотоксичность — это появление структурно-функциональных поражений печени, вызванных приёмом фармацевтических препаратов.
Противораковые средства на основе дакарбазина широко используются в клинической практике для лечения злокачественной меланомы, саркомы мягких тканей, классической лимфомы Ходжкина и неходжкинской лимфомы [8]. Однако, несмотря на высокую терапевтическую эффективность, данные многочисленных исследований свидетельствуют о тяжёлых гепатотоксических побочных эффектах дакарбазина [4], [9–10]. При этом наибольший урон печени наносят активные формы кислорода — свободные радикалы, которые вырабатываются в ответ на приём противоракового лекарства [10].
Новая стратегия защиты печени
На базе Государственного университета Южной Дакоты российско-американский коллектив учёных разработал стратегию по защите печени от негативного влияния противораковых препаратов. Предложенный подход, не нарушая эффективности химиотерапии, позволяет значительно снизить показатели гепатотоксичности, при этом морфология печени остается близкой к нормальной. Успешность разработки была подтверждена в ходе экспериментов на животных. Результаты этого исследования опубликованы в журнале Frontiers in Bioengineering and Biotechnology [11]. Кроме того, новая стратегия по снижению побочных эффектов гепатотоксичных лекарств была защищена патентом.
В чём новизна?
Существующие в настоящее время методы защиты печени от гепатотоксичных лекарств предполагают продолжительный приём таблеток, содержащих молекулы-протекторы. Одним из наиболее часто используемых гепатопротекторов с доказанной клинической эффективностью является силимарин или его активный компонент – силибинин. Это вещество, полученное из семян расторопши (чертополоха), активирует антиоксидантные клеточные механизмы, напрямую нейтрализует свободные радикалы, препятствует провоспалительной активации макрофагов печени, вызванной приёмом лекарств.
Важно отметить, что фармакокинетика лекарств-гепатопротекторов, включая силибинин, далека от идеальной. Вводимые перорально, они очень быстро выводятся из организма, и лишь небольшая их часть достигает печени, что не позволяет в полной мере запустить защитные процессы. К тому же при таком подходе часть протекторных агентов может попадать в опухоль и оказывать нежелательное воздействие на ход противораковой терапии. Стандартный внутривенный способ введения этих молекул в свободном виде практически неосуществим из-за их низкой растворимости в воде.
Фармакокинетика — совокупность процессов, происходящих с лекарством после его попадания в организм: всасывание, распределение, метаболизм и выведение.
Чтобы преодолеть вышеуказанные ограничения, учёные разработали новую стратегию высокоэффективной доставки силибинина в печень путем его внутривенного введения в наноинкапсулированном виде. Препарат предназначен для использования перед началом химиотерапии в качестве превентивного средства. За счёт применения полимерных нанокапсул в качестве носителя гепатопротектор за короткое время и в достаточном количестве накапливается в тканях печени и запускает в них каскад реакций, благодаря которым активируются механизмы антиоксидантной защиты клеток. Таким образом, препарат позволяет эффективно «подготовить» печень к встрече с цитотоксическим противораковым лекарством.
Новый препарат стал результатом совместной работы химиков и специалистов по биомедицинской инженерии. Его активным компонентом является силибинин, а носителем служат нанокапсулы из полилактид-ко-гликолида — безопасного биоразлагаемого полимера (рис. 1). Разработанный метод инкапсуляции позволил получить однородные по размеру наночастицы с высоким содержанием силибинина (его массовая доля составила 15%). Одним из достоинств данного препарата является то, что активный компонент медленно выделяется из нанокапсул, что обеспечивает его повышенную концентрацию в тканях печени в течение продолжительного времени.
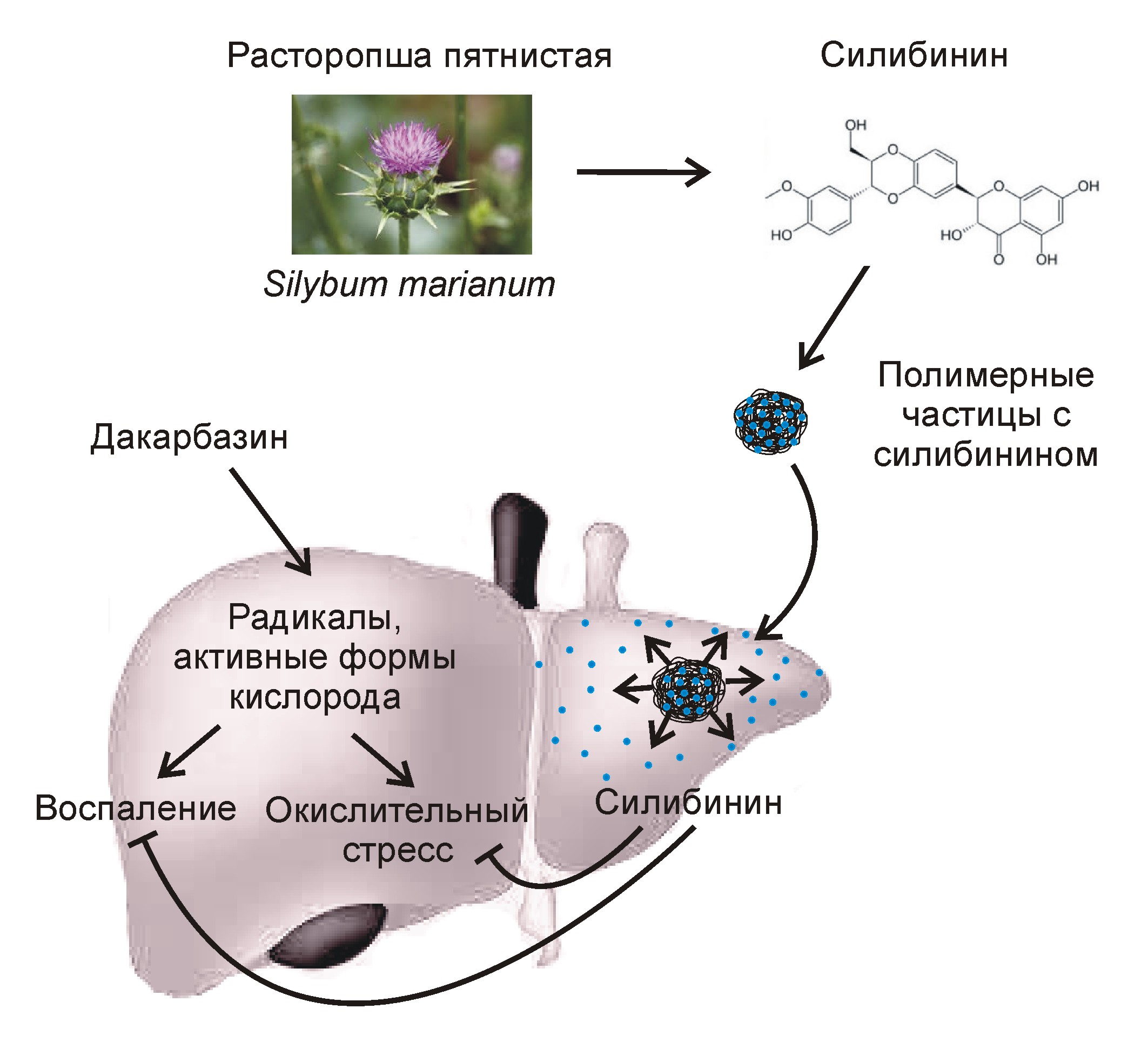
Рисунок 1. Препарат на основе силибинина и полимерных наночастиц для защиты печени от побочных эффектов противоракового лекарства (дакарбазина).
рисунок автора статьи
Превратить недостатки полимеров в достоинства
Любопытно, что классическим «недостатком» полимерных носителей для адресной доставки лекарств обычно считается их быстрое накопление в печени. Это серьёзно ограничивает возможности терапии с использованием полимерных носителей, т.к. в идеале они должны достигать очага поражения, минуя здоровые ткани и органы, в особенности — печень. Но в данном случае задача адресной доставки была совсем иной. Необходимо было обеспечить попадание молекулы-протектора именно в печень, и учёные превратили ключевой «недостаток» полимерных носителей в ощутимое преимущество.
Стоит отметить, что использование нанокапсул снижает риск локализации гепатопротектора в опухоли, что неизбежно при пероральном приеме таблеток. Таким образом, удаётся избежать возможного нежелательного воздействия этих молекул на эффективность противораковой терапии.
За счёт своей гидрофобной природы полимерные нанокапсулы после внутривенного введения быстро накапливаются в печени. Оказываясь в крови, эти частицы подвергаются опсонизации , после чего они становятся «узнаваемыми» для макрофагов печени и сразу же поглощаются ими. В данной работе наночастицы полилактид-ко-гликолида накапливались в печени уже в первый час после внутривенного введения. Используемый полимер после поглощения макрофагами подвергается гидролитической деградации до лактата и гликолевой кислоты, а высвобождающийся силибинин распространяется между соседними клетками печени.
Опсонизация — процесс адсорбции опсонинов (специальных белков) на поверхности инородных частиц, который стимулирует и облегчает их фагоцитоз.
Испытания на животных
В качестве противоопухолевого препарата, от которого нужно защищать печень, исследователи выбрали дакарбазин. Его часто используют для лечения злокачественных опухолей меланомы. К сожалению, несмотря на высокую терапевтическую эффективность, многочисленные исследования сообщают о гепатотоксических побочных эффектах лекарства, которые зачастую вынуждают прекращать терапию [4], [9]. В клинической практике наблюдались случаи острой печёночной недостаточности, веноокклюзионной болезни печени и даже смерти в течение нескольких дней после приёма дакарбазина.
В ходе доклинических испытаний животные с раковыми опухолями подвергались химиотерапии путём системного введения дакарбазина. Часть мышей проходила предварительную «подготовку», получая разработанный учёными препарат для защиты печени. Исследователи подобрали оптимальный временной интервал между введением протектора и дакарбазина, позволяющий получить наилучший защитный эффект. У животных, прошедших стандартную химиотерапию, были обнаружены признаки серьёзного повреждения печени — некроз сосудистого эндотелия, вакуолизация и некроз гепатоцитов. А морфология печени мышей, предварительно получавших протектор на основе нанокапсул и силибинина, была близка к нормальной (рис. 2).
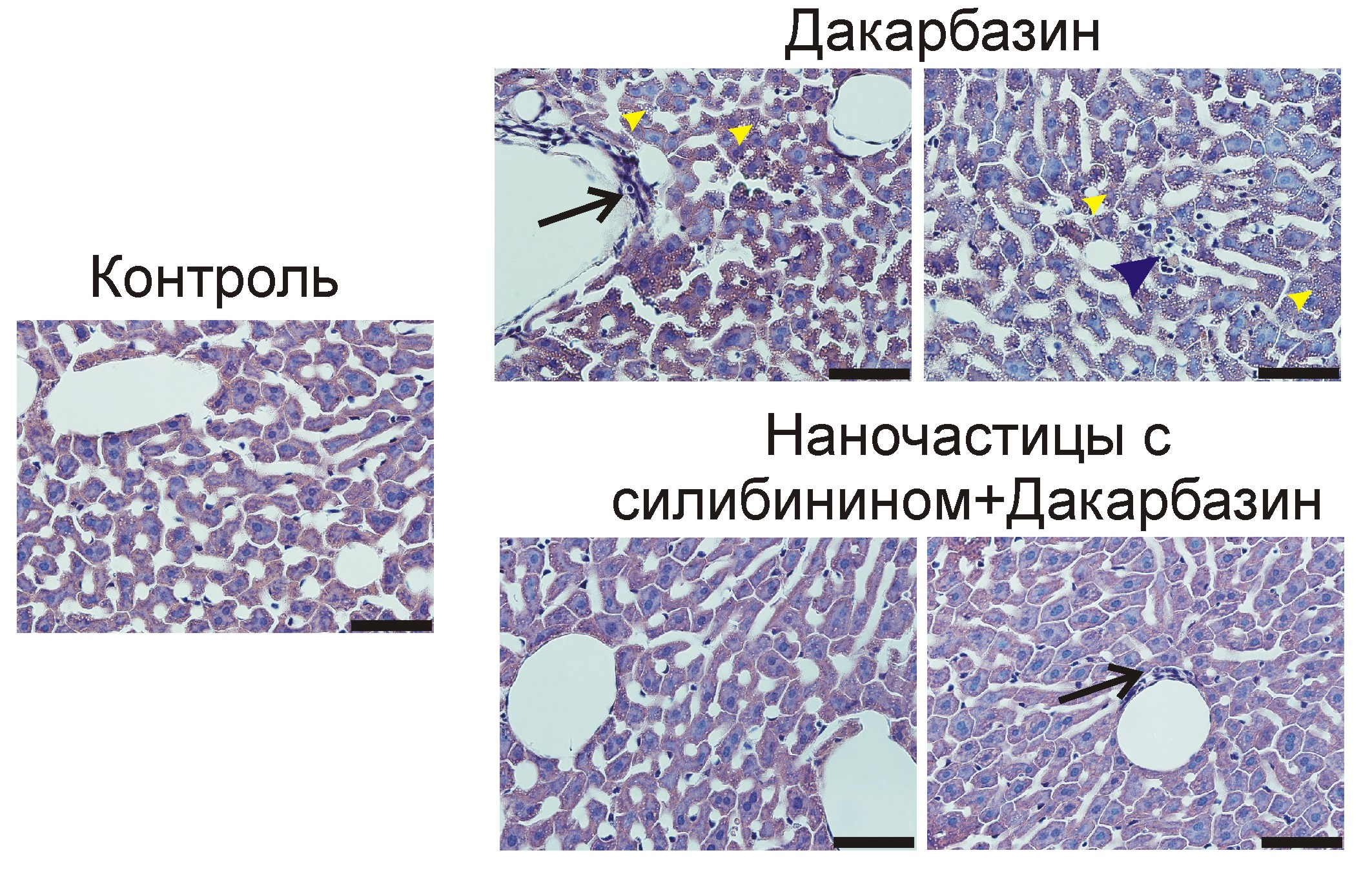
Рисунок 2. Морфология печени мышей, подвергавшихся воздействию дакарбазина и нового гепатопротектора. Контроль (нормальная морфология); дакарбазин (признаки повреждения печени); наночастицы с силибинином + дакарбазин (нормальная морфология, признаки повреждения отсутствуют). О некрозе гепатоцитов свидетельствует скопление лейкоцитов, поглощающих остатки погибших клеток (синяя стрелка). О некрозе сосудистого эндотелия свидетельствует скопление лейкоцитов в области эндотелия (чёрная стрелка). О вакуолизации свидетельствует наличие внутриклеточных пузырьков в гепатоцитах (жёлтые стрелки). Срезы окрашены гематоксилином и эозином.
«Возможно, благодаря новой разработке удастся снять ограничения с широкого ряда лекарственных препаратов, использование которых лимитируется их гепатотоксичностью. Презентация наших работ в Бостоне на конференции CRS (Controlled Release Society) вызвала интерес со стороны фармацевтических компаний. Возможно, этот интерес перерастёт в проведение клинических испытаний», — отметил руководитель лаборатории, профессор Государственного университета Южной Дакоты Джошуа Рейнеке.
Все составные части разработанного препарата являются биосовместимыми и уже применяются в медицинской практике, что повышает шансы на ускоренный путь нового лекарства к клиническому использованию.
Литература
- Paul D. King, Michael C. Perry. (2001). Hepatotoxicity of Chemotherapy. The Oncologist. 6, 162-176;
- Grigorian A. and O'Brien C.B. (2014). Hepatotoxicity Secondary to Chemotherapy. JCTH. 2;
- Einar Björnsson. (2016). Hepatotoxicity by Drugs: The Most Common Implicated Agents. IJMS. 17, 224;
- Bruno Vincenzi, Grazia Armento, Mariella Spalato Ceruso, Giovanna Catania, Mark Leakos, et. al.. (2016). Drug-induced hepatotoxicity in cancer patients - implication for treatment. Expert Opinion on Drug Safety. 15, 1219-1238;
- Таргетная терапия — прицельный удар по болезни;
- Генная терапия против рака;
- F. Peter Guengerich. (2011). Mechanisms of Drug Toxicity and Relevance to Pharmaceutical Development. Drug Metabolism and Pharmacokinetics. 26, 3-14;
- F MARCHESI, M TURRIZIANI, G TORTORELLI, G AVVISATI, F TORINO, L DEVECCHIS. (2007). Triazene compounds: Mechanism of action and related DNA repair systems. Pharmacological Research. 56, 275-287;
- Christian Erichsen, Per-Ebbe Jönsson. (1984). Veno-occlusive liver disease after dacarbazine therapy (DTIC) for melanoma. J. Surg. Oncol.. 27, 268-270;
- Neil Kaplowitz. (2005). Idiosyncratic drug hepatotoxicity. Nat Rev Drug Discov. 4, 489-499;
- Mikhail Durymanov, Anastasia Permyakova, Joshua Reineke. (2020). Pre-treatment With PLGA/Silibinin Nanoparticles Mitigates Dacarbazine-Induced Hepatotoxicity. Front. Bioeng. Biotechnol.. 8.






