
Наукоемкий бизнес: как и почему фармацевтические компании сотрудничают с учеными и стартаперами?
26 октября 2020
Наукоемкий бизнес: как и почему фармацевтические компании сотрудничают с учеными и стартаперами?
- 2731
- 3
- 16
Современную разработку лекарств уже трудно представить без сотрудничества, обмена идеями, взаимной поддержки. Рисунок в оригинальном разрешении.
иллюстрация Любови Колосовской
-
Автор
-
Редакторы
-
Иллюстратор
Ценность научных открытий очевидна — именно на фундаментальных знаниях об окружающем нас мире базируются все современные достижения цивилизации. Несмотря на этот факт, пропасть между учеными в лабораториях и разработчиками, выводящими их на рынок, все еще существует. В спецпроекте «Открытые инновации» мы поговорим о том, как достижения науки становятся бизнесом, решая прикладные задачи здравоохранения. Как происходят разработки лекарств в современном мире? Почему разные игроки рынка иногда сотрудничают, а не конкурируют? И может ли ученый встроиться в эту систему так, чтобы его открытие начало приносить практическую пользу как можно быстрее?
Открытые инновации
Спецпроект о модели открытых инноваций, разработанной для создания и вывода инновационных разработок на фармацевтический рынок через сотрудничество ученых, стартапов, корпораций, пациентских сообществ и государственных организаций.
Партнер спецпроекта — медико-биологическая компания BAYER — разработчик инновационных технологий для здравоохранения и сельского хозяйства. Компания BAYER придерживается модели открытых инноваций и уже несколько лет развивает в России научно-исследовательский акселератор «КоЛаборатор», направленный на поддержку биомедицинских проектов на ранних стадиях развития.

В первой статье спецпроекта «Открытые инновации», проводимого совместно с компанией Bayer, мы расскажем о том, какие существуют концепции создания и вывода на фармацевтический рынок научных разработок, как создают лекарства и почему эти процессы теперь идут не только внутри R&D-отделов корпораций. Также разберем, что такое модель открытых инноваций, в чем преимущества этой модели по сравнению с другими, а также приведем успешные примеры из практики!
Процесс разработки лекарств
В XX веке почти все фармацевтические компании разрабатывали лекарства внутри своих подразделений R&D. После открытия пенициллина Александром Флемингом [1] многие фармкомпании создали собственные микробиологические подразделения с целью поиска новых антибиотиков и других лекарств. Разработка лекарств [2] в фармацевтической компании представляла собой в то время закрытый процесс, многие данные не публиковались, взаимодействие с академическими институтами и особенно с государственными регуляторами было ограничено — это обусловливалось в том числе нежеланием «упустить» инновацию, лишившись тем самым конкурентных преимуществ и возможности получить патент на разработку, а также спецификой фармацевтики того времени. Деятельность фармкомпаний регулировалась гораздо слабее — например, не было предписаний публиковать результаты клинических исследований. При этом решение прикладных задач зачастую приводило сотрудников исследовательских подразделений к значимым научным успехам (включая получение Нобелевских премий! [3]) даже быстрее, чем занятия только академической наукой в институтах и университетах. До 1970–1980-х годов поиск лекарств велся во многом в соответствии с подходом forward pharmacology, при котором действующее вещество выделяют, изучают его эффекты в модельных системах, а потом, если удается — определяют молекулярную мишень. Успехи фармацевтической индустрии XX века были связаны с изучением механизмов патогенеза многих распространенных заболеваний: инфекционных, сердечно-сосудистых, аллергий, некоторых видов онкологических заболеваний. Этот «традиционный» подход привел к появлению ряда важных препаратов, многие из которых используются по сей день: антибиотики, статины, химиотерапевтические препараты, антигистаминные и множество других.
Однако постепенно возможности традиционного подхода стали исчерпываться. C 1970-х годов появляется подход на основе reverse pharmacology (или target-based), при котором сначала идентифицируется и валидируется молекулярная мишень, а потом против нее создают лекарства [2]. Для лечения многих болезней необходимо было глубокое понимание молекулярных основ патогенеза и технические возможности для исследования живых систем на молекулярном и атомном уровнях. Разработка лекарств стала невозможна без знаний о геноме человека и возможностей клонировать и экспрессировать гены, кодирующие терапевтически важные биологические мишени. Так появилось понятие лекарственных мишеней [4], началось бурное развитие биотехнологий.
Стало возможным теоретически предсказывать удачные мишени для терапевтического воздействия, а также химически модифицировать структуры лекарств, получая новые соединения с оригинальными свойствами. Подробнее про историю фармацевтики можно прочесть в статье «Биомолекулы» «Три поколения лекарств» [5].
В области разработки лекарств стали появляться новые игроки — малые биотехкомпании (small biotech). Как правило, такая компания-стартап образуется для проверки и коммерциализации одной научной идеи: например, чтобы протестировать в доклинических и клинических исследованиях ингибитор недавно открытой тирозинкиназы и выяснить, действительно ли это позволит продлить жизнь пациентам с онкологическими заболеваниями. Зачастую интеллектуальная собственность передается из академического института в стартап, а в руководство компании приходят опытные биотех-предприниматели, которые работали раньше в Большой фарме и участвовали в выводе лекарств на рынок от лица известной компании. Иногда ученый остается работать в академическом институте, а иногда становится научным директором (Chief scientific officer) нового стартапа.
К 2000-м годам сложилась инфраструктура инноваций, при которой фундаментальные исследования и ранняя разработка лекарственных кандидатов проводятся в академических институтах — вузах, НИИ, — а затем лекарственный кандидат лицензируется Бигфарме или биотех-стартапу. Как правило, биотех-стартапы начала 2000-х не в силах были провести все этапы клинической разработки сами, поэтому в случае успеха первой-второй фазы клинических исследований их покупала одна из фармацевтических компаний и завершала разработку. Кроме того, как мы уже упоминали ранее, исторически многие разработки новых лекарственных препаратов проводились in-house, то есть силами самой фармацевтической компании. Таким образом, R&D-отделы Бигфармы по большей части действовали независимо от биотех-компаний и академии, и для всей этой системы была характерна закрытость.
Что такое клинические исследования и как их проводят, читайте в нашем спецпроекте.
Но уже в начале 2000-х годов, а особенно в 2010-х, мировые фармацевтические компании столкнулись с кризисом продуктивности исследований и разработок. Если посмотреть на количество лекарств, зарегистрированных американским регулятором FDA, и соотнести его с затраченными на разработку деньгами, мы увидим постоянно снижающуюся кривую (рис. 1). Стоимость разработки лекарств постоянно растет, а вероятность успеха так и остается низкой: в среднем лишь около 10% лекарств, начинающих клинические исследования, доходит до регистрации.
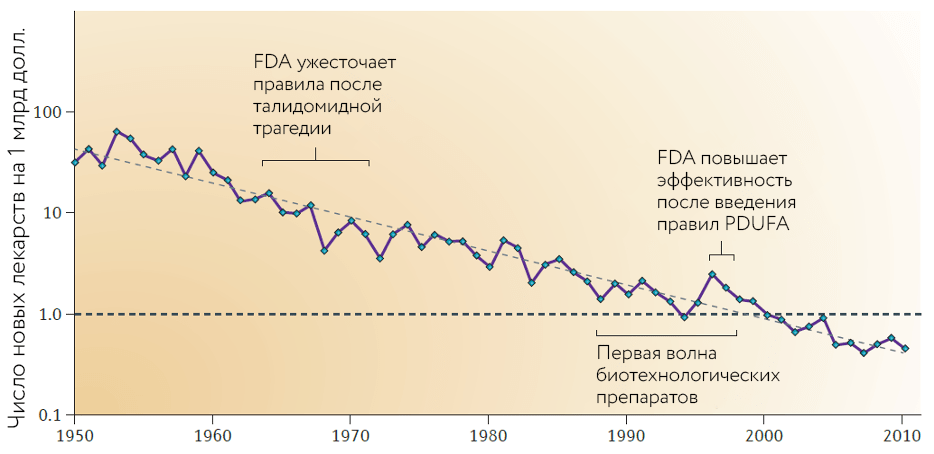
Рисунок 1. Количество новых лекарств, зарегистрированных FDA, в расчете на каждый миллиард долларов, потраченный на разработку (с учетом инфляции). Как видно из графика, за каждые девять лет число зарегистрированных лекарств уменьшается примерно вдвое.
[11], рисунок адаптирован
Тому есть несколько причин [6]: сложность поиска и валидации новых мишеней, невозможность в полной мере экстраполировать данные животных моделей на человека, наличие множества эффективных лекарств на рынке, с которыми всё труднее соревноваться, и другие.
В итоге крупные фармкомпании пришли к выводу, что обмен данными и сотрудничество с академическими институтами, малыми биотех-компаниями и сообществом разработчиков позволяет существенно ускорить и удешевить разработку лекарств по сравнению с исследовательской деятельностью только внутри компании, своими силами. А ведь именно скорость разработки во многом определяет коммерческий успех в современных реалиях.
Изменившиеся реалии и усилия фармкомпаний, которые ищут способы увеличения продуктивности разработок [7], привели к тому, что стали возникать новые механизмы поддержки, создания и вывода научных разработок на рынок. Как видно из рисунка 2, фармкомпании применяют различные подходы к решению проблемы продуктивности R&D, и эффективность у них различается.
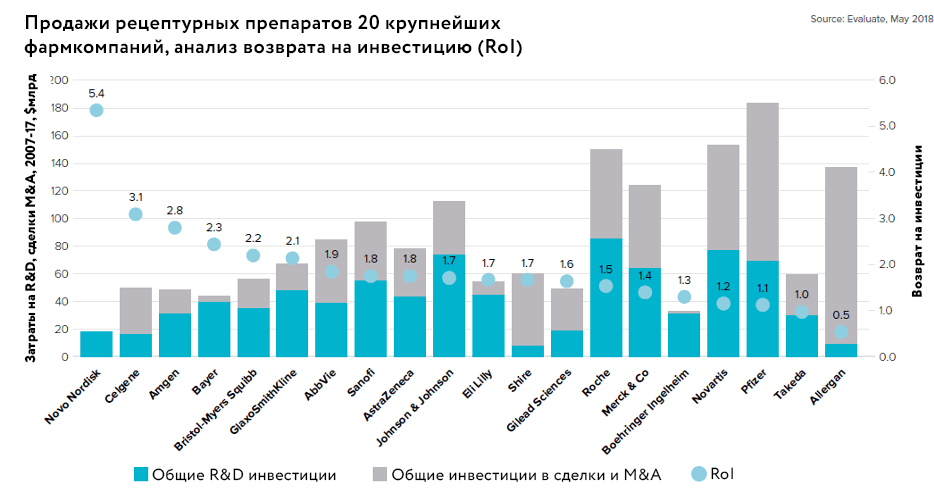
Рисунок 2. Сравнение затрат на R&D, сделок по слиянию и поглощению и возврата на инвестицию (ROI) для крупнейших фармкомпаний
EvaluatePharma World Preview 2020, Outlook to 2026, рисунок адаптирован
Концепция, получившая название открытых инноваций (ОИ), появилась как один из способов решения проблемы и объединила в себе несколько подходов, направленных на поиск перспективных разработок не только внутри корпорации. Помимо уже упомянутой снижающейся эффективности внутреннего R&D корпораций наметилось еще несколько предпосылок к становлению модели открытых инноваций:
- Продукты на рынке фармацевтики устаревают быстрее, чем раньше: множество новых конкурентных разработок сокращают рынок имеющегося лекарства. У любого нового лекарства на рынке довольно быстро появляются «последователи».
- Усложнение технологий приводит к необходимости более узкой специализации команды, отвечающей за разработку.
- Развитие венчурных инвестиций приводит к появлению новых игроков, занимающихся разработками — малых биотех-компаний, стартапов.
- Мобильность специалистов становится нормой: один человек может легко переходить между академическими институтами, Бигфармой и стартапами.
Современные модели разработки лекарств
Безусловно, внутри R&D-отделов многих крупных компаний всё еще ведутся ранние разработки, однако ни одна компания не может охватить все перспективные области: пришлось бы содержать слишком широкий штат узких специалистов. Более того, постоянно появляются новые «горячие» направления, где высокая потребность в новых способах терапии удачно сочетается с развитием науки. В качестве иллюстрации можно вспомнить коронавирусную пандемию. Пытаться предугадать такие ситуации или держать огромный штат узких специалистов? Мало реальная и очень дорогостоящая задача.
Сегодня фармацевтические компании всё больше полагаются на внешние источники инноваций. Первый механизм взаимодействия заключается в грантах, выдаваемых академическим коллективам с целью стимулировать развитие наиболее перспективных направлений. Также у большинства крупных компаний есть корпоративные венчурные фонды, финансирующие разработки на стадии доклинических и ранних клинических исследований. Интересно, что зачастую разные компании не конкурируют между собой, а сотрудничают, инвестируя вместе в один и тот же стартап! Тут ярко проявляется относительно новый принцип, что инновации — это игра не с нулевой суммой, а в случае успеха выигрывают все. Например, одна из компаний может забрать лицензию на новое лекарство, а остальные просто получат финансовый выигрыш, или права на разные географические регионы могут быть разделены между инвесторами. Новая технология получает практическое подтверждение, у всех разработчиков снижаются риски, а в будущем открываются новые рынки. Итогом становится венчурная экосистема, способствующая отбору лучших инновационных разработок и отбраковке тех, которые не проходят последовательные «фильтры» доклинического и клинического тестирования.
Итак, к концу 2000-х годов сложился следующий типичный путь лекарственной разработки от идеи до рынка:
- Фундаментальные исследования патогенеза, поиск и начальная валидация мишеней проводятся группами в академических институтах. Они финансируются грантами от государства и от частных компаний.
- Когда появляются лекарственные кандидаты, действующие на мишень, создается биотех-стартап. Он получает финансирование от венчурных фондов (в том числе, корпоративных), а иногда и от бизнес-ангелов, то есть частных лиц.
- По мере продвижения разработки стартап собирает всё новые раунды венчурного финансирования.
- После снятия части рисков провала из-за неэффективности или небезопасности (раньше это происходило обычно на клинической стадии, теперь чаще на доклинической) стартап может выйти на публичный рынок (произвести IPO — initial public offering, то есть начальное публичное размещение акций) и дальше финансироваться уже крупными финансовыми организациями, такими как хедж-фонды.
- В любой момент компанию может целиком купить крупная компания (это называется M&A — mergers and acquisitions).
- Также в любой момент каждый из продуктов компании может быть лицензирован другой компании. Обычно в этом случае компания получает часть денег на счет, а часть — в виде обязательства получить их в будущем, при достижении определенных условий (они называются milestones), например, успеха в клиническом исследовании.
В современных реалиях новая разработка может быть зарегистрирована как небольшой биотех-компанией, так и Бигфармой, причем за последние 10 лет крупные фармацевтические компании регистрируют в FDA только 26–40% новых лекарств, а остальное приходится на «маленьких» игроков рынка.
О том, как проводятся клинические исследования и как они заканчиваются регистрацией препаратов, рассказывается в спецпроекте «Биомолекулы» «Клинические исследования».
Несмотря на кажущееся многообразие источников финансирования, биотех-стартапам на ранней стадии приходится особенно тяжело: результатов еще нет, а деньги уже уходят. Поскольку создание новых лекарств — это научно-поисковые исследования, многое может не «выгореть», а процесс получения результата занимает месяцы и даже годы. И если в целом концепция не опровергнута (скажем, мишень валидирована, но не получается создать достаточно селективную молекулу против нее), то после каждого отрицательного результата приходится возвращаться на шаг назад и переделывать (рис. 3).
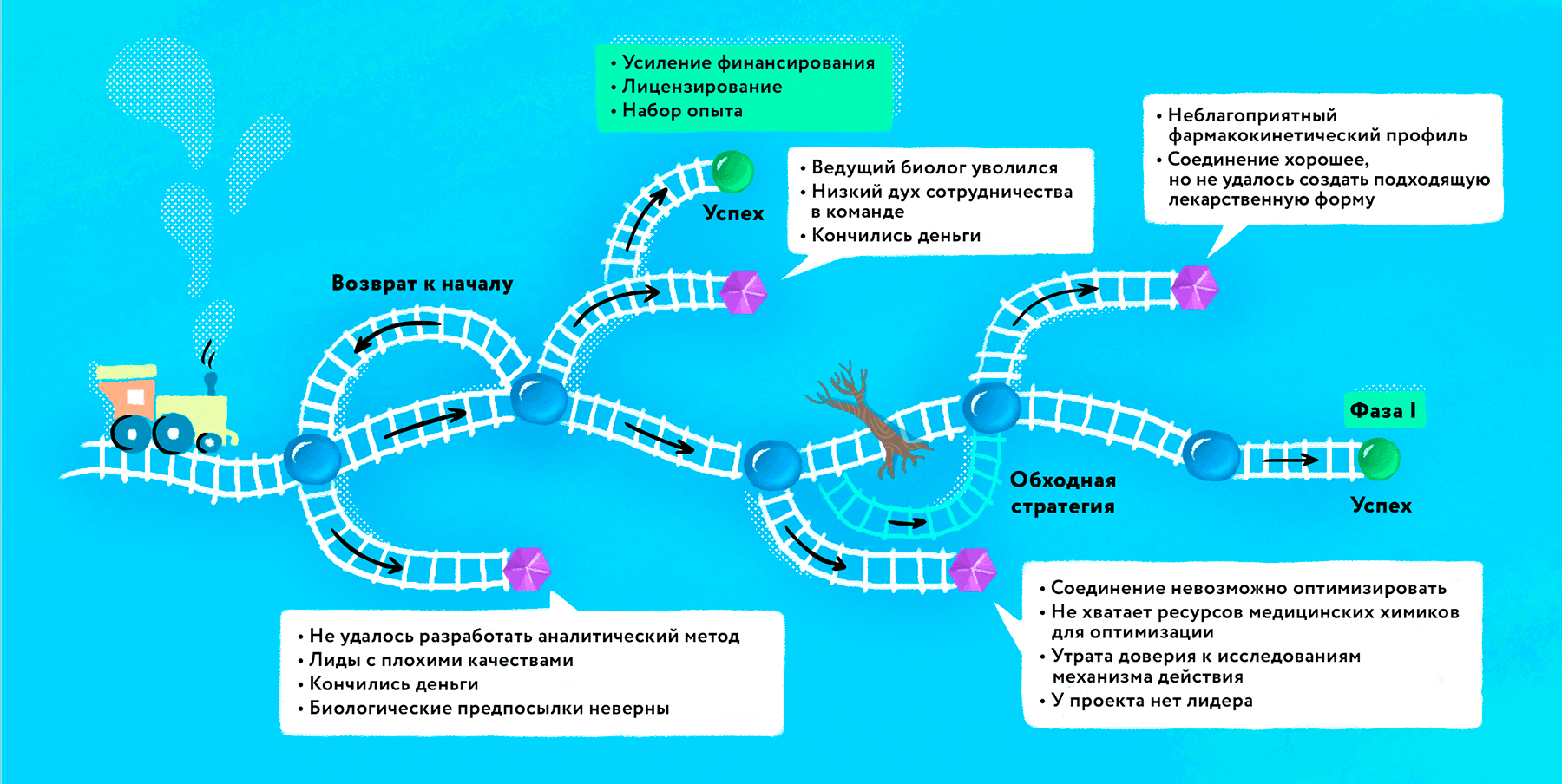
Рисунок 3. Сложный путь ранней фармацевтической разработки к успеху. На первом этапе нередко приходится возвращаться назад, например, когда новые эксперименты не подтвердили первоначальную гипотезу. Часть проектов завершается уже на этой фазе: первоначальная идея или выбранный тип молекулы оказываются непригодными, либо исследователям не хватает финансирования на продолжение работы. По мере продвижения вперед биотех-стартап может как быстро стать успешным (получив прямое финансирование или после лицензирования продукта), так и столкнуться с критичными сложностями, среди которых может быть уход ключевых членов команды, низкий уровень менеджмента внутри компании, усиление проблем с финансированием, невозможность объяснить механизм действия или оптимизировать соединение для достижения необходимой селективности и минимизации побочных эффектов. В среднем от идеи до первой фазы клинических испытаний могут проходить годы, а итоговый результат может отличаться от оригинальной задумки ученых.
иллюстрация Любови Колосовской на основе [12]
Разработчикам и ученым без коммерческого опыта, кроме своей непосредственной задачи, приходится одновременно решать и множество других проблем: трудно сразу найти крупные инвестиции, которые позволят арендовать лабораторные помещения, оценить маркетинговый потенциал, проработать стратегию защиты интеллектуальной собственности, а также запустить процесс разработки самостоятельно. Кроме этого, не всегда исследователь относится к своему проекту беспристрастно или имеет достаточный кругозор, чтобы принять правильное решение при выборе приоритетного направления развития стартапа или общей стратегии. Для того чтобы помочь таким командам, идеально подходит модель с использованием инкубаторов, акселераторов и то, что объединяют под общим термином «открытые инновации».
Открытые инновации
Парадигма открытых инноваций предполагает использование опыта и экспертизы различных внешних источников, обмен знаниями, информацией, а в некоторых случаях и интеллектуальной собственностью настолько широко, насколько это возможно [6]. Для многих компаний партнерство с академическими центрами стало важным механизмом доступа к новейшим исследованиям и технологиям без необходимости инвестировать в свою собственную инфраструктуру фундаментальных исследований. Академические исследователи и стартапы, в свою очередь, получают от фармкомпаний недостающую экспертизу и ноу-хау в области разработки лекарств, построения исследовательской программы и регуляторных взаимодействий, а также финансовые возможности Бигфармы.
Открытые инновации полагаются на гибкое, хорошо скоординированное и интегрированное сообщество внутренних и внешних экспертов, каждый из которых привносит свои уникальные компетенции. Партнерства в рамках открытых инноваций, как мы увидим ниже, способствуют ускорению сроков исследований и разработки лекарств, снижению стоимости и увеличению процента успеха.
Участники процесса открытых инноваций, помимо упомянутых уже крупных фармкомпаний, биотех-стартапов и академических учреждений, включают контрактные исследовательские организации (CRO), исследовательские центры, независимых инвесторов, государственные регуляторные органы и пациентские организации. Пациентские организации могут собирать собственные фонды для финансирования новых разработок и выполняют важную функцию донесения потребностей пациентов до фармкомпаний и других разработчиков: мы уже писали про то, как пациентские организации помогают в борьбе с хроническими [8] и аутоиммунными [9] заболеваниями.
В рамках открытых инноваций существуют различные модели взаимодействия участников процесса.
Простейшая модель — инкубаторы и акселераторы, которые организуются крупными фармкомпаниями, иногда инвестиционными фондами или образовательными учреждениями. В инкубаторе молодой стартап может получить доступ к оборудованию на льготных условиях и экспертную поддержку со стороны опытных ученых и предпринимателей. В акселераторе, как правило, стартапам предоставляют инвестиции, поэтому отбор и контроль там более жесткие.
Участие в биотех-стартапе в качестве инвестора или источника грантов позволяет фармкомпании на ранней стадии получить доступ к новой технологии и без дополнительных инфраструктурных затрат обозначить свое присутствие в новом для себя секторе. Фармкомпания держит руку на пульсе такой разработки, помогает своими компетенциями в области стратегического планирования, регуляторных взаимодействий и бизнес-девелопмента: например, стартапу, в капитале которого уже есть венчурные деньги Бигфармы, легче найти следующих инвесторов, потому что доверие к такой компании выше. Затем в случае успеха больше вероятность, что та же Бигфарма лицензирует продукт или купит компанию целиком. Так, в рамках инициативы Open Innovation компания Bayer предоставляет ученым гранты на разработку новых лекарств от рака, болезней сердца, гинекологических и других заболеваний.
Ряд компаний прибегли к краудсорсингу для повышения эффективности своих разработок. Краудсорсинг — это использование компетенций широкого круга специалистов, которые могут зарегистрироваться на платформе фармкомпании и все вместе принять участие в исследованиях и разработках, обмениваться идеями и генерировать новые. Для примера можно посмотреть на инициативу Grant4Targets компании Bayer: запущенная в 2009 году программа направлена на поддержку проектов в области поиска и валидации новых терапевтических мишеней, а также релевантных биомаркеров [6].
Платформа работает следующим образом: дважды в год внешних экспертов приглашают предложить новую лекарственную мишень для валидации и проверки гипотезы. Предложение оценивается учеными Bayer, и если оно принимается, предлагавшему вручается финансовая награда. Важно отметить, что права на интеллектуальную собственность остаются за заявителями. За первые пять лет работы программы поступило более 1100 заявок, которые вылились в 10 исследовательских проектов [6]. Из них 6 привели к созданию лида, 1 проект дошел до стадии оптимизации лида, и два стали лекарственными кандидатами.
Многие компании прибегают к частно-государственным партнерствам и образованию больших альянсов, состоящих из нескольких компаний, публичных институтов, благотворительных фондов. Так, в Евросоюзе реализуется проект IMI (Innovative Medicines Innovative), направленный на финансирование разработок в области медицины. Он создан на деньги Евросоюза и европейских фармкомпаний, в том числе, Bayer. Проекты, профинансированные IMI, валидировали 35 новых лекарственных мишеней, создали 34 новых модели in vitro, 316 компьютерных моделей и 70 моделей in vivo. Получено свыше 1500 линий стволовых клеток, разработано двенадцать методов визуализации. В разработке находится 326 биомаркеров, из которых 136 уже валидировано. В рамках IMI Bayer принял участие в следующих направлениях деятельности:
- стандартизация и валидация методик;
- BigData и цифровое здравоохранение;
- оценка и гармонизация процессов;
- вовлечение пациентов;
- работа над проектами, процессами и платформами.
Какие проекты участвуют в IMI? Это, например, CANCER-ID — разработка диагностики опухоли по анализу крови. Проект направлен на техническую и клиническую валидацию методик для определения биомаркеров крови для прогноза течения болезни, предсказания ответа опухоли на лечение и мониторинга этого процесса. Или создание сообщества педиатров Connect 4 Children, облегчающей разработку новых лекарств и методов терапии, обеспечивающий доступ к ним пациентов и распространяющий знания о методах терапии, которые сейчас применяются у детей.
Пример еще одного такого альянса — European Lead Factory. Любой ученый из европейского академического института или стартапа может предложить мишень для скрининга кандидатов или идею для библиотеки соединений. ELF включает множество государственных и частных партнеров, в том числе, AstraZeneca, Sanofi и Bayer. «Фабрика» предложила уже сотни тысяч соединений и десятки мишеней для высокопроизводительного скрининга.
Говоря об открытых инновациях, обязательно нужно упомянуть и создание так называемых инновационных центров. Например, компания Bayer организовала альянс с немецким центром исследования рака (Deutsches Krebsforschungszentrum, DKFZ) с целью ускорения трансляции результатов фундаментальных научных исследований в разработки новых лекарственных препаратов [6].
Всегда ли совместные разработки должны проходить в определенном центре или институте? В принципе, нет. Для биотех-стартапов можно реализовать модель виртуальной разработки. В этом случае у компании нет ничего, кроме офиса и нескольких профессионалов высочайшего класса, которые координируют разработки. Все работы отданы на аутсорс в контрактные организации или проводятся вместе с партнерами. Сотрудники компании занимаются планированием всей исследовательской программы, отдельных экспериментов, обрабатывают их результаты и решают, что делать дальше. Но при всех очевидных плюсах такая модель предъявляет очень высокие требования к опыту и компетенциям каждого сотрудника: начинающие стартаперы без опыта разработки «руками» вряд ли справятся с задачей удаленного контроля всего процесса.
Крупным компаниям гораздо тяжелее виртуализироваться, хотя в специалистах, способных руководить разработкой в таком формате, недостатка, как правило, нет. Виртуальные разработки предпочитают такие компании, как Shire, Debiopharm, Endo Pharmaceuticals. А Eli Lilly, например, выделила особое подразделение Chorus, которое ведет работу в виртуальном режиме.
Вне зависимости от конкретной модели открытых инноваций, ключевую роль во всей концепции играет открытость данных как минимум в двух аспектах: всё больше научных журналов открывают свободный доступ к своим статьям, а регуляторы требуют от разработчиков публиковать результаты исследований всё полнее. Так, ЕМА и FDA давно публикуют экспертные отчеты, на основании которых новые лекарства получают регистрацию (к сожалению, Минздрав РФ таким подходом похвастаться пока не может). А с недавних пор идет эксперимент и по публикации полных отчетов о клинических исследованиях. Такого рода информация очень важна экспертам для оценки конкурентного окружения, потребности в новых терапиях, построения пути разработки лекарств.
Примеры успешных разработок в рамках ОИ
В 2015 году компания Bayer запустила инициативу LEAPS для инвестиций в решения самых насущных проблем в области наук о жизни, стоящих перед человечеством: от лечения сердечных заболеваний у детей до разработки безопасных инсектицидов. Это пример программы, самостоятельно созданной компанией на основании анализа областей с наибольшей потребностью в новых технологиях. В рамках LEAPS появился проект Casebia Therapeutics, который нацелен на лечение редких генетических заболеваний в области гематологии и аутоиммунных болезней с использованием технологии редактирования генома CRISPR/Cas9.
Другой пример — компания BlueRock Therapeutics, исследующая возможности применения плюрипотентных стволовых клеток для лечения болезни Паркинсона и хронической сердечной недостаточности.
В качестве примера инновационной совместной разработки, которая закончилась выкупом компании, можно привести компанию Algeta (создана уже за рамками LEAPS). Она была основана в 2005 году, а одним из инвесторов выступило SROne, венчурное подразделение фармгиганта GlaxoSmithKlein. В 2009 году компания вступила в сотрудничество с Bayer для совместной разработки и коммерциализации радиофармацевтического препарата «Ксофиго»® (радия хлорид [223 Ra]). В 2013 году препарат был одобрен в США и Европе, и в декабре 2013 Bayer купил Algeta за $2,9 млрд. В 2018 году продажи Xofigo составили $414 млн.
В 2006 году Bayer заключил соглашение с компанией Regeneron о совместной разработке офтальмологического препарата «Эйлеа»® (афлиберцепт). В 2011 году лекарство было зарегистрировано и стало блокбастером: продажи в США в 2019 году составили $4,65 млрд.
Барьеры на пути перехода к открытым инновациям
Если открытые инновации так привлекательны с точки зрения повышения эффективности лекарственных разработок, почему же еще не все фармкомпании практикуют их в той же степени, что лидеры в этой области? Дело в том, что принципы открытых инноваций задают довольно высокие требования к организации процессов, качеству экспертизы и управления в компании, а также заставляют перестраивать структуру компании и менять менталитет всех, кто задействован в этих процессах. Как организация компаний, так и люди, работающие там, обычно довольно инертны, и требуются большие усилия, чтобы перейти к новой парадигме исследований.
Скажем, классический ученый в организации закрытого типа — это интроверт, который с недоверием относится к внешней экспертизе и мыслит в парадигме «свой—чужой». В рамках открытых инноваций каждый ученый должен быть, наоборот, готов к обмену мнениями, внешней критике, сотрудничеству с людьми других культур и методов работы.
Также и компания закрытого типа с опаской относится к раскрытию своих данных, контактам с внешними экспертами, зачастую излишне бюрократизируя эти процессы. Только понимание того, что открытость в конечном итоге приносит выгоду всем участникам процесса (естественно, при надлежащей организации), способно поменять установки внутри компании.
Заключение и перспективы
Традиционная модель исследований и разработок, похоже, уперлась в потолок своей продуктивности. Лекарства передовой терапии — генной и клеточной [10] — требуют новых подходов к поиску источников инноваций, а риски и затраты разработок заставляют компании искать способы их снижения, меняя подходы к работе, делая их более гибкими и открытыми.
Каждая компания выбирает свою модель с той или иной степенью открытости, и нет такой, которая бы подходила всем одинаково хорошо. В то же время сам характер разработки накладывает ограничения на то, как она будет вестись.
Похоже, что модель открытых инноваций внесла свой вклад в борьбу с кризисом продуктивности фармкомпаний, который проиллюстрирован рисунком 1, — «страшная» кривая за последнее время начала выходить на плато (рис. 4).
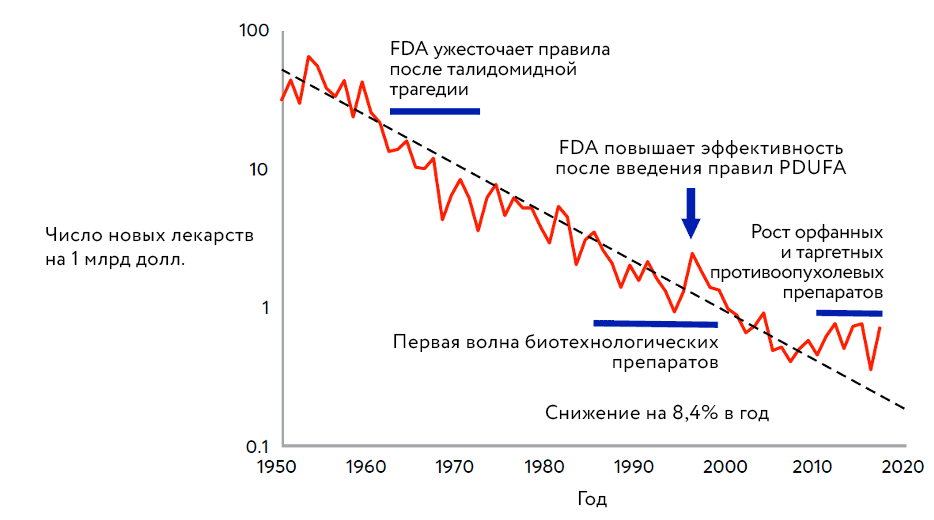
Рисунок 4. Регистрация новых лекарств в расчете на миллиард потраченных долларов, современное состояние
The Biomedical Bubble, рисунок адаптирован
Можно не сомневаться, что и малые, и крупные компании продолжат экспериментировать с различными способами организации исследований лекарств, добиваясь всё более эффективного вывода новых препаратов на рынок.
Во второй статье спецпроекта мы расскажем подробнее о работе внутри акселераторов, а основатели проектов, отобранных в российский «КоЛаборатор», поделятся своим опытом. В завершающей статье мы опубликуем интервью с медицинским директором Bayer Дмитрием Власовым, который поведает, как выглядит развитие Бигфармы «изнутри».
Литература
- Победитель бактерий;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Кузница нобелевских кадров;
- Поиск лекарственных мишеней;
- Три поколения лекарств;
- Alexander Schuhmacher, Oliver Gassmann, Nigel McCracken, Markus Hinder. (2018). Open innovation and external sources of innovation. An opportunity to fuel the R&D pipeline and enhance decision making?. J Transl Med. 16;
- Regina Au. (2014). The paradigm shift to an “open” model in drug development. Applied & Translational Genomics. 3, 86-89;
- Пациентский активизм и борьба с хроническими заболеваниями;
- Пациентские организации в борьбе с аутоиммунными болезнями;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Jack W. Scannell, Alex Blanckley, Helen Boldon, Brian Warrington. (2012). Diagnosing the decline in pharmaceutical R&D efficiency. Nat Rev Drug Discov. 11, 191-200;
- Jayme L. Dahlin, James Inglese, Michael A. Walters. (2015). Mitigating risk in academic preclinical drug discovery. Nat Rev Drug Discov. 14, 279-294.







