Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей
09 октября 2007
Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей
- 2042
- 2
- 4
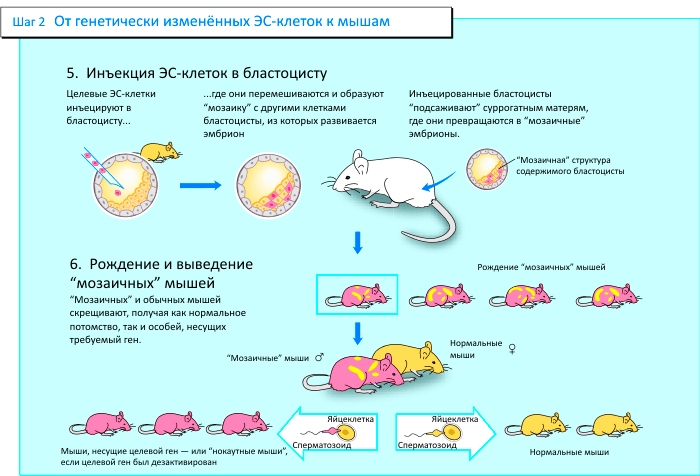
«Мозаичная мышь» — такой термин учёные предложили для обозначения животного, в эмбрион которого были подсажены генно-модифицированные стволовые клетки
-
Авторы
-
Редакторы
8 октября Нобелевский комитет принял решение о присуждении Нобелевской премии в области физиологии или медицины Марио Капеччи, Мартину Эвансу и Оливеру Смитису за открытие ими «принципа внесения специфических изменений генов мышей с применением эмбриональных стволовых клеток». «Биомолекула» представляет перевод пресс-релиза, посвященного этому событию.
8 октября 2007 года Нобелевская ассамблея Королевского института приняла решение присудить Нобелевскую премию по физиологии или медицине 2007 года Марио Капеччи (Mario R. Capecchi), Мартину Эвансу (Martin J. Evans) и Оливеру Смитису (Oliver Smithies) за их открытие «принципа внесения специфических изменений генов мышей с применением эмбриональных стволовых клеток».
Нобелевские лауреаты этого года совершили серию основополагающих открытий в области биологии эмбриональных стволовых клеток и механизмов рекомбинации ДНК млекопитающих. Их открытия привели к созданию невероятно мощной технологии, названной «направленное изменение генов мышей». Этот подход применяется практически во всех областях современной биомедицины — от фундаментальных исследований до создания новых методов терапии.
Направленное изменение ДНК часто применяется для инактивации одиночных генов. Подобные эксперименты по генному «нокауту» помогли выяснить роль многих генов, отвечающих за эмбриональное развитие, регуляцию физиологических процессов во взрослом организме, а также за старение и болезни. На сегодняшний день, более десяти тысяч мышиных генов (около половины генома млекопитающих) были успешно «нокаутированы». Совместные усилия учёных из разных стран скоро сделают «мышь с нокаутом» любого гена доступной уже в ближайшем будущем.
Использование метода направленного изменения генов позволяет вносить практически любые модификации в последовательность ДНК мышей, что даёт учёным возможность изучать функционирование отдельных генов в норме и патологии. При помощи этого метода уже создано более пятисот мышиных моделей человеческих заболеваний, включая сердечно-сосудистые, нейродегенеративные, рак и диабет.
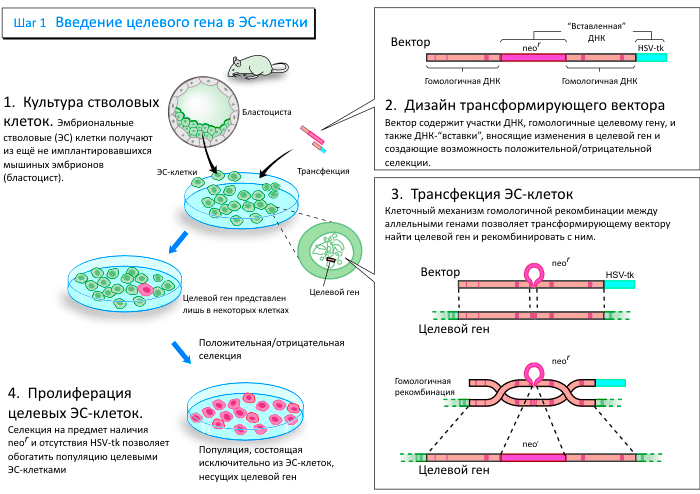
Изменение генов посредством гомологичной рекомбинации
Информация о развитии и работе нашего организма на протяжении всей его жизни содержится в ДНК. ДНК упакована в хромосомы, которые представлены парами — одна хромосома наследуется от отца, другая — от матери. Обмен генетической информацией (последовательностями ДНК) между хромосомами в паре увеличивает генетическое разнообразие популяций и происходит за счёт гомологичной рекомбинации. Этот процесс, открытый у бактерий ещё в 1958 г. другим нобелевским лауреатом, Джошуа Ледербергом, свойственен всем живым организмам и необходим для их эволюции.
Марио Капеччи и Оливер Смитис прозорливо полагали, что гомологичная рекомбинация может быть использована для специфического изменения генов в клетках млекопитающих, и оба последовательно работали для достижения этой цели.
Капеччи показал, что гомологичная рекомбинация может происходить между привнесённой и хромосомной ДНК в клетках млекопитающих. Он продемонстрировал, что дефектный ген может быть исправлен посредством гомологичной рекомбинации с искусственно введённой в клетку ДНК. Смитис изначально пытался исправить мутировавшие гены в клетках человека. Он считал, что некоторые болезни крови, передающиеся по наследству, можно вылечить, исправив вызывающие болезнь мутации в стволовых клетках красного кровяного мозга. Он открыл, что гены в клетке могут быть направленно изменены вне зависимости от их активности. Это наталкивало на мысль, что вообще любые гены доступны для гомологичной рекомбинации.
Эмбриональные стволовые клетки — материал мышиной зародышевой линии
Тип клеток, изначально использовавшихся в исследованиях Капеччи и Смитиса, не мог служить для создания животного с направленно модифицированными генами. Для этого требовался другой тип клеток — такой, который мог бы дать начало зародышевой линии. Только в этом случае изменения ДНК смогут наследоваться.
Мартин Эванс работал с клетками мышиной эмбриональной карциномы (ЭК), которые, хотя и происходили от клеток опухоли, могли давать начало практически любому типу клеток. Он придумал использовать клетки ЭК как транспортное средство для внесения генетического материала в мышиную зародышевую линию. Его первоначальные попытки окончились неудачей, поскольку клетки ЭК имели необычный набор хромосом и поэтому не могли дать начало зародышевой линии. В поисках альтернативы, Эванс обнаружил, что нормальную по числу хромосом культуру клеток можно получить из ранних мышиных эмбрионов. Теперь эти клетки называют эмбриональными стволовыми (ЭС) клетками.
Следующим шагом было доказательство того, что ЭС клетки могут давать начало клеткам зародышевой линии. В мышиные эмбрионы одной линии были введены ЭС клетки другой линии. Полученные таким образом мозаичные (т. е. содержащие клетки как одной, так и другой линии) эмбрионы были имплантированы «приёмной» матери. Полученное мозаичное потомство скрещивали. Наличие генов, пришедших с эмбриональными стволовыми клетками, проверяли у новорождённых мышат, полученных в результате скрещивания. Эти гены уже наследуются согласно законам Менделя.
Эванс начал модифицировать полученные стволовые клетки, и для этой цели избрал ретровирусы, способные встраивать собственные гены в хромосомную ДНК клетки. Ему удалось показать перенос ретровирусной ДНК из ЭС клеток, через мозаичную мышь в зародышевую линию мышей. Эванс успешно использовал эмбриональные стволовые клетки для создания мыши, несущей новый генетический материал.
Две идеи сходятся воедино — гомологичная рекомбинация и ЭС клетки
К 1986 году всё необходимое было под рукой, чтобы начать создание ЭС клеток с направленно изменёнными генами. Капеччи и Смитис продемонстрировали, что гены могут быть изменены посредством гомологичной рекомбинации в культуре клеток. Вкладом Эванса было создание необходимого «транспортного средства» для доставки в зародышевую линию — ЭС клеток. Следующим шагом было объединение этих двух замечательных достижений в одно.
Для своих начальных экспериментов, Смитис и Капеччи избрали ген (hprt), который можно было бы легко опознать. Этот ген связан с редким наследственным заболеванием (синдром Леш-Нихана). Капеччи улучшил стратегию направленного изменения генов и разработал новый метод (положительно-отрицательную селекцию), подходящий для широкого применения.
Рождение мыши с нокаутом — начало новой эры в генетике
Первое сообщение о применении гомологичной рекомбинации для получения мыши с направленно изменённым геном было опубликовано в 1989 г. С тех пор число мышей с нокаутом того или иного гена растёт экспоненциально. Направленное изменение генов превратилось в многоцелевую технологию. Сегодня возможно вносить мутации, которые могут быть активированы в строго определённый момент времени или в определённых клетках и тканях, как в процессе эмбрионального развития, так и во взрослом животном.
Направленное изменение генов используется в изучении здорового организма и его болезней
Почти любой аспект физиологии млекопитающих можно изучать, применяя направленное изменение генов. На наших глазах произошёл взрыв числа научных исследований, использующих данную технологию. Направленное изменение генов использовалось таким большим количеством исследовательских групп в таких различных контекстах, что даже краткое изложение их результатов не представляется возможным. Некоторые из последних вкладов, внесённых Нобелевскими лауреатами этого года, перечислены ниже.
Направленное изменение генов помогло нам понять роль многих сотен генов, участвующих в развитии плода у млекопитающих. Исследования Капеччи установили функции генов, участвующих в формировании органов и общего плана тела. Его работа пролила свет на причины нескольких врождённых пороков развития у человека.
Эванс применял направленное изменение генов для создания мышиных моделей болезней человека. Он разработал несколько моделей тяжёлого наследственного заболевания — кистозного фиброза — и использовал эти модели для изучения механизмов болезни и оценки результатов генной терапии.
Смитис также использовал направленное изменение генов для разработки мышиных моделей наследственных заболеваний, таких как кистозный фиброз, и талассемия (болезнь крови). Он также создал модели для таких распространённых человеческих заболеваний, как атеросклероз и гипертония.
В заключение стоит сказать, что направленное изменение генов мышей сегодня проникло во все области биомедицины. Ещё долгие годы значение этого открытия для нашего понимание работы генов и его польза для всего человечества будет только возрастать.
Литература
- The Nobel prize in physiology or medicine 2007. (2007). The Nobel Prize.