
Новый рубеж: получена пространственная структура β2-адренорецептора
11 декабря 2007
Новый рубеж: получена пространственная структура β2-адренорецептора
- 1984
- 0
- 5
Структура нового белка из семейства G-белоксопряжённых рецепторов — β2-адренорецептора — вынесена на обложку журнала Science. Показаны молекулы рецептора, кристаллографического липида и антагониста каразолола, использовавшегося при кристаллизации белка.
-
Автор
-
Редакторы
С 2000 года фоторецептор родопсин оставался единственным представителем семейства G-белоксопряжённых рецепторов (GPCR), для которого определена пространственная структура. Многочисленные попытки структурного описания этих важнейших мембранных рецепторов (являющихся мишенью действия бóльшей части производимых лекарств) заканчивались неудачей из-за низкой концентрации в клетке, а также сложности изучения с помощью экспериментальных методов. Сейчас, в конце 2007 года, двум группам американских исследователей удалось независимо получить трёхмерные структуры нового члена GPCR-семейства — β2-адренорецептора.
Развитие множества заболеваний — таких разнообразных как астма, шизофрения, гипертоническая болезнь, аллергии и даже инсульт с инфарктом — происходит с участием интегральных рецепторов клеточной мембраны, действующих через активацию цитоплазматических тримéрных G-белков (рецепторы, сопрежённые с G-белком, или GPCR, от англ. G-protein-coupled receptors). Например, β2-адренорецепторы играют определённую роль в нормальной работе сердечнососудистой системы, а их дисфункция может вызывать астму или артериальную гипертонию. Семейство GPCR-рецепторов крайне разнообразно: всего в геноме человека идентифицировано чуть менее тысячи таких белков, главной задачей которых является восприятие внеклеточного стимула (свет и запахи, белковые гормоны и пептиды, низкомолекулярные соединения и ионы) и передача его в цитоплазму путём активации G-белка, запускающего дальнейшие биохимические механизмы.
В настоящий момент на GPCR-рецепторы ориентировано действие более чем половины всех выпускаемых в мире лекарств (а это многомиллиардные ежегодные обороты!), и цифра эта, скорее всего, существенно вырастет — ведь терапевтический потенциал этих рецепторов только начинает осваиваться, а функции многих из них до сих пор слабо изучены. Всё это обозначает, что GPCR-рецепторы — заманчивая мишень не только для химических и физических импульсов, но и для фармацевтических гигантов, желающих захватить новые рынки с выпуском новых, эффективных и безопасных лекарств.
Однако эффективная разработка лекарственных соединений в XXI веке [1] требует аккуратного изучения молекулярных механизмов взаимодействия лекарства со своим белком-«мишенью», для чего необходимо знать пространственную структуру рецептора, воздействие на который, по гипотезе разработчиков, должно принести желанный лечебный эффект. (Если структура недоступна, можно использовать качественную теоретическую модель этого рецептора.)
С тех пор как в 2000 году было определено трёхмерное строение фоторецептора родопсина [2], он оставался единственным структурно охарактеризованным представителем семейства GPCR. Многочисленные исследования косвенно указывали на то, что структура родопсина является как бы «прототипом» структуры всех остальных GPCR-рецепторов (по крайней мере, в трансмембранной области), и до недавнего времени именно родопсин являлся отправной точкой для компьютерного моделирования структуры других рецепторов.
Научное сообщество, конечно, понимало, что «срисовывать» модели столь большого числа разнообразнейших по своим функциям рецепторов с одного-единственного белка (тем более, столь необычного — реагирующего на свет [3]) вряд ли абсолютно корректно. Однако многочисленные попытки получить структуру ещё хоть одного рецептора, кроме родопсина, проваливались на протяжении долгих лет. Можно назвать два основных фактора, препятствующих решению задачи определения структуры GPCR-белков:
- Большинство рецепторов присутствует в мембране клетки в крайне небольшом количестве, недостаточном для экспериментов по определению структуры (в отличие от родопсина, которым буквально «напичкана» мембрана клеток сетчатки). (Генно-инженерная наработка рецептора в in vitro системах и их последующая очистка связаны с отдельными сложностями.)
- Подбор условий, в которых очищенный образец рецептора перейдёт в высокоупорядоченное состояние (то есть, образует кристалл, пригодный для изучения структуры с помощью метода рентгеноструктурного анализа) — крайне нетривиальная задача, не имеющая в настоящее время однозначного решения. (Метод спектроскопии ядерного магнитного резонанса пока не позволяет изучать столь крупные мембранные белки).
Кроме того, считается, что родопсин кристаллизуется значительно лучше своих «собратьев» за счет того, что ретиналь — ковалентно связанный кофактор, акцептирующий свет, — по сути является антагонистом родопсина, стабилизирующим его «неактивную» (и конформационно стабильную) форму. Большинство же других рецепторов ковалентно связанного лиганда не содержат, а потому их отличают бóльшие структурные флуктуации, препятствующие формированию упорядоченного кристалла.
И вот, по прошествии более чем семи лет, две американские группы исследователей докладывают об успешном определении структуры нового представителя семейства G-белоксопряжённых рецепторов — β2-адренорецептора (обе группы провели независимый эксперимент) [4–6]. Руководителем обеих групп является Брайан Кобилка (Brian Kobilka), более чем 15 лет работы лаборатории которого посвящены структурному изучению GPCR-рецепторов и в частности — β2-адренорецептора. «Большая часть гормонов и нейротрансмиттеров действует через GPCR-рецепторы. И поскольку все они родственны структурно, новое знание об одном из них означает шаг вперёд во всей этой области. И чем больше мы будем знать о структуре какого-либо рецептора, тем больше возможностей у нас будет для дизайна новых лекарств, нацеленных на этот рецептор», — поясняет Кобилка важность достигнутых им результатов.
Под руководством одного и того же учёного вышло сразу три публикации в ведущих научных журналах, посвящённых двум структурам одного рецептора [4–6]. Постараемся разобраться, в чём тут дело. Статья в Nature [4] (появившаяся в онлайне 21 октября) представляет собой результат работы группы самого Кобилки (относящейся к медицинскому факультету Стэнфордского университета). Они поставили задачу получить структуру β2-адренорецептора, максимально близкую к его «нативной» форме (то есть, не содержащей (почти) генно-инженерных модификаций). Как уже было сказано, получить структуру GPCR-рецептора — непростая задача. И, говоря строго, структура «дикого типа» рецептора так и не была получена — получить кристалл с хорошей дифракцией не удалось. Поэтому учёные прибегли к некоторым хитростям: рецептор кристаллизовали в комплексе с моноклональным антителом, специально сконструированным для связывания третьей внутриклеточной петли рецептора. Эта мера (довольно часто используемая в кристаллографии), а также совместная кристаллизация с антагонистом β2-адренорецептора каразололом, позволили снизить конформационную лабильность рецептора и получить кристалл, дающий чёткую дифракционную картину. Структура, полученная с пространственным разрешением 3,4 Å, получила краткое название β2AR–Fab5 (рис. 1, справа).
Пара других статей, появившаяся 25 октября на сайте Science [5], [6], детально описывает другую структуру, полученную группой Кобилки в сотрудничестве с группой Рэймонда Стивенса (Raymond C. Stevens) из Института Скриппса. Полученная с более высоким разрешением (2,4 Å) и также представляющая собой комплекс с антагонистом каразололом, эта структура описывает «химерный» рецептор, большая часть которого соответствует β2-адренорецептору, а третья цитоплазматическая петля (ЦП-3) заменена на T4-лизозим — небольшой глобулярный белок (структура получила краткое название β2AR–T4L, рис. 1, слева).
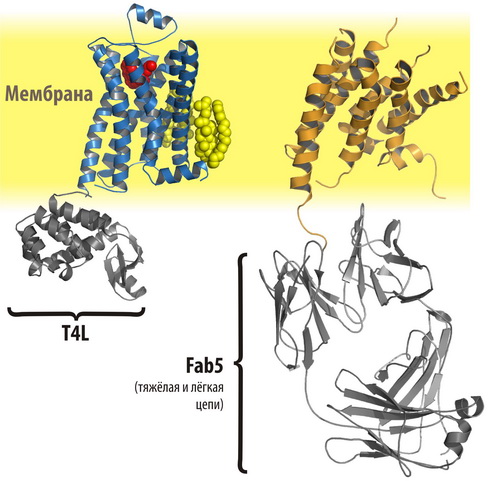
Рисунок 1. Две структуры β2-адренорецептора.
Слева: β2AR–T4L — химерный белок, большая часть которого соответствует адренорецептору, а третья цитоплазматическая петля (ЦП-3) заменена на глобулярный Т4-лизозим с целью стимулировать кристаллизацию. Этот белок выбран из соображений хорошей кристаллизуемости и расстояния между его N- и C-концами, приблизительно соответствующего дистанции между «повисшими» концами 5-й и 6-й трансмембранных α-спиралей. Также показаны антагонист каразолол, в комплексе с которым проводили кристаллизацию, и молекулы холестерина и пальмитоиловой кислоты.
Справа: β2AR–Fab5 — нековалентный комплекс β2-адренорецептора с антиген-связывающим доменом специально полученного моноклонального антитела к ЦП-3 адренорецептора (Fab5). Разрешение, с которым была получена эта структура, значительно ниже, чем в случае β2AR–T4L, и в ней «не видны» внеклеточные петли и каразолол, который использовался и в этом случае.
Идея вставки вместо структурно нестабильной ЦП-3 участка другого белка принадлежит Дэниэлу Розенбауму (Daniel Rosenbaum) из лаборатории Кобилки — это позволило увеличить число полярных межмолекулярных контактов, способствующих кристаллизации. Другой ключевой компонент успеха был предложен Стивенсом и его сотрудником Вадимом Черезовым. Согласно их методике, кристаллизацию проводили в кубической липидной фазе, содержащей повышенное количество холестерина, стабилизировавшего кристаллизуемую молекулу. Условия кристаллизации были подобраны с помощью автоматической установки, осуществившей более 15000 попыток, прежде чем был получен кристалл, пригодный для изучения рентгеновской дифракции.
«Я ужасно доволен, что предложенная методика так хорошо себя зарекомендовала, — сказал Черезов. — GPCR-белки — это просто Эверест мембранной структурной биологии, и увидеть их строение так подробно — значит понять механизм их работы».
Кстати, полученные структуры подтвердили гипотезу, что трансмембранный (ТМ) домен GPCR-рецепторов весьма консервативен. Укладка всех семи ТМ-α-спиралей оказалась очень схожей с таковой в родопсине, но с небольшими вариациями. В частности, цитоплазматические концы 3-й и 6-й ТМ-спиралей оказались довольно сильно разведены друг от друга, по сравнению с родопсином. (Этот микродомен считается важным для процесса активации рецептора, и «ионная защёлка», удерживающая концы спиралей в родопсине вместе, отвечает за стабилизацию неактивного состояния.) Учёные считают этот факт объяснением того, что большинство рецепторов (но не родопсин!) обладают «базальной» (т. е. не зависящей от связывания лиганда) активностью (рис. 2).
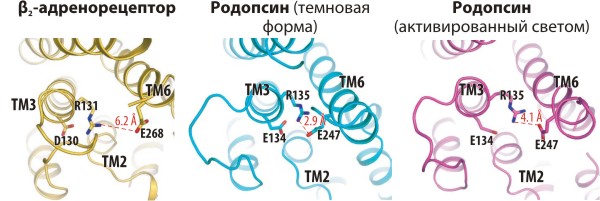
Рисунок 2. «Ионная защёлка» в трёх структурах GPCR: β2-адренорецепторе (β2AR–Fab5), «темновой» (неактивированной) и фотоактивированной [7] формах родопсина. (Вид с цитоплазматической стороны, перпендикулярно плоскости мембраны.) Показаны остатки аспарагиновой либо глутаминовой кислот и аргинина из третьей трансмембранной α-спирали (ТМ3), входящие в консервативный (D/E)RY мотив, и ионный мостик с остатком глутаминовой кислоты в ТМ6. Считается, что эти остатки («ионная защёлка») поддерживают родопсин и другие рецепторы в неактивной конформации (мутация одного из них приводит к появлению постоянно активных форм), а связывание агониста вызывает конформационную перестройку («активацию») рецептора с разрушением «защёлки» и связыванием G-белка. Большое расстояние между Arg и Glu в адренорецепторе (даже связанном с антагонистом) делает его похожим скорее на активную, чем «темновую» форму родопсина.
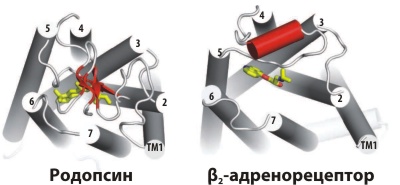
Рисунок 3. Строение второй внеклеточной петли в родопсине и адренорецепторе. Общая трансмембранная (ТМ) укладка родопсина и β2-адренорецептора (β2AR–T4L) примерно одинакова, включая одинаковое расположение сайта связывания антагонистов — ковалентно присоединённого ретиналя в родопсине и каразолола в адренорецепторе. Однако внеклеточная петля, «накрывающая» сайт связывания, устроена в этих рецепторах по-разному: в родопсине пара β-листов плотно прикрывает сайт, затрудняя доступ лигандов, в то время как в адренорецепторе эта петля содержит более подвижную α-спираль, видимо, обеспечивающую проникновение растворимых лигандов в сайт связывания, находящийся в ТМ области рецептора.
Другое найденное отличие заключается в строении одной из внеклеточных петель, как бы «прикрывающих» сайт связывания лиганда. В родопсине пара β-листов образуют плотную «крышку» над ковалентно присоединённым ретиналем, в β2-адренорецепторе же эта область принимает α-спиральную конформацию, облегчая, как считают исследователи, доступ к сайту связывания со стороны внеклеточной области — как и должно быть в рецепторе, лиганд которого должен иметь свободный доступ к активному центру (рис. 3).
Не стоит думать, что пара полученных структур — это избыточная работа (или противоречащие друг другу данные). У каждой из работ есть свои преимущества: в одной удалось получить структуру с бóльшим разрешением, а в другой — сохранить практически неизменной полную структуру белка. Раз уж не удалось совместить оба эти обстоятельства в одной структуре, учёные использовали результаты друг друга, чтобы подтвердить надёжность полученных данных. Так, если биохимическую корректность созданной химеры β2AR–T4L подтвердили, изучая взаимодействие этого «гибридного» рецептора с лигандами и обнаружив фармакологическую идентичность с рецептором «дикого типа», то обосновать корректность пространственного строения без второй структуры было бы не просто! В самом деле: как доказать, что встраивание довольно большого глобулярного белка вместо сравнительно короткой цитоплазматической петли не нарушает структуру рецептора в целом? Сравнение же со структурой β2AR–Fab5, хотя и менее детальной (в частности, на ней «не видны» внеклеточные петли и связанный лиганд), но зато не подвергнутой такой существенной «доработке», показало, что эти две структуры очень близки. Фактически, это подтвердило корректность использованного приёма — замены подвижной петли на стабильный глобулярный домен для облегчения кристаллизации рецептора.
«Мы ещё в начале пути, — сказал Кобилка. — В драг-дизайне давно уже используют модели, основанные на структуре родопсина, но необходимость в новых структурах GPCR-рецепторов просто огромна. Особенно это касается тех из них, для которых пытаются разработать новые лекарства».
Литература
- Драг-дизайн: как в современном мире создаются новые лекарства;
- K. Palczewski. (2000). Crystal Structure of Rhodopsin: A G Protein-Coupled Receptor. Science. 289, 739-745;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Søren G. F. Rasmussen, Hee-Jung Choi, Daniel M. Rosenbaum, Tong Sun Kobilka, Foon Sun Thian, et. al.. (2007). Crystal structure of the human β2 adrenergic G-protein-coupled receptor. Nature. 450, 383-387;
- V. Cherezov, D. M. Rosenbaum, M. A. Hanson, S. G. F. Rasmussen, F. S. Thian, et. al.. (2007). High-Resolution Crystal Structure of an Engineered Human 2-Adrenergic G Protein-Coupled Receptor. Science. 318, 1258-1265;
- D. M. Rosenbaum, V. Cherezov, M. A. Hanson, S. G. F. Rasmussen, F. S. Thian, et. al.. (2007). GPCR Engineering Yields High-Resolution Structural Insights into 2-Adrenergic Receptor Function. Science. 318, 1266-1273;
- D. Salom, D. T. Lodowski, R. E. Stenkamp, I. L. Trong, M. Golczak, et. al.. (2006). Crystal structure of a photoactivated deprotonated intermediate of rhodopsin. Proceedings of the National Academy of Sciences. 103, 16123-16128;
- R. Ranganathan. (2007). Signaling Across the Cell Membrane. Science. 318, 1253-1254.






