О чем не знал Гальвани: пространственная структура натриевого канала
22 июля 2011
О чем не знал Гальвани: пространственная структура натриевого канала
- 3113
- 0
- 5
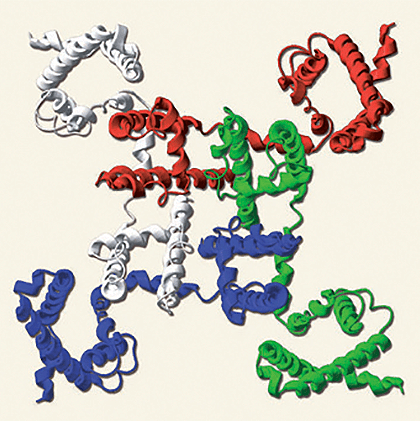
«Общий план» организации Na+-канала бактерии Arcobacter butzleri (NavAb): каждый из четырех мономеров, образующих пору (отверстие в центре), показан своим цветом. «Периферические» участки каждого мономера — потенциал-чувствительные домены, соединенные с доменом, образующим пору, гибким «шарниром». Каждый мономер состоит из шести трансмембранных α-спиралей, обозначаемых S1–S6.
-
Автор
-
Редакторы
В основе «животного электричества» и вообще всех электробиохимических потенциалов, столь важных для существования любой формы жизни, лежат ионные каналы, способные управлять прохождением тех или иных заряженных частиц через биологическую мембрану. Каналы, селективно пропускающие ионы натрия, отвечают за начальную фазу электрического возбуждения многих клеток, на котором держится передача нервных импульсов, сокращение мышц, секреция гормонов и многое другое. После многих лет исследований ученым удалось получить пространственную структуру потенциал-чувствительного натриевого канала, — правда, пока это канал бактерий, устроенный более просто, чем канал животных. Трехмерная организация проводящей поры и домена, «чувствующего» электрический потенциал, поможет лучше понять тонкости электрической активности возбудимых тканей и даст исследователям новое оружие против невралгических болей, эпилепсии и аритмии.
В 1786 году Луиджи Гальвани с помощниками наблюдали знаменитое подергивание лапок препарированной лягушки в ответ на прикосновение скальпеля к обнаженным бедренным нервам животного (рис. 1), что положило начало идее животного электричества, или гальванизма. Однако чего они в то время не осознали, это что любой (а не только посмертный!) прыжок лягушки начинается со своего рода «искры», запускающей биоэлектрический процесс возбуждения в нервах и мышцах. В наше время хорошо известно, что этот процесс носит название потенциала действия, и начинается он с лавинообразного входа внутрь возбудимой клетки (такой как нейрон или клетка мышц) положительно заряженных ионов натрия (Na+), которых вне клетки в десять раз больше, чем внутри нее. Почти сразу после этого события входящий натриевый ток сменяется выходящим током ионов калия (K+, которых внутри клетки, напротив, в двадцать раз больше), что восстанавливает исходный электрический потенциал на мембране. Равновесная концентрация самих ионов после этого нормализуется при помощи Na+/K+-насоса.

Рисунок 1. Описание Гальвани своего опыта: «Я разрезал и препарировал лягушку... и, имея в виду совершенно другое, поместил ее на стол, на котором находилась электрическая машина..., при полном разобщении от кондуктора последней и на довольно большом расстоянии от него. Когда один из моих помощников острием скальпеля случайно очень легко коснулся внутренних бедренных нервов этой лягушки, то немедленно все мышцы конечностей начали так сокращаться, что казались впавшими в сильнейшие тонические судороги. Другой же из них, который помогал нам в опытах по электричеству, заметил, как ему казалось, что это удается тогда, когда из кондуктора машины извлекается искра... Удивленный новым явлением, он тотчас же обратил на него мое внимание, хотя я замышлял совсем другое и был поглощен своими мыслями. Тогда я зажегся невероятным усердием и страстным желанием исследовать это явление и вынести на свет то, что было в нем скрытого».
«Шлюзом», в состоянии покоя не пускающим ионы натрия из межклеточной среды внутрь, являются потенциал-чувствительные натриевые каналы (ПЧНК), которые открываются при деполяризации — изменении электрического потенциала на мембране в сторону нуля (в покое, когда все ионные каналы закрыты, этот потенциал равен примерно −70 мВ). Пространственное строение натриевых каналов, несмотря на пятидесятилетнюю историю изучения, до недавнего времени оставалось неизвестным, — в отличие от K+-каналов, для нескольких типов которых в последнее десятилетие были получены пространственные структуры высокого разрешения. И вот ученые из Университета Сиэттла (штат Вашингтон, США) расшифровали пространственное строение ПЧНК бактерии Arcobacter butzleri (этот канал называется NavAb) [1], что должно позволить лучше понять, как работают натриевые каналы животных. Работа выполнена в лаборатории Уильяма Каттеролла, более 30 лет посвятившего изучению натриевых каналов.
«Электрические сигналы от потенциал-чувствительных натриевых каналов кодируют информацию в мозгу и передают ее в нервной системе, заставляют мышцы сокращаться, а также стимулируют выработку инсулина в поджелудочной железе», — поясняет Каттеролл важность выбранного им для изучения объекта. — «Если вам выполнили спинальную блокаду или дантист сделал вам инъекцию лидокаина, — натриевые каналы в зоне укола временно перестают работать и не сообщают мозгу о том, что происходит что-то не то» [2].
Натриевые каналы входят в большую группу потенциал-чувствительных ионных каналов, куда также относятся калиевые и кальциевые каналы. Однако функция ПЧНК уникальна тем, что именно с них начинается потенциал действия, когда в ответ на деполяризацию эти каналы временно (очень быстро, но очень ненадолго!) открываются, впуская Na+ внутрь клетки. Считается, что активация и инактивация Na+-каналов происходит в разных участках этих белков [3], [4]. Как и другие потенциал-чувствительные каналы, ПЧНК могут полностью активироваться в ответ на всего лишь 10-мВ деполяризацию [5], вызывая каскадное открывание все новых каналов, что обусловливает крайне высокую чувствительность возбудимых тканей. В результате волна возбуждения (нервный импульс) будет бежать по нервному волокну до тех пор, пока не вызовет в нервном окончании секрецию молекул нейромедиатора, «передавая эстафету» другому нейрону или мышечной клетке.
Потенциал-чувствительные каналы либо состоят из четырех идентичных субъединиц, образующих в центре общую пору (так устроены калиевые каналы и «новоисследованные» Na+-каналы бактерий NavAb, см. заглавный рисунок), либо образованы одной длинной полипептидной цепью, образующей четыре гомологичных (но не идентичных) домена, каждый строением напоминающий мономер K+-канала или NavAb. Эти четыре домена образуют пору аналогичным образом, «сворачиваясь» вокруг общего центра. Четырехдоменное строение характерно для кальциевых и натриевых каналов животных, — что и отличает, главным образом, полученную структуру NavAb от натриевых каналов, находящихся в мембранах наших нейронов и мышечных клеток.
Пóра, образованная четырьмя поровыми доменами каждого из мономеров NavAb (или каждым из четырех доменов натриевых каналов животных), «настроена» на селективное пропускание ионов Na+ через мембрану, когда канал открыт; при этом энергетический барьер прохода на другую сторону мембраны снижается настолько, что натрий проходит через канал практически со скоростью свободной диффузии. Открытие поры (образована трансмембранными сегментами S5 и S6) регулируется потенциал-чувствительными доменами (ПЧД, сегменты S1–S4), образующими «лепестки» канала (см. заглавный рисунок). Трансмембранный сегмент S4 этого домена несет большой положительный заряд: каждый третий аминокислотный остаток здесь — аргинин или лизин, выстроенные точно в линию по одной из сторон α- (точнее, 310) спирали S4. Вообще-то, наличие заряженных остатков весьма нетипично для гидрофобной среды мембраны, однако именно такое устройство позволяет ПЧД крайне чувствительно реагировать на изменение потенциала и, «выезжая» из мембраны под действием меняющегося электрического поля, заодно открывать и пору, раздвигая образующие ее α-спирали.
В уже известных пространственных структурах K+-каналов [6], [7] пóра находится в открытом состоянии, что вполне согласуется с тем фактом, что при деполяризации канал открывается. Однако в структуре канала NavAb, полученной Каттероллом и его коллегами, пóра закрыта, несмотря на состояние ПЧД, характерное для активированного (открытого) канала. Согласно предположению ученых, им удалось «поймать» канал либо в «пред-открытом», либо в инактивированном состоянии (последнее — это когда канал закрыт и в течение какого-то времени не может быть активирован).
Дело в том, что в настоящее время сымитировать электрический потенциал на мембране в процессе определения пространственной структуры белка нет никакой возможности, потому что мембраноподобное окружение создается в этом случае за счет мицелл или других детергентных сред, где просто нет непрерывной границы, которая могла бы разделять области с разным потенциалом.
Структура канала NavAb объясняет, как устроен потенциал-чувствительный домен с его «обоймой» положительно заряженных аминокислотных остатков, пронизывающих всю мембрану и способных под влиянием электрического поля двигаться «вверх-вниз», подобно поршню. Интересно также строение селективного фильтра, избирательно пропускающего ионы натрия, но непроницаемого для калия, — хотя он и существенно, судя по всему, отличается от селективного механизма ПЧНК животных. Однако самым интересным, по-видимому, стали «бреши» в стенках поры, открывающие доступ в ее внутренний резервуар прямо из толщи мембраны (рис. 2). По-видимому, именно эти «бреши», отсутствующие в K+-канале, являются причиной чрезвычайно высокой чувствительности ПЧНК к местным анестетикам, селективно блокирующим пору канала, — возможно, проникая внутрь нее именно из среды липидов мембраны (многие из этих анестетиков достаточно для этого гидрофобны) [8].
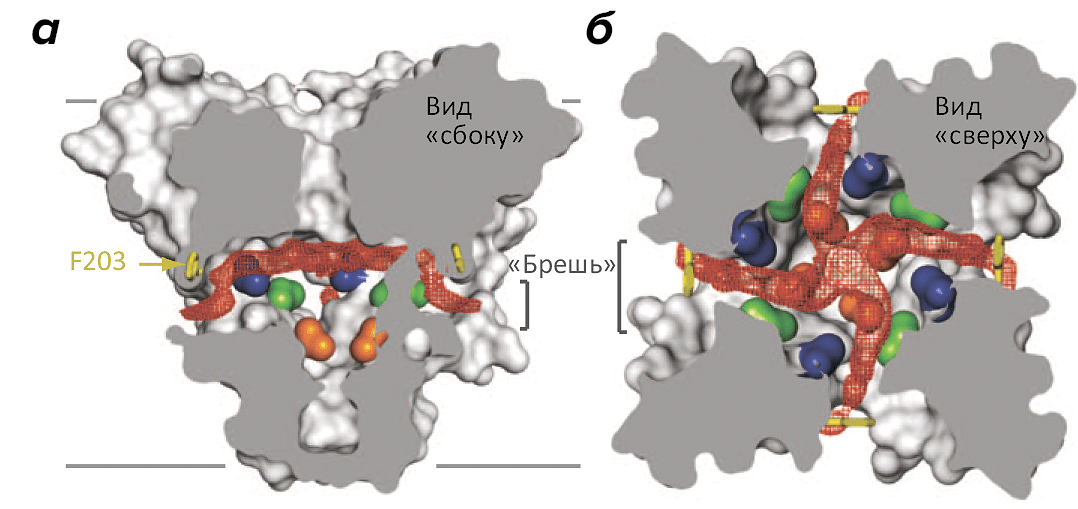
Рисунок 2. «Бреши» в боковых поверхностях натриевого канала NavAb. Бактериальный натриевый канал образован четырьмя идентичными мономерами, «сплетенными» между собой наподобие лепестков диафрагмы (поровый домен одного мономера тесно взаимодействует с потенциал-чувствительным доменом соседнего мономера). а — Боковое сечение канала, на котором видны «бреши», открывающие доступ из гидрофобной среды мембраны во внутренний резервуар поры (пустое пространство показано красным контуром). Границы мембраны показаны серыми линиями. б — Сечение в виде «сверху» показывает размер внутреннего резервуара поры NavAb в закрытом состоянии.
«Учитывая такое интересное строение натриевых каналов, открывается широкий простор для дизайна новых лекарственных веществ, действующих на эти каналы, — подытоживает Каттеролл. — Ученые надеются разработать новые лекарства, действующие на натриевые каналы „изнутри“. В частности, очень хотелось бы увидеть новые анестетики без побочных эффектов, а также лекарства, которые помогли бы против эпилепсии и расстройства сердечного ритма, приводящего иногда к внезапной сердечной смерти» [2]. Но это, конечно, не у бактерий — а значит, еще предстоит большая работа по выяснению того, как устроены натриевые каналы у животных и в особенности — у млекопитающих.
Написано с использованием материалов Nature News [9].
Литература
- Jian Payandeh, Todd Scheuer, Ning Zheng, William A. Catterall. (2011). The crystal structure of a voltage-gated sodium channel. Nature. 475, 353-358;
- Atomic structure discovered for a sodium channel that generates electrical signals in living cells. (2011). ScienceDaily;
- F Bezanilla, E Stefani. (1994). Voltage-Dependent Gating of Ionic Channels. Annu. Rev. Biophys. Biomol. Struct.. 23, 819-846;
- William A. Carterall. (2008). Molecular Mechanisms of Gating and Drug Block of Sodium Channels. Sodium Channels and Neuronal Hyperexcitability. 206-225;
- B. Hirschberg. (1995). Transfer of twelve charges is needed to open skeletal muscle Na+ channels. The Journal of General Physiology. 106, 1053-1068;
- S. B. Long. (2005). Voltage Sensor of Kv1.2: Structural Basis of Electromechanical Coupling. Science. 309, 903-908;
- Stephen B. Long, Xiao Tao, Ernest B. Campbell, Roderick MacKinnon. (2007). Atomic structure of a voltage-dependent K+ channel in a lipid membrane-like environment. Nature. 450, 376-382;
- H. Fozzard, P. Lee, G. Lipkind. (2005). Mechanism of Local Anesthetic Drug Action on Voltage-Gated Sodium Channels. CPD. 11, 2671-2686;
- Richard Horn. (2011). Peering into the spark of life. Nature. 475, 305-306.