Ослепительные хламидии: история почти забытой болезни
28 ноября 2024
Ослепительные хламидии: история почти забытой болезни
- 1619
- 0
- 4
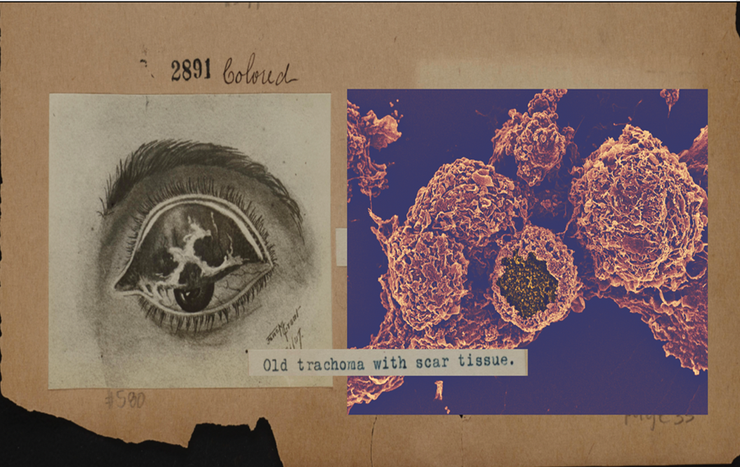
Слева — пораженный трахомой глаз человека на стадии рубцевания века, иллюстрация 1907 года, Университет Кентукки, США; справа — сканирующая электронная микроскопия бактерий Chlamydia trachomatis.
Рисунок в полном размере.
коллаж автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В современном мире хламидии ассоциируются у большинства людей с крайне неприятным заболеванием мочеполовой системы — хламидиозом. А ведь 60 лет назад их знали не иначе как ослепляющих микробов, которые провоцировали «египетскую офтальмию», гранулезный конъюнктивит, болезнь бедных или, попросту говоря, — трахому. Болезнь величали десятками имен на протяжении веков, но суть оставалась единой: она поражала миллионы людей по всему миру. Вступив в неравную схватку с невидимым врагом, человечество лишь в середине ХХ века смогло сорвать маску с ослепляющих убийц. Несмотря на успехи в поиске лекарств и существующих подходов к лечению, Всемирная организация здравоохранения по-прежнему включает трахому в список опасных тропических болезней человечества. О том, как люди столетиями боролись с трахомой, при чем тут хламидии и почему до сих пор битва с болезнью не окончена, читайте в этой статье.
Конкурс «Био/Мол/Текст»-2024/2025
 Эта работа заняла второе место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.
Эта работа заняла второе место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
С чего все начиналось
«Слепота — несчастье, перед которым смерть — ничто»
Шиллер
Особое место среди многочисленных болезней, с которыми сталкивалось на протяжении веков человечество, занимали патологии, приводившие к безвозвратной потере зрения. Ведь, лишившись зрения, человек терял и способность к нормальному существованию. Среди таких коварных болезней — трахома (от греческого τραχύς — шероховатый), которая в иные столетия провоцировала пандемии слепоты. Даже сегодня трахома представляет серьезную проблему для общественного здравоохранения по меньшей мере 42 стран в мире, и ежегодно около 1,3 миллионов человек теряют из-за неё зрение. Но спроси Вы, дорогой читатель, жителей развитых регионов: «Что такое трахома?», навряд ли получите ответ. Так было и со мной, когда в Национальном музее Республики Карелия наткнулась на небольшой стенд, посвященный русскому офтальмологу Илье Александровичу Шехману и его неравной борьбе с подавлением эпидемий слепоты в Поволжье. А ведь каких-то 100 лет назад трахома ослепляла по меньшей мере миллионы людей по всему земному шару. Каким же образом человечество почти искоренило из памяти это заболевание?
Трахома — болезнь с длинной историей, насчитывающей по меньшей мере не одно тысячелетие. Обнаруженные австралийскими археологами повреждения на останках черепов древних людей эпохи ледникового периода (приблизительно 10 тысяч лет до н.э.) свидетельствуют о хронических глазных инфекциях, в том числе о трахоме [1]. А данные генетических исследований позволяют утверждать, что таинственный возбудитель заболевания появился у первых млекопитающих аж 100 миллионов лет назад [2]! Получается, что трахома преследовала человечество всю «сознательную» жизнь. Но не будем раскрывать карты раньше времени.
Первые упоминания о трахоме, дошедшие до наших дней, датируются примерно 2700 годом до н.э. в Китае, а также 2000 г. до н.э. в Шумере и 1500 г. до н.э. в Древнем Египте (рис. 1) [2].

Рисунок 1. Папирус Эрбеса, в котором содержатся упоминания о трахоме и способах ее лечения, 1500 г. до н.э.
Однако откуда возникла и как именно распространилась трахома в этих местах, сложно сказать. При отсутствии средств лечения, санитарных норм и гигиены эта коварная болезнь становилась невидимым спутником многих народов. Ученые до сих пор ведут спор о том, какие земли стали первыми свидетелями эпидемий невидимого убийцы: междуречье Янцзы и Хуанхэ в Китае или речная система Тигр и Евфрат в Месопотамии. Трахома встречалась и в других крупных поселениях, например, в низовьях Нила и в долинах рек Ганг и Инд. Вспомним историю: эти районы представляли собой места пересечения крупнейших торговых путей. А значит, становились точкой притяжения не только большого числа торговцев и путешественников, но и трахомы, которая в условиях антисанитарии распространялась в гиперболическом масштабе.
На заре нашей эры великие умы Древней Греции и Древнего Рима тоже столкнулись с трахомой. Яркая вспышка заболевания произошла во время Пелопоннесской войны в 431–414 годах до н.э. в Афинах. Уже тогда люди задумались о причинах возникновения трахомы и путях ее развития. Например, Платон одним из первых выдвинул предположение о заразности заболевания. Аристотель же утверждал, что заразиться трахомой можно, лишь посмотрев на больного человека. А Гиппократ, будучи врачевателем, подробно изучал механизмы развития трахомы (рис. 2). В своем Сборнике Corpus Hippocraticum он сравнивал воспаленные, утолщенные и испещренные гнойными волдырями веки больных с разрезанным напополам спелым инжиром [2].
Он же, кстати, назвал трахому, непонятную в то время человечеству, «офтальмией» (дословно — «болезнь глаз»), что закрепилось за невидимой убийцей на долгие века. Гиппократ писал, что в случае отсутствия лечения заболевание переходило в так называемую фазу «цикатрикса» (формирования рубцов). Даже когда воспаление глазной поверхности спадало, образовавшийся рубец способствовал загибанию века во внутрь, в результате чего ресницы начинали расти в анатомически неправильном направлении и царапали роговицу («трихиаз»). В конечном итоге наступала неминуемая слепота. Для профилактики заболевания Гиппократ советовал «избегать холодных ветров с севера и теплых южных ветров», дабы предупредить развитие трахомы [3]. Для лечения заболевания знаменитый врачеватель предложил хирургическое вмешательство путем рассечения воспаленных век, прижигания раскаленным железом и обработку поврежденных поверхностей медным купоросом. Крайне болезненная терапия, но, увы, на тот момент — единственно возможная.
Между тем, в IV веке до н.э. в Александрии медицинское знание о болезнях глаз — офтальмология — выделилось в отдельную научную специальность. Известный александрийский врач Герофил написал целую книгу о глазных заболеваниях. Встречается трахома и в знаменитых «Трактатах о священных болезнях» Цельса, где он подробно описывал ее симптомы. Позднее Клавдий Гален (129-200 гг.), опираясь на труды Гиппократа, использовал термин «трихиаз» как характеристику острой фазы трахомы (рис. 3). А также описал четыре стадии заболевания: псорофтальмия (зуд), трахома (появление шероховатости), сикоз (рубцевание) и тилоз (трихиаз). Тем самым он опередил время и заложил основу более поздней классификации форм трахомы, разработанной Артуром Фергюсоном МакКалланом и увидевшей свет лишь в 1908 году [4], [5].
В странах Ближнего Востока за период 800–1000 годов по приблизительным оценкам было написано около 60 трудов, посвященных заболеваниям глаз. Трахоме уделялось особое внимание. Известный иранский врач и алхимик Абу Бакр Мухаммад ар-Рази писал: «при воспалении глаз не забудьте вывернуть веки больного, и вы найдете трахому» [3]. Опираясь на труды Гиппократа и Галена, ар-Рази предложил усовершенствованный комплекс хирургических вмешательств для лечения трахомы. Однако и ему не удалось найти чудодейственного средства, которое бы позволило полностью уничтожить невидимого врага.
Египетская сила!

Рисунок 4. «Человек, ослепленный из-за сглаза». Иллюстрация из книги Георга Бартиша Ophthalmodouleia, 1583 г.
В Средние века трахома была занесена в страны Европы. Главной причиной тому стали многочисленные войны и крестовые походы. Болезнь нашла косвенное отражение даже в трудах католической церкви, например, в сказаниях о святом Франциске Ассизском. Побывав в Египте во время пятого крестового похода, он вернулся в родные края с воспалением глаз. Предположительно заразившись трахомой в крайне острой форме. К концу жизни, в 1226 году итальянский монах «потерял зрение из-за слез, пролитых им за грехи мира» [3]. Тогда медики не смогли объяснить причин возникновения болезни и провести какие-либо хирургические операции. Да и неудивительно: ведь это было под строжайшим запретом из-за давления церкви!
В те времена считалось, что ослепляющая болезнь передается из-за влажности, плохой погоды, а иногда путем «дурного сглаза» (рис. 4) [6].
По-настоящему вкусить последствия трахомы, или, как ее в то время называли врачи — «египетского воспаления» («египетской офтальмии»), — человечеству пришлось 200 лет назад, после военных кампаний Наполеона Бонапарта в страны Африки в 1798–1801 годах (рис. 5). В те времена в Египте бушевала трахома: многие путешественники называли страну фараонов «землей слепых» [3]. Антисанитария, скопления большого числа людей в казармах, а также изнеможение солдат и сниженный иммунитет сделали свое дело: в одной только французской армии насчитывалось свыше 3000 заболевших [7].

Рисунок 5. Слева представлен фрагмент карты с обозначением районов, куда выдвинулись войска Наполеона. В верхнем правом углу и снизу — фрагменты из письма Наполеона генералу Луи Шан Антеану Дезе с указаниями отплыть в Египет, 1798 год. В правом нижнем углу — картина «Бонапарт в Египте», Жан-Леон Жером, 1863 г. По центру — фото народного артиста РФ Бориса Клюева в роли Николая Воронина из сериала «Воронины».
В 1801 году в Египте высадились английские войска, на радость ослепляющему убийце. После трех лет военных действий солдат эвакуировали обратно на родину. Одним из лучших примеров, документально иллюстрирующих масштабы эпидемии слепоты, была вспышка трахомы в 1804 году во втором батальоне 52-го полка, расквартированного после военных походов. В течение нескольких месяцев из 700 человек были госпитализированы 636 солдат с диагнозом «офтальмия» (трахома). Дальнейшая картина оказалась весьма печальной: 50 заболевших полностью утратили зрение [8].
На этом история не закончилась. Поистине с наполеоновским размахом трахома начала распространяться по европейским державам. Военные по возвращении домой, зачастую ни о чем не подозревая, «передавали» трахому гражданскому населению. В Италии, по нескромным подсчетам, у 4000 человек диагностировали трахому. В Португалии в 1815 году было зафиксировано 10 тысяч случаев заражения. А в Бельгии насчитывалось свыше 100 тысяч инфицированных! Не обошла трахома стороной и Российскую Империю. В 1817–1818 годах вспыхнула самая настоящая эпидемия трахомы среди русских войск, которые в тот момент оккупировали Францию. Сначала случаи повышенной заболеваемости были зафиксированы среди населения в Царстве Польском, а уже в 1823 году — в Санкт-Петербурге. По приблизительным оценкам, в русской армии заболело около 80 тысяч человек [3]. Постепенно трахома перерождалась в настоящую пандемию!
В поисках способов и средств лечения трахомы врачи предлагали порой ужасающие процедуры. Например, британский врач Джон Ветч предлагал делать венесекцию (иначе — кровопускание), что, по его мнению, должно было снизить степень воспаления век [8]. Его коллега Уильям Адамс, памятуя Гиппократа и Галена, пытался лечить военных прусской армии путем хирургического вмешательства (удаления крупных гнойных образований с внутренней поверхности века) и примочек растворами медного купороса. Успеха такое лечение не принесло! Многие врачи применяли мази на основе ацетата свинца или делали прижигания специальными карандашами из нитрата серебра. А для облегчения болей и снятия зуда использовали препараты опиума (например, спиртовую опиумную настойку — ландаум), средства из ртути и другие. Встречались случаи, когда врачи наносили пациентам мази из белладонны (это ядовитое растение, содержащее сильные психотропные вещества, в числе которых — алкалоид атропин).
Но для превентивного удара по египетской офтальмии одними операциями было не обойтись! После многочисленных споров ученых и врачей стало очевидно, что трахома — заразное заболевание. Многими исследованиями того времени было показано, что трахома может передаваться контактным путем, когда выделения из глаз заболевшего попадали на глазную поверхность здорового человека. И самое катастрофическое — болезнь могла начать прогрессировать в урогенитальном тракте при занесении туда выделений из больных глаз. Теряясь в догадках, врачи постарались подключить логику, да что и оставалось делать в условиях эпидемии! Они отмечали, что вспышки заболевания возникали в тех местах, где наблюдалась скученность людей и отсутствовали санитарные нормы. Этим вполне очевидно объяснялся стремительный рост числа случаев заражения в казармах. Чтобы сдержать распространение трахомы среди военных, врачи предложили проводить ежедневные осмотры, изолировать пациентов с диагностированной болезнью и запретить общее использование средств гигиены: полотенец, носовых платков и т.п. Такой подход дал положительные результаты: количество зараженных среди солдат постепенно снижалось.
Рождение офтальмологии
Тем не менее, трахома продолжала бушевать. Все осложнялось тем, что заболевание постепенно перекочевало в ряды простых горожан. Хуже того, в большей степени от «египетской офтальмии» страдали дети! Но и здесь заболевание оказалось в роли троянского коня: несмотря на существенный урон здоровью населения, трахома стала отправной точкой для развития офтальмологии как самостоятельной области медицины. Для срочного предотвращения эпидемии во многих государствах Европы были организованы специальные медицинские учреждения. Еще в 1805 году в Лондоне открылись Королевский лазарет для лечения глазных заболеваний и Диспансер для лечения болезней глаза и уха — первые учреждения, открывшие миру специфику офтальмологии. Все говорило о том, что пришла пора посвятить глазным болезням отдельное место в медицине.
Несмотря на эпидемиологическую ситуацию, до середины XIX века споры о необходимости развития навыков и компетенций врачей, занимавшихся только глазными заболеваниями, не утихали. В защиту офтальмологов выступил ирландский врач Уильям Уайлд, отец знаменитого писателя Оскара Уайлда, который доказал необходимость выделения глазных заболеваний в самостоятельную категорию. Так появилась новая врачебная специализация. А с изобретением офтальмоскопа (специального прибора для изучения глазного яблока) немецким врачом и физиком Германом фон Гельмгольцем в 1851 году офтальмология лишь упрочила свои позиции.
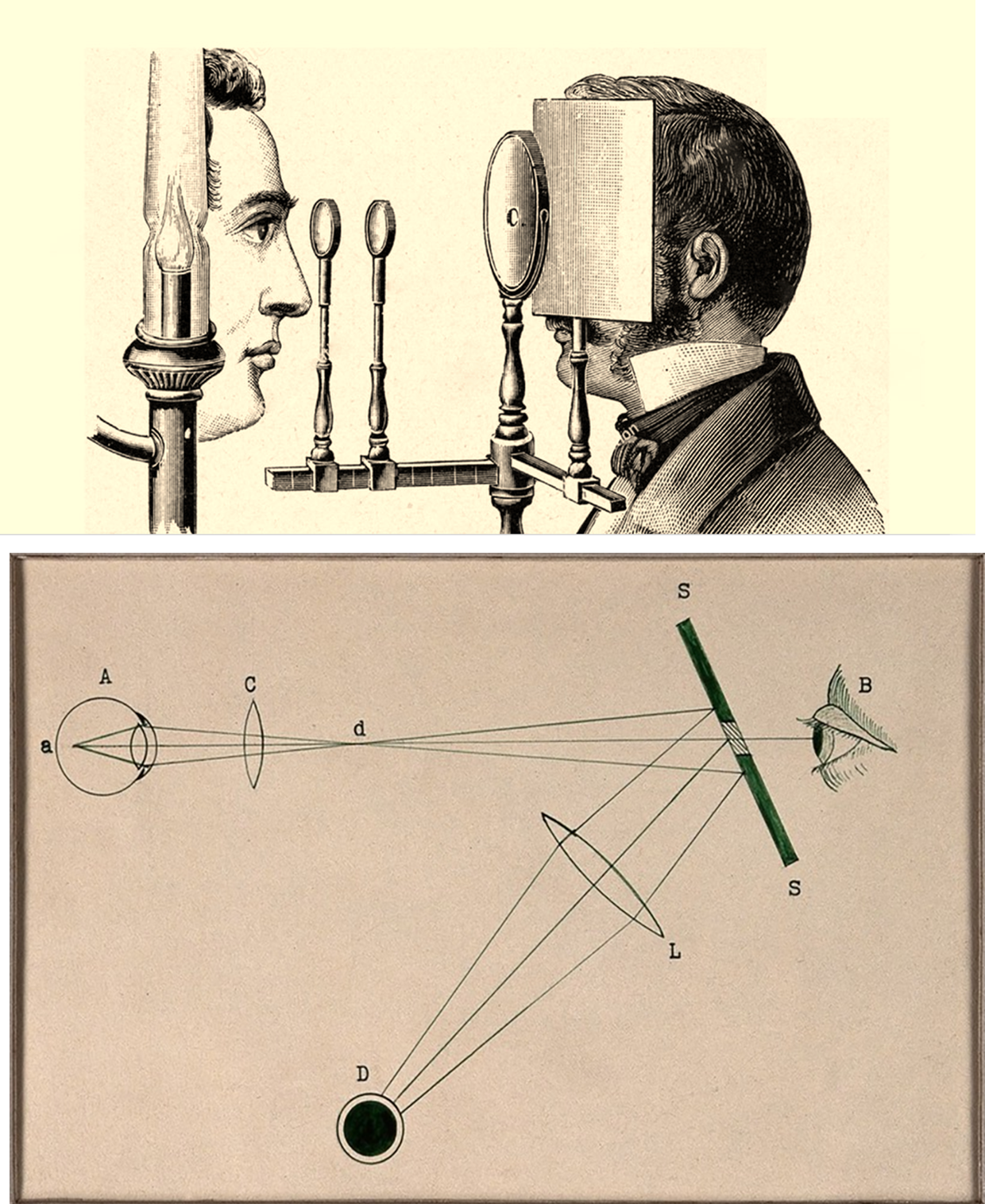
Рисунок 6. Офтальмоскоп Гельмгольца. Сверху: внешний вид устройства, снизу: принцип работы.
Кроме того, окончательное мнение о заразности трахомы укрепилось в этот же период благодаря открытиям Луи Пастера и Роберта Коха, которые отвергли теорию миазмов (заразных начал) и обосновали микробную теорию болезней. Это проливало свет на специфику распространения трахомы. Но, увы, не позволяло достоверно утверждать, какой именно микроорганизм спрятался под маской коварного ослепителя.
Социальное бедствие
Поэтому еще долгие годы, несмотря на усилия врачей, трахома продолжала свирепствовать. Если в XIX веке она распространялась в основном за счет войн, то в начале следующего столетия причиной стихийных вспышек заболевания стала миграция населения. В США в 1902 году был принят закон, по которому каждая пароходная компания могла быть оштрафована на 100 долларов за пассажира с трахомой. Чтобы предотвратить попадание на борт судна «нежелательных» пассажиров, компании начали устраивать массовые проверки на наличие трахомы перед посадкой. Для осмотра использовались специальные крючки для застегивания пуговиц, которые позволяли приподнять верхнее веко и обнаружить признаки возможной инфекции (рис. 7).

Рисунок 7. Представители пароходной компании осматривают пассажиров на предмет трахомы.
По закону 1905 года, каждого иммигранта, въезжающего в США через остров Эллис (тот самый, который впоследствии опишет Э.М. Ремарк в своем романе «Земля обетованная» как «самый гуманный лагерь»), проверяли на предмет трахомы (рис. 8А).
И если человек оказывался зараженным, его либо отправляли назад, либо оставляли на лечение в больнице на острове. Для обследования мигрантов была также создана Служба общественного здравоохранения. В период с 1897 по 1924 год было обследовано порядка 21 миллиона приезжих, из которых почти 34 тысячи человек имели острую форму болезни. Для борьбы с трахомой Служба общественного здравоохранения распространяла специальные информационные листовки, в которых говорилось о правилах гигиены и профилактики опасного заболевания (рис. 8Б).
На регулярной основе эпидемии трахомы вспыхивали в индейских резервациях. В 1912 году в Оклахоме было обнаружено около 69% заболевших трахомой. Особенно болезнь бушевала среди детей: в одной из школ-интернатов 92% учащихся подверглись заражению [9]. Однако у любой медали есть две стороны. Несмотря на заразность, трахома способствовала развитию системы здравоохранения. Для сдерживания эпидемии правительство США создало специальную медицинскую службу по оказанию помощи индейскому населению, что стало основой для постоянного медицинского обслуживания в резервациях (рис. 9).
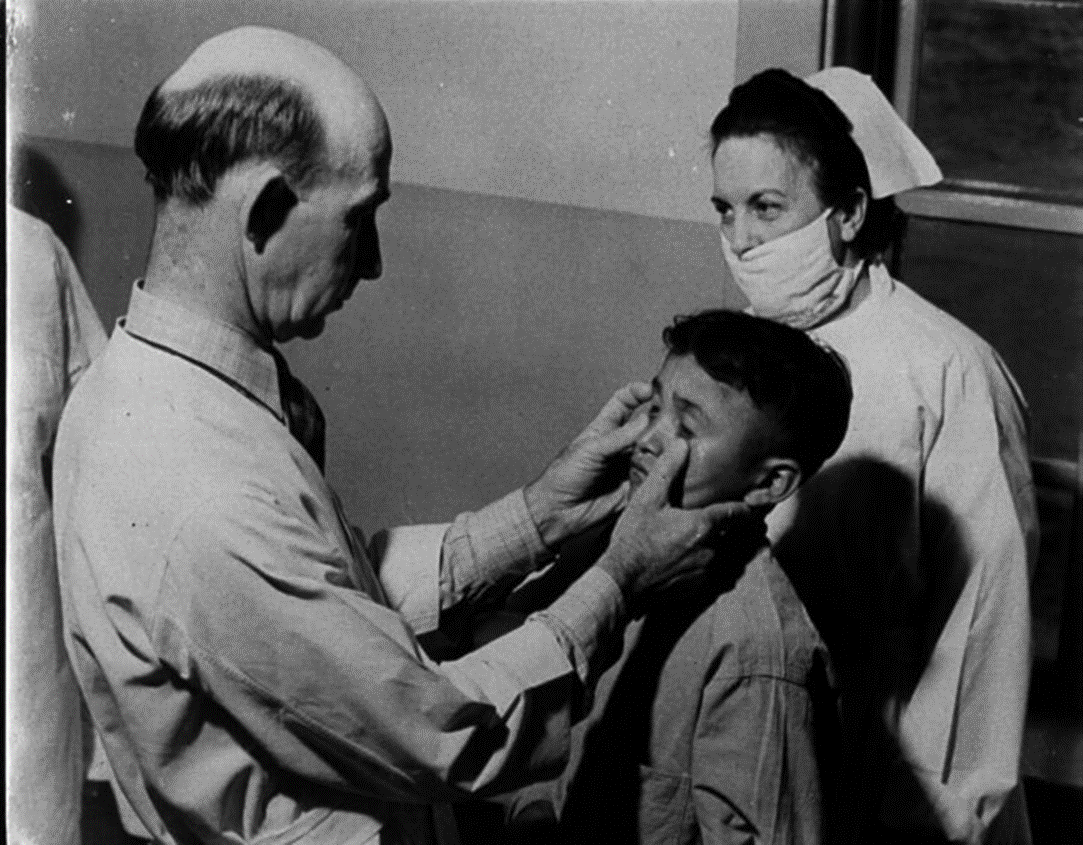
Рисунок 9. Доктор В. П. Уиттед осматривает глаза пациента с трахомой, Форт Дефайанс, Аризона, 1941 год.

Рисунок 10. Портрет Ильи Александровича Шехмана 1896 года.
из архива Федерального государственного бюджетного учреждения культуры и искусства «Военно-медицинского музея» Министерства обороны Российской Федерации (Военно-медицинского музея)
Тем временем в Российской империи в конце XIX века эпидемия трахомы с неистовой силой вспыхнула в Поволжье. Интересно, что ученые по-прежнему не могут ответить на вопрос, каким именно образом трахома оказалась в этом районе. Предположительно, заболевание дремало без малого несколько сотен лет, со времен нашествия татаро-монгольских войск. И в условиях низкого социального положения жителей (крайней бедности, а также ограниченного культурного просвещения), антисанитарии и нехватки медицинского обеспечения трахома пробудилась и волной прокатилась среди населения. Сначала считалось, что болезнь может передаваться воздушно-капельным путем, или же вовсе быть причиной злого наговора. Этот миф всеми силами старался развеять русский военный врач Илья Александрович Шехман, отличник Военно-медицинской академии, который отправился в Поволжье в 1900 году (рис. 10). В неравной схватке с заболеванием ему удалось подавить распространение трахомы все теми же способами: «Гигиена и еще раз — гигиена»! За вклад в борьбу с коварной болезнью Шехман был удостоен Бухарского ордена золотой звезды 3-й степени. Вернувшись в родной Петрозаводск (Карелия), он участвовал в открытии офтальмологической больницы — первой профильной медицинской организации на Северо-Западе Российской Империи.
Тем не менее, через несколько лет трахома вновь нагрянула на регион Поволжья. «Здесь она (трахома) растет, как в сказке, не по дням, а по часам и грозит затопить весь край и ослепить его» [10]. Сначала специалисты полагали, что болезнь поражает определенные народности из-за «предрасположенности». Статистика заболевания была удручающей: если среди русских крестьян заболевало приблизительно 18%, то среди татар — 44%, а среди чувашей — около 75% населения. Однако не будем забывать о культурных традициях: многие народности, например, татары, использовали для умывания одно полотенце на всю семью. Помимо этого, болезнь передавалась через грязные руки, предметы быта и личной гигиены. Неудивительно, что трахома распространялась в геометрической прогрессии.
Цифры были ужасающими! В 1901 году в Уфимской губернии насчитывалось 1297 человек, переболевших трахомой, из которых 452 пациента полностью утратили зрение. Двумя годами позже — официально зарегистрировано порядка 300 тысяч слепых человек, из числа которых 180 тысяч потеряли зрение из-за отсутствия медицинского обеспечения для лечения трахомы [11]. В августе 1901 года была создана Уфимская глазная лечебница Уфимского отделения Попечительства императрицы Марии Александровны о слепых, где врачи пытались лечить в том числе и трахому. Болезнь стала серьезным социальным бедствием России в первой половине ХХ столетия. На медицинской гигиенической выставке 1913 года было отмечено, что трахома, наряду с сифилисом и туберкулезом, была самым распространенным в России заболеванием.
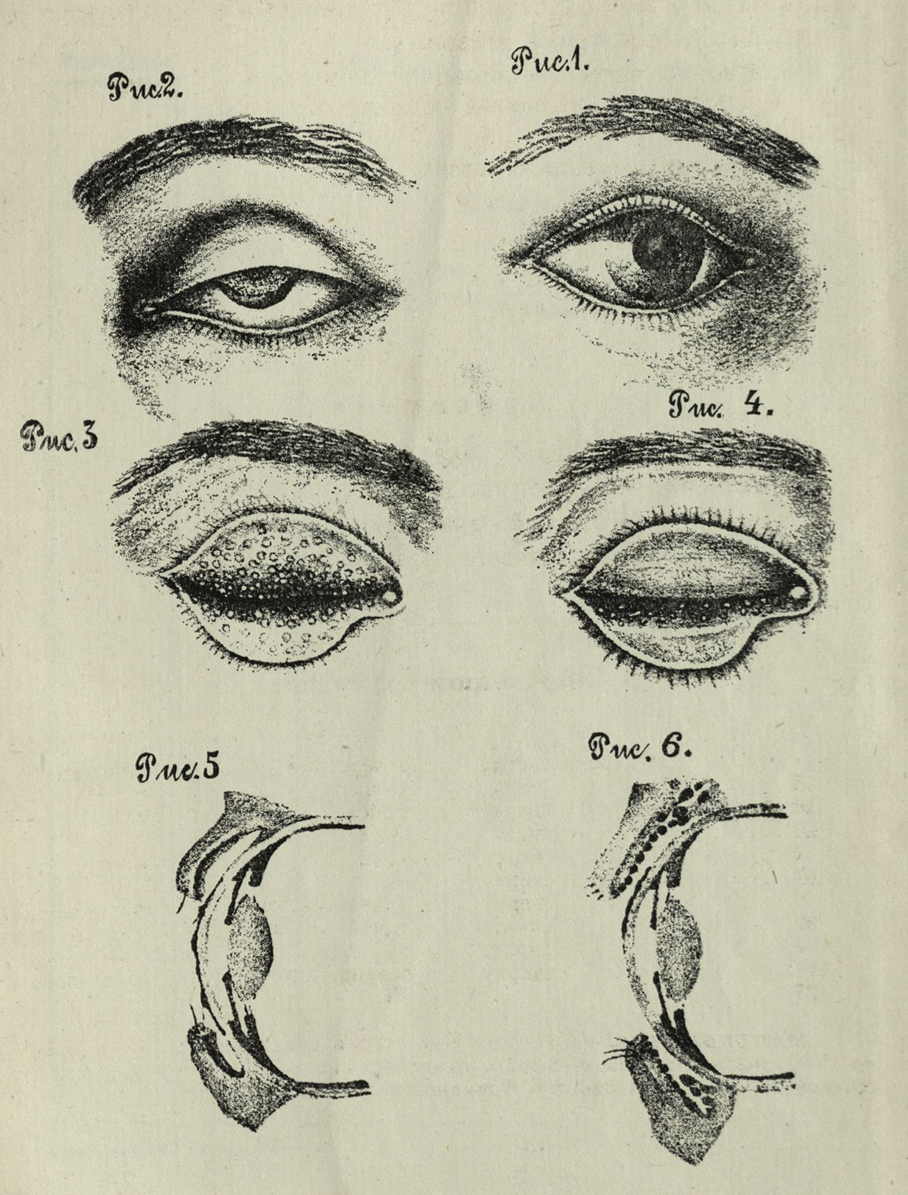
Рисунок 11. Фрагмент из книги доктора И.К. Лукьянова «Трахома в Волжко-Камском крае. Очерки и материалы», 1925 год. Приведены рисунки нормального глаза без патологий (рис. 1), стадий трахомы по мере ее развития (рис.2–4), а также «заворота век» (рис. 5) и «выворота век» (рис. 6).
В период политических потрясений, захлестнувших Россию, трахома достигла апогея — по нескромным подсчетам, заболело около миллиона человек. Новая власть направила все силы на борьбу с ослепляющим врагом. Политика была крайне проста: профилактика, лечение, информирование населения и подготовка профильных специалистов. В 1922 в Казани было создано первое на тот момент специализированное учреждение для лечения болезни — медицинский трахоматозный институт. Главой института стал выдающийся ученый-офтальмолог Василий Васильевич Чирковский, который заложил основу для развития современной офтальмологии в России. Тогда же он предложил организовать «трахоматозные», или «глазные», отряды, которые регулярно осуществляли медицинские осмотры среди населения. Систематизировались данные по описанию симптомов болезни, составлялись специализированные медицинские пособия для врачей и медсестер (рис. 11).
Дополнительно проводились мероприятия просветительского характера: людям рассказывали о мерах профилактики и необходимости соблюдения гигиены, раздавали специальные листовки (рис. 12).

Рисунок 12. Информационные листовки для советских граждан в период активной борьбы с трахомой, 1926 год.
В 1926 году открылся Башкирский трахоматозный научно-исследовательский институт, а через 10 лет начала свою работу кафедра глазных болезней Башкирского государственного медицинского института. В 1929 году состоялся первый офтальмологический съезд, где были разработаны рекомендации для лечения опасной болезни (рис. 13). А в 1927 году был принят закон, разрешавший «глазным» отрядам совершать осмотры всех, кто не только заболевает, но и просто подвержен риску заражения трахомой.

Рисунок 13. Первое областное совещание по борьбе с трахомой, 1929 год.
По инициативе В.В Чирковского, в 1933 году был создан Чувашский трахоматозный институт. Повсеместно открывались специализированные глазные больницы, врачебные глазные и сестринские трахоматозные пункты, проводились регулярные съезды специалистов для выработки стратегии борьбы. И трахома постепенно начала отступать. Однако полной капитуляции болезни помешала Великая Отечественная война. А также нехватка данных о том, какой микроб скрывался за маской трахомы и каким лекарством можно окончательно сразить его наповал.
Несмотря на совершенствование системы здравоохранения, трахома продолжала преследовать население, пусть и в меньшей степени. Вопрос оставался открытым: какова природа возбудителя? Врачи по всему миру полагали, что трахому вызывает «неопределенного рода „вирус“ — яд особенный, действующий лишь на конъюнктиву глаза» [10]. Тогда как же бороться с невидимым врагом? По мере накопления научных знаний человечество делало осторожную попытку вступления в завершающую стадию противостояния опасной болезни.
Очная ставка с невидимым врагом
Наступил 1907 год. Научная экспедиция, в состав которой входили немецкий ученый-бактериолог Людвиг Гальберштедтер и польский естествоиспытатель Станислаус фон Провачек, отправилась в Джакарту, что на острове Ява, для изучения сифилиса [3]. В условиях крайней бедности и антисанитарии у жителей острова обнаруживался букет различных заболеваний, среди которых, в том числе, процветала трахома. Недолго думая, ученые решили проверить, насколько заразна эта болезнь. Для этого они помещали гнойные выделения с глаз больных трахомой пациентов на глазную поверхность здоровых орангутангов. Очевидно, что по прошествии некоторого времени все животные заболели. Ученые обнаружили, что клетки конъюнктивы (слизистой оболочки) орангутанов содержали своеобразные цитоплазматические включения с множеством мельчайших частиц. Тот самый «спелый инжир», который в глубкой древности описывал Гиппократ. Для идентификации непонятных включений исследователи использовали специфический способ окрашивания, предложенный ученым Густавом Гимзе, с помощью смеси анилиновых красителей (метиленового синего, азура и эозина). В результате Гальберштедтер и Провачек увидели в окуляр микроскопа включения синего цвета, которые окутывали, как мантия, небольшие красные тельца (рис. 14).
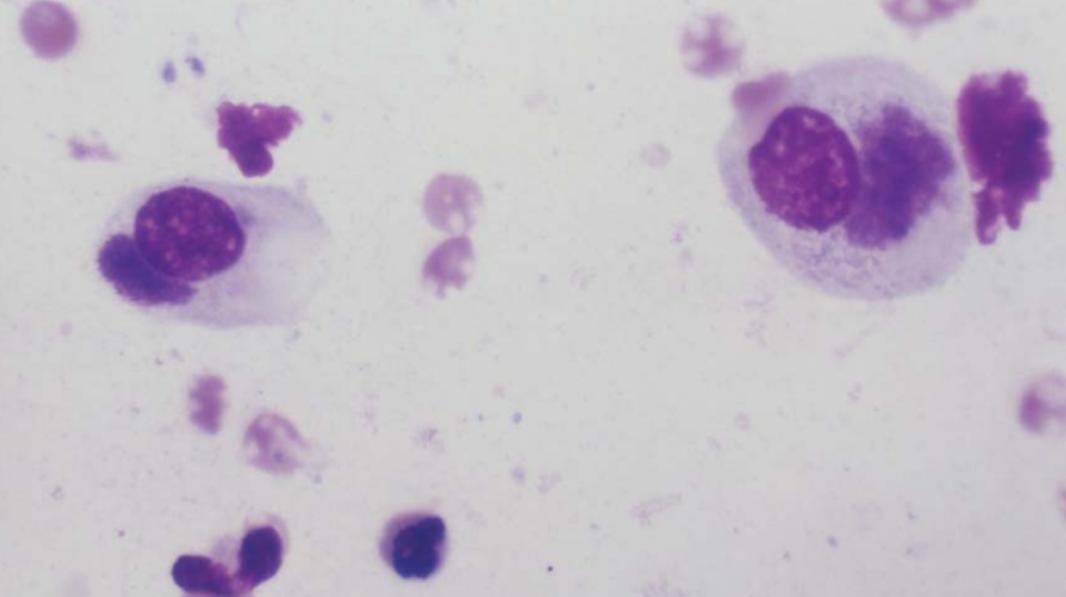
Рисунок 14. Окрашивание хламидий по Гимзе.
Позже они назвали их элементарными тельцами, что закрепилось в микробиологии и используется по сей день. А обнаруженные включения получили имя Chlamidozoa, или хламидии (от греч. chlamidiozoon — плащ, мантия, оболочка), что впоследствии стало нарицательным. Природу патогена оно, к сожалению, не объясняло. Для вирусных частиц объекты были маловаты, а для бактерий — слишком странными и нехарактерными. Ведь классические способы культивирования хламидий на питательной среде не помогали их обнаружить. То есть они упорно отказывались расти в таких условиях. В результате вопросов возникало больше, чем ответов.
Эксперимент Гальберштедтера и Провачека позднее повторяли многие исследователи. Но даже воспроизводимость результатов вызывала споры: краситель не во всех случаях окрашивал элементарные тельца, что затрудняло диагностику трахомы. Помимо того, аналогичные включения обнаруживались при изучении других заболеваний: глазных инфекций у новорожденных, уретритов (заболеваниях мочеполовой системы), что не вязалось с концепцией заражения трахомой. Но вместе с тем появились основания полагать, что все эти заболевания вызывают схожие патогенные микроорганизмы.
Еще долгие годы хламидий относили к вирусным частицам. Прорыв в научном знании произошел лишь в 1958 году. Китайские исследователи и врачи во главе с Таном Фейфанем впервые смогли вырастить и выделить штаммы хламидий вне человеческого организма — в культуре клеток куриных эмбрионов (рис. 15). Для этого ученые поместили клетки хламидий в желток, добавив необходимые антибиотики (пенициллин и стрептомицин) для защиты образцов от стороннего воздействия других бактерий и грибов. Чудо свершилось! Таинственные возбудители трахомы были рассекречены и культивировались в подобранных условиях. Теперь открывались возможности для полноценного изучения бактерий в лаборатории.

Рисунок 16. На фото: «Проверим результаты нашего опыта», — говорит А. А. Шаткин лаборантке В. Р. Мартыновой. Фото В. Кузьмина.
В тот же период в СССР борьба с трахомой набирала новые обороты: делом занялся Институт вирусологии. По-прежнему оставался открытым вопрос: кто такие хламидии? Для выявления природы возбудителя лабораторные мыши не подходили, картина заболевания несколько отличалась от протекания трахомы у людей. Требовались клинические испытания. На эксперимент по самозаражению решился молодой научный сотрудник Института вирусологии академии наук СССР Анатолий Альбертович Шаткин (рис. 16). Втайне от коллег Шаткин ввел себе в левый глаз выделения из конъюнктивы женщины с острой фазой трахомы. В течение 26 дней ученый подробно описывал симптомы заболевания. И приступил к лечению лишь тогда, когда обнаружил ухудшение зрения. Кроме того, он смог получить первый в стране экспериментальный штамм возбудителя трахомы, подтвердив результаты китайских исследователей. Его опыт был крайне рискованным, ведь ученые на тот момент не знали наверняка, каким лекарством можно гарантированно вылечить трахому. В результате испытаний Шаткин доказал, что трахома — не вирусное заболевание, а бактериальное.
Чуть позже ученый написал книгу о причинах возникновения и способах лечения трахомы. И тем самым заложил прочную основу для разработки лекарственных средств антибактериального действия.
Благодаря подвигам исследователей человечество получило штаммы хламидий, которые помогли более детально изучить их природу и специфику, разработать методы диагностики и терапии.
«Видишь суслика? — Нет. — А он там есть!»
Примерно такой фразой можно охарактеризовать хламидий, паразитирующих в эпителии слизистой оболочки глаз! И неудивительно. Для выживания хламидии придумали весьма хитрые способы маскировки. Последние достижения в области клеточной и молекулярной биологии значительно расширили представления человечества о бактериях-паразитах и цикле их развития. Возбудителем трахомы являются грамотрицательные бактерии Chlamydia trachomatis. И не просто бактерии, а облигатные внутриклеточные паразиты человека. Как оказалось, хламидии не способны к самостоятельному синтезу энергетических молекул аденозинтрифосфата (АТФ) [3]. Другими словами, хламидии — энергетические паразиты клеток человека, не способные самостоятельно расти на искусственной питательной среде. Вот почему на заре обнаружения хламидий ученым не удавалось культивировать их классическими способами!
В основу современной классификации представителей C. trachomatis положено их антигенное строение. В зависимости от того, какой набор антигенов содержат хламидии, их объединяют по результатам анализов сыворотки крови (серологических исследований) в своеобразную группу — серотип (серовар). Такая классификация очень удобна для эпидемиологического изучения заболеваний. На сегодняшний день идентифицируют 18 серотипов хламидий, каждый из которых вызывает определенные болезни (таблица 1). Кстати, особой популярностью в настоящее время пользуются урогенитальные штаммы бактерий, которые провоцируют возникновение и развитие крайне неприятного заболевания — хламидиоза. Этим, в частности, объясняется неутихающий интерес научного сообщества к поиску дополнительной информации о поведении хламидий и для создания инновационных лекарственных средств.
Но вернемся к «глазным» штаммам хламидий! Оказалось, что трахому могут провоцировать серотипы А, В, Ва и С. Однако по данным полногеномного секвенирования хламидий (расшифровки всей последовательности ДНК) удалось выяснить, что принадлежность того или иного серотипа к определенной анатомической нише не является абсолютной. Получается, что хламидии в некотором роде эволюционируют, чтобы быстрее адаптироваться к изменяющимся условиям окружающей среды. Для этого они запускают процессы рекомбинации — перетасовки генетического материала за счет обмена сходными (гомологичными) участками последовательностей ДНК и последующей сборки фрагментов в другом порядке. В результате получаются новые комбинации. Например, рекомбинации в гене ompA, кодирующим белок наружной мембраны хламидий, приводят к обмену генетическим материалом как в пределах одного серовара, так и между конъюктивальными и урогенитальными штаммами [12]. Поэтому не исключена ситуация, когда глазной серотип, попадая, например, в мочеполовую систему, может со спокойной совестью начать там паразитировать. И наоборот!
| Серовары | Заболевания |
|---|---|
| А, В, Ва и С | Трахома |
| D, E, F, G, H, I, J, K | Паратрахома (аналогичное трахоме заболевание — инфекционный конъюнктивит, вызванный урогенитальными штаммами хламидий), урогенитальный хламидиоз (в настоящее время крайне распространенное заболевание, связанное с бессимптомными воспалительными процессами мочеполовой системы, которые впоследствии переходят в хроническую форму), пневмония новорожденных (воспалительное поражение дыхательных путей у новорожденных) |
| L1, L2, L3 | Лимфогранулема (венерическое заболевание, сопровождающиеся бессимптомным поражением кожных покровов с увеличением лимфоузлов в области паха или таза) |
Все представители C. trachomatis начинают атаку организма по общему пути. Назло всему миру, хламидии имеют весьма сложных двухфазный цикл развития (рис. 17).
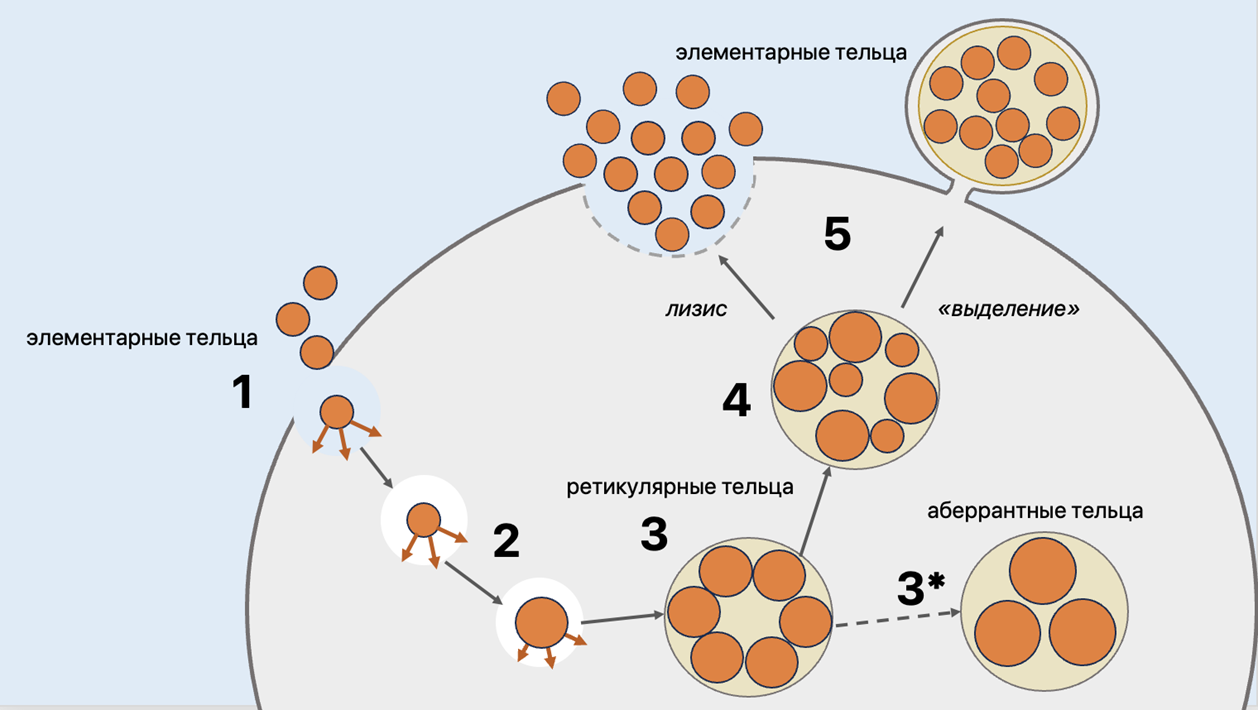
Рисунок 17. Жизненный цикл хламиди: 1 — захват элементарных телец клеткой-хозяина (эндоцитоз) и формирование включения; 2 — трансформация элементарных телец в ретикулярные; 3 — размножение; 3* — переход ретикулярных телец в аберрантную (латентную) форму существования в случае персистенции (длительного выживания в организме хозяина); 4 — частичный переход ретикулярных телец в элементарные; 5 — выход элементарных телец из клетки-хозяина путем лизиса (разрушения клетки) или «выделения» включения, содержащего элементарные тельца.
В подробностях жизненный цикл описан далее в тексте.
Ведь нужно же как-то обмануть систему! Сначала бактерия перемещается между клетками хозяина в виде инфицированной формы (элементарного тела, диаметром не более 0,3 мкм). С помощью захвата элементарного тельца клетками-хозяина (рецептор-опосредованного эндоцитоза) происходит попадание хламидии в специальные вместилища — включения, которые формируются из мембраны клетки хозяина и хламидийных белков. Как только элементарное тело попадает в это вместилище, где защищено от внешних негативных воздействий и укрыто от пристального взора иммунных клеток, оно реорганизуется в метаболически активную форму — ретикулярное тело. Размеры такого тела увеличиваются примерно в четыре раза (до 1,2 мкм). И все для того, чтобы легко и непринужденно приступить к репликации (размножению). По прошествии 72 часов количество ретикулярных телец достигает нескольких сотен и даже тысяч [3], [12]. Размножение в геометрической прогрессии! Затем ретикулярные тельца дифференцируются в элементарные, чтобы после выйти в межклеточное пространство и приступить к заражению еще большего числа клеток и тканей (рис. 18) [15].
Интересно, что в случае нехватки питательных веществ ретикулярные тельца впадают в своеобразную спячку (фазу персистенции), когда репликация и многие метаболические процессы приостанавливаются. Такое латентное состояние иначе называется аберрантным тельцем. В этой форме хламидии начинают вырабатывать стресс-белки (белки теплового шока, например, Hsp60), которые позволяют им противостоять воздействиям извне, в особенности — действию антибиотиков.
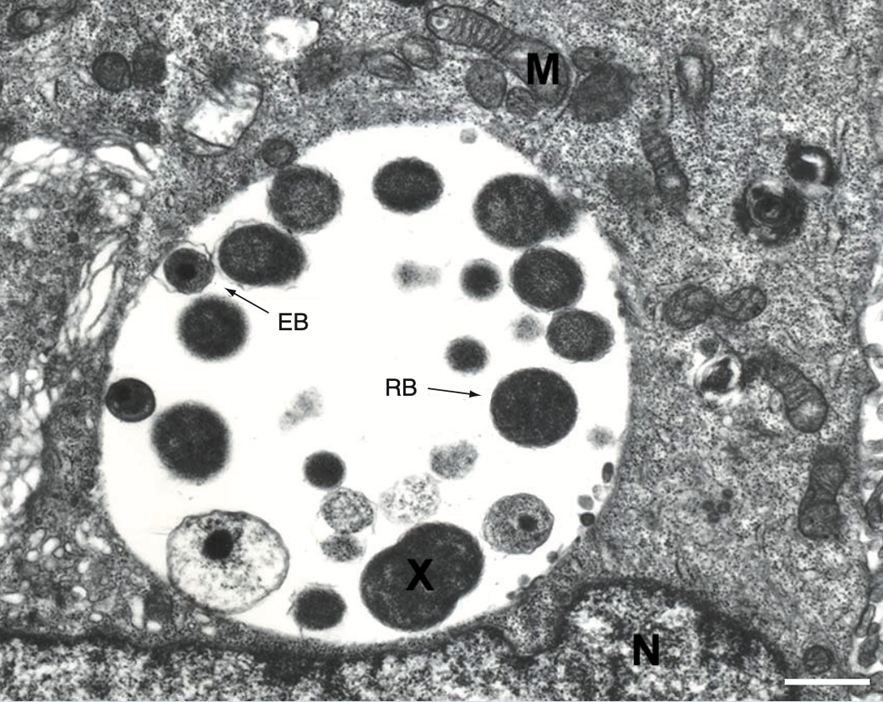
Рисунок 18. Микрофотография эпителиальной клетки человека, инфицированной хламидиями. Цитоплазма клетки содержит включение, в котором присутствуют хламидии на поздней стадии своего развития. Можно различить ЕВ — элементарное тельце; RB — ретикулярное тельце; М — митохондрии. Также четко идентифицируется деление ретикулярного тельца (обозначено Х) и формирование нового ЕВ (обозначено стрелкой), в котором наблюдается конденсация хромосомной ДНК.
При этом хламидиям удается ускользнуть от сурового взора иммунных клеток организма за счет целого комплекса механизмов. В первую очередь, благодаря своему строению. Известно, что элементарные тельца хламидий имеют достаточно жесткую клеточную стенку, которая помогает им выживать в неблагоприятных условиях. Там содержится уже упомянутый белок наружной мембраны MOMP (Major Outer Membrane Protein), занимающий до 60% массы клеточной стенки [3], [12]. Его основная функция заключается в обеспечении «прилипания» к клетке хозяина. В отличие от других грамотрицательных бактерий, хламидии поддерживают целостность своей клеточной стенки не за счет пептидогликана, как это делает большинство бактерий, а с помощью сети дисульфидных связей белков внешней мембраны. Казалось бы, жесткая клеточная стенка делает хламидии в форме элементарных телец метаболически неактивными. Но благодаря именно этим связям образуется слишком прочный каркас, который позволяет им не бояться антибиотиков. Помимо этого, липополисахариды клеточной стенки элементарных телец, состав которых значимо отличается от «бактериального стандарта», менее иммуногенны.
Чтобы гарантированно прилипнуть к клеткам-хозяина и выжить внутри них, хламидии в ходе эволюции еще 700 миллионов лет назад приобрели специальный аппарат — систему секреции III типа [16]. Она представляет собой иглоподобную структуру, которая «собирается» по принципу детской пирамидки снизу вверх: от специальных колец в основании и внешних колец в мембране бактерии до белков-мономеров, накапливающихся друг на друга и формирующих иглу во внеклеточном пространстве (рис. 19). Сама игла представляет собой крайне маленькую структуру, порядка 60–80 нм длиной. И в этом ее преимущество: благодаря малым размерам она способна эффективно доставлять вредоносные белки из клетки хламидии в цитоплазму клетки-хозяина, независимо от внеклеточных бактериальных структур (например, липополисахаридов в клеточной стенке) [16].
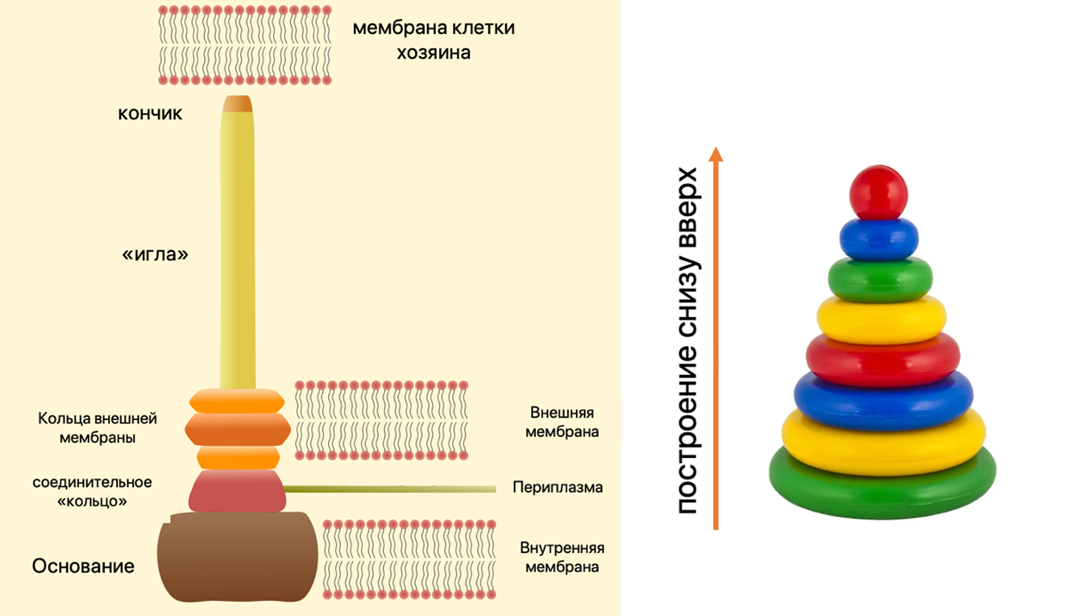
Рисунок 19. Система секреции III типа у хламидий (общая схема).
Высвобождение вредоносных белков прерывает работу рецепторов клеточного распознавания. В результате у клетки-хозяина блокируется выработка защитных факторов — провоспалительных цитокинов и эффекторов врожденного иммунитета. Затем хламидии начинают активно подавлять опухолевый супрессор — белок р53, который при воспалительных процессах предупреждает иммунную систему о деградации ДНК и клеточной гибели (апоптозе) [12]. В конечном итоге, невидимый враг незаметно и постепенно заселяется в клетках и начинает без риска для существования размножаться. А человек при этом постепенно теряет зрение!
Поражение глаз: в деталях
Согласно современным данным, при заражении трахомой первые признаки заболевания развиваются в течение одной-двух недель. В этот период хламидии начинают активно размножаться, и в клетках конъюнктивы происходит разрушение эпителия. То есть возникает воспалительный процесс (по-научному — гиперемия) конъюнктивы, из-за чего глаз покрывается сеточкой кровеносных сосудов. В зону воспаления отправляются иммунные клетки (Т-лимфоциты, В-клетки, макрофаги), скопления которых формируют лимфоидные фолликулы (трахоматозные гранулемы) диаметром 0,5 мм и более на конъюнктиве хряща верхнего века. Эта стадия называется трахоматозным фолликулярным конъюнктивитом. По этическим соображениям, стадии развития трахомы представлены в виде схемы (рис. 20).
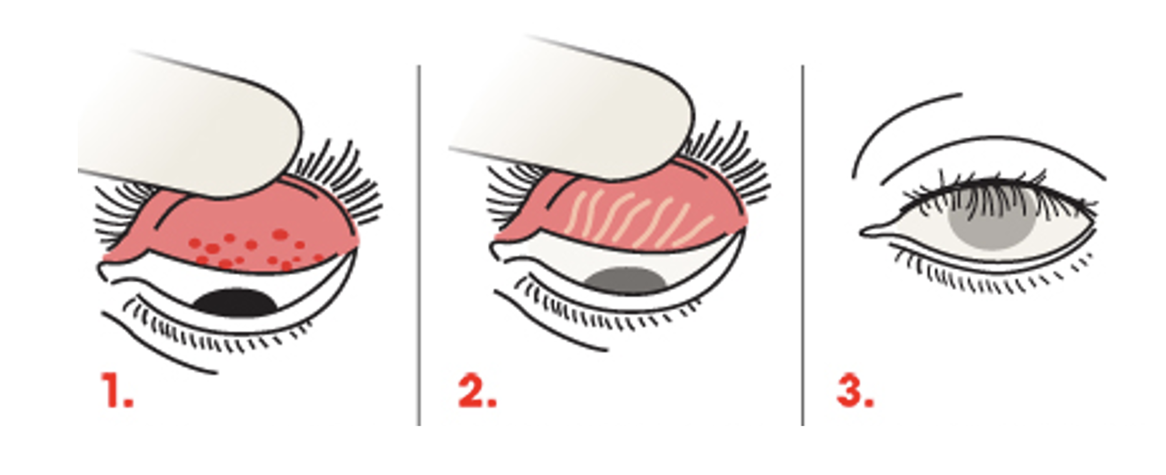
Рисунок 20. Стадии трахомы: 1 — трахоматозный фолликулярный конъюнктивит, 2 — рубцевание; 3 — трихиаз.
Однако хламидиям не удается до конца обмануть иммунную систему. Степень и интенсивность протекания стадии трахоматозного фолликулярного конъюнктивита характеризуется клеточно-опосредованным иммунным ответом. Основную роль здесь играют специальные антигены — CD4+ лимфоциты Т-хелперы 1-го порядка, которые способствуют увеличению экспрессии гамма-интерферона, ряда противовоспалительных цитокинов (например, интерлейкинов 12В) и численности клеток-киллеров, которые участвуют в работе врожденного иммунитета [17]. В результате гамма-интерферон способствует разрушению триптофана — аминокислоты, которая необходима для роста и развития «глазных» серотипов хламидий [12]. И в некоторых случаях (ученые пока что не нашли точного обоснования этой гипотезы) атака интерфероном срабатывает: подавляется рост C. trachomatis, что приводит либо к гибели бактерий, либо к их персистенции.
Если отсутствует лечение, начинается стадия выраженного трахоматозного конъюнктивита. Воспаление усиливается, и появляется отек век. Фолликулы при этом увеличиваются в размере, часть из них сливается и образует язвы. В то же время, роговица глаза становится непрозрачной, а слезная пленка постепенно истончается. У пациентов начинает снижаться зрение. На следующем этапе происходит рубцевание — на месте язв образуются рубцы в виде белых линий и полос. Эти рубцы «разрастаются» по внутренней поверхности века, деформируя ее — происходит фиброз ткани. Увеличивается уровень экспрессии CD45+ антигенов (веществ на поверхности лейкоцитов, ответственных за обнаружение воспалительных очагов), антимикробного пептида S100A7 (псориазина), провоспалительных цитокинов, а также матриксных металлопротеиназ (ферментов, разрушающих внеклеточные структуры соединительной ткани, а также белки по типу коллагена) [18]. Повышенная выработка металлопротеиназ связана с обширным разрушением соединительных тканей при рубцевании и заменой ее четкой архитектуры на коллаген.
Когда стадия рубцевания достигает своего апогея, начинается нарушение роста ресниц (трихиаз): они как бы заворачиваются вовнутрь. В конечном итоге, если пациента никак не лечили, развивается ярко выраженное помутнение роговицы, край зрачка размывается, и наступает потеря зрения.
Безоговорочная капитуляция трахомы?
С открытием природы хламидий стало очевидно, что одними гигиеническими требованиями и болезненными хирургическими операциями не обойтись. К тому же иммунитет к трахоме не вырабатывался: можно заболеть повторно. Поэтому в ХХ веке ученые сфокусировались на поиске лекарственных средств.
Впервые в 1938 году американский врач Фред Лоэ предложил использовать сульфаниламиды (противомикробные средства) для лечения трахомы (рис. 21). Результат не заставил себя ждать: до 90% больных были вылечены [9]. Всего лишь за три года число случаев заражения снизилось в семь раз.

Рисунок 21. Фото пациентов трахоматозного института, 1941 год, Форд Форт Дефайнас, штат Аризона, США. Буква «Т» символизирует трахому, «S» — сульфаниламиды.
Но вот незадача: ситуация снова ухудшилась во время Второй мировой войны. Опять старый сценарий: антисанитария, скученность людей, сниженный иммунитет. Но врачи уже успели раскусить стратегию врага. Трахоме оставалось недолго пировать! Уже в 1945 году был синтезирован антибиотик тетрациклин, который показал еще большую эффективность для лечения заболевания [3]. Во многих странах внедрялись выверенные годами санитарные процедуры, да и количество специалистов в области офтальмологии к тому моменту заметно увеличилось (рис. 22). Ослепительных хламидий начали побеждать по уже проверенным методикам. А улучшение жилищных и санитарных условий, повышение уровня медицинской помощи помогли добиться полной победы над трахомой в развитых странах.

Рисунок 22. Деятельность ВОЗ по лечению детей в странах третьего мира.
На пути к окончательной капитуляции трахомы мировая общественность столкнулась с проблемой невозможности внедрить терапевтические процедуры на всем земном шаре. Особенно в странах третьего мира. Был и еще один нюанс: трахома оказалась эндемичным (характерным для определенной местности) заболеванием для регионов Африки, Азии, Центральной и Южной Америки [2], [3]. При этом активной трахомой болеют, как правило, дети в возрасте до 15 лет. Взрослые, в особенности старики, страдают от трахомы в острой фазе, связанной с рубцеванием и слепотой (рис. 23).
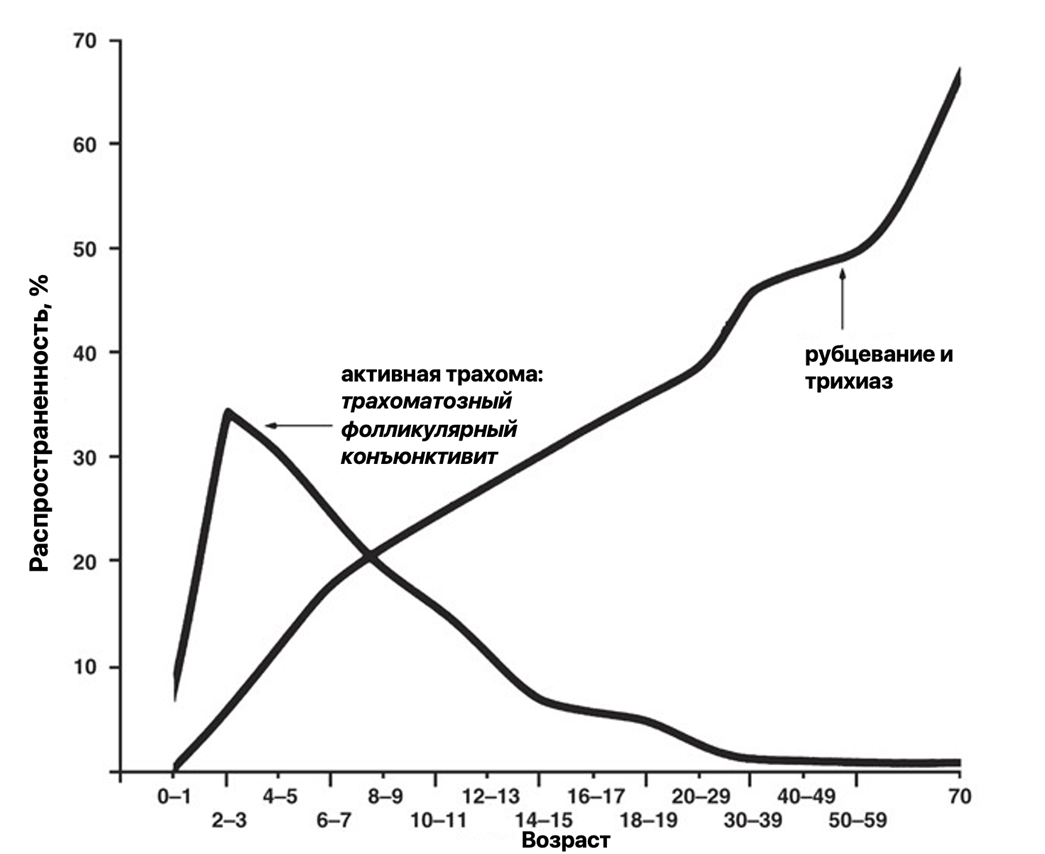
Рисунок 23. Распространенность трахомы у австралийских аборигенов в зависимости от возраста.
К тому моменту началась эпоха антибиотиков, поэтому победа над трахомой стала более чем очевидной. Эффективное средство для лечения заболевания было найдено в начале 1990-х годов. Им оказался антибиотик азитромицин. В 1993 году Всемирная организация здравоохранения внедрила целую стратегию по борьбе с трахомой, которая получила название SAFE: S — stand for surgery (хирургические вмешательства на стадии рубцевания, которая приводит к потере зрения); A — antibiotics (терапия антибиотиками); F — facial cleanliness (гигиена лица); E — environmental improvements (улучшение санитарных условий, медицинского обеспечения).

Рисунок 24. Стратегия SAFE для борьбы с трахомой.
Эта стратегия оказалась эффективной. Медленными шагами процедуры лечения помогали специалистам побеждать трахому. Но статистика оказалась не столь впечатляющей: за восемь лет упорной борьбы число людей, находящихся в зоне риска, сократилось лишь вдвое (рис. 25, 26).
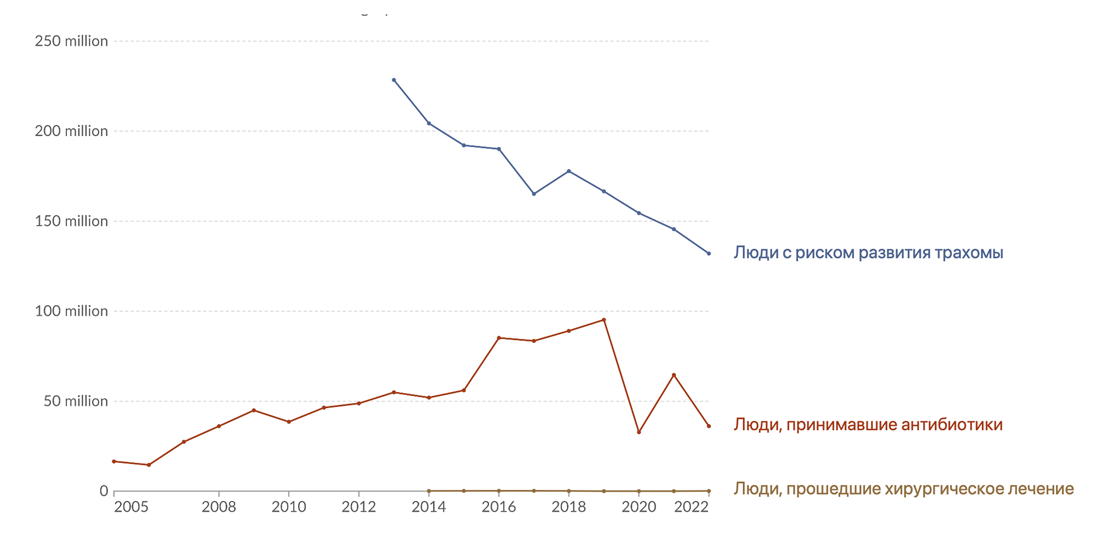
Рисунок 25. Численность людей, находящихся в зоне риска заражения трахомой (синяя линия); людей, прошедших антибиотикотерапию (красная линия); людей, прошедших хирургическое лечение (коричневая линия).

Рисунок 26. Осмотр детей на предмет заболевания трахомой.
фото Элизабет Гилберт, Международная организация по борьбе с трахомой
Это объясняется тем, что диагностику и лечение трахомы крайне трудно проводить в регионах с низким уровнем социальной и санитарной культуры. Кроме того, для эффективности лечения необходима терапия азитромицином в течение как минимум 12 месяцев [19]. По прогнозам специалистов, для устранения трахомы, в особенности среди детей, необходимо проводить терапию антибиотиками как минимум дважды в год (рис. 27).
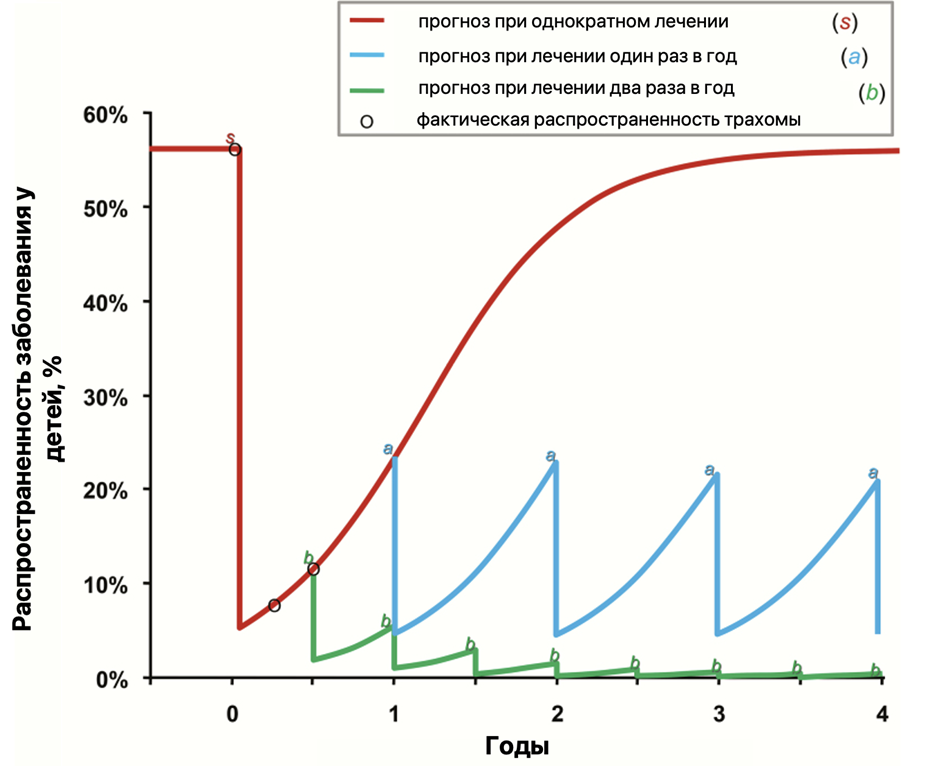
Рисунок 27. Прогноз развития трахомы у детей в зависимости от частоты приема антибиотиков.
Если бы речь шла о сотнях больных, ситуацию можно было бы контролировать. Но когда счет идет на миллионы, появляются проблемы: за всеми, с учетом имеющихся возможностей, не уследить!
Тем не менее, усиление общественного здравоохранения проложило дорогу в сторону частичной победы над трахомой. По данным за октябрь текущего 2024 года, ВОЗ сообщила об устранении заболевания в 21 стране, среди которых — Китай, Бенин, Камбоджа, Иран, Мексика, Непал, Пакистан, Саудовская Аравия и другие.
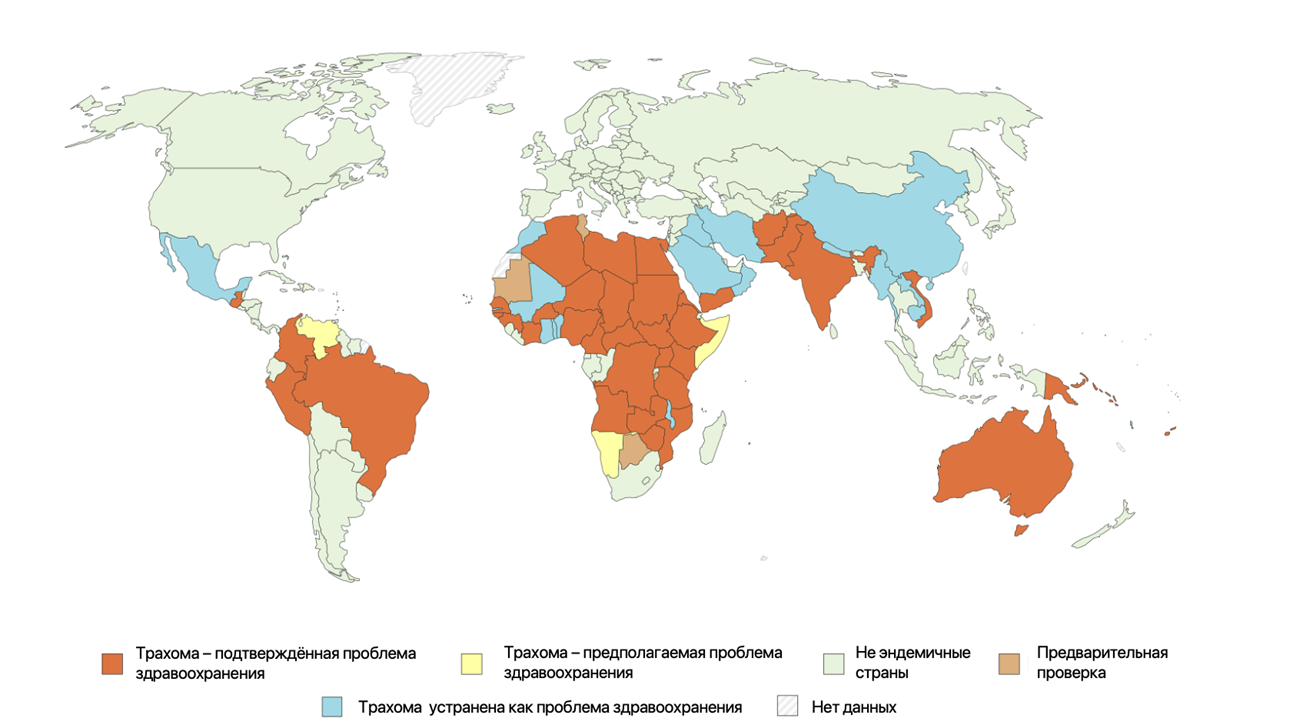
Рисунок 28. Страны, в которых трахома является проблемой общественного здравоохранения, по состоянию на 2023 год.
Финальный аккорд
Общими усилиями трахому удалось одолеть — почти. Но даже сегодня борьба человечества с ослепляющими хламидиями не окончена. Болезнь свирепствует в беднейших районах мира, где в зоне риска оказываются, по нескромным подсчетам, свыше 100 миллионов человек. В особенности — маленькие дети. Людям с острой фазой трахомы требуются не только антибактериальные средства, но и серьезное хирургическое вмешательство. Кроме того, ученые не до конца уверены в путях передачи инфекции. В последних исследованиях сообщается о комнатных (Musca domestica) и базарных мухах (M. sorbens), которые обитают в эндемичных трахоме регионах и могут служить переносчиками инфекции [3], [20]. Поэтому науке в решении данного вопроса приходится заниматься всесторонним изучением не только хламидий, но и эпидемиологии заболевания с учетом огромного количества сторонних факторов.

Рисунок 29. Преобладание мух M. sorbens и M. Domestica в ряде эндемичных трахоме стран может быть косвенной причиной передачи инфекции от человека к человеку.
А пока что общественное здравоохранение продолжает бороться с трахомой в самых удаленных уголках планеты, куда еще не добралась цивилизация — или добралась, но с трудом. Для полной ликвидации заболевания необходимо внедрение более совершенных технологий и подходов к мониторингу. Например, сегодня разрабатываются экспресс-тесты для выявления хламидий на ранних стадиях, процедуры сопровождения пациентов в ходе лечения антибиотиками и после хирургических операций, а также, не поверите, вакцины! Несмотря на то, что выработка иммунитета по отношению к хламидиям невозможна в полной мере, многие ученые убеждены в необходимости обеспечить хотя бы кратковременную защиту людей, наиболее подверженных заболеванию. К сожалению, исследования в этой области протекают крайне медленно из-за меньшей актуальности по сравнению с другими злободневными заболеваниями (тем же COVID-19). По состоянию на 2024 год, в клинических испытаниях участвует лишь один кандидат [21]. Насколько разработка вакцины от трахомы — эффективное мероприятие, судить не нам. Вспомним лучше цитату Антона Павловича Чехова из знаменитой «Палаты № 6»: «А как же теория наследственности, открытия Пастера и Коха, гигиена со статистикой?». Все это, в совокупности с улучшением условий окружающей среды — извилистый и тернистый, но, так или иначе, более действенный путь. Будем надеяться, что, согласно глобальной стратегии ВОЗ, трахома станет окончательно канувшим в лету тропическим заболеванием.
Литература
- Sheila K West. (2004). Trachoma: new assault on an ancient disease. Progress in Retinal and Eye Research. 23, 381-401;
- H R Taylor. (2009). Doyne Lecture: trachoma, is it history?. Eye. 23, 2007-2022;
- Hugh Taylor, Chandler R. Dawson. (2009). Trachoma: A Blinding Scourge from the Bronze Age to the Twenty‐First Century:Trachoma: A Blinding Scourge from the Bronze Age to the Twenty‐First Century. CLIN INFECT DIS. 48, 845-846;
- Michael MacCallan. (2015). Arthur Ferguson MacCallan: trachoma pioneer in Egypt 1903–1923. Br J Ophthalmol. 99, 577-579;
- Gregory Tsoucalas, Theodoros Papaioannou, Marianna Karamanou. (2018). Michael Constantine Psellus (1020–1105 AD) and his definition of strabismus. Strabismus. 26, 155-157;
- C Reeves, D Taylor. (2004). A history of the optic nerve and its diseases. Eye. 18, 1096-1109;
- Mehrdad Mohammadpour, Mojtaba Abrishami, Ahmad Masoumi, Hassan Hashemi. (2016). Trachoma: Past, present and future. Journal of Current Ophthalmology. 28, 165-169;
- Robert M. Feibel. (1983). John Vetch and the Egyptian ophthalmia. Survey of Ophthalmology. 28, 128-134;
- Robert M. Feibel. (2011). Fred Loe, MD, and the History of Trachoma. Arch Ophthalmol. 129, 503;
- Лукьянов И.К. Трахома в Волжско-Камском крае. Чебоксары: типография Чувашского издательства, 1925. — 141 с.;
- Ufa Eye Research Institute, Ufa, Y. S. Galimova. (2021). Historical milestones of the Bashkir Research Trachomatous Institute. POV.E-W. 72-75;
- Anthony W. Solomon, Matthew J. Burton, Emily W. Gower, Emma M. Harding-Esch, Catherine E. Oldenburg, et. al.. (2022). Trachoma. Nat Rev Dis Primers. 8;
- Хрянин А. А., Решетников О. В. Хламидийная инфекция : эволюция взглядов. М.: «ГЭОТАР-Медиа», 2020. — 208 с.;
- Cherilyn Elwell, Kathleen Mirrashidi, Joanne Engel. (2016). Chlamydia cell biology and pathogenesis. Nat Rev Microbiol. 14, 385-400;
- Nicholas R Thomson, Ian N Clarke. (2010). Chlamydia Trachomatis : Small Genome, Big Challenges. Future Microbiol.. 5, 555-561;
- Elizabeth A. Rucks. (2023). Type III Secretion in Chlamydia. Microbiol Mol Biol Rev. 87;
- Прирожденные убийцы: NK-клеточная терапия;
- Sam M. Murray, Paul F. McKay. (2021). Chlamydia trachomatis: Cell biology, immunology and vaccination. Vaccine. 39, 2965-2975;
- Thomas M Lietman, Amy Pinsent, Fengchen Liu, Michael Deiner, T Deirdre Hollingsworth, Travis C Porco. (2018). Models of Trachoma Transmission and Their Policy Implications: From Control to Elimination. Clinical Infectious Diseases. 66, S275-S280;
- Carla Enrica Gallenga, Martina Maritati, Marco Del Boccio, Rossella D’Aloisio, Pio Conti, et. al.. (2023). Why the SAFE—S Strategy for Trachoma? Are Musca sorbens or Scatophaga stercoraria Really the Culprit?—A Brief Historical Review from an Italian Point of View. Pathogens. 12, 1419;
- Vivek P Chavda, Anjali Pandya, Erica Kypreos, Vandana Patravale, Vasso Apostolopoulos. (2022). Chlamydia trachomatis: quest for an eye-opening vaccine breakthrough. Expert Review of Vaccines. 21, 771-781.