Прирожденные убийцы: NK-клеточная терапия
18 февраля 2022
Прирожденные убийцы: NK-клеточная терапия
- 7132
- 4
- 18
Клетки — натуральные киллеры — безжалостны к чужеродным элементам.
Рисунок в оригинальном разрешении.
-
Автор
-
Редакторы
-
Иллюстратор
Впечатляющие успехи CAR-T лимфоцитов в лечении гемобластозов привлекли внимание медицинских специалистов и широкой общественности, но постоянно возникает вопрос: а можно ли и другие иммунные клетки поставить на борьбу с раком? В этой области сегодня нам много обещают так называемые естественные киллеры — клетки, способные преодолеть ограничения Т-клеточного лечения и стать новым словом в иммунотерапии онкологических заболеваний. Рассказываем о них в продолжении пецпроекта по генной и клеточной терапии.
Генная и клеточная терапии

Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Адоптивная клеточная терапия (АКТ) основана на современных технологиях, позволяющих изолировать и размножить «в неволе» наши же собственные иммунные клетки, чтобы потом уже направить армию этих элитных бойцов на уничтожение злокачественных клеток. Впервые такой подход применили в 1988 году, когда выделенные от пациентов опухоль-инфильтрующие лимфоциты — с усилением их специфической активности интерлейкином-2 — после размножения и введения обратно больным помогли обратить вспять метастатическую меланому [1], [2].
Стоит сказать, что сама по себе клеточная терапия берет начало еще раньше: с трансплантации гемопоэтических стволовых клеток, которой и сегодня лечат множество онкогематологических (и редких генетических) заболеваний. В случае онколечения такую технологию применяют в сочетании с химиотерапией — она сначала «зачищает» опухолевые клетки, а трансплантация затем уже помогает организму восстановить пул здоровых клеток и справиться с болезнью. Подробнее об известных типах клеточных терапий читайте в статье «Клетки, которые лечат людей» [3].
С тех пор адоптивный перенос иммунных клеток с противоопухолевой активностью показал эффективность в лечении некоторых рефрактерных и рецидивирующих форм гематологических онкозаболеваний [4], [5]. Публикация первых таких успехов вызвала большой ажиотаж в публичном поле и интерес крупных фармацевтических компаний, — а за ней последовал шквал клинических исследований, что привело к регуляторному одобрению CAR-T клеточного лечения в 2017 году [2].
То есть не поддающихся лечению. В этих случаях успех Т-клеток, полученных по протоколу стимуляции и размножения ex vivo и даже подвергнутых предварительной генной модификации для внедрения химерного антигенного рецептора (собственно СAR-T клеток), — во многом беспрецедентен. Об этом «Биомолекула» рассказала в подробностях в ряде статей.
Однако далеко не все виды рака поддаются лечению CAR-T: попытки использовать эту технологию для уничтожения сóлидных опухолей не увенчались успехом. С одной стороны, это связано с плохим проникновением Т-лимфоцитов в плотную ткань таких новообразований (строму), что препятствует достаточному накоплению этих клеток для эффективного взаимодействия с их опухолевыми «визави». С другой стороны, на эти опухоли не так просто нацелиться — для этого у них недостает хорошей «мишени» (подобной рецептору CD19 в гематологических опухолевых бластах). Но даже если подходящий для селективного связывания маркер и удается найти (например, HER2 для некоторых опухолей молочной железы), — этого не всегда бывает достаточно. Ведь опухолевые, а также рекрутированные «силами зла» иммунные клетки стромы умеют подавлять направленную на них активность , из-за чего Т-лимфоциты не срабатывают.
О том, как опухолевые клетки научились подавлять иммунитет и даже ставить иммунные клетки себе на службу, можно узнать из статьи «Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет» [6].
Так что, несмотря на все преимущества, ученые волей-неволей рассматривают иммунные клетки, способные заменить (или дополнить) сегодняшнюю Т-клеточную терапию. NK-клетки здесь особо интересны: есть надежда, что они могут лучше лечить при некоторых показаниях, и при этом более безопасны, относительно просты в производстве и недороги. Что же сделало их такими особенными?
NK-клетки: кто они?
Естественные (или натуральные) киллеры, они же NK-клетки (англ. Natural killer (NK) cells), — тип цитотоксических лимфоцитов, участвующих в работе врождённого иммунитета (рис. 1, 2). Впервые были описаны в далеких 1970-х, когда шведские и британские исследователи независимо друг от друга обнаружили клетки, которые нельзя было однозначно отнести к B- или Т-лимфоцитам, но все же способные к уничтожению опухолей. С тех пор ученые неоднократно пытались направить «силу и мощь» этих клеток на борьбу против рака.

Рисунок 1. Какие они, прирожденные убийцы?
Несколько лет спустя оказалось, что NK-клетки убивают клетки лимфомы без комплекса тканевой совместимости I (известного также как MHC I), в то время как «нормальные» (MHC I позитивные) клетки они не трогают [7]. Антигенные комплексы MHC I на клетках подтверждают их принадлежность к определенному организму — это своего рода «молекулярный паспорт». И когда в таком «паспорте» происходят изменения, это служит сигналом Т-клеткам, что перед ними «чужак», которого следует «найти и уничтожить». Однако не все так просто, ведь опухоли и тут могут обмануть иммунитет [8].
MHC, совместимость тканей и естественные киллеры
Аббревиатура MHC переводится на русский язык как главный комплекс гистосовместимости (англ. Major histocompatibility complex). Для человека эта совокупность белковых молекул имеет и еще одно, более старое, название — человеческие лейкоцитарные антигены (англ. HLA, Human Leukocyte Antigens). Называются так эти поверхностные клеточные белки потому, что при несовпадении их у реципиента и донора они могут индуцировать отторжение пересаженных органов и тканей, — и именно в этом качестве когда-то были обнаружены учеными. Впрочем, сейчас уже их название, скорее, анахронизм, — ведь оказалось, что «зона ответственности» таких белков намного шире. HLA помогают иммунному надзору, участвуют во многих физиологических реакциях, определяют патогенез и предрасположенность к различным заболеваниям и многое другое. При этом и разнообразие белков тканевой совместимости очень велико, как и кодирующих их генов. Известно, что это самая полиморфная система генов, включающая более 10 тысяч генетических вариантов (аллелей), неравномерно распределенных среди разных этносов [9].
Презентация антигенов и уничтожение опухолей
Впрочем, сейчас нас больше интересуют белки класса MHC I, ведь именно они умеют презентировать CD8+ Т-клеткам (кстати, по функциям очень похожим на NK-клетки, — недаром их еще называют Т-киллерами) белковые фрагменты возбудителей инфекций или опухолевых клеток. Такие кусочки чужеродных агентов (известные также как антигены) получаются внутри клетки нарезанием целых белков и могут попадать на поверхность клетки как раз в составе MHC I. Процесс этот многоступенчатый, что предоставляет массу возможностей злокачественным клеткам его избежать. Так, к этому может привести нарушение в любом из генов, кодирующих какой-либо участвующий в презентации антигена белок. Ну а самые разнообразные генетические нарушения в опухолях, как известно, далеко не редкость, что и позволяет им в итоге уклоняться от иммунного надзора. Подливает масла в огонь селективное давление отбора иммунной системой — ведь благодаря этому может случиться так, что среди «разношерстных» опухолевых клеток выживут лишь те, у которых либо отсутствуют MHC I, либо нарушен процесс презентации через них антигена [10]. Т-киллеры не способны уничтожить такие клетки, а значит, они будут и дальше бесконтрольно делиться. Если их не остановить, заболевание будет прогрессировать. Сказать слово «стоп» здесь как раз способны естественные киллеры, ведь их-то так просто не проведешь.
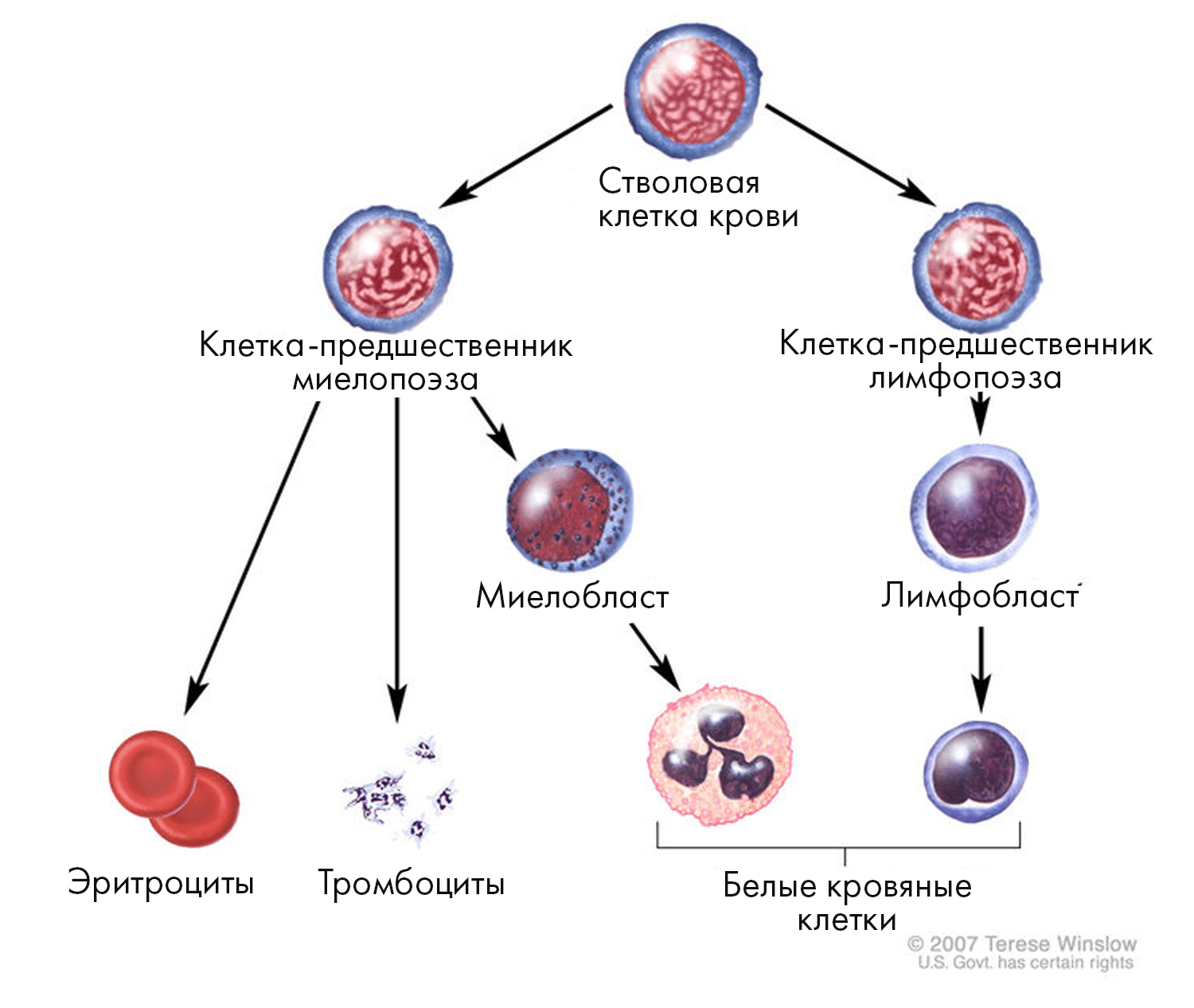
Рисунок 2. В нормальном гемопоэзе все клетки крови происходят из CD34+ гемопоэтических стволовых клеток. NK-клетки (наряду с B- и T-лимфоцитами) берут начало от лимфобласта, который, в свою очередь, дифференцируется из общего лимфоидного предшественника. Почитать об этом занимательном процессе подробнее можно в комиксе «Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию» [11].
Наоборот, NK-клетки способны даже активироваться, «видя» отсутствие «своих молекул» (тех же самых MHC I) на опухолевых клетках (рис. 3). Эта особая чувствительность, позволяющая NK-клеткам отделять «чужаков» от «своих» по утрате антигенных комплексов, получила теоретическое обоснование, известное как «гипотеза потери своего» (missing self-hypothesis) [7]. И такая способность — далеко не единственное преимущество NK- перед T-клетками.
NK-клетки vs. T-клетки
В отличие от Т-клеток адаптивной иммунной системы, NK-клетки — это часть врожденной иммунной системы, и им для активации не нужен контакт с антигенами. Они могут реагировать на то, что «покажется» им чужеродным, но по умолчанию не активируются, имея своего рода «предохранительный механизм», защищающий здоровые клетки от бесконтрольного уничтожения этими убийцами (подробнее — на рис. 3) [12], [13].
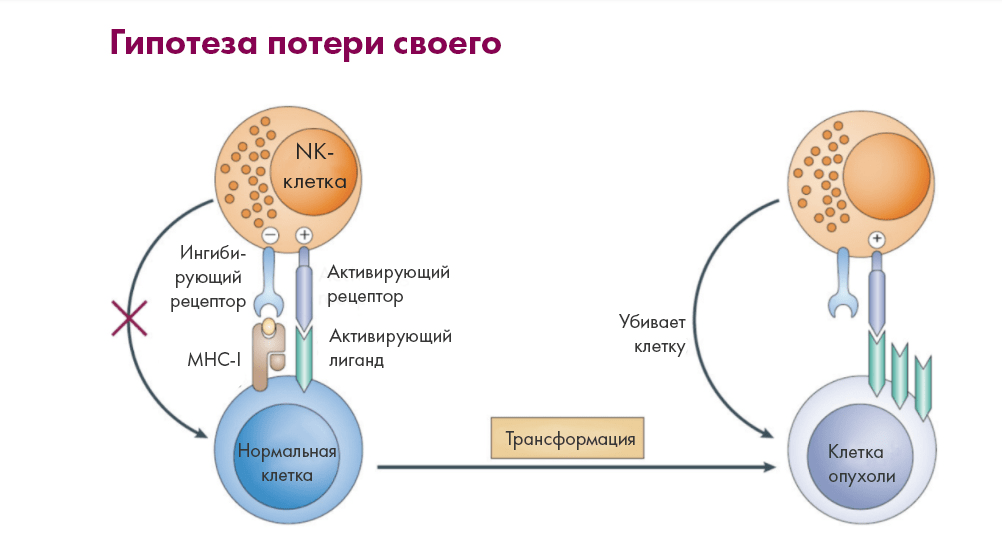
Рисунок 3. Механизм активации NK-клеток («гипотеза потери своего»). NK-клетки активируются сложным балансом сигналов от рецепторов с противоположными функциями (ингибирующей и активирующей), запускаемыми соответствующими лигандами на клетках-мишенях. При этом ингибирующие рецепторы семейства иммуноглобулин-подобных рецепторов NK-клеток (KIR) (либо поверхностные гликопротеины типа II с каркасом C-лектина, известные как NKG2A/СD94) узнают молекулы MHC I на поверхности здоровых клеток, не будя подозрений естественных киллеров. Когда же связывания с MHC I нет, «тормоза» отсутствуют, и тут уже активирующие рецепторы могут разбудить NK-клетки. «Прирожденные убийцы» начинают продуцировать цитокины и литические вещества, убивающие жертвы.
Важно, что NK-клетки выходят на тропу войны при соблюдении двух условий: утери клеткой «паспорта гражданина» (MHC I) и экспрессии ею же стресс-индуцированных лигандов. Здоровые клетки такие лиганды не экспрессируют и «паспорт» не теряют, что и предохраняет их от атаки NK-клеток [12]. За счет этого в норме ингибирование доминирует над активацией .
Однако этот элегантный механизм «спасает» не всегда, ведь у злокачественных клеток есть свои механизмы уклонения и от NK-клеток, во многом связанные с опухолевым микроокружением [14]. А в окружении этом голодно, мало кислорода (гипоксия) и много цитокинов (таких как IL-10 и TGF-β) [15], как продуцируемых самой опухолью, так и привлекаемыми Т-регуляторными клетками, — все это не дает нашим «убийцам» пройти все стадии профессионального роста и как следует принять свои обязанности [16].
На практике все это означает, что есть хорошая перспектива для аллогенных NK-клеток с хорошей иммунологической совместимостью. Несовпадение ингибирующих рецепторов донора с антигенными комплексами пациентов может лишь усиливать их активацию в отношении опухолевых клеток [12], что до определенной степени делает такие NK уже «готовыми к использованию» (off-the-shelf use) для производства в больших количествах и лечения многих онкологических больных [17].
То есть, полученных от донора; в отличие от аутологичных — полученных от пациента.
Дело в том, что генная модификация может быть полезна и NK-клеткам — для придания дополнительной специфичности и эффективности. Об этом мы поговорим ниже.
В то же время для Т-клеток как раз метод их производства имеет серьезные ограничения, включая наработку требуемого количества клеточного материала. Например, у пациента с иммуносупрессией после пройденного лечения первой линии (химиотерапией) может быть просто недостаточно таких клеток для проведения аутологичной терапии. Ну и это просто долго, дорого и технологически сложно, что делает такое лечение экономически не очень эффективным, а значит, труднодоступным для возмещения затрат системами здравоохранения [18].
С другой стороны, NK-клетки, как немодифицированные, так и измененные генной инженерией, уже показывают многообещающие результаты в ранних клинических исследованиях без существенных нежелательных явлений, зачастую сопровождающих Т-клеточное лечение. Речь о следующих опасных феноменах:
- Нейротоксичность [19].
- Реакция «трансплантат против хозяина», при которой трансплантированные клетки атакуют и разрушают чужеродные для них ткани хозяина. Это бывает при терапии аллогенными клетками, но в случае NK такой риск значительно ниже [20].
- Цитокиновый шторм — явление, при котором иммунные клетки выделяют угрожающе много провоспалительных сигнальных молекул (цитокинов). Их выделение само по себе стимулирует и другие иммунные клетки к секреции других воспалительных медиаторов, запуская своего рода «цепную реакцию». Возникающее воспаление — вначале локальное, но по мере распространения охватывающее весь организм, — может быть смертельно опасным.
Биология естественных киллеров
Человеческие NK-клетки широко распространены в лимфоидных и нелимфоидных тканях, таких как кровь, ткани печени, матки и селезенки. Они весьма разнородны — отличаются функционалом, стадиями созревания и экспрессией рецепторов [21]. По рецепторам их и классифицируют: по отсутствию CD3 (маркера Т-клеток) и наличию CD56-поверхностных маркеров, причем по уровню экспрессии последнего их дополнительно подразделяют на CD56brightCD16dim/− и CD56dimCD16+ . Представителей первой группы считают менее зрелыми (и при этом мощными продуцентами цитокинов), а второй, напротив, более зрелыми (и мало секретирующими цитокины), но обладающими наибольшей цитотоксичностью.
Обозначение bright («яркий») говорит о высоком уровне экспрессии соответствующего рецептора, в то время как dim («тусклый») — о низкой.
Приблизительно 90% циркулирующих NK-клеток считаются цитотоксическими популяциями CD56dimCD16+, при этом их рецептор FcγRIII (CD16) способен связываться с Fc-участком иммуноглобулина G, что важно для антителосвязанной цитотоксичности (об этом далее). У этих клеток много гранул с гранзимом и перфорином, которые они могут высвобождать, а также продуцировать цитокины (такие как фактор некроза опухоли α, TNF-α и интерферон γ, IFN-γ) — уже после распознавания ими клеток-мишеней.
Меньшая популяция CD56brightCD16dim/− играет преимущественно иммунорегуляторную роль, определяемую по секреции различных цитокинов (тех же TNF-α и IFN-γ), а также хемокинов . Секреция этих молекул, в свою очередь, провоцируется стимуляцией NK-клеток различными интерлейкинами , что работает как само по себе, так и может быть усилено сигналами от активирующих рецепторов. Причем такая реакция NK-клеток занимает всего несколько минут, в отличие от Т-клеток, которым требуется больше времени [22].
Это цитокины, такие как RANTES и MIP-1α/β, помогающие лейкоцитам мигрировать в ткани.
Это цитокины, играющие важную роль в процессах воспаления (и не только), такие как IL-2, IL-12, IL-15, IL-18 и IL-21. В основном они управляют развитием и жизненным циклом лейкоцитов [23], [24].
Также есть доказательства, что комбинация стимуляции IL-12, IL-15 и IL-18 может наделять NK-клетки памятью (превращать их в memory-like NK cells). Последние могут сохранять активность даже после прекращения или отсутствия первоначальной стимуляции. Ну а при повторной стимуляции (например, цитокинами) или встрече с опухолевыми клетками они становятся уже «суперпродуцентами» IFN-γ, что поднимает их цитотоксический потенциал на новые высоты [22], [27].
Уничтожение аномальных клеток
NK-клетки убивают своих жертв в первую очередь литическими гранулами (granule-mediated cytotoxicity), но могут переключаться и на другой метод — опосредованный рецепторами смерти апоптоз [28]. В этом случае связывание рецепторов смерти с их лигандами на клетках-мишенях — такими как TRAIL и FasL — инициирует апоптоз путем активации каспаз-8 и −10 (рис. 4) [12].
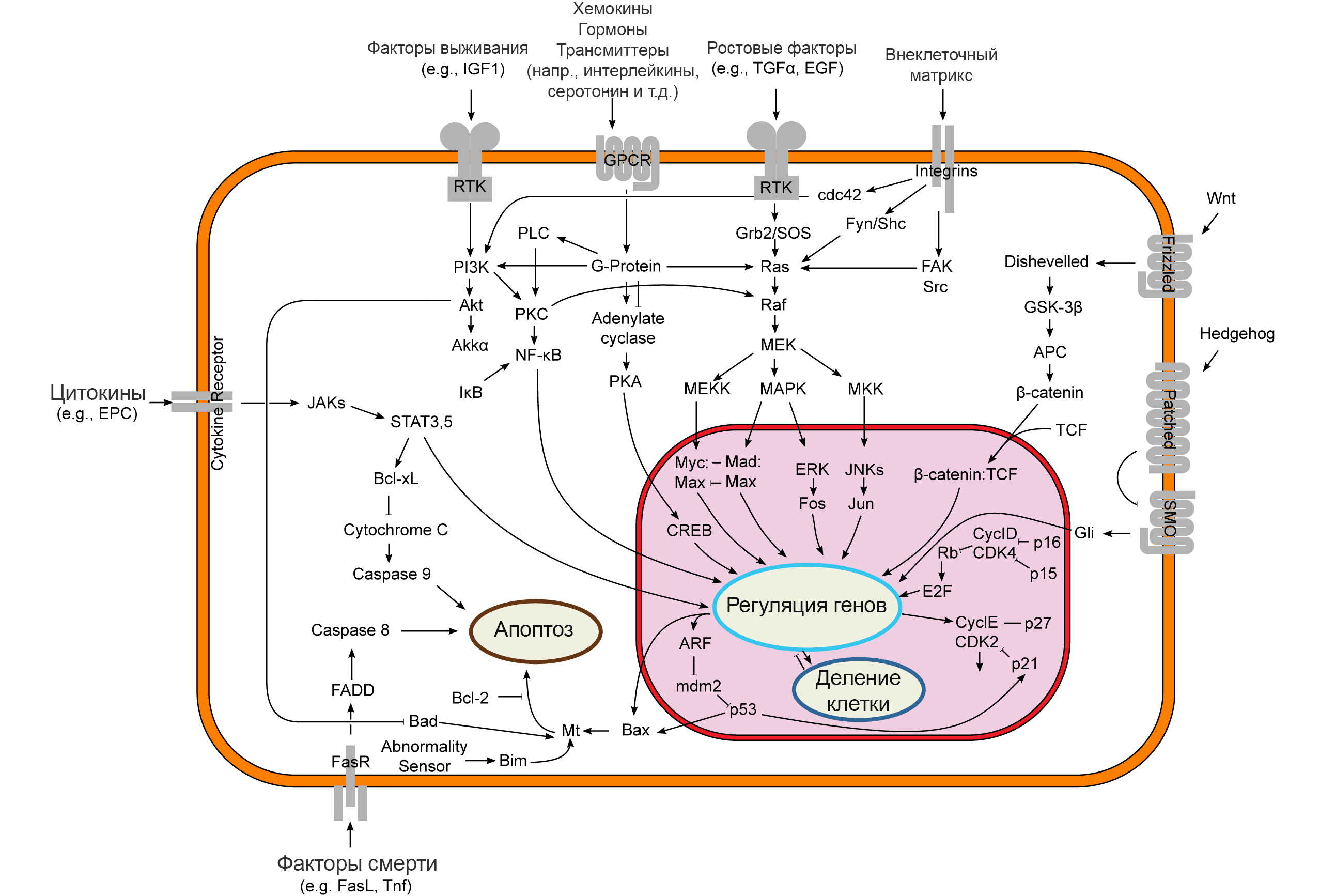
Рисунок 4. Пути передачи сигналов, участвующих в апоптозе. Цитотоксичность, опосредованная рецептором смерти, может реализовываться путем связывания рецепторов смерти NK-клеток с их лигандами TRAIL и FasL (см. внизу рисунка слева) — они обычно экспрессируются опухолевыми клетками, — после чего активируется каспазный сигнальный каскад, приводящий к апоптозу.
И все же основной способ убийства NK-клетками инфицированных или опухолевых мишеней — это разрушение литическими гранулами. Они содержат перфорин — белок, расщепляющий клеточные мембраны, — а также гранзим — фермент семейства сериновых протеаз. Когда NK-клетки узнают своих жертв, между ними формируется иммунологический синапс. И вот тут-то высвобождаются секреторные гранулы, заливая синаптическую щель перфорином и гранзимом. Перфорин «дырявит» мембрану клетки-жертвы, формируя трансмембранные поры, через которые и диффундируют внутрь гранзимы (рис. 5). А эти молекулы индуцируют апоптоз, приказывающий жертвам покончить с собой, после чего киллеры аккуратно отдаляются от своих умирающих жертв и могут взяться за серийное убийство новых — пока еще живых — клеток-мишеней [29].
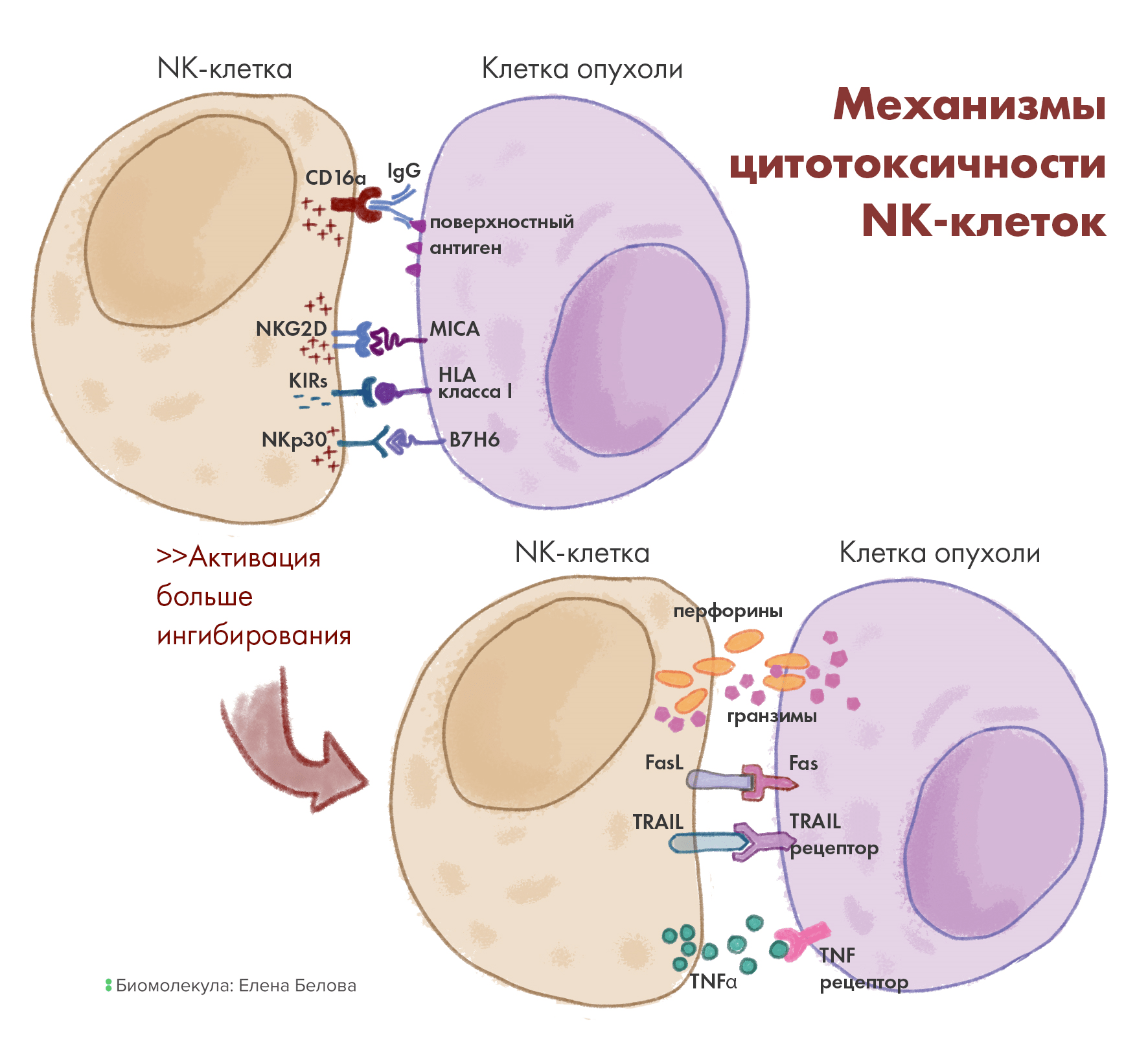
Рисунок 5. Механизмы цитотоксичности NK-клеток.
рисунок Елены Беловой по [29]
Другой механизм «клеточного убийства» — антителозависимая цитотоксичность (ADCC) — реализуется через активацию рецептора CD16, связывающего Fc-участок антител, опсонизирующих («облепляющих») клетки-мишени. Это приводит к дегрануляции NK-клеток и убийству при помощи перфорина (как описано выше). Ну а поскольку различные подтипы NK-клеток имеют разное количество CD16, то CD56dimCD16+ гораздо активнее использует путь ADCC.
Так или иначе, в медицинских целях нужно использовать превосходные цитотоксическую и цитокин/хемокин продуцирующую способности NK-клеток. Именно поэтому важно добиваться совершенствования этих способностей, производя лекарства на основе NK-клеток (об этом мы и поговорим ниже).
Рецепторы NK-клеток и их активация
В целом эти клетки имеют широкий репертуар разнообразных рецепторов. Однако, в отличие от TCR, рецепторы NK-клеток не «сборные» — они получаются не в результате V(D)J-рекомбина́ции . Какими они будут, уже «зашито» в их ДНК. Такие рецепторы в принципе делятся на активирующие, ингибирующие и вспомогательные (ко-активирующие) (табл. 1 и рис. 6) [30].
Об этом интересном явлении, меняющем генетическую идентичность лимфоцитов, повествует статья: «Анализ индивидуальных репертуаров Т-клеточных рецепторов» [31].
| Рецептор | Лиганды |
|---|---|
| NK-активирующие рецепторы | |
| NKG2D | Стресс-индуцируемые белки MICA и MICB [32], а также ULBP1-6 |
| DNAM1 | PVR(CD155), нектин-2 (CD112) |
| NKp30 (NCR3) [33] | pp65, B7-H6, galectin-3, BAG6, и другие [34] |
| NKp44 (NCR2) | PDGF-DD, 21spe-MLL5, PCNA, и другие [35] |
| NKp46 (NCR1) | Complement factor P, viral HA, HS GAGs, (DBL)-1a domain of Plasmodium falciparum erythrocyte membrane protein-1, vimentin |
| CD16 (FcγRIII) | Fc фрагмент антител |
| NK-ингибирующие рецепторы | |
| CD94/NKG2A | HLA-E |
| KIR2DL1 | HLA-C, группы 2 |
| KIR2DL2/3 | HLA-C, группы 1 |
| KIR3DL1 | HLA-Bw4 |
| KIR3DL2 | HLA-A3, A11 |
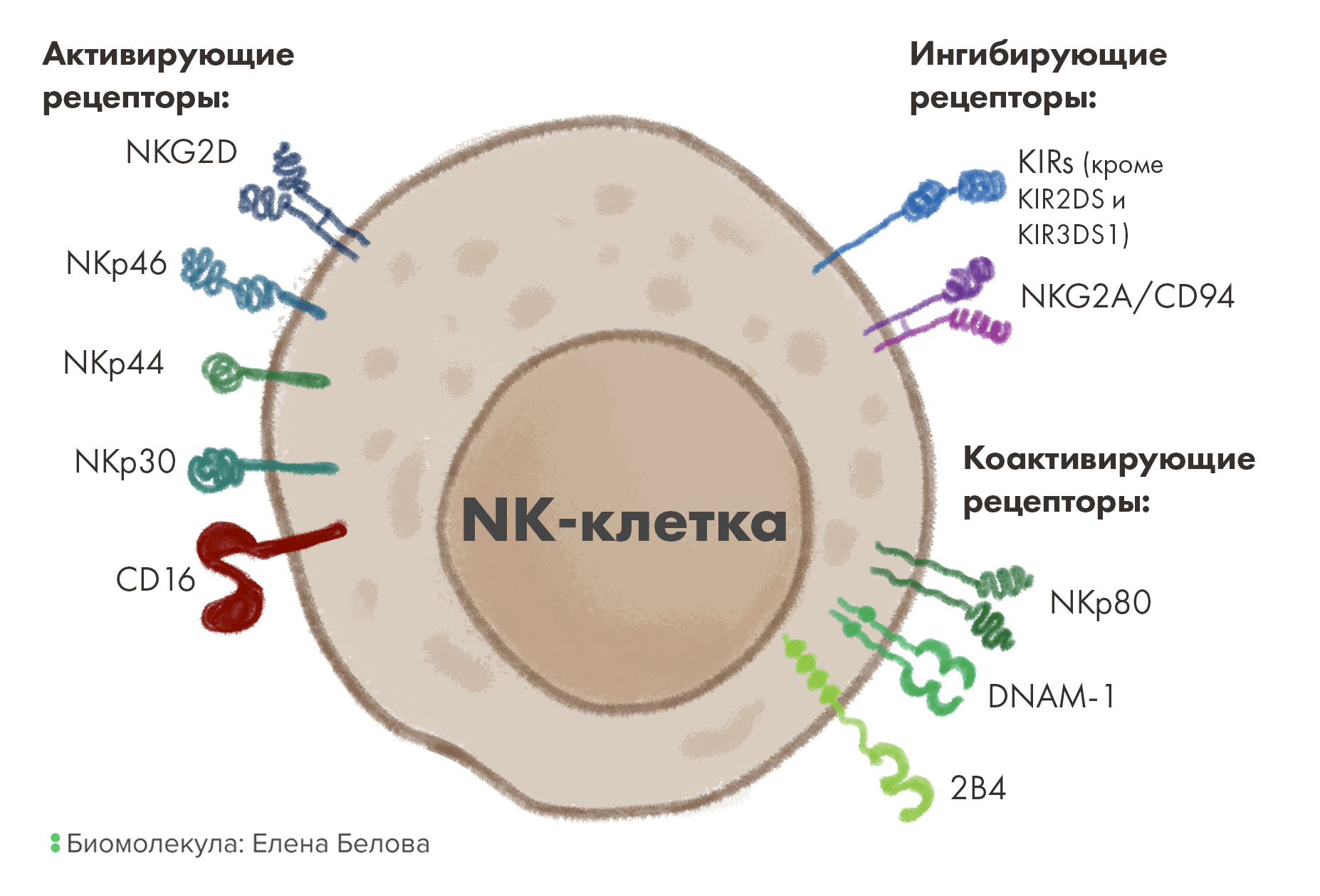
Рисунок 6. Основные активирующие, ко-активирующие и ингибирующие рецепторы на поверхности NK-клеток.
рисунок Елены Беловой по [30]
По этим рецепторам NK-клетки можно делить на дополнительные — помимо указанных выше — подтипы. Они могут отличаться пролиферативным потенциалом (способностью к делению), чувствительностью к апоптозу и восприимчивостью к трансдукции (инфицированию) вирусными частицами [36]. Сегодня исследования в этой области продолжаются, а получаемые знания в будущем могут позволить создать более эффективную иммунотерапию NK-клетками [36].
Не NK едиными: NKT-клетки
Науке известна еще одна уникальная подгруппа лимфоцитов, умеющая экспрессировать как Т-клеточный рецептор (TCR), так и рецепторы NK-клеток. Зовутся эти «уникумы» NKT-клетками, и уже многое известно об их роли в аутоиммунных, инфекционных и онкозаболеваниях [37]. Как выяснилось, NKT-клетки — как бы мостик между врожденной и адаптивной ветвями иммунитета [37]. И это только одно из свойств, дающих надежду на уникальный терапевтический потенциал.
NKT-клетки могут атаковать опухолевые клетки как сами по себе, так и стимулировать к этому другие клетки иммунитета. В частности, путем активации врожденной иммунной системы они могут уничтожить утерявшие «паспорт» (MHC I) злокачественные клетки, с которыми обычные Т-клетки не справляются. Правда, без работы здесь не останутся и они, — активируясь и атакуя опухоль (рис. 7) [38].
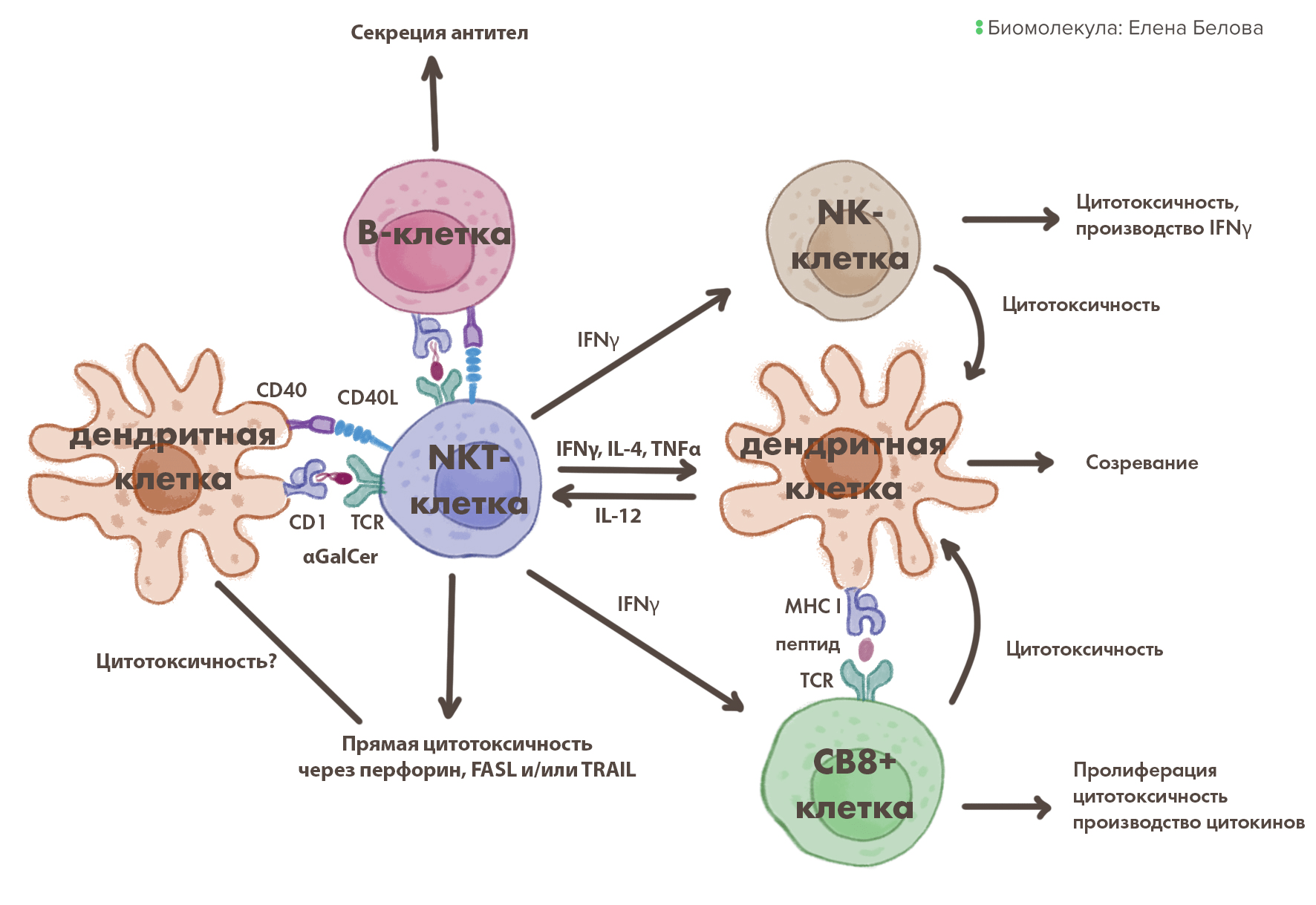
Рисунок 7. NKT-клетки уничтожают рак как напрямую, так и активируя прочие иммунные клетки. Активировавшись, NKT-клетки продуцируют цитокины, которые «будят» натуральных киллеров, а также ускоряют созревание дендритных клеток врожденной иммунной системы. Созрев, последние презентируют антигены через MHC I Т-киллерам, которые таким образом тоже активируются. Получается, что активация врожденной и адаптивной иммунной систем взаимно усиливают друг друга в борьбе с опухолью.
рисунок Елены Беловой по [38]
И все же, несмотря на большой потенциал в онкологии, современные методы NKT-терапии пока совсем непросто внедрить в клинику. Это редкие «птицы» — их всего 0,01–1% от общего числа T-лимфоцитов, и выделить и размножить их для работы очень сложно. Однако есть специалисты, связывающие будущее онкологического лечения именно с NKT. Например, биотехнологическая компания Kuur Therapeutics специализируется на создании и исследовании терапий такими клетками с внедренным в них CAR-рецептором.
Источники и производство NK-клеток
Клинические испытания показали: нужно использовать высокие дозы NK и многократные инфузии. Это позволяет преодолевать ингибирующее действие лигандов стресса в плазме пациентов с нейробластомой, ограничивающее эффективность терапии [22], [26]. Исходно в клинических исследованиях NK-клетки вводили в дозе 106–109 клеток/кг, но недавно ее увеличили уже до 1010 клеток/кг без видимого вреда для пациентов.
Потребности в NK-клетках растут, но поскольку их всего лишь 10–20% от всех лимфоцитов, много от одного донора не выделишь. А значит, нужно искусственно стимулировать NK-киллеров на размножение ex vivo, а попутно — дополнительно активировать и улучшать их функционал [22], [26].
Производство естественных клеток-киллеров для иммунотерапии
Успешное размножение NK, достаточное для клинического использования, зависит от ряда факторов, определяющих не только количество таких клеток, но и их качество (рис. 8).
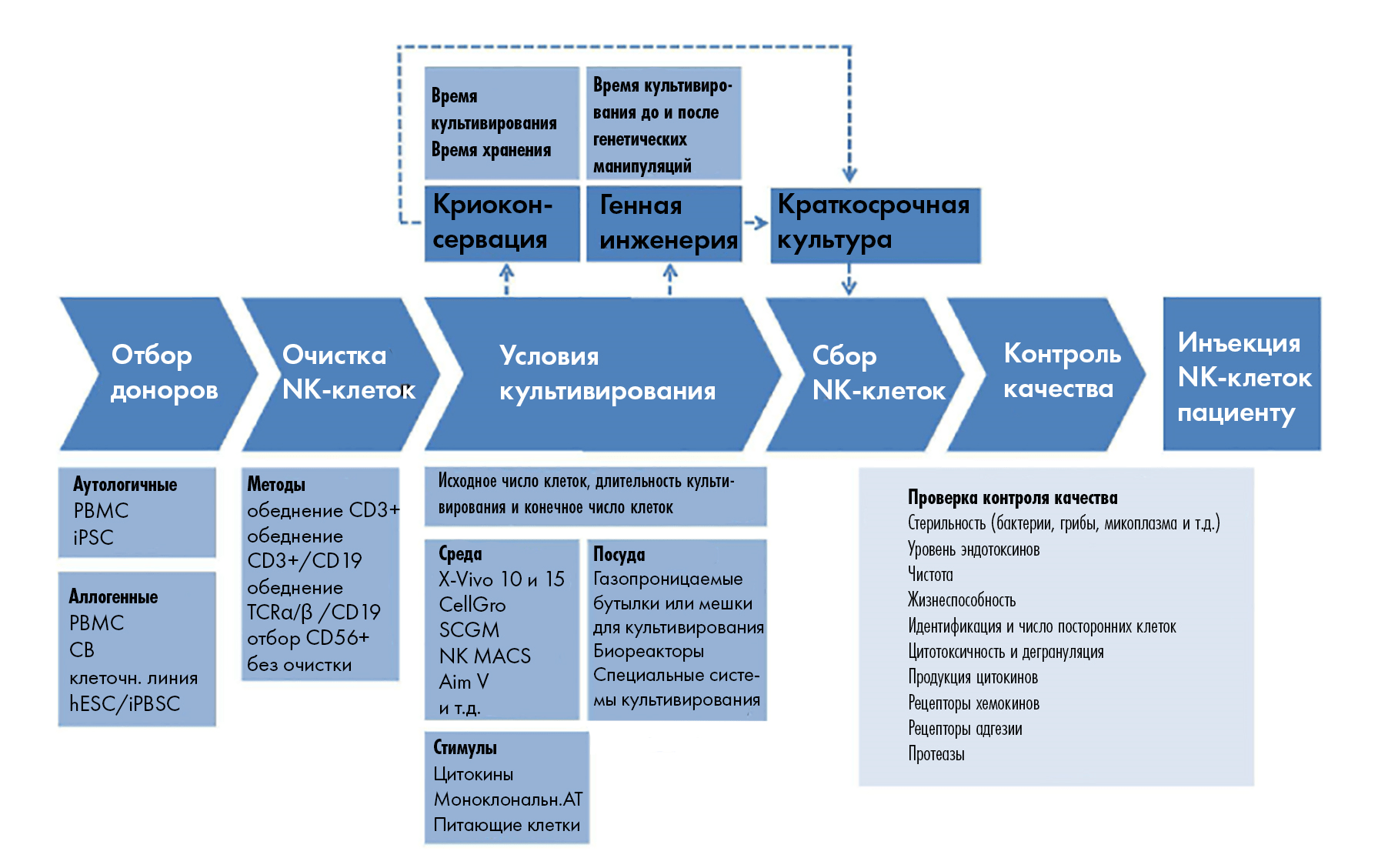
Рисунок 8. Производственные параметры для NK-клеток. На производстве таких клеток нужно контролировать ряд важных параметров, ведь от этого будет зависеть как конечное количество полученных клеток, так и их фенотип (а равно и функциональность ─ читай активность). Особо критичными тут считают: количество клеток при «засеве» (в начале культивирования), их источник, клеточную плотность во время размножения, а также характеристики выбранной для культивирования емкости. Но и другие параметры бывают важными (см. рисунок); пунктиром выделены «необязательные» этапы, ─ без которых иногда в производстве можно и обойтись.
Источники NK-клеток
Существуют различные источники NK: периферическая и пуповинная кровь, костный мозг, человеческие эмбриональные стволовые клетки, NK из индуцированных плюрипотентных стволовых клеток (ИПСК-NK) и NK-клеточные линии. И хотя аутологичные и аллогенные NK-клетки как будто безопасны, найти наилучший их источник — задача нетривиальная.
Считается, что таким характеристикам во многом отвечают NK-клетки периферической крови — они безопасны, просты в получении и прекрасные «киллеры». Однако при изъятии от онкологических больных (аутологичная терапия) их далеко не всегда выходит как следует размножить, и далеко не все они будут иметь в итоге противоопухолевую активность. Когда же их получают от донора, возникают ограничения, связанные с контролем качества: в клинических условиях каждая такая партия потребует проверки, а это отнимет время у пациента, который им может уже просто не располагать.
Другой многообещающий источник — «бессмертные» клоны NK-клеток. Эти клеточные линии гораздо лучше подходят для генно-инженерных манипуляций (например, внедрения CAR) — во многом из-за однородности клеточной популяции и простоты размножения в культуре (а не в доноре). Клеточную линию NK-92 когда-то выделили у пациента с неходжкинской лимфомой, и чаще всего ее использовали в создании CAR-NK для исследований (и даже клинических испытаний, например, NCT00900809 и NCT00990717) [18].
Однако, как это часто бывает, преимущества и недостатки идут рука об руку, и линии NK-92 здесь не стали исключением — у них часто пропадают CD16 и важные активирующие рецепторы, снижая цитотоксический потенциал этих клеток. Так выходит, что из-за короткого срока жизни они не успевают оказать свой терапевтический эффект. Кроме того, есть опасения, что эти клетки могут и сами вызвать онкогенез [18].
В последние годы все более интересно получать NK из ИПСК, — ведь такой источник способен обойти многие ограничения клеточной терапии. Эти клетки обладают плюсами NK-92 (неограниченный рост, отсутствие необходимости в донорах, готовность к использованию (off-the-shelf), однородность популяций) и лишены некоторых их минусов (например, необходимости облучения перед использованием). Но есть у них и прорывные достоинства.
Преимущества ИПСК как источника NK
Гомогенные популяции ИПСК-NK можно «размножать» в клинических масштабах, причем полученные таким путем клетки in vitro показали цитотоксичность против некоторых гематологических и солидных опухолей. У них полный набор поверхностных NK-маркеров, таких как KIRs, CD16, NKp44, NKp46, NKG2D и TRAIL; а ИПСК со встроенным CAR-рецептором уже неплохо нацеливаются на опухоли человека в доклинических исследованиях [18].
В целом такие клетки прекрасно подходят для генетических модификаций, и пока они находятся в плюрипотентной стадии, их можно неограниченно размножать. Другое важное преимущество — выбор курса дифференцировки для формирования фенотипа и функциональности конечного продукта. Например, усиление сигнального пути Wnt ингибитором GSK3b запускает гемопоэз, приводящий к более высокой продукции провоспалительных цитокинов в итоговых NK, в то время как альтернативный путь, напротив, приводит к более цитотоксическому фенотипу. Благодаря выбору типа дифференцировки можно даже создавать органоспецифические фенотипы, повышая тем самым лечебный эффект этих клеток [12].
Совокупность преимуществ и немногие недостатки ИПСК, очевидно, делают такой источник одним из лучших. Убедиться в этом можно, сравнив основные характеристики различных источников в табл. 2 и на рис. 9.
| Источник NK | Преимущества | Ограничения |
|---|---|---|
| Периферическая кровь |
|
|
| Пуповинная кровь |
|
|
| Клеточные линии NK92 |
|
|
| Индуцированные плюрипотентные стволовые клетки (ИПСК) |
|
|
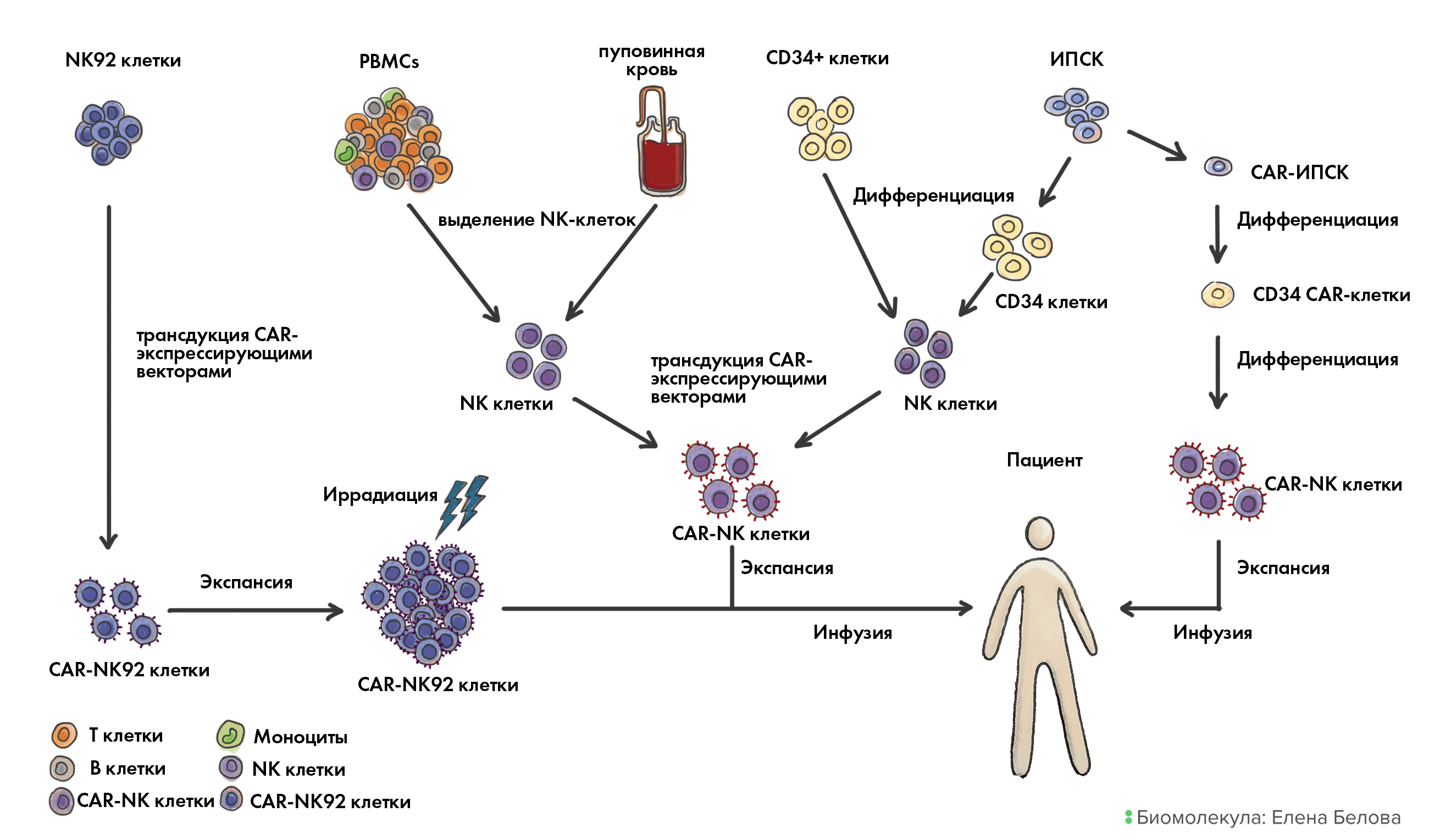
Рисунок 9. Источники и производство NK-клеточных продуктов.
- NK92-клеточные линии широко применялись в качестве источника NK, ведь они неограниченно размножаются in vitro и легко переносят заморозку/оттаивание. Однако как злокачественные клетки (полученные из NK-клеток лимфомы), NK92 даже после генетической инженерии с целью внедрения CAR должны подвергаться летальному облучению перед инфузией пациентам.
- Первичные NK-клетки могут быть выделены напрямую из периферической или пуповинной крови здоровых доноров, затем они могут быть активированы, генетически изменены с внедрением в них вирусными векторами (например, лентивирусом или ретровирусом) CAR, — после чего размножены в особой среде, содержащей цитокины (и соответствующей требованиям GMP для клинического применения).
- NK-клетки могут быть также дифференцированы из CD34+ гемопоэтических предшественников с использованием коктейля из цитокинов при культивировании. Полученные в итоге NK модифицируют рецептором CAR и размножают in vitro перед инфузией.
- Недавно привлекательным источником NK-клеток стали ИПСК — во многом благодаря неограниченной способности к делению. ИПСК можно превратить в предшественники CD34+ и затем в NK-клетки, а если внедрить в ИПСК CAR — то и в CAR-NK-клетки. Так что в этом случае можно достаточно простым и элегантным (но при этом высокотехнологичным) способом получать готовые к применению (off-the-shelf) CAR-NK-клеточные продукты.
NK в клинике: основные стратегии
Сегодня в некоторых продвинутых клинических приложениях используют NK-клеточный потенциал при трансплантации гаплоидентичных гемопоэтических стволовых клеток . В этих случаях активность NK запускается, когда ингибиторные KIR донора и MHC I пациента несовместимы, — а это значит, сигналы к «успокоению» наших убийц отсутствуют, и они спокойно могут приступить к своим прямым обязанностям [39].
Это такая трансплантация, при которой из-за невозможности найти близко совпадающего по HLA-комплексам донора клетки для адоптивного переноса берут у людей, совпадающих по этим маркерам лишь частично. Обычно это близкие родственники: например, у родителей с их детьми всегда 50% соответствие по HLA. У братьев и сестер эти антигенные комплексы тоже могут совпадать наполовину, — но тут уже шансы такого соответствия 1 к 2. Такая технология считается продвинутой во многом потому, что пока еще относительно нова, и услугу эту могут предложить далеко не все медицинские центры.
Другой довольно интересный подход — индукция ADCC с использованием присутствующих на рынке препаратов-антител, специфичных к опухолевым антигенам. Такое возможно, ведь механизмы ADCC, как уже было сказано, тесно связаны с рецептором NK-клеток FcγRIII (CD16), распознающим Fc-фрагменты антител, опсонизирующих клетки-мишени. Так как такая токсичность может приводить к эффективной гибели клеток-мишеней, исследовались несколько стратегий для ее усиления. В частности, комбинация IL-2 или IL-12 с ритуксимабом (антитело против CD20) и трастузумабом (антитело против HER2) у пациентов с лимфомой и раком молочной железы, соответственно, а также трансплантация активированных IL-2 и размноженных ex vivo аутологичных NK-клеток с ритуксимабом. Кроме того, исследовались и биспецифические антитела, способные как к связи с рецептором FcγRIII, так и с опухолевым антигеном, что «по задумке» могло дополнительно усилить нацеливающие свойства NK-клеток. Правда, пока такие подходы так и не показали устойчиво хороших результатов в клинических исследованиях и не дошли до широкого применения.
Кстати, терапия NK-клетками может применяться и в сочетании с традиционными терапевтическими протоколами (химиотерапией, например), что также может помочь ей более эффективно лечить онкологические болезни (рис. 10) [40].
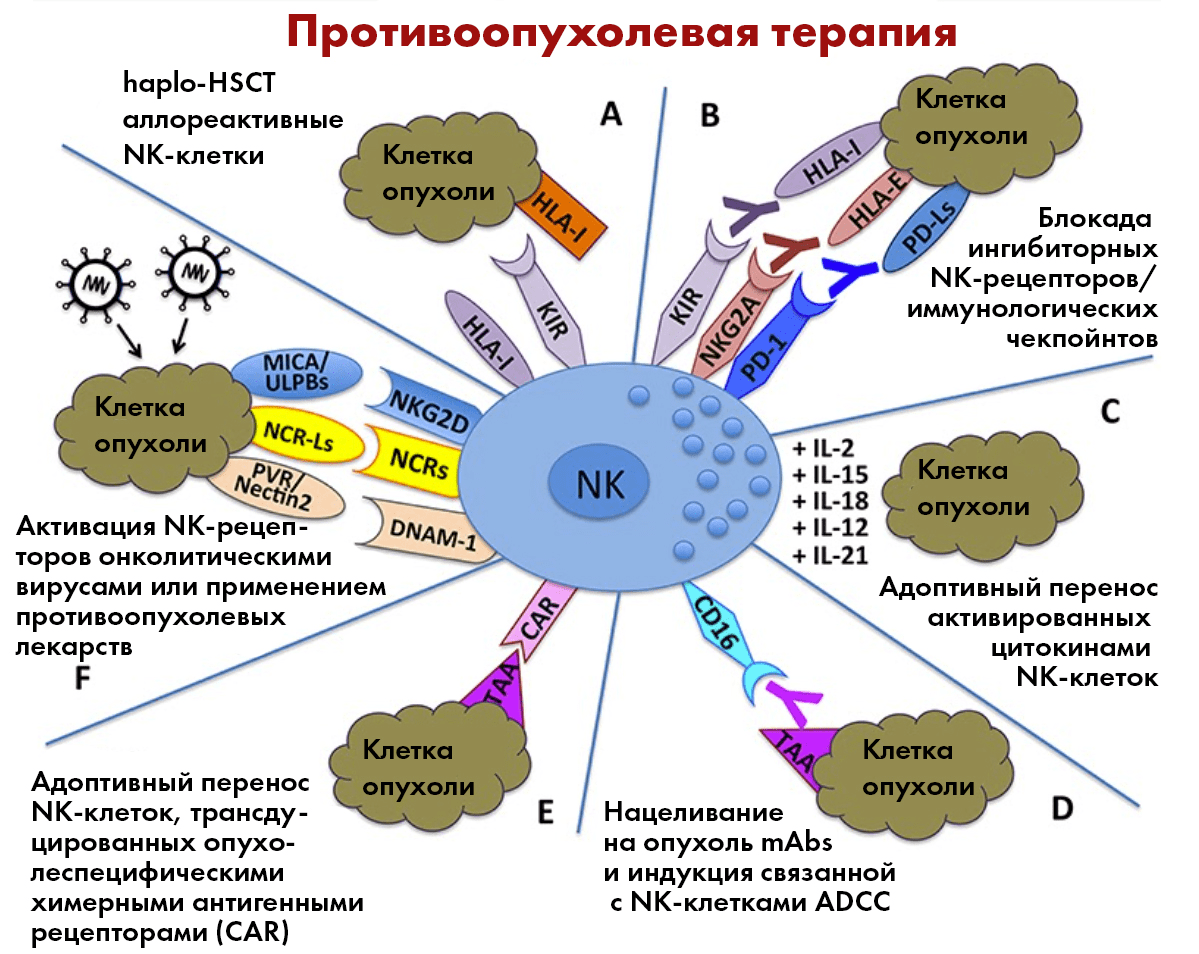
Рисунок 10. Возможные клинические приложения NK-клеток в противоопухолевой иммунотерапии. haplo-HSCT аллореактивные NK-клетки могут уничтожать остаточные лейкемические клетки (А); нацеливание моноклональных антител на иммунологические чекпойнты может «спустить с привязи» противоопухолевую активность NK-клеток — они перестанут «узнавать» в злокачественных клетках «своих» и начнут их уничтожать (B); уничтожение опухолевых клеток может быть усилено за счет адоптивного переноса активированных цитокинами NK-клеток (C) или NK-клеток, трансдуцированных опухолеспецифическими химерными антигенными рецепторами (CAR) (E); нацеливание на опухоль mAbs может индуцировать связанную с NK-клетками ADCC (D); активация NK-рецепторов может быть спровоцирована онколитическими вирусами или применением противоопухолевых лекарств (F).
Совсем недавно CAR-технология, разработанная изначально для «дизайна» Т-лимфоцитов, была применена и к NK-клеткам, и были получены обнадеживающие результаты в терапии как гематологических, так и солидных опухолей. После внедрения CAR такие клетки можно вводить пациентам немедленно, как того и требуют клинические условия. При этом ими можно эффективно разрушать солидные опухоли, клетки которых, как правило, устойчивей, чем опухолевые бласты гематологических онкозаболеваний (например, острого миелоидного лейкоза, неходжкинской лимфомы). И кстати, в NK-клетках CAR фактически играет роль дополнительного «девайса» для распознавания опухолевых «врагов», потому что инструменты естественной цитотоксичности никто не отменял — а они ведь тоже работают и разрушают злокачественные клетки [18]. Так что тут и без того «вооруженные до зубов» NK приобретают дополнительное «нацеливающее» оружие, что и позволяет им стать еще более эффективными убийцами (рис. 11).
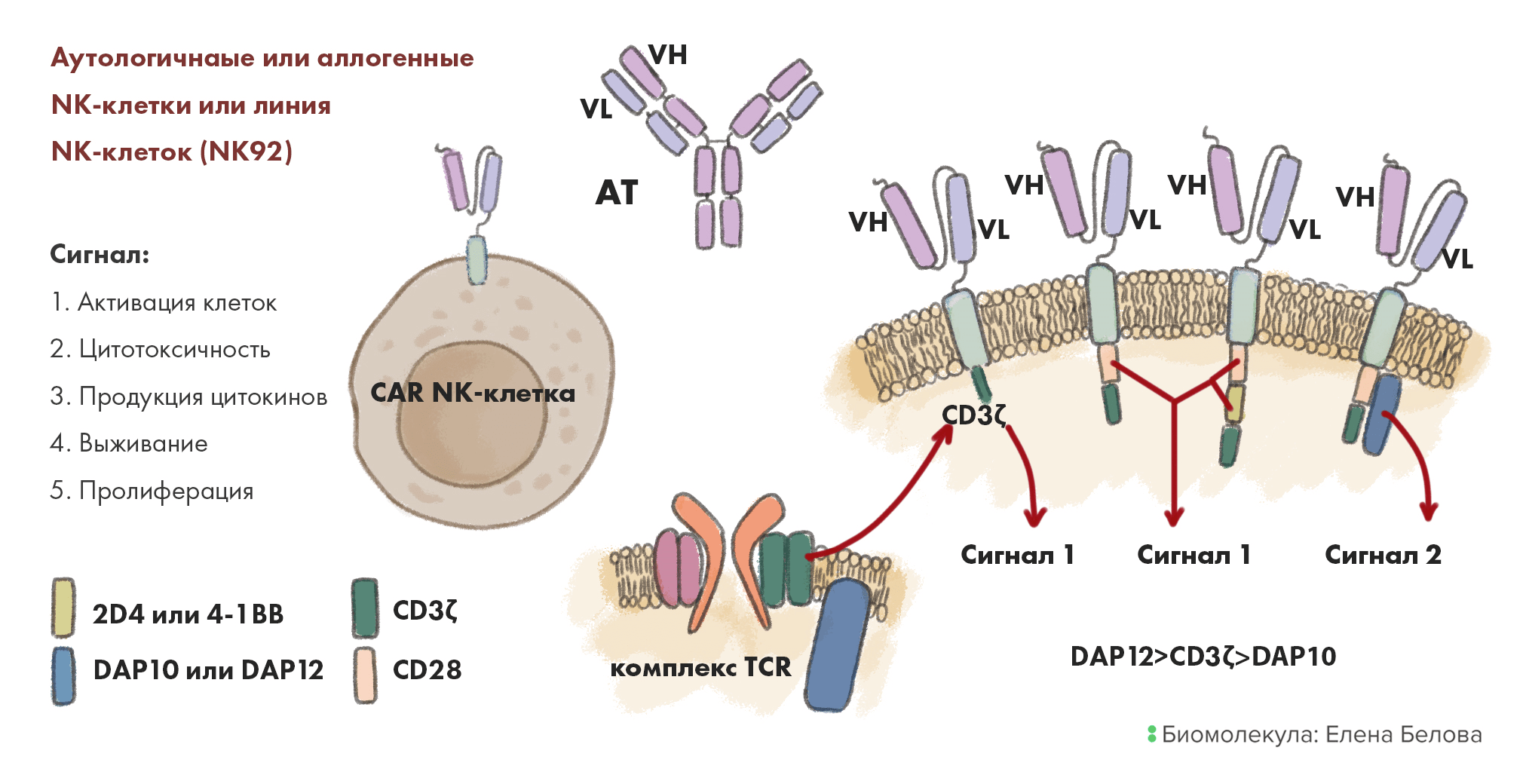
Рисунок 11. Фундаментальные основы инжиниринга трех поколений CAR-NK-клеток. Сам по себе CAR для NK чем-то похож на аналогичный для Т-клеток, но в нем могут быть и отличия. Например, подобно клеткам CAR-T , в NK этот рецептор имеет три основные части: внеклеточную (антиген-детектирующий домен), состоящую из одноцепочечного вариабельного фрагмента (scFv) для нацеливания на специфический опухолевый антиген; трансмембранную; и внутриклеточную (сигнальный домен). Первое поколение CAR-NK-клеток имело в качестве сигнального домена только CD3-ζ (дзета) цепь. В дальнейшем исследования показали, что добавление одного или двух ко-стимуляторных доменов улучшает потенциал и цитотоксичность CAR-NK-клеток. Поэтому второе поколение, помимо первичной CD3-ζ цепи, имеет также CD-28 (или даже комбинацию данного домена с дополнительной сигнальной молекулой 4-1BB). CAR третьего поколения может включать активирующий рецептор (NKG2D), который может быть собран так, чтобы содержать сигнальные молекулы: CD3-ζ и DAP10/12. Было обнаружено, что CD3-ζ имеет лучшие сигнальные свойства, чем DAP10, при этом DAP12, видимо, может активировать NK-клетки даже еще лучше, чем CD3-ζ и DAP10. Так или иначе, вся эта конструкция работает: связывание антигена с рецептором NK-клеток или получение такими клетками сигналов от активирующих рецепторов (таких как NKG2D) приводит к передаче сигнала внутрь клетки, за этим следует активация NK, высвобождение литических ферментов, продукция цитокинов, а также их размножение и включение в защитный противоопухолевый ответ и других иммунных клеток.
О CAR-T и их поколениях можно подробнее прочесть в статье «Способны ли CAR-Т-клетки уничтожить опухоль?» [41].
рисунок Елены Беловой по [18]
Какое будущее ждет прирожденных убийц?
Очевидно, что понимание биологии NK-клеток (функционала, особенностей активирующих и ингибирующих рецепторов) постепенно прокладывает путь к успешному применению в клинике. Это перспективное направление, ведь в NK природой заложено быть «универсальными убийцами» — им даже не мешают такие механизмы ускользания опухолей от иммунного надзора как потеря антигена или подавление экспрессии МНС I. Наоборот (!) — это может их даже «раззадорить» (что в общем-то и требуется), после чего «разъяренным» убийцам остается лишь встретиться с опухолевыми «супостатами». Собственно, современные исследования во многом на это и нацелены: многочисленные попытки как следует активировать и размножить NK, чтобы потом уже направить их в опухоль. Ну и как мы видели на примере ИПСК — здесь тоже есть свои успехи.
Но ученые не были бы учеными, если бы пользовались только тем, что создала природа и никак не пытались бы все это улучшить. В области NK-лечения активно пробуют комбинированную терапию с использованием антител, а также подход CAR-NK. Он уже демонстрирует обнадеживающие результаты в уничтожении различных злокачественных новообразований — как гематологических, так и солидных.
Все существующие экспериментальные подходы активно изучаются, и хотя некоторые из-них, показав большие перспективы в доклинических испытаниях, потерпели неудачу на разных этапах клинических исследований [42], хочется верить, что «лучшие из лучших» все же выведут такую терапию к регуляторному одобрению в самое ближайшее время.
Литература
- May Sabry, Mark W. Lowdell. (2020). Killers at the crossroads: The use of innate immune cells in adoptive cellular therapy of cancer. Stem Cells Translational Medicine. 9, 974-984;
- Три поколения лекарств;
- Клетки, которые лечат людей;
- May Sabry, Mark W. Lowdell. (2020). Killers at the crossroads: The use of innate immune cells in adoptive cellular therapy of cancer. Stem Cells Translational Medicine. 9, 974-984;
- Nawid Albinger, Jessica Hartmann, Evelyn Ullrich. (2021). Current status and perspective of CAR-T and CAR-NK cell therapy trials in Germany. Gene Ther. 28, 513-527;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Faroogh Marofi, Alaa S. Al-Awad, Heshu Sulaiman Rahman, Alexander Markov, Walid Kamal Abdelbasset, et. al.. (2021). CAR-NK Cell: A New Paradigm in Tumor Immunotherapy. Front. Oncol.. 11;
- Paola Minetto, Fabio Guolo, Silvia Pesce, Marco Greppi, Valentina Obino, et. al.. (2019). Harnessing NK Cells for Cancer Treatment. Front. Immunol.. 10;
- Алексеев Л.П., Хаитов Р.М., Долбин А.Г., Болдырева М.Н., Алексеева П.Л., Трофимов Д.Ю., Минина М.Г., Кофиади И.С., Сергеев И.В., Кривошеев М.В. (2015). Иммуногенетика человека и клиническая трансплантация органов в России. Иммунология. 2, 76–89;
- Ahmet Hazini, Kerry Fisher, Len Seymour. (2021). Deregulation of HLA-I in cancer and its central importance for immunotherapy. J Immunother Cancer. 9, e002899;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- Sizhe Liu, Vasiliy Galat, Yekaterina Galat4, Yoo Kyung Annie Lee, Derek Wainwright, Jennifer Wu. (2021). NK cell-based cancer immunotherapy: from basic biology to clinical development. J Hematol Oncol. 14;
- Hans-Gustaf Ljunggren, Karl-Johan Malmberg. (2007). Prospects for the use of NK cells in immunotherapy of human cancer. Nat Rev Immunol. 7, 329-339;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Can M. Sungur, William J. Murphy. (2014). Positive and Negative Regulation by NK Cells in Cancer. Crit Rev Oncog. 19, 57-66;
- Ombretta Melaiu, Valeria Lucarini, Loredana Cifaldi, Doriana Fruci. (2020). Influence of the Tumor Microenvironment on NK Cell Function in Solid Tumors. Front. Immunol.. 10;
- Elizabeth L. Siegler, Yanni Zhu, Pin Wang, Lili Yang. (2018). Off-the-Shelf CAR-NK Cells for Cancer Immunotherapy. Cell Stem Cell. 23, 160-161;
- Faroogh Marofi, Heshu Sulaiman Rahman, Lakshmi Thangavelu, Aleksey Dorofeev, Favian Bayas-Morejón, et. al.. (2021). Renaissance of armored immune effector cells, CAR-NK cells, brings the higher hope for successful cancer therapy. Stem Cell Res Ther. 12;
- Juliane Gust, Agne Taraseviciute, Cameron J. Turtle. (2018). Neurotoxicity Associated with CD19-Targeted CAR-T Cell Therapies. CNS Drugs. 32, 1091-1101;
- Guozhu Xie, Han Dong, Yong Liang, James Dongjoo Ham, Romee Rizwan, Jianzhu Chen. (2020). CAR-NK cells: A promising cellular immunotherapy for cancer. EBioMedicine. 59, 102975;
- Nawen Du, Feifei Guo, Yufeng Wang, Jiuwei Cui. (2021). NK Cell Therapy: A Rising Star in Cancer Treatment. Cancers. 13, 4129;
- Chaopin Yang, Yue Li, Yaozhang Yang, Zhiyi Chen. (2020). Overview of Strategies to Improve Therapy against Tumors Using Natural Killer Cell. Journal of Immunology Research. 2020, 1-16;
- Спецагенты по борьбе с аутоиммунным воспалением: место моноклональных антител в современной ревматологии;
- Как толщина миелина и эпигенетика помогают устойчивости к стрессу;
- Eric Vivier, David H. Raulet, Alessandro Moretta, Michael A. Caligiuri, Laurence Zitvogel, et. al.. (2011). Innate or Adaptive Immunity? The Example of Natural Killer Cells. Science. 331, 44-49;
- Madison N. Temples, Blanka Sharma. (2020). Manufacturing of natural killer cells for treating solid malignancies. Journal of Immunology and Regenerative Medicine. 10, 100031;
- Margery Gang, Pamela Wong, Melissa M. Berrien-Elliott, Todd A. Fehniger. (2020). Memory-like natural killer cells for cancer immunotherapy. Seminars in Hematology. 57, 185-193;
- Ute Sartorius, Ingo Schmitz, Peter H. Krammer. (2001). Molecular Mechanisms of Death-Receptor-Mediated Apoptosis. ChemBioChem. 2, 20-29;
- Yui Harada, Koji Teraishi, Minori Ishii, Hiroshi Ban, Yoshikazu Yonemitsu. (2017). Clinical Applications of Natural Killer Cells. Natural Killer Cells;
- Rasa Islam, Aleta Pupovac, Vera Evtimov, Nicholas Boyd, Runzhe Shu, et. al.. (2021). Enhancing a Natural Killer: Modification of NK Cells for Cancer Immunotherapy. Cells. 10, 1058;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Hormas Ghadially, Lee Brown, Chris Lloyd, Leeanne Lewis, Arthur Lewis, et. al.. (2017). MHC class I chain-related protein A and B (MICA and MICB) are predominantly expressed intracellularly in tumour and normal tissue. Br J Cancer. 116, 1208-1217;
- Ondřej Skořepa, Samuel Pazicky, Barbora Kalousková, Jan Bláha, Celeste Abreu, et. al.. (2020). Natural Killer Cell Activation Receptor NKp30 Oligomerization Depends on Its N-Glycosylation. Cancers. 12, 1998;
- Strandmann E.P., Shatnyeva O., Hansen H.P. (2015). NKp30 and its ligands: emerging players in tumor immune evasion from natural killer cells. Ann Transl Med. 30, 314;
- Monica Parodi, Herman Favoreel, Giovanni Candiano, Silvia Gaggero, Simona Sivori, et. al.. (2019). NKp44-NKp44 Ligand Interactions in the Regulation of Natural Killer Cells and Other Innate Lymphoid Cells in Humans. Front. Immunol.. 10;
- Anastasia I. Palamarchuk, Nadezhda A. Alekseeva, Maria A. Streltsova, Maria O. Ustiuzhanina, Polina A. Kobyzeva, et. al.. (2021). Increased Susceptibility of the CD57− NK Cells Expressing KIR2DL2/3 and NKG2C to iCasp9 Gene Retroviral Transduction and the Relationships with Proliferative Potential, Activation Degree, and Death Induction Response. IJMS. 22, 13326;
- Yu Cui, Qi Wan. (2019). NKT Cells in Neurological Diseases. Front. Cell. Neurosci.. 13;
- Simkins H. Immune Responses in Perforin Deficient Mice: A thesis for the degree of Doctor of Philosophy in Cell and Molecular Biology. — New Zealand, Victoria University of Wellington, 2009. — 251 p.;
- Loredana Ruggeri, Sarah Parisi, Elena Urbani, Antonio Curti. (2015). Alloreactive Natural Killer Cells for the Treatment of Acute Myeloid Leukemia: From Stem Cell Transplantation to Adoptive Immunotherapy. Front. Immunol.. 6;
- Massimo Vitale, Claudia Cantoni, Mariella Della Chiesa, Guido Ferlazzo, Simona Carlomagno, et. al.. (2019). An Historical Overview: The Discovery of How NK Cells Can Kill Enemies, Recruit Defense Troops, and More. Front. Immunol.. 10;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Surojit Karmakar, Pradipta Pal, Girdhari Lal. (2021). Key Activating and Inhibitory Ligands Involved in the Mobilization of Natural Killer Cells for Cancer Immunotherapies. ITT. Volume 10, 387-407.