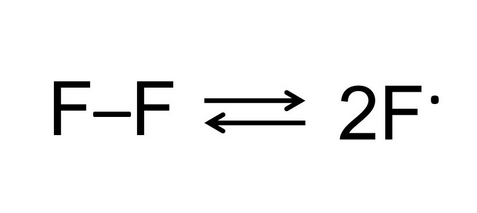От биодеградации к сюрпризам биохимии
28 декабря 2021
От биодеградации к сюрпризам биохимии
- 3097
- 0
- 6
Взирая на красоту природы, мы редко задумываемся о крошечных организмах — бактериях и грибах — которые неустанно стоят на страже чистоты окружающей среды. И, порой, преподносят ученым удивительные сюрпризы.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Тема защиты окружающей среды с каждым годом приобретает все большую актуальность. Вот мы уже взялись за раздельный сбор мусора — десять лет назад об этом даже не задумывались всерьез. Безусловно, на этой волне растет и интерес к биодеградации — одному из самых естественных способов очистки воды и почвы от промышленных и бытовых загрязнителей. Многие солидные и авторитетные научные коллективы плотно заняты этой тематикой. Научные фонды готовы давать приличные гранты — разумеется, в случае убедительной аргументированности проекта. Итак, серьезность и обоснованность биодеградации уже не вызывает сомнений. Но настоящий ученый, романтик по натуре, всегда смотрит вдаль. Ему давай ребусы посложнее, пусть даже их решение не принесет немедленную отдачу. Можно ли, исследуя биодеградацию, встретить такие загадки природы? Оказывается, можно. И если за них взяться, то можно выйти за строгие пределы биодеградации и взглянуть на биохимию в целом. Проследить ее эволюцию. Найти в живых клетках самые невероятные вещества. Обнаружить микробы, перед которыми не устоят ни камень, ни металл. Или даже развернуть биодеградацию вспять и заняться… синтезом.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Занимаясь биодеградацией не первый год, я, естественно, пристально интересовался этой проблематикой. Свои исследования в этой области постарался осветить в статье [1], хотя нельзя не отметить, что за прошедшие после ее опубликования без малого шесть лет работа ушла далеко вперед.
В первую очередь меня, как специалиста-биохимика, интересовал именно биохимический аспект биодеградации, благо, здесь обширнейшее поле для изучения. И произошло закономерное явление. Чем глубже я вникал в метаболизм чужеродных веществ, тем больше получал знаний в смежных областях науки, на первый взгляд с биодеградацией никак не связанных. Проявился знаменитый парадокс Сократа, который представил область знаний как площадь окружности. Чем больше знаний, тем обширнее граница с непознанным, и тем больше проявляется недостаток знаний. Со времен Сократа ничего не изменилось.
Особо подчеркну: смежные области никак не связаны с предметом изучения только на первый взгляд! Но надо очень долго изучать предмет и вникать в его суть, чтобы понять это. В этой статье я хочу сделать акцент не на тех примерах биодеградации, которые доказали свою полезность и уже применяются для защиты окружающей среды. А больше на случаях, вызывающих удивление, не исследованных до конца, не приносящих пользы (временами наоборот, вредных), парадоксальных и порой, спорных. Имеющих большой, но еще не раскрытый потенциал. Или даже, относящихся к биодеградации косвенно, не напрямую. Одним словом, примеров, с которых не следует начинать изучать биодеградацию, но которые хорошо демонстрируют громадные возможности путей метаболизма. В конечном итоге, изучение биодеградации — это изучение химии самой жизни на Земле.
Всегда ли биодеградация полезна?
В одной из своих статей в журнале «Наука и жизнь» [2] я рассказывал про невероятный пример биодеградации. Грибы превращали очень ядовитый и обладающий радиоактивностью металлический обедненный уран в нерастворимую в воде соль, значительно менее опасную для окружающей среды. Вообще, для биодеградации металлов, их сплавов и различных конструкционных материалов (например, бетона) существует особый термин «биокоррозия», хотя в статье [3], откуда был почерпнут данный материал, употребляется более широкий термин «коррозия». Конечно, если речь идет об уране, в полезности этого явления можно не сомневаться. Но микроорганизмы не задумываются о том, где им селиться, и разрушают не только металлолом, но и важные конструкции, от прочности которых зависит безопасность и жизнь людей. То есть, в большинстве случаев биокоррозия — явление вредное, поскольку сокращает срок эксплуатации конструкций и зданий.
Алюминий никому представлять не надо — этот металл в промышленности по важности занимает второе место после железа. Материал легкий и отличающийся отличной электропроводностью, даже по меркам металлов, уступая только серебру и меди. Благодаря низкой плотности алюминий давно и прочно вошел в авиационную промышленность. Точнее, конечно, не чистый алюминий, а его сплавы, имеющие сравнительно высокую прочность. В последние десятилетия в авиастроении, судостроении и космической промышленности сплавы алюминия потеснили более прочные и устойчивые к высоким температурам титановые сплавы, но титан заметно дороже.
Кроме того, алюминий имеет серебристо-белый цвет и замечательную светоотражательную способность. Обертка из алюминиевой фольги прекрасно задерживает тепло и широко применяется, например, в пищевой промышленности (рис. 1а). Итак, алюминий в технике стоит на втором месте после железа. Но в земной коре его больше! Алюминий по распространенности в земной коре среди химических элементов занимает третье место (больше него только кислорода и кремния, и все вместе они слагают алюмосиликатные породы, из которых, собственно говоря, земная кора и состоит). А железо стоит на четвертом месте.
Так почему же алюминий не потеснил железо в металлургии? Главная причина — высокая химическая активность этого металла. Железо хоть изредка, но встречается в самородном виде, поэтому было известно в глубокой древности. Алюминий никогда не образует самородки и встречается в природе исключительно в виде соединений. Металлурги производят его электролизом расплавленного минерала боксита, и процесс этот сопровождается тратой уймы электроэнергии. До появления мощных электростанций, в позапрошлом веке металлический алюминий ценился дороже драгоценных металлов! Вот в этом месте мы подходим к интересному моменту.
Известен главный враг изделий из сплавов железа — чугуна и стали. Это ржавчина, которая серьезно, иногда в десятки раз, сокращает их жизнь. По составу ржавчина напоминает некоторые железные руды: активный металл самопроизвольно превращается в энергетически выгодную, стабильную форму, из которой его с трудом вывели металлурги! Но алюминий еще активнее, и должен еще быстрее окисляться в такой агрессивной среде, как атмосфера. Почему же самолеты, чьи корпуса изготовлены из алюминиевых сплавов, служат десятки лет?
Специфика железа в том, что покрывающие его оксиды и гидроксиды — ржавчина — имеют рыхлую структуру и пропускают кислород и воду к металлу, не препятствуя дальнейшему его разъеданию. А алюминий на воздухе покрывается прочной пассивирующей пленкой из минерала корунда, представляющего собой оксид алюминия Al2O3. Даже само слово «корунд» звучит несокрушимо твердо. И это название полностью отражает свойства материала, который совсем не похож на металлический алюминий. Алюминий плавится при 660 градусах Цельсия, а корунд при 2000 с лишним. Алюминий мягкий и непрочный металл, а корунд… Слово «наждак» изначально употреблялось к одной из разновидностей корунда, состоящей из мелких кристаллов. Понятно, что материал для полировки должен быть твердым. Таким образом, любой предмет из алюминия одет в своего рода футляр из устойчивого оксида. Это и делает его стойким к коррозии.
Различные разновидности корунда являются природными минералами алюминия. Про наждак мы уже говорили. Другой разновидностью является боксит, из которого получают алюминий. Редкий и красивый, похожий на хрусталь лейкосапфир является драгоценным камнем. Сапфиры (рис. 1в) тоже представляют собой разновидность корунда, но окрашены примесями разнообразных металлов в синий, красный, реже в зеленый и желтый цвета. Красный сапфир издавна называется рубином. Эти камни стали цениться ювелирами за тысячелетия до того, как стала известна их химическая природа. Ставшие популярными «сапфировые» защитные стекла на экранах смартфонов тоже представляют собой корунд, только выращенный искусственно и к настоящим природным сапфирам отношения не имеющий. Хотя, отдается должное свойствам минерала: именно его высокая прозрачность в сочетании с прочностью определили использование корунда для этой цели. Мелкодисперсный оксид алюминия является замечательным сорбентом, применяемым в хроматографии.
Казалось бы, под такой надежной защитой, как пленка корунда, алюминию ничего не страшно. И тем не менее… Похоже, живые организмы ко всему могут «подобрать ключ». Прочнейший минерал падает под ударами неприметных плесневых грибков, обитающих на его поверхности.
Коллектив авторов из Нижегородского государственного технического университета длительное время исследовал биокоррозию алюминия и других металлов [4]. В результате они пришли к выводу, что механизм коррозии достаточно прост. Пассивирующая пленка растворяется, поверхность химически активного металла оголяется и окисляется кислородом воздуха. Продуктом коррозии становится все тот же корунд. То есть, алюминий, как и железо, возвращается в термодинамически стабильное состояние руды. А вот как это происходит? До конца неизвестно. Грибки разных видов, среди которых наиболее активной корродирующей способностью обладает альтернария Alternaria alternate (рис. 1б), выделяют экссудат, обладающий слабощелочной реакцией. Авторы предполагают, что разрушающим воздействием обладают активные формы кислорода — перекись водорода и радикал супероксид, продуцируемые грибом в составе экссудата.
Зачем грибам окислять алюминий? Доподлинно мы это тоже не знаем. Возможно, они не стремятся к этому, и биокоррозия — просто побочное действие их жизнедеятельности. Возможно, растворяя минералы, грибы выискивают примеси необходимых биогенных элементов, например, калия или железа. Сам алюминий им нужен навряд ли, поскольку его биологическая роль не выявлена (разве что влияние на окраску лепестков растений, продемонстрированное на рис. 1ж) [5]. Более правдоподобно обратное — микроорганизмы окисляют алюминий, чтобы превратить его в нетоксичный, биологически инертный корунд. Металлический алюминий и его растворимые соли ядовиты! Возможен и более удивительный вариант. Любой металл — это богатейший источник электронов, которые живые клетки используют в своих электронтранспортных цепях. Но такое использование металлов и их соединений характерно для бактерий-хемосинтетиков [6], не для грибов.
Те же авторы продемонстрировали биокоррозию цинка несколькими бактериальными штаммами [7]. В работе [8] сообщается о биокоррозии зубных коронок, изготовленных из титанового сплава, микрофлорой ротовой полости. Цинк и титан схожи с алюминием в том плане, что тоже являются химически активными металлами, легко окисляются и также покрываются на воздухе пассивирующей пленкой из оксидов.
Оказывается, даже такой инертный материал, как стекло, подвержен биодеградации. Плесневые грибы разрушают его, вытравляя поверхность [9]. Бетонные конструкции страдают от биокоррозии, вызываемой растущими на их поверхности бактериями и плесневыми грибами, а точнее, продуцируемыми ими кислотами [10]. Подумать только, какая сила заключена в невидимых глазом микробах, если они способны разрушать бетон — прочнейший материал! Для окружающей среды биокоррозия полезна, поскольку позволяет обезвреживать ядовитые металлы и возвращает в природный круговорот биогенные элементы. Для хозяйственной деятельности человека это явление в ряде случаев может оказаться очень вредным. Разрушение бетона от биокоррозии сопровождается образованием солей, таких как гипс, и является частью глобального природного процесса растворения горных пород уникальным микробным сообществом, включающим силикатные бактерии, добывающие из силикатов питательные элементы. Бактерии «грызут гранит» в самом буквальном смысле!
Разложение вспять
В своей статье [11] я рассказывал про очень необычную реакцию — полимеризацию анилина при помощи растительной пероксидазы. Собственно, в самой полимеризации органических молекул ничего необычного нет — она постоянно происходит в природе и находит широкое применение в промышленности. Удивительно то, что в ней оказался задействован фермент! В последние десятилетия биотехнология все глубже внедряется в химическое производство, поскольку ферменты являются самыми эффективными катализаторами [12]. Это является мощным стимулом для поиска и изучения новых ферментативных активностей. И наши представления о ферментативных реакциях существенно расширились.
При помощи той же самой пероксидазы хрена удается полимеризовать фенол. Фермент превращает молекулы фенола в активные радикалы, за счет отщепления воды. Дальше радикалы образуют недостающие химические связи между собой, и получается полимер полифенол — материал, по свойствам сильно похожий на фенолформальдегидные пластики и который, возможно, придет им на смену [13], [14] (рис. 2). Про фенолформальдегидные смолы я уже рассказывал в статье [15]. В некотором смысле эту полимеризацию можно рассматривать как детоксикацию: полимеризуясь, фенол полностью теряет токсические свойства. А технологов эта реакция заинтересовала потому, что традиционное производство пластмасс требует сразу двух высокотоксичных видов сырья — фенола и формальдегида. Полимеризация фенола позволяет исключить хотя бы формальдегид.
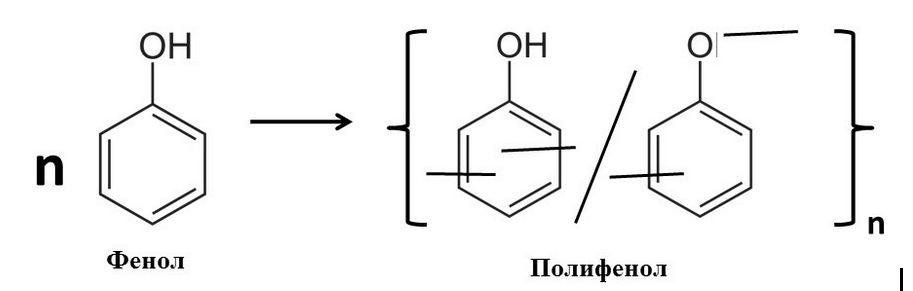
Рисунок 2. Полимеризация фенола пероксидазой.
Рисунок автора
Известно, что большинство ферментативных реакций обратимые [12]. В определенных условиях фермент может продукты собственной реакции превратить обратно в субстраты. Но, даже зная об этом, я был удивлен, ознакомившись с несколькими примерами того, как ферменты, в норме расщепляющие сложные молекулы, могут заново «собирать» их. При этом обратном катализе могут получаться точно такие же молекулы, как до расщепления, либо близкие природным аналогам по структуре. То есть, ферменты оборачивают биодеградацию вспять!
Ферменты липазы в природе имеют важное значение для усвоения пищи животными и микроорганизмами. Они осуществляют гидролиз жиров и масел (рис. 3б) до глицерина и жирных кислот, которые, будучи намного более гидрофильными по сравнению с исходными липидами, легче усваиваются. Фактически, жир превращается в туалетное глицериновое мыло, только без щелочи. Не зря химики-технологи называют процесс гидролиза жиров (правда, щелочной, не ферментативный) «омылением». Неудивительно, что липазы являются обязательным компонентом любых современных стиральных порошков и моющих средств.
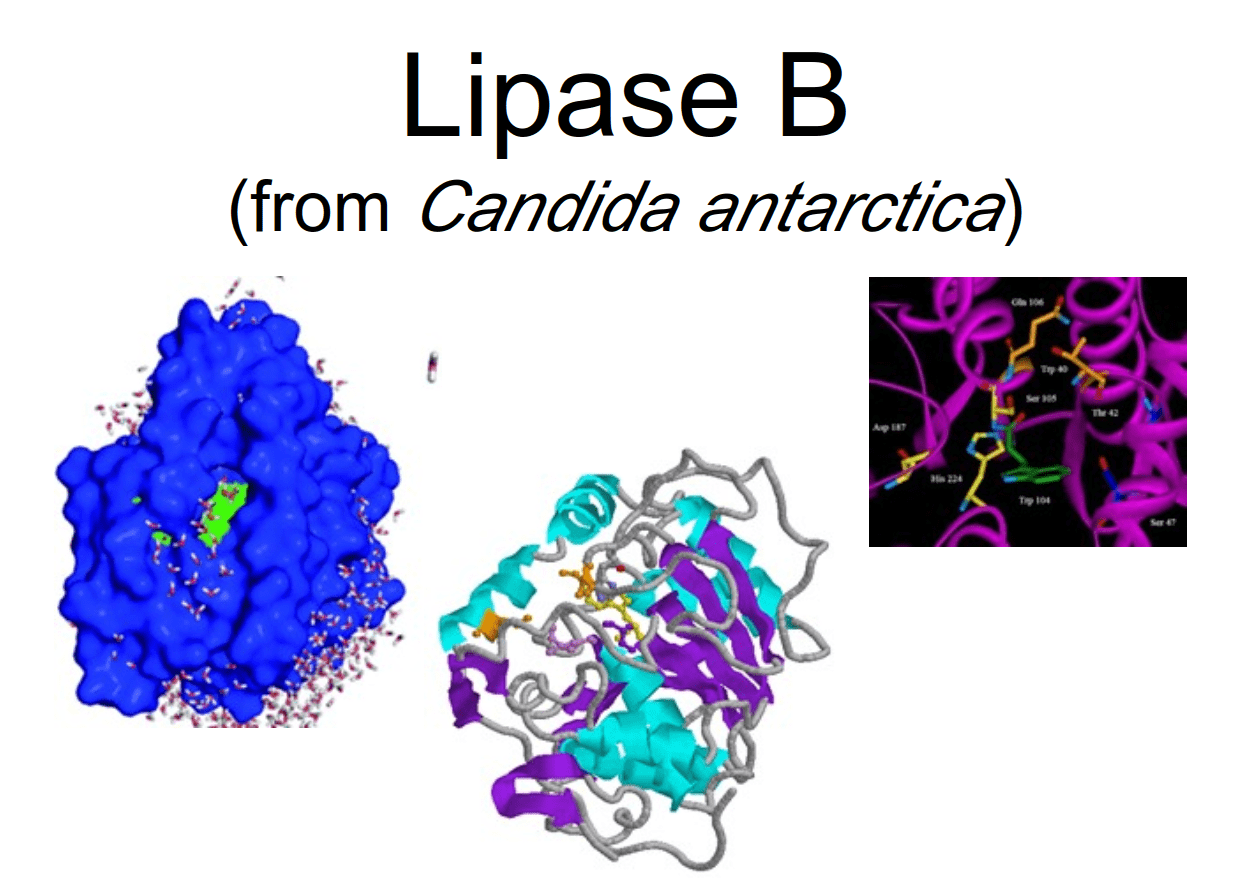
Однако субстратная специфичность липаз очень широка. Поэтому данный класс ферментов вызывает куда более пристальный интерес, чем просто средства для выведения пятен на одежде. В этом плане особенно выделяется липаза из дрожжевого грибка Candida antarctica — очень популярного продуцента ферментов для коммерческих биопрепаратов [16] (рис. 3а).
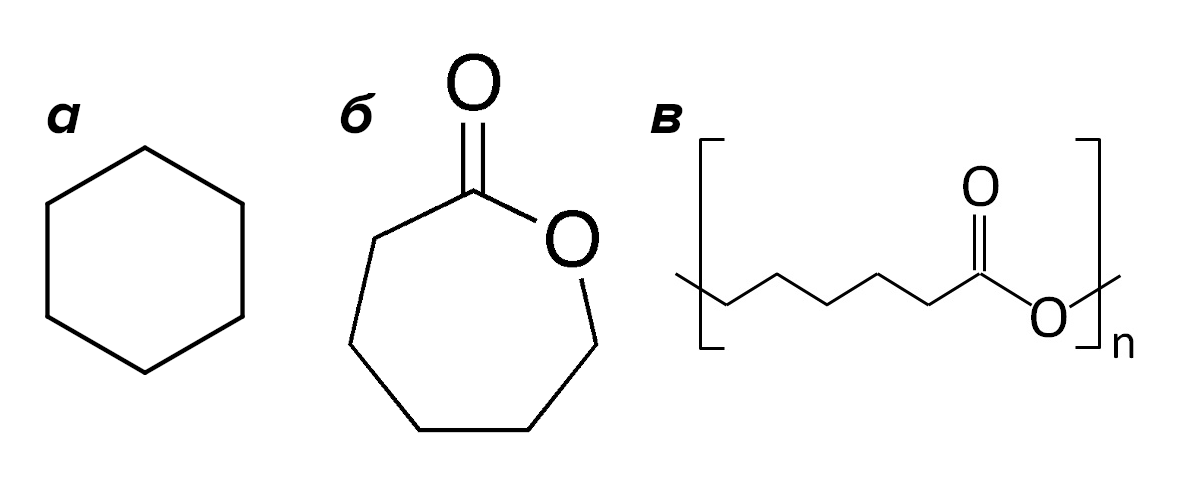
Если напрячь память, то можно вспомнить из школьного курса органической химии, что животные жиры и растительные масла относятся к классу сложных эфиров. То есть, липазы — одна из групп многочисленного семейства ферментов эстераз, занятых гидролизом сложных эфиров до кислот и спиртов. И вот выяснилось, что липазы не только гидролизуют сложные эфиры. Они ведут обратную реакцию их синтеза, конденсацию спиртов и кислот с отщеплением воды. Причем в качестве спирта может выступать не только глицерин, но и этиленгликоль, сахар, этанол, бензиловый спирт — практически любое вещество, содержащее спиртовую гидроксильную группу. Мало того, липазы синтезируют не только сложные эфиры жирных кислот, но и амиды, в которых кислород замещен на азот, а также полиэфиры на основе двухзамещенных карбонатов и трехзамещенных фосфатов. Оказалось, что с помощью липаз можно получать большое разнообразие соединений, в том числе даже совсем не имеющие отношение к жирам полимеры — полиэфиры и полиамиды [17], [18]. Для этого одноосновные жирные кислоты нужно замещать двухосновными, скажем, адипиновой кислотой, способными образовывать две эфирные связи одновременно (рис. 4б). Сополимеризацией адипиновой кислоты и гексаметилендиамина получают полиамид нейлон — известный материал для пошива одежды: курток, женских чулок и колготок (рис. 4в). Что тут говорить — при помощи липаз удалось даже полимеризовать ε-капролактам и получить капрон (рис. 4а), до сих пор считавшийся совершенно чуждым для биологических объектов [19]!
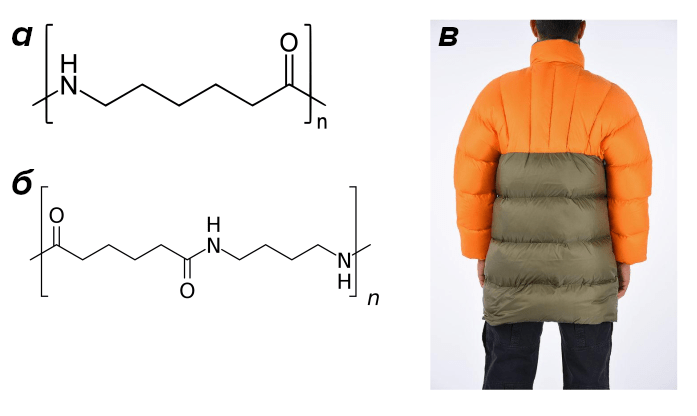
Рисунок 4. а — cтруктурная формула нейлона 6 (капрон, полимер ε-капролактама) и б — нейлона 6,6 (анид, сополимер адипиновой кислоты и гексаметилендиамида). В настоящее время их получают химической конденсацией мономеров, однако, в ближайшем будущем, возможно, будут привлечены и ферменты. в — Полиамиды различного состава, объединенные торговым названием «нейлон», являются искусственными заменителями шелка, и используются, в производстве одежды, тросов и т.д.
«Википедия», Glamood
При помощи поли-3-гидроксибутиратдеполимеразы из Pseudomonas lemoignei — близкого к липазам фермента, в норме гидролизующего запасные вещества бактерий полигидроксиалканоаты — удалось полимеризовать ε-капролактон, который сам является метаболитом циклогексана (рис. 5а). Причем не только микробным: аналогичным образом циклогексан метаболизируется и в организме человека [20]. Таким образом, давно известное биоразлагаемое волокно поликапролактон, применяемое для изготовления медицинских швов (рис. 5г), условно можно считать природным веществом, и даже более того, получать биологической конверсией компонента нефти [21]!
Поистине, биотехнология находит применение в самых неожиданных сферах. А мне, как специалисту в области биодеградации, стало интересно другое. Ферменты, в норме осуществляющие катаболические реакции расщепления, могут осуществлять прямо противоположные реакции синтеза! Конечно, для раскрытия необычных способностей липаз и прочих эстераз необходимо выполнить ряд условий, которые не реализуются в природе. Например, реакции конденсации осуществляют в неводных растворителях, таких как толуол. Здесь все понятно: в водной среде, в условиях сильнейшего избытка Н2О, обратимая реакция будет смещаться в сторону гидролиза. Это и наблюдается в природе, в живых клетках. Оказалось, что липазы не теряют активность в органических растворителях, что и позволяет использовать их в производстве полимеров.
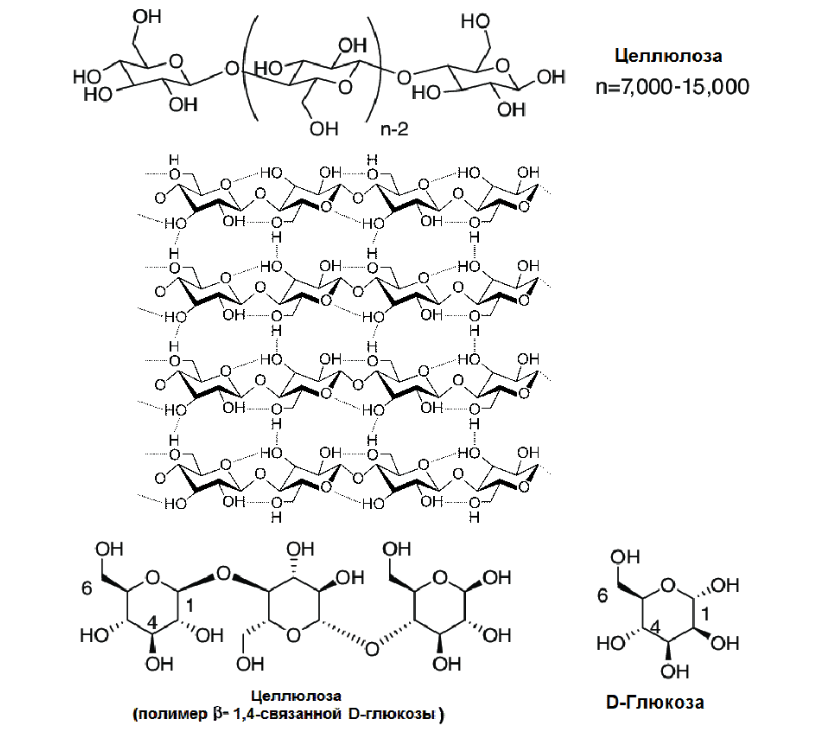
Эстеразы, в свою очередь, входят в обширный класс ферментов гидролаз, осуществляющих гидролиз, как следует из названия. Гликаназы заняты гидролизом полисахаридов. Интересно, могут ли они, подобно липазам, осуществлять обратные реакции синтеза? Целлюлоза, или клетчатка, является самым распространенным органическим веществом в биосфере (рис. 6а). За год в биосфере Земли растениями, бактериями и некоторыми своеобразными представителями морских хордовых животных (оболочники, тела которых одеты в тунику из туницина — одной из форм клетчатки) синтезируется количество целлюлозы, масса которой в тысячу раз превосходит вес всего человечества [22]! Про строение этого важнейшего полисахарида я уже рассказывал в статье [23]. Значение целлюлозы для промышленности трудно переоценить. Из нее состоят бумага и картон, хлопковая ткань. Производят целлюлозу не химическим путем — ее синтез представляет собой большую проблему, с ним справляются только ферменты — а по старинке, из растительного сырья. Сравнительно низкомолекулярную целлюлозу для изготовления бумаги получают из древесины, а более прочную высокомолекулярную для производства хлопчатобумажных тканей — из волокнистых «парашютов» семян хлопчатника (растения из рода Gossypium семейства мальвовых) (рис. 6б). А как вырабатывается целлюлоза в самих растениях? При помощи сложнейших целлюлозосинтетазных ферментных комплексов, состоящих из 36 субъединиц и способных двигаться, оставляя за собой целлюлозную фибриллу [24]. Предшественниками целлюлозы являются фосфорные эфиры глюкозы — уридиндифосфатглюкоза или гуанидиндифосфатглюкоза.
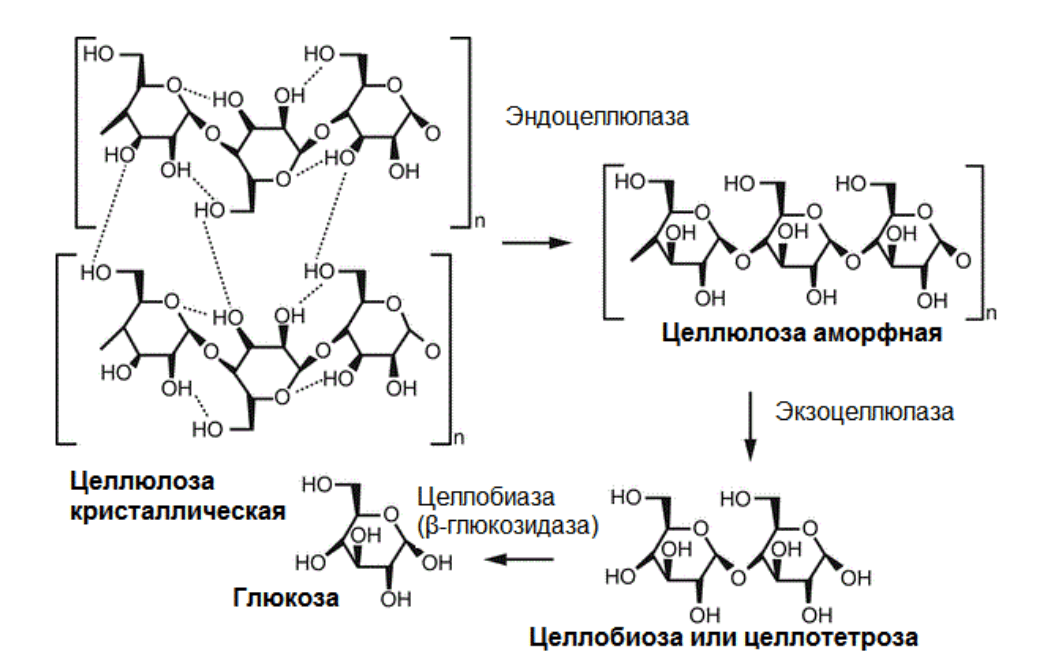
Разложением целлюлозы занимаются совсем другие ферменты — целлюлазы. Целлюлазы действуют эффективно: очень устойчивая к физическим и химическим воздействиям, прочная целлюлоза растворяется при комнатной температуре за считанные недели или даже дни. Эти ферменты гидролизуют целлюлозу до дисахарида целлобиозы, в котором два остатка глюкозы соединены β-1,4-гликозидной связью. Фактически, целлобиоза — это структурная единица целлюлозы.
И вот, я встретил интереснейший обзор, написанный авторами из Японии и посвященный ферментативной полимеризации [25]. В нем представлен весьма любопытный пример синтеза искусственной целлюлозы. Как и в случае с липазами, реакция производится в неводном растворителе — авторами использовался ацетонитрил с ацетатным или фосфатным буфером. Продукт целлюлаз целлобиоза был заменен близким по структуре β-целлобиозилфторидом. В этих условиях целлюлаза производила синтез целлюлозы! То есть, реакцию, обратную той, которую данный фермент осуществляет в природе. Конечно, конденсация дисахарида сопровождается в данном случае отщеплением не воды, а фтористого водорода HF (рис. 6в). Продуктом реакции становится нерастворимая волокнистая масса искусственной целлюлозы. Правда, укладка молекул не такая, как у натуральной. Если целлюлозосинтетаза синтезирует целлюлозу I, то продуктом целлюлазы становится целлюлоза II — эта модификация обычно образуется при выделении целлюлозы из растворов.
Синтез искусственной целлюлозы, безусловно, интересен. Но поднимается вопрос практической значимости. Целлюлозу настолько легко производить из растительного сырья, а искусственные синтезы ее столь сложны и нерентабельны, что описанная реакция может иметь только фундаментальное значение. Впрочем, нет ничего практичнее хорошей теории, не так ли?
На самом деле, синтез при помощи целлюлаз может получить практическое применение. Достаточно вспомнить о том, что используется не только нативная целлюлоза, но и ее производные. Это метилцеллюлоза, этилцеллюлоза, нитроцеллюлоза, ацетилцеллюлоза, фосфорилированная целлюлоза, карбоксиметилцеллюлоза, диэтиламиноэтилцеллюлоза (ДЭАЭ-целлюлоза) и ряд других. Из них делают взрывчатые вещества, искусственные волокна и пленки, ионообменники, огнеупорные материалы, изоляционные материалы и пенообразователи, эмульгаторы и пищевые добавки. А для получения этих производных следует подвергать химическому воздействию целлюлозу, что может негативно сказываться на свойствах материалов. Например, целлюлоза во время реакции может терять молекулярную массу, и соответственно, прочность.
И вот выяснилось, что, заменяя целлобиозилфторид его замещенными производными, можно получать не существующие в природе разветвленные и замещенные полисахариды на основе целлюлозы. Например, упомянутую метилцеллюлозу — из нее кинематографисты изготавливают хлопья искусственного снега. Применяется метилцеллюлоза и в качестве эмульгатора. Целлюлозосинтетаза так работать не станет, слишком щепетильна к выбору субстрата. А у целлюлазы субстратная специфичность намного шире, она справляется. И ведь целлюлаза не единственная! Из α-мальтозилфторида при помощи фермента амилазы, в норме гидролизующего крахмал, получена искусственная амилоза — компонент того же крахмала. Из β-ксилобиозилфторида при помощи ксиланазы в сходных условиях образуется ксилан, из оксазолинового мономера хитобиозы при помощи хитиназы — синтетический хитин, а из оксазолина N-ацилхондрозина посредством гиалуронидазы — гиалуроновая кислота, входящая в состав хрящевой ткани. С учетом возможных химических модификаций, таким путем можно синтезировать огромное количество полимеров с самыми разнообразными свойствами! Так что описанная схема синтеза полисахаридов вполне может оказаться востребованной на практике.
На мой взгляд, самыми удивительными примерами ферментативной полимеризации является полимеризация винильных групп СН2=СН–. Да-да, тех самых, которые встречаются в молекулах большинства промышленных мономеров. В статье [27] я уже рассказывал про полимеризацию акриламида лакказой — ферментом, в природе разлагающего лигнин. Так вот, таких примеров известно несколько. Например, при помощи ксантиноксидазы из E. coli удалось полимеризовать метилметакрилат, при помощи пероксидаз — стирол и его производные [28–31]. Напомню о важном значении, которые имеют эти полимеры. Полиметилметакрилат (рис. 7а) издавна прозвали «органическим стеклом» за его прозрачность. В отличие от настоящего стекла, оргстекло легче, гибче и не бьется, только трескается при ударе. Поэтому изначально, еще до Второй мировой войны, полиметилметакрилат под торговым названием «плексиглас» применяли для изготовления кабин самолетов (рис. 7в). Полистирол (рис. 7б) всем известен — из него делают одноразовую пластиковую посуду, стаканчики для йогуртов, пенопласты (рис. 7г). Таким образом, полиметилметакрилат, полиакриламид и полистирол могут являться продуктами ферментативных реакций! Вполне возможно, что не только они. Винилхлорид или этилен теоретически тоже могут полимеризоваться ферментами, хотя эти реакции еще не описаны. Во всяком случае, вряд ли можно сомневаться в том, что в недалеком будущем пластмассы будут производить при помощи ферментов.
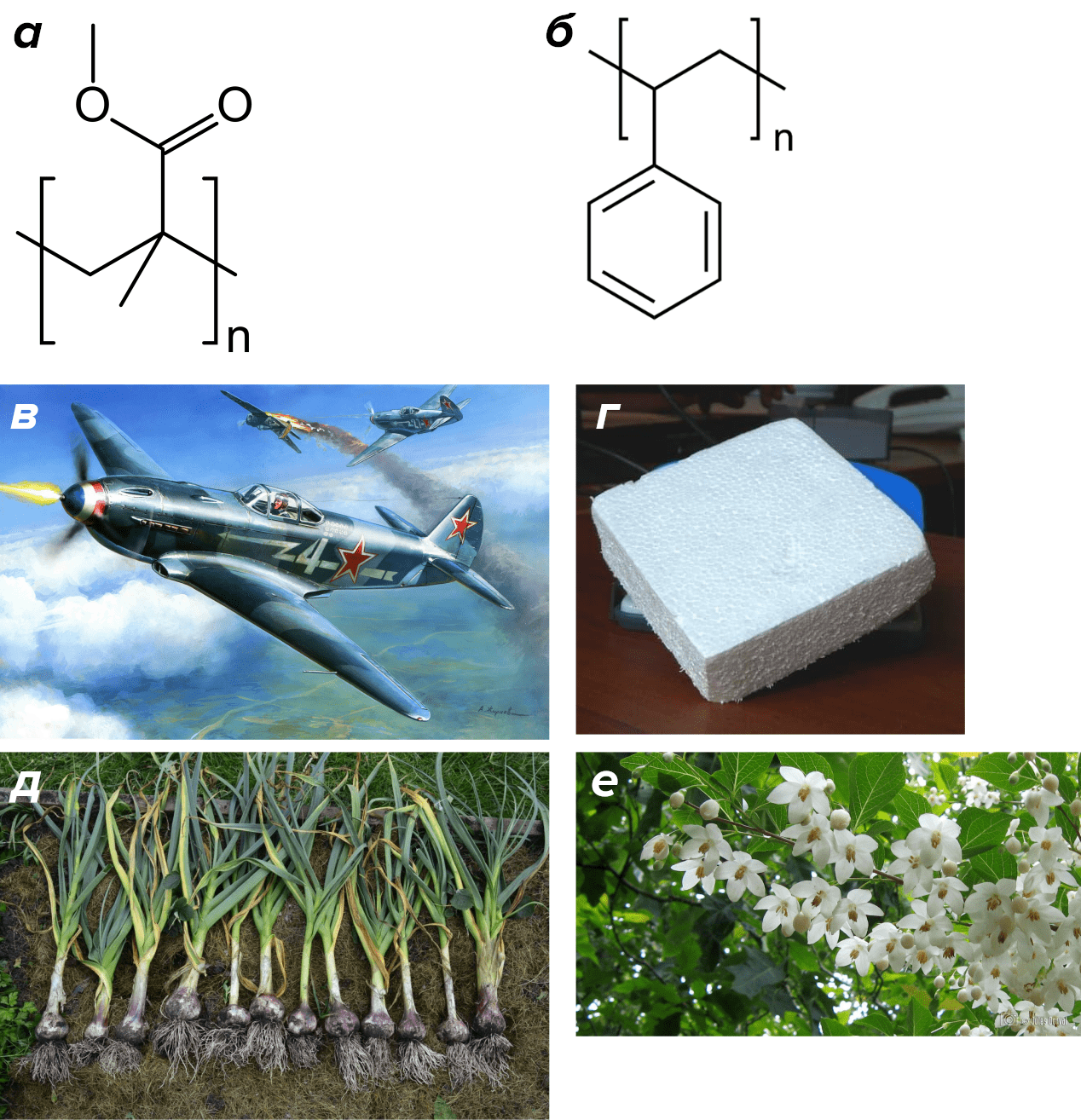
Рисунок 7. а — Структурная формула полиметилметакрилата. б — Структурная формула полистирола. Объемные фенильные радикалы мешают макромолекулам полистирола плотно упаковываться в кристалле. Поэтому данный полимер обладает низкой прочностью и идет на изготовление одноразовых вещей — пластиковой посуды для пикников и пенопластов. в — Из легкого и прочного органического стекла делали колпаки кабин самолетов Второй мировой войны. г — Кусок пенопласта из пенополистирола. д — Мономерная метакриловая кислота является метаболитом чеснока (Allium sativum) е — Веточка «ландышевого дерева» — стиракса бензойного — в цвету. В смоле этого дерева, помимо прочего, содержится мономерный стирол.
Следует добавить, что мономерные стирол и метакриловая кислота известны в природе [32], [33]. Стирол входит в состав лечебной смолы, продуцируемой тропическими деревьями Styrax benzoin, произрастающими на Суматре (рис. 7е). В последнее время его стали вырабатывать при помощи микроорганизмов — бактерий и дрожжей [34]. Метакриловая кислота является промежуточным звеном в биосинтезе едкого вещества аллицина в луке и чесноке (рис. 7д). Стало быть, есть основания считать данные полимеры (раз уж их производят ферменты!) природными веществами. Что, конечно, отнюдь не означает, что их следует бесконтрольно выбрасывать без утилизации.
Таким образом, ферменты, заточенные эволюцией под разложение веществ сложного строения, их биодеградацию, оказываются способны и к биосинтезу. Причем субстратная специфичность таких ферментов, как правило, выше, чем у ферментов, выполняющих функции синтеза в живых клетках. Поэтому они находят и будут находить применение в промышленном производстве высокомолекулярных соединений.
За гранью фантастики
В своей статье в «Биомолекуле»: [15] я рассказывал про биосинтез L-серина из формальдегида, присоединяемого к глицину. В последующей статье [11] описал биосинтез L-аспарагина и L-аспарагиновой кислоты из серина и цианида. Признаюсь, меня очень сильно вдохновил этот биосинтез. Причем не только своей полезностью (два яда первого класса опасности превращаются в аминокислоту, «кирпичик жизни!»), но и поразительным изяществом. Одноуглеродные фрагменты входят в состав природной молекулы, как строительные блоки. Можно, конечно, повосхищаться совершенством метаболического пути и забыть, заняться другими делами, более злободневными. Но настоящие ученые, разумеется, так не поступают.
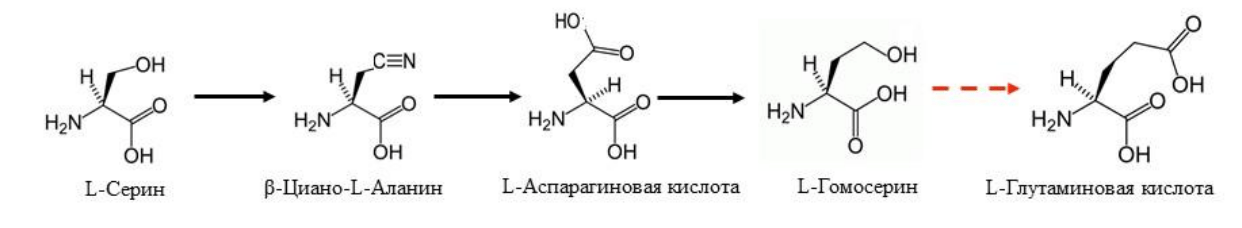
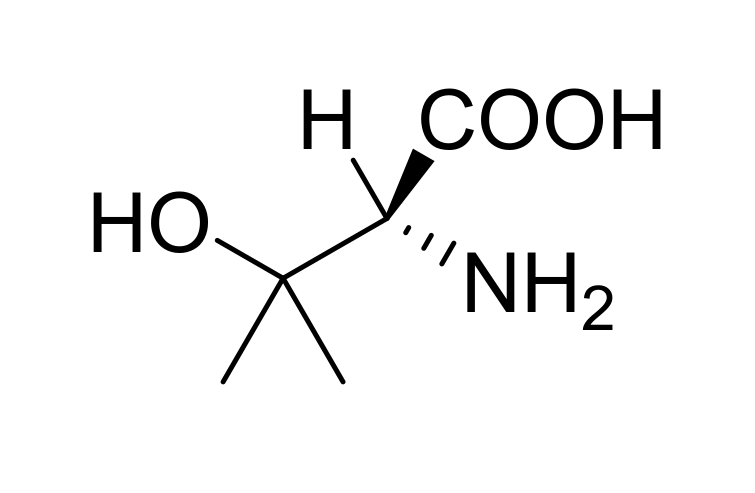
Итак, напомню, что аспарагиновая кислота образуется из другой ценной аминокислоты — аспарагина. Аспарагин, в свою очередь, образуется в том числе при помощи ферментов нитрилаз из β-цианоаланина, который, в свою очередь, получается реакцией синильной кислоты с цистеином или (реже) серином. Но давайте вспомним, что у этих аминокислот есть «двойники», (или, по-научному, гомологи) — аминокислоты гомоцистеин и гомосерин, которые не входят в состав белков, но задействованы в метаболизме аминокислоты метионина. Приставка «гомо-» как раз и взята от слова «гомолог» и означает присутствие дополнительной метиленовой группы. То есть, если цистеин и серин являются производными пропионовой кислоты (серин — это α-амино-β-гидроксипропионовая кислота, а цистеин, соответственно, — α-амино-β-меркаптопропионовая), то гомосерин и гомоцистеин — это производные масляной кислоты. Например, гомосерин представляет из себя α-амино-γ-гидроксимасляную кислоту. А теперь вопрос на засыпку — какое соединение является биохимическим предшественником гомосерина? Правильно, аспарагиновая кислота [35]! Карбоксильная группа последней восстанавливается до альдегидной и далее до спиртовой, гидроксиметильной. То есть, мы можем представить биосинтез гомосерина из формальдегида и синильной кислоты как продолжение биосинтеза аспартата.
В диссертационной работе сотрудника Берлинского технического института, китайского исследователя Инь Ма, описаны интереснейшие реакции замещения гидроксильной группы гомосерина, имитирующие биосинтез метионина [36]. И среди них уже знакомая нам реакция гомосерина с цианидом, приводящая к аминокислоте γ-цианогомоаланину при помощи фермента гомосеринацетилтрансферазы бактерии Corynebacterium glutamicum. Эта аминокислота, судя по всему, не встречается в природе. Но при ее гидролизе нитрилазой получатся очень хорошо известные гомологи аспарагина и аспарагиновой кислоты — глутамин и глутаминовая кислота (рис. 8). Эти аминокислоты входят в состав белков и придают им гидрофильные свойства.
Глутаминовая кислота выполняет роль нейромедиатора в центральной нервной системе и является предшественником другого важнейшего и известного медиатора — ГАМК, γ-аминомасляной кислоты [37]. Пожалуй, каждый наслышан о глутамате натрия, который порой нещадно добавляют в фастфуд для придания последнему аппетитного запаха и вкуса вареного мяса. Именно глутаминовая кислота, одна из самых распространенных аминокислот в белках, является для наших вкусовых рецепторов своего рода маркером, сообщающим, что пища мясная. Для нас же важно, что эти важнейшие биологические молекулы можно получить из молекулы формальдегида и двух молекул синильной кислоты.
Кстати, образующийся в качестве промежуточного продукта L-гомосерин может стать предшественником не только метионина, но и N-ацил-L-гомосеринлактонов, сигнальных молекул у бактерий, полярных липидов гомосеринбетаинов, а также входящей в состав белков аминокислоты L-треонина [38]. Глутамат, в свою очередь, является предшественником аминокислоты L-аргинина, иминокислот пролина и оксипролинов, входящих в состав белков и пептидов. А также, широко востребованных медициной антибиотиков карбапенемов, L-теанина, придающего вкус зеленому чаю, упомянутой выше γ-аминомасляной кислоты и многих других природных молекул. Бесспорно, некоторые из этих соединений играют важнейшую роль в живой природе, которую трудно переоценить.
Химикам-органикам, далеким от работы с ферментами, хорошо известно удлинение углеродной цепочки путем последовательного присоединения и гидролиза одноуглеродных цианидных групп. Хорошей иллюстрацией является циангидринный синтез (рис. 9), при помощи которого легко получаются искусственные сахара. Синтез аспарагиновой и глутаминовой кислот путем последовательного присоединения цианида к серину как раз является примером такой реакции, осуществляемой ферментами в живой природе. Разумеется, напрашивается продолжение этого синтеза, приводящее к высшим гомологам.
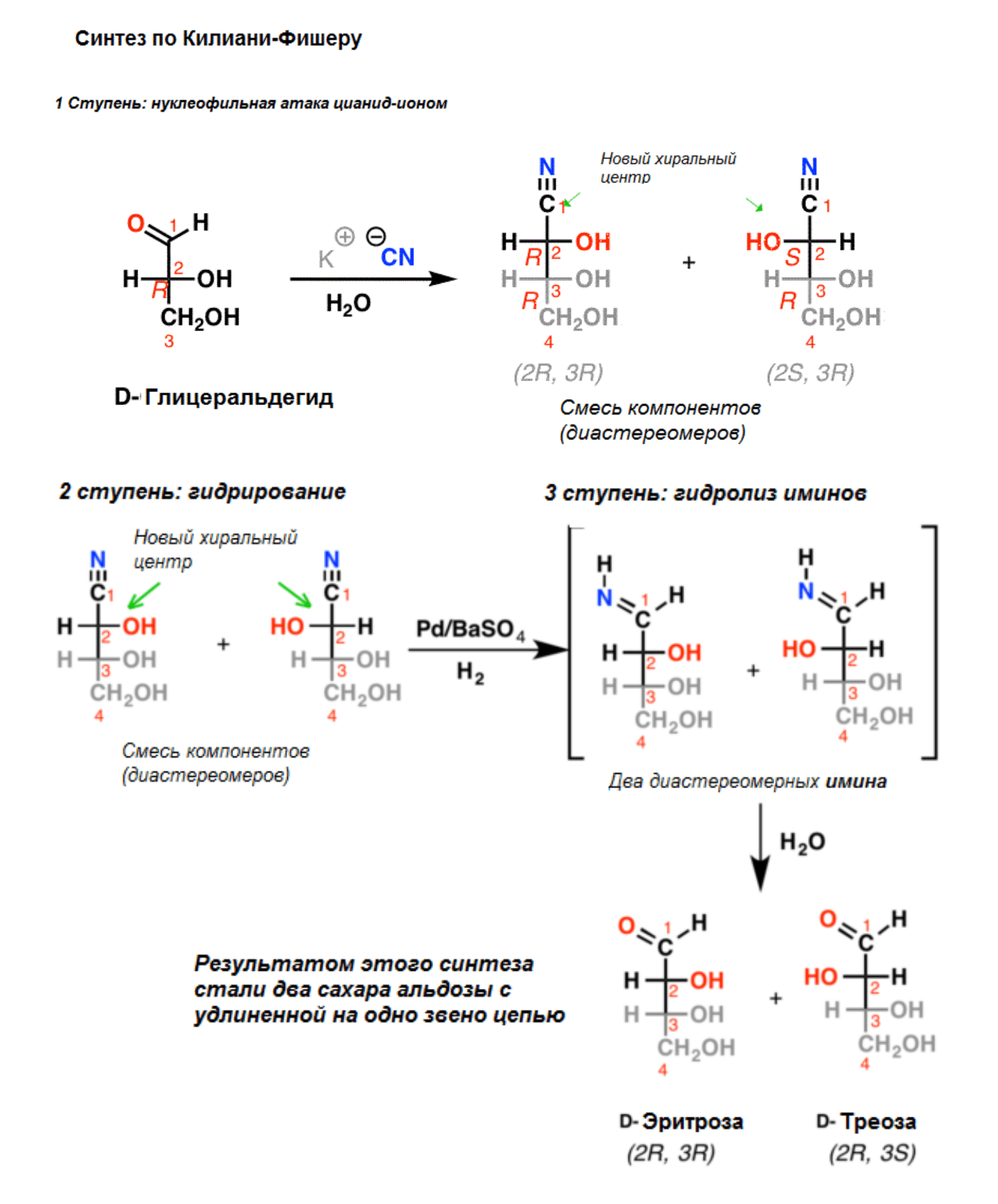
Рисунок 9. Циангидринный синтез сахаров по Килиани—Фишеру.
Pinterest, рисунок адаптирован
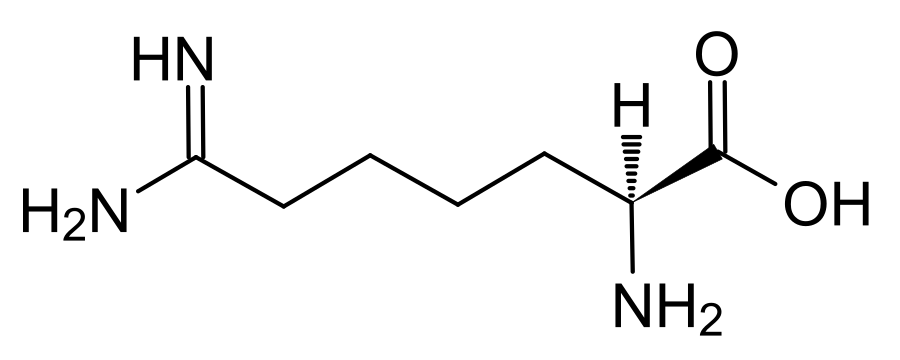
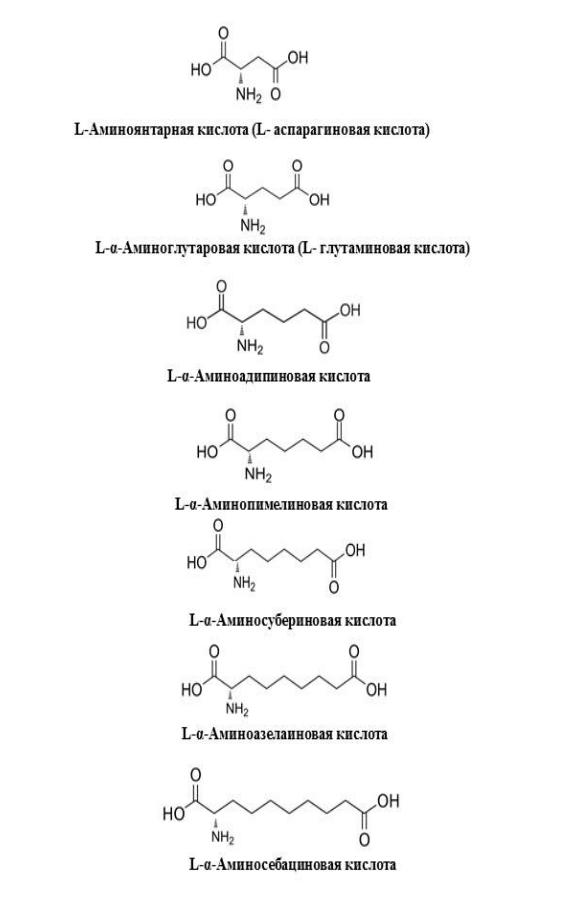
Теоретически возможно ферментативное восстановление глутаминовой кислоты до гомолога серина (только как назвать его? Гомогомосерин?). Продолжение этого пути с добавлением третьей молекулы HCN приведет к L-α-аминоадипиновой кислоте — предшественнику и метаболиту L-лизина [39]. Промежуточным продуктом ее синтеза будет L-лизиннитрил — аминокислота, в реальности образующаяся при воздействии на лизин миелопероксидазой [40]. Про миелопероксидазу я немного рассказывал в своей статье [56]. Но аминоадипиновая кислота является предшественником не только лизина. Из нее синтезируется класс веществ, ставший очень важным в последние десятилетия — β-лактамы. К ним относятся важнейшие классы антибиотиков, пенициллины, цефалоспорины и цефамицины [41].
Наш биосинтез можно продолжать и дальше, только теперь его продуктами станут экзотические, редкие в природе и выполняющие узкоспецифичные функции молекулы. Четвертая молекула синильной кислоты приведет к L-α-аминопимелиновой кислоте, метаболиту ядовитой аминокислоты индоспицина из тропического растения Indigofera spicata [42] (рис. 10б). Из пяти молекул получится L-α-аминосубериновая кислота, входящая в состав нескольких природных пептидов, обладающих антималярийной и ингибирующей гистонацетилазу активностью, например, апицидина F, продуцируемого фитопатогенным грибком Fusarium fujikuroi (рис. 10д) [43].
Дальнейшее наращивание углеродной цепочки приведет к веществам, еще неизвестным в природе. Хотя химики и фармакологи их уже изучают. Из шести молекул синильной кислоты получится L-α-аминоазелаиновая кислота — перспективный компонент некоторых лекарственных препаратов, например, полусинтетических аналогов циклопептидного антибиотика трапоксина, продуцируемого грибками Helicoma ambiens [44], [45]. Из семи — L-α-аминосебациновая кислота, используемая в экспериментах по физиологии в качестве нейромедиатора [46], [47] (рис. 10в).
Уточню сразу. Описанный в разделе блестящий синтез питательных и лекарственных веществ из синильной кислоты гладко протекает пока еще только на бумаге. В природе осуществляется только самая первая его стадия — превращение серина и цистеина в аспарагин. Глутамин, глутамат и их высшие гомологи образуются совсем другими путями биосинтеза. На практике осуществление такого наращивания углеродной цепи проблематично, поскольку неизвестны ферменты, катализирующие большинство его реакций. Но ведь такие ферменты можно создать искусственно, при помощи генной и белковой инженерии. В конце концов, каждый последующий цикл удлинения является повторением предыдущего, поэтому сильно менять активность ферментов не придется. Только вносить изменения в их специфичность, хотя это само по себе труднейшая и интереснейшая работа. Поэтому вполне можно допустить, что в скором времени этот биосинтетический путь станет реальностью. А может быть, уже стал, но первооткрыватели его патентуют и не выкладывают в открытый доступ?
Кстати, ферментативный циангидринный синтез тоже известен — ферменты гидроксинитриллиазы ведут как прямую реакцию разложения цианогидринов, так и обратную их синтеза из синильной кислоты и карбонильных соединений [50]. Так что цианиды — это не только опаснейшие яды, но и ценные «кирпичики» в строительстве сложных органических молекул, в том числе и природных.
Предельный показатель
Хорошо известно, что специфичность большинства ферментов несколько шире (иногда значительно шире, как показал пример липаз!) той, которая реализуется в природе [51]. В естественных условиях у фермента, как правило, только один субстрат, превращением которого он и занимается. Но у исследователей в лаборатории возможности более обширные, и они могут «предлагать» ферментам выбор из многих веществ, структура которых более или менее похожа на природный субстрат. Иногда такие эксперименты приводят к неожиданным результатам, вплоть до синтезов перспективных лекарств или веществ, нужных промышленности. Или просто очень необычных реакций, которые интересны сами по себе.
Фермент тирозингидроксилаза в природе (в том числе в организме человека) выполняет важную функцию: вводит в ароматическое кольцо аминокислоты тирозина дополнительную гидроксильную группу, и превращает тирозин в 2,3-дигидроксифенилаланин, известный под своим сокращенным до аббревиатуры названием, ДОФА. ДОФА является предшественником важных веществ, таких как дофамин, адреналин и норадреналин, меланин. Безусловно, это само по себе делает тирозингидроксилазу чрезвычайно важной для нашей с вами жизнедеятельности.
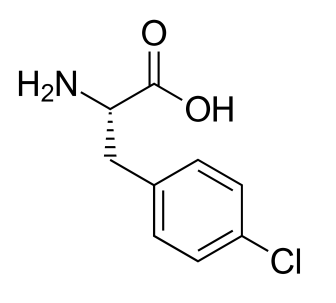
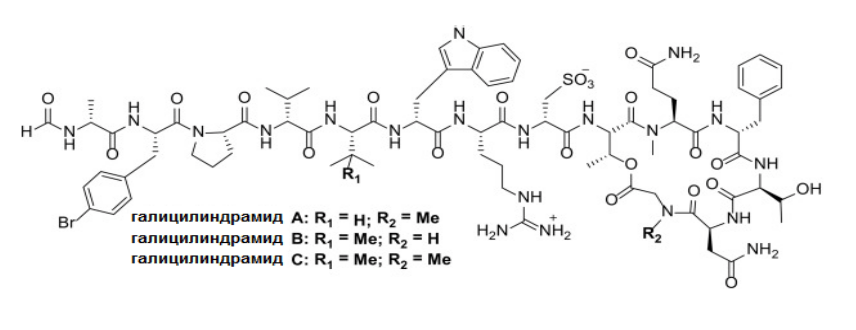
Однако неиссякаемое любопытство заставило ученых подыскивать ферменту новые субстраты. Такие, как пара-галофенилаланины. Это, фактически, тирозин, у которого гидроксил в положении 4 (пара-, п-) заменен атомом галогена. Впрочем, может и не любопытство вовсе, а здравый смысл — соединения данного ряда, надо отметить, весьма интересные. Начнем с того, что п-бромфенилаланин встречается в природе в составе пептидов галицилиндрамидов (рис. 11б) и теонелламидов, выделенных из морских губок Halichondria cylindrata [52] и Theonella swinhoei, соответственно (рис. 11в). Пептиды эти обладают фунгицидным действием. П-йодфенилаланин в природе не найден, однако белковые инженеры уже создают белки с этой экзотической аминокислотой, экспериментируя с генетическим кодом [53]. П-хлорфенилаланин (ПХФА) (рис. 11а) является, пожалуй, самым известным членом ряда. Под названием фенклонин он уже давно используется в медицинской психиатрической практике и исследованиях физиологии животных. Фенклонин является специфическим и необратимым ингибитором фермента триптофангидроксилазы и блокирует выработку серотонина [54]. Наконец, п-фторфенилаланин является сильным ядом, структурным аналогом, конкурентом и антагонистом натуральной аминокислоты фенилаланина. Будучи похожим на фенилаланин, он блокирует ферменты, осуществляющие его превращения в организме — например, в пресловутый тирозин. Правда, обратимо — введение в организм избытка фенилаланина снимает симптомы отравления, это показали исследования, проведенные еще до 1950 года [55]. Это, впрочем, само по себе не удивляет — конкурентное ингибирование ферментов распространено в природе широко.
Судя по данным, представленным в капитальном обзоре [56], тирозингидроксилаза гидроксилирует п-галофенилаланины не только в привычное положение 3 (именуемое мета-), но и в пара-положение. При этом гидроксильная группа замещает галоген и образуется тирозин, как в наше время принято говорить, «идентичный натуральному». В случае п-фторфенилаланина тирозин образуется почти со 100%-ным выходом. По мере роста массы галогена доля 3-гидрокси, 4-галофенилаланинов возрастает. П-хлорфенилаланин дает выход тирозина 38%, а п-бромфенилаланин всего 25%.
Конечно, эти превращения формально можно рассматривать как биодеградацию — мощные физиологически активные, к тому же токсичные, препараты в одну стадию превращаются в незаменимую аминокислоту. Пример интересный, но все-таки не удивительный, ведь структуры веществ с самого начала были очень похожи. На страницах своих статей я приводил немало куда более захватывающих примеров биодеградации. Удивительно здесь другое. Рассматривая превращения п-галофенилаланинов в тирозин, мы совсем забыли про атом галогена, который отщепился. Он тоже никуда не пропадает! А в каком виде галоген отщепляется? Самая стабильная и привычная форма — это галогенид-ионы. Но для превращения галогена в галогенид требуется донор электронов, которого в данной ферментативной реакции не хватает. Значит, отщепляется свободный радикал, атомарный галоген? Вот эта форма галогенов является реакционноспособной, проявляет свойства сильного окислителя. Причем чем легче галоген, тем «свирепее» его свободный радикал. Поэтому подробнее остановиться надо на фторе (рис. 11г).
В своей статье [57] я рассказывал про грибы трутовики, добывающие себе пропитание при помощи агрессивных гидроксил-радикалов, разрушающих лигнин. Так вот, атомарный фтор является еще более сильным окислителем! Это вообще самый сильный окислитель, существующий в природе. В двухатомной молекуле фтора атомы связаны очень непрочной одинарной связью, поэтому фтор легко диссоциирует на атомы даже при отрицательных температурах (рис. 11е). То есть, молекулярный фтор F2 всегда содержит примесь атомарного фтора. Именно атомарный фтор придает редкую химическую агрессивность газообразному молекулярному фтору. В сочетании с окисляющей способностью (атомы фтора имеют наибольшую электроотрицательность среди всех химических элементов, поэтому элементарный фтор является сильнейшим окислителем среди простых веществ, а все более сильные окислители среди сложных веществ тоже содержат фтор) это дает поистине «гремучую смесь».
Например, в атмосфере фтора горят вещества, в нашем сознании совершенно не ассоциирующиеся с горением. Вода тушит огонь — это все знают. Но во фторе вода горит фиолетовым пламенем (рис. 11д), а среди продуктов горения присутствуют, помимо фтороводорода, кислород и озон! Здесь воспламеняются стекло, асбест и даже платиновая проволока! Соединения кислорода с фтором состава О2F2 и ОF2 являются единственными, в которых кислород имеет положительные степени окисления, +1 и +2. Сам фтор не имеет положительных степеней окисления никогда. Мало того. Элементный фтор способен, хотя и с трудом, отрывать электроны от атомов тяжелых инертных газов, таких как ксенон и криптон. Эти атомы больше вообще ни с кем не вступают в реакции! Только легкие инертные газы, гелий, неон и аргон, успешно «держатся» против фтора и не реагируют с ним. А водород молекулярный фтор окисляет со взрывом, даже на морозе и в темноте. Само название элемента происходит от греческого φθοριος, что переводится как «разрушительный». Стоит ли говорить о том, что элементный фтор ядовит для всего живого.
Химики получают молекулярный фтор электролизом фторидов — других эффективных методов просто не существует. В природе он не встречается. Хотя нет, неправда. Один природный источник все-таки есть. Это минерал антозонит — «вонючий шпат», редкая разновидность флюорита, представляющий собой фтористый кальций CaF2 с примесью радиоактивных элементов урана и тория. Именно воздействие радиоактивного излучения на фториды приводит к образованию газообразного фтора. Если черно-фиолетовые кристаллы антозонита размолоть, можно почувствовать запах фтора, напоминающий озон. Поэтому его и назвали вонючим.
Неужели этот «монстр окисления» образуется в результате ферментативной реакции, да еще внутри живых клеток? Начнем с того, что образование радикалов фтора тирозингидроксилазой еще не доказано. Это только предположение, хотя имеющее основания. Авторы обзора говорят об этом чрезвычайно осторожно. Во-вторых, если даже они образуются, то существуют пренебрежительно малое время, доли секунды. Но этот короткий промежуток времени они проводят ярко, окисляя все вокруг. В-третьих, из-за крайне низкой продолжительности существования, радикалы фтора никогда не накопятся в высокой концентрации. И найдут, скорее всего, не их самих, а продукты превращений («следы», выражаясь терминологией физики элементарных частиц, которые тоже в свободном виде существуют пренебрежительно малое время).
Возможно, что токсичность п-фторфенилаланина во многом определяется именно радикалами фтора? Если, конечно, они действительно возникают. Если возникают, значит, тирозингидроксилаза является вторым источником фтора в природе, после антозонита — конечно, при условии поступления п-фторфенилаланина. Совсем неплохой результат, в очередной раз демонстрирующий, как мало мы еще знаем возможности биохимии, да и живой природы в целом.
Пятый элемент
Элемент бор под номером пять находится в той же группе периодической таблицы, что и алюминий, про который я рассказывал в начале статьи. В третьей. Следовательно, свойства двух этих элементов похожи. Понятно, что есть и различия. Бор легче алюминия и находится во втором периоде, а алюминий, соответственно, в третьем. Поэтому бор не металл, а металлоид, образующий, подобно кремнию, углероду и фосфору, несколько аллотропных модификаций. А борная кислота, в отличие от амфотерного гидроксида алюминия, растворима в воде. Вероятно, именно последнее обусловливает различие биологических свойств этих элементов. Бор, в отличие от алюминия, играет значительную роль в жизнедеятельности.
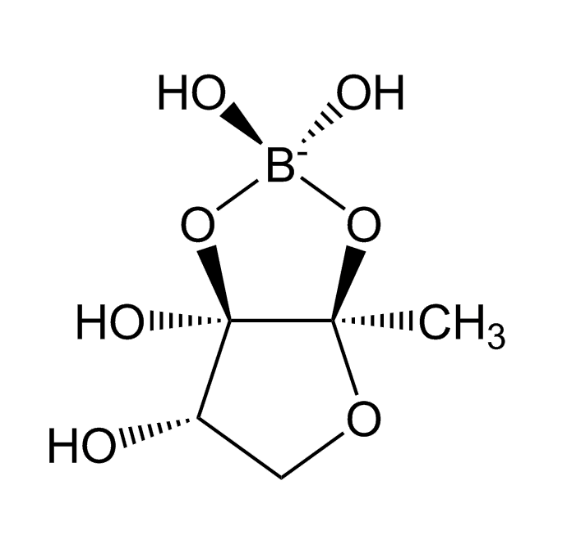
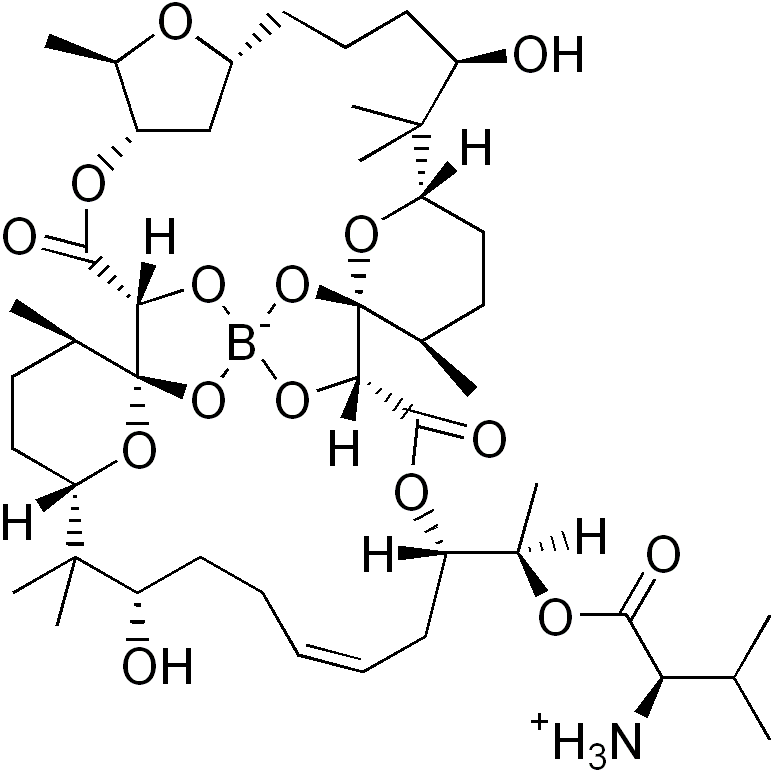
Так, актиномицеты Streptomyces antibioticus продуцируют антибиотик боромицин (рис. 12б), подавляющий рост бактерий [58] (рис. 12г). Сами бактерии общаются между собой, подавая химические сигналы. Одной из важных сигнальных молекул является так называемый аутоиндуктор 2 ((2R,4S)-2-метил-2,3,3,4-тетрагидрокситетрагидрофуранозилборат) (рис. 12а). Разумеется, такое название произносить, да и писать не под силу, поэтому химики называют аутоиндуктор сокращенным названием S-ТГМФ-борат [59]. Тоже неблагозвучно, но уже терпимо.
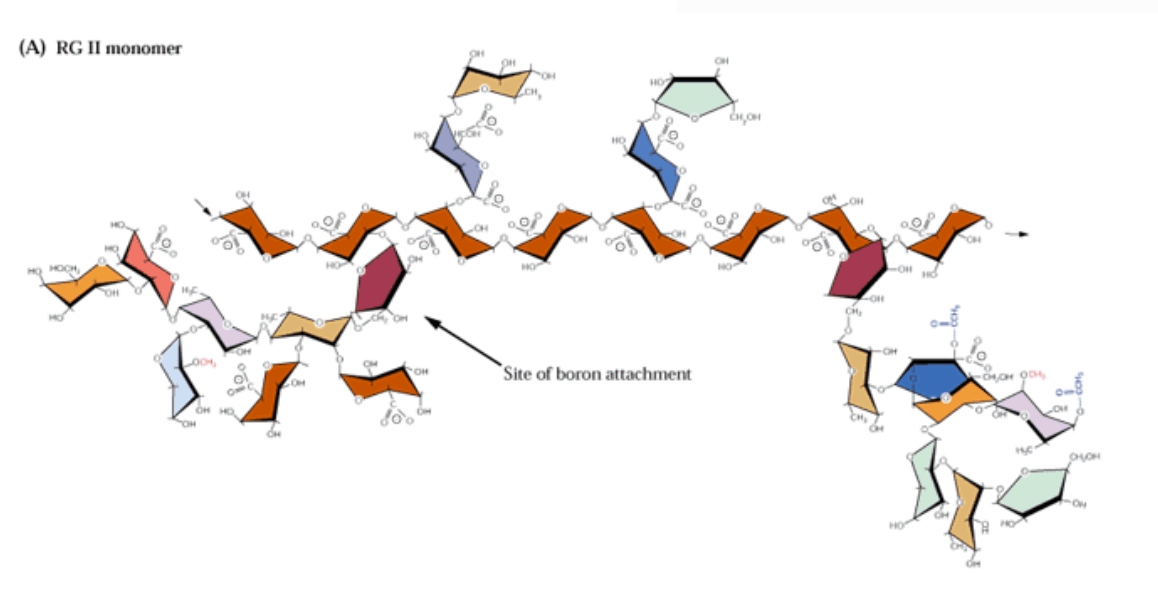
Но самая известная биологическая роль бора — это, конечно его вхождение в состав клеточных стенок растений. Точнее, одного их компонента — пектинового полисахарида рамногалактуронана II (рис. 12д). Рамногалактуронан II (РГ II) считается одной из самых сложных из известных в настоящее время биомолекул. Формально он является полисахаридом. Но любой полимер состоит из повторяющихся звеньев, а каждый остаток сахара в составе боковых цепей РГ II уникален, и каждая связь в них формируется отдельным ферментом . То есть, боковые цепочки рамногалактуронана II — это, на самом деле, мономеры с очень сложной структурой — вот такой химический феномен. А вот то, что РГ II образует димеры, это совершенно точно. И образуются они благодаря мостикам из остатков борной кислоты [60]. Опуская подробности, можно сказать, что при дефиците бора нормальные клеточные стенки в растениях не образуются. Это делает бор ценным микроэлементом, а подкормки бором — необходимыми в растениеводстве (рис. 12е, ж).
Следует подчеркнуть, что роль бора в биосфере чрезвычайно высока, это не вызывает сомнений. Но при этом он выполняет очень узкоспецифичные функции. И даже если неожиданно будут найдены новые биологические функции бора, общую картину это не изменит. Разнообразие природных веществ, содержащих бор, крайне низкое — большинство из них мы только что перечислили. Вот поэтому бор является микроэлементом — потребность в нем у живых организмов мала. Его содержание в тех же растениях составляет от одной тысячной до одной миллионной весовой доли [61].
Глядя на представленные формулы борсодержащих природных соединений, замечаешь, что все они без исключения представляют собой сложные эфиры борной кислоты — с сахарами или, в случае боромицина, со спиртовыми гидроксилами поликетидной цепочки. Борорганические вещества, в которых бор образует связи с углеродом или водородом, хорошо известны химикам, но в живой природе не найдены. Конечно, это вовсе не означает, что их никогда не найдут. Обнаружение первых фосфорорганических и галогенорганических природных соединений тоже вызывало переполох и резкую смену взглядов у ученых. Но пока борорганические вещества в природе не нашли, правильнее придерживаться точки зрения, что их там нет.
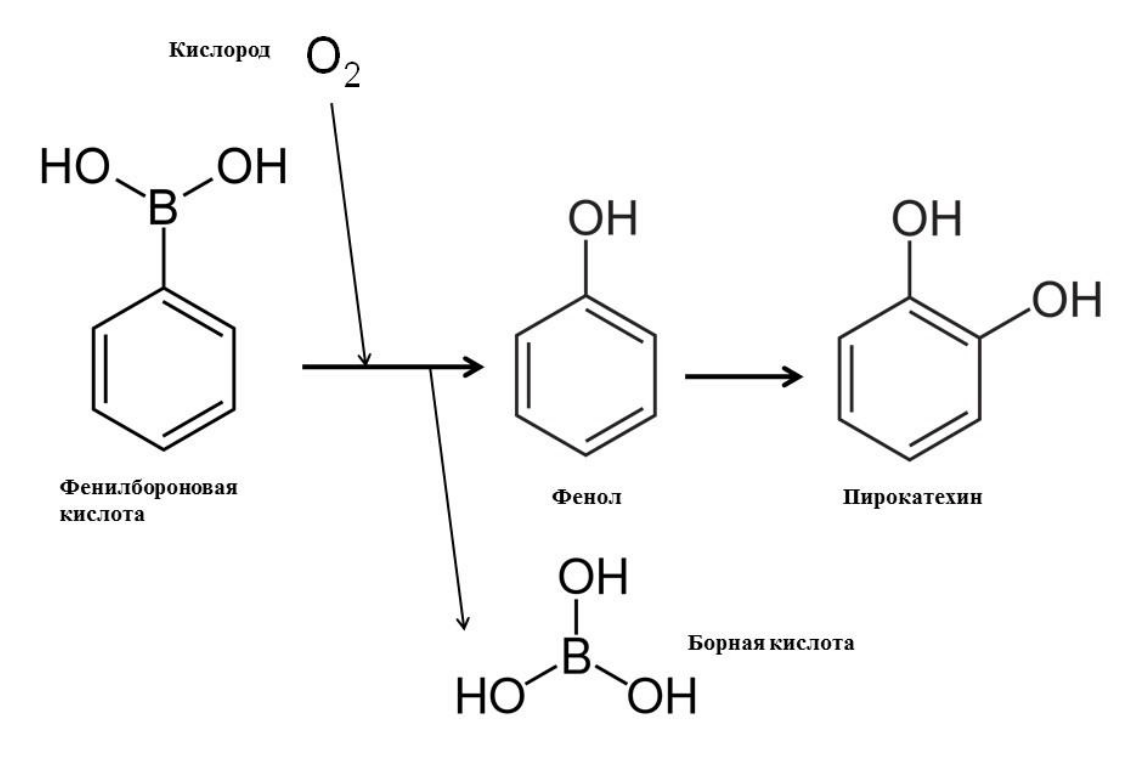
Типичное борорганическое соединение фенилбороновая кислота С6Н5В(ОН)2 часто используется в органическом синтезе в качестве донора ароматической фенильной группы [62]. Тем удивительнее следующий факт. Арилбороновые кислоты успешно разлагаются бактерией артробактером Arthrobacter sp. PBA (рис. 13б) [63]. Например, пресловутая фенилбороновая кислота окисляется кислородом при помощи оксидоредуктазы артробактера в одну стадию до фенола и борной кислоты (рис. 13а). Последняя легко утилизируется упомянутыми чуть выше растениями.
То есть, бактериальный фермент разрывает связь бор-углерод, с которой в процессе эволюции никогда не сталкивался. Более того, эти связи, с большой долей вероятности, вообще не встречаются в природе. И тем не менее, совершенно случайно повстречав экзотический борорганический ксенобиотик, фермент (а вместе с ним и его продуцент, микроорганизм) успешно справились с его обезвреживанием. Образующийся в качестве продукта деградации фенол далее разлагается по схеме общей для ароматических веществ (рис. 13а) — сначала гидроксилируется до пирокатехина, и далее деароматизируется, превращается в производное цис, цис-муконовой кислоты, затем превращается в совсем безвредные соединения, легко включаемые в микробный метаболизм, — например, в ацетат. То есть, не встречающаяся в природе фенилбороновая кислота в конечном итоге обезвредится живым организмом полностью, без остатка!
Конечно, за этим удивительным фактом скрывается четкая эволюционная логика. Ферменты оксидоредуктазы часто используются живыми клетками для детоксикации ксенобиотиков. Поэтому в процессе эволюции они приобрели широкую субстратную специфичность и готовы, образно выражаясь, «пойти туда, не знаю куда и принести то, не знаю что». То есть осуществлять метаболизм любых встреченных чужеродных веществ, даже самых невероятных. Это открывает перед биодеградацией широчайшие перспективы, которые на современном уровне знаний даже сложно оценить.
Не только биодеградация!
Рассказывая о биодеградации, конечно, нельзя забывать о химическом разнообразии живой природы. О том, что она сама служит источником многих необычных и неожиданных химических соединений. В своих предыдущих статьях я постарался осветить связь между двумя этими явлениями. Способность биосферы Земли к биодеградации созданных человеком веществ определяется впечатляющим многообразием и совершенством протекающих в ней путей метаболизма. Соответственно, и разнообразием природных веществ.
К перечисленным в предыдущих работах примерам, с позволения читателей, добавлю еще два. Оба связаны с биохимией морских организмов — одной из самых загадочных, малоизученных и удивительных областей знания.
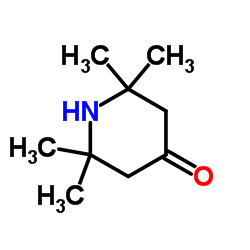
Вещество с мудреным названием 2,2,6,6-тетраметилпиперидин-4-он, по давней традиции химиков, обычно именуют тривиальным названием — триацетонамин (рис. 14б). Это тривиальное название замечательно отображает способ получения соединения. В промышленности его получают конденсацией ацетона и аммиака в соотношении 3:1 при нагреве. Триацетонамин известен давно и находит достаточно широкое практическое применение. Он является полупродуктом для получения таких интересных соединений, как стабильный нитроксильный свободный радикал ТЕМРО, используемый как «ловушка радикалов» и катализатор окисления, сильное органическое основание LTMP. Триацетонамин сам является сильным основанием. Его соль с 4-толуолсульфоновой кислотой используется в медицине в качестве анксиолитического препарата, успокоительного. Кроме того, триацетонамин и его производные используются в качестве антиокислителей — ингибиторов полимеризации олефинов, «старения» резины и пластмасс. Вот такое многообразное применение находит триацетонамин. Понятно, что это вещество давно известно химикам, широко и глубоко изучено. Но исключительно как продукт синтеза.
И вот выяснилось, что данное вещество, а также близкий по строению 2,2,6,6-тетраметилпиридин-3(6H)-он являются натуральными алкалоидами, продуцируемыми морскими губками Agelas oroides — обитателями Средиземного моря, живущими на глубинах до 150 метров [64] (рис. 14а). Авторы статьи назвали эти метаболиты «беспрецедентными».
А самое беспрецедентное в них, на мой взгляд, даже не структура, а возможный путь биосинтеза. Все известные на сегодняшний день способы синтеза триацетонамина сводятся, в конечном итоге, к конденсации ацетона и аммиака в соотношении 3:1. При этом образуются искомое соединение и вода в соотношении 1:2. Вероятно, в природе это вещество должно синтезироваться аналогичным образом. Но где взять исходные реагенты? Ацетон и аммиак (рис. 15а,б) синтезируются практически всеми живыми клетками. Но оба вещества являются токсичными продуктами обмена и почти никогда не накапливаются в высоких концентрациях. Клетки стараются от таких соединений поскорее избавляться. Тем более сложно представить, чтобы живой организм — даже если речь идет о губке — использовал эти продукты для биосинтеза.
Значит, биосинтез триацетонамина должен отличаться от синтезов, разработанных химиками. Но не слишком сильно — в конце концов, химические процессы в живых клетках подчиняются тем же законам, что и в лабораторных колбах или заводских колоннах. В литературе я не нашел путь биосинтеза триацетонамина губками. Вероятно, его никто не изучал — непросто исследовать метаболизм организма на стометровой морской глубине, а практическая значимость такого исследования нулевая, триацетонамин из губок добывать никто не собирается. К сожалению, многие удивительные открытия не совершили по этим причинам.
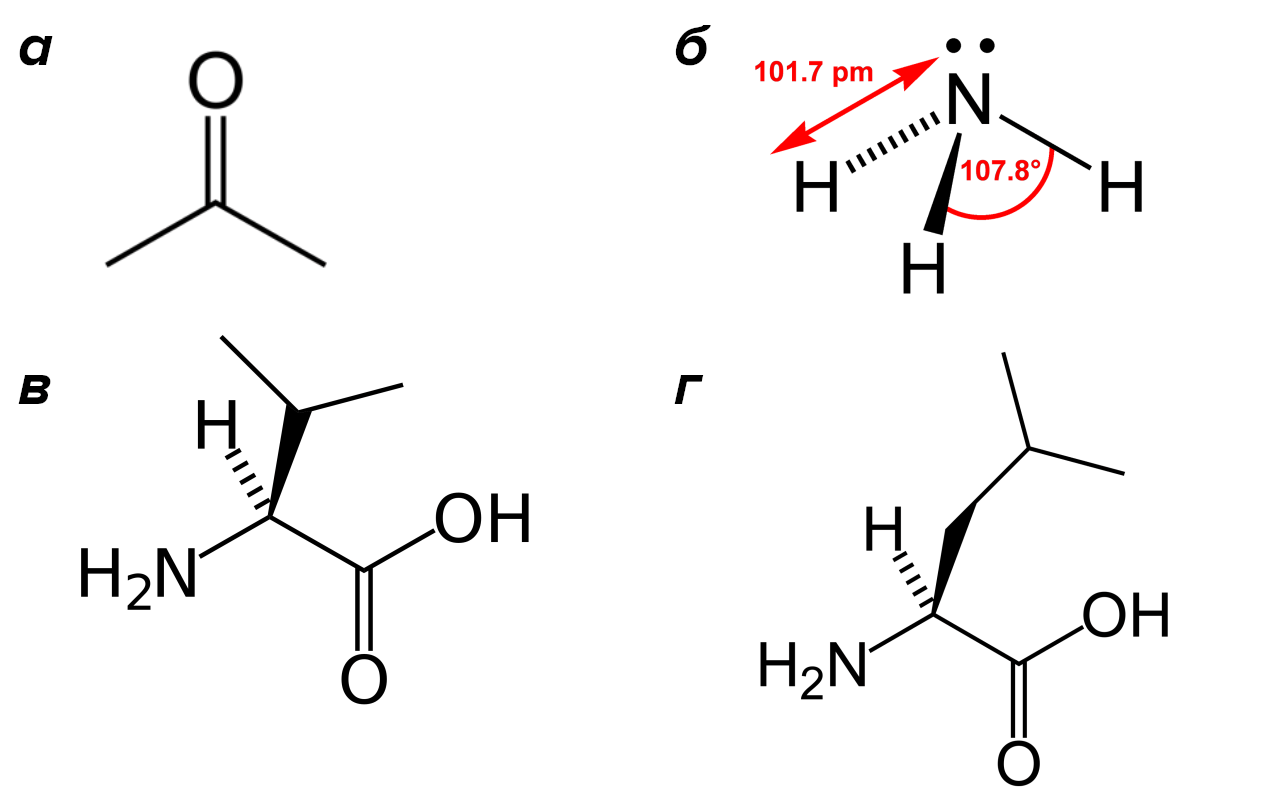
У меня есть своя идея на этот счет, а подтвердится она или нет — покажут только время и будущие исследования. В природе основным предшественником ацетона являются аминокислоты валин и лейцин (рис. 15в,г) — их изопропильный радикал является «готовой заготовкой» молекулы ацетона. В статье [65] описаны несколько различающиеся, но в целом сходные пути образования ацетона из лейцина бактериями Vibrio и Pseudomonas. А в ядовитых грибах плевроцибеллы вытянутой (Pleurocybella porrigens) (рис. 15д), произрастающих в Японии, содержится еще более близкий предшественник ацетона — токсичная аминокислота β-гидроксивалин [66].
Так вот, вполне возможно образование предшественника триацетонамина конденсацией трех боковых радикалов подобных аминокислот или их производных. Аммиак при этом может заменить аминогруппа, тоже принадлежащая, например, аминокислоте. Вот так известный химический синтез может быть адаптирован к живой системе.
Другой интересный пример тоже связан с морской биохимией. Мшанки (Bryozoa) (рис. 16г) представляют собой тип водных первичноротых беспозвоночных животных, ведущих прикрепленный образ жизни — передвигаться в пространстве могут только личинки этих существ, благодаря им мшанки расселяются. Мшанки обитают как в пресных водоемах, так и в морях и океанах. Большинство из них образуют сложно организованные колонии, в которых отдельные особи выполняют строго специфические роли. Одни снабжают колонию пищей (мшанки фильтруют воду при помощи венчика щупалец вокруг рта), другие полностью посвящают себя размножению, третьи своими телами укрепляют колонию. Есть даже особи-солдаты, которые защищают колонию от вторжения непрошеных гостей. Но, пожалуй, самым эффективным оружием некоторых морских видов мшанок являются ядовитые вещества — полиэфиры и алкалоиды, уникальные именно для этих удивительных организмов.
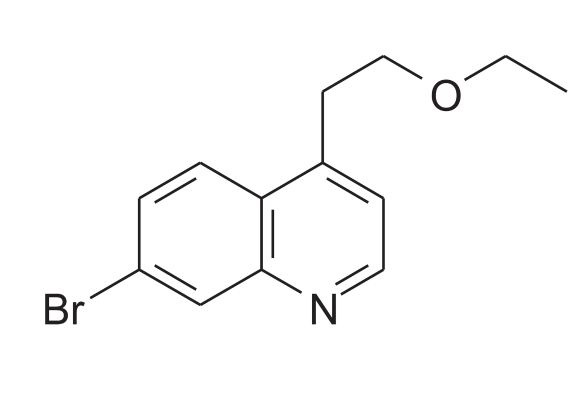
Просматривая обширный обзор, посвященный природным соединениям брома [67], я сразу обратил внимание на структурную формулу алкалоида 7-бром, 4-(2-этоксиэтил)хинолина, вырабатываемого морскими мшанками Flustra foliacea, обитающими в Северной части Атлантического океана (рис. 16б). Соединение и впрямь необычное. Начнем с того, что это единственный обнаруженный в природе бромхинолин. Однако первое, что обращает на себя внимание — странная 2-этоксиэтильная группа в положении 7. Одного взгляда достаточно, чтобы увидеть ее сходство с диэтиловым эфиром — тем самым, который не первое столетие применяется в медицине для местного и общего наркоза (рис. 16в, сверху). Фактически, этот алкалоид является замещенным диэтиловым эфиром и должен проявлять общие с ним свойства — например, окисляться на воздухе с образованием взрывчатых пероксидов или образовывать оксониевые соли с сильными кислотами.
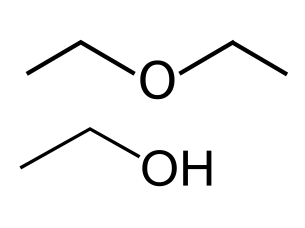
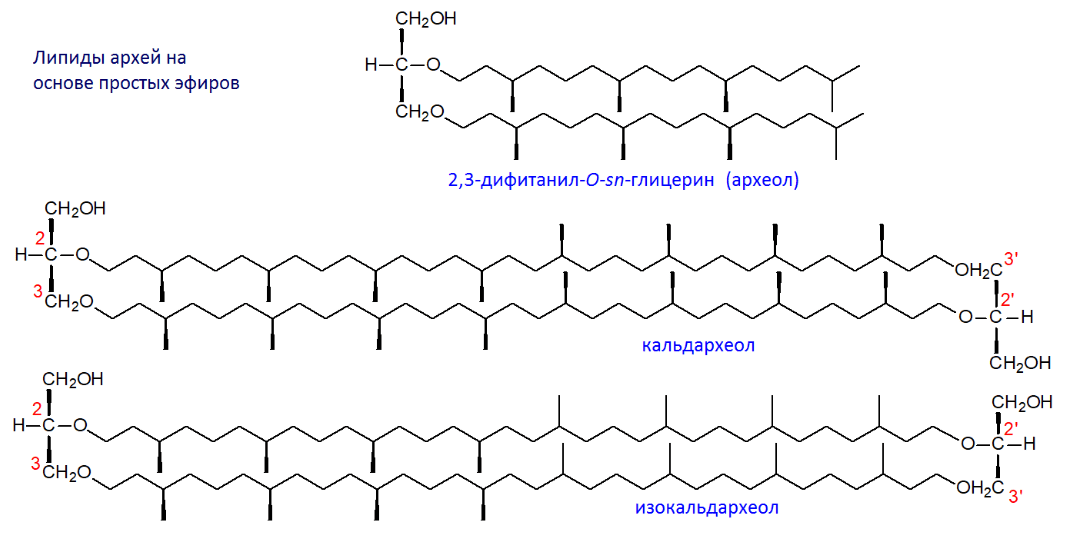
Каким образом возникает эта группа? Она вполне может синтезироваться самим организмом мшанки. Это наиболее простой и логичный вывод. Предшественниками могут служить двууглеродные молекулы, например, ацетил-КоА. Простые эфиры, в отличие от сложных, про которые уже говорилось выше, в живой природе необычны. Тем не менее, природные простые эфиры существуют и синтезируются ферментами — достаточно вспомнить липиды мембран архей [68] (рис. 16д,е). Однако один из авторов открытия вещества, доктор Кристоферсен из университета Копенгагена в статье [69], посвященной метаболитам морских мшанок, предполагает, что 2-этоксиэтильный радикал мог возникнуть в результате реакции алкалоида с этиловым спиртом — этот растворитель использовали для экстракции метаболитов.
Действительно, этанол (рис. 16в, снизу) — самый подходящий кандидат на роль донора этильных групп. Но следует помнить о том, что спирты дегидратируются до простых эфиров с большой неохотой и только в жестких условиях. Пресловутый диэтиловый эфир получают из этанола, смешивая последний с серной кислотой и нагревая смесь до 150 градусов. Значит, если бромхинолин прореагировал с этанолом при слабом нагреве, без катализа, с образованием простого эфира, исходно в положении 7 у него была очень реакционноспособная группа. Какая именно? После реакции однозначно сказать уже нельзя. Для ее идентификации нужны дополнительные исследования, значительно более трудоемкие. Кто знает, может быть, это одна из тех химических групп, которые еще не находили в природных соединениях? И биохимическое разнообразие еще шире, чем мы думаем?
Эти два примера демонстрируют нам, сколько загадок, нерешенных проблем и будущих громких открытий, ждущих своего первооткрывателя, таит в себе биохимия.
Вместо послесловия
Вот мы и пришли к выводу, что биодеградация — это не всегда биодеградация. И не только биодеградация. Данное явление, как и любое другое, тысячами неразрывных нитей связано со смежными научными дисциплинами. Конечно, двигателем развития любой проблематики является практическая значимость. В случае биодеградации она бесспорна. И тем не менее, многие конкретные примеры биодеградации могут выглядеть курьезными и бесперспективными.
Но настоящие ученые могут интуитивно чувствовать потенциал таких разработок. Альберт Эйнштейн в свое время пришел к выводу, что перспективы вновь открытого явления легко проверить, пускай в настоящее время они совсем неочевидны. Если оно обладает красотой и внутренней логикой, хорошо объясняет наблюдаемые факты и вписывается в картину мира, значит, потенциал есть. Таким образом, постоянно описываемые курьезные и неправдоподобные примеры со временем могут лечь в основу очень важных и востребованных методов — лабораторных или даже промышленных.
По крайней мере, у нескольких из представленной в статье разработок, без сомнения, есть будущее, даже если сегодня они не используются. Например, у ферментативного синтеза полимеров. Я уверен, что на этом поприще будет сделано много. И конкретных примеров синтеза полимеров будет гораздо больше, их хватит на книгу, а не на фрагмент статьи. Вполне возможно, что при помощи ферментов когда-нибудь получат полиэтилен, и неожиданно откроют новые перспективные полимеры, неизвестные на сегодняшний день.
С атомарным фтором, который может образоваться в метаболических путях, дело обстоит сложнее. Хотя бы потому, что его не наблюдали, только предсказали возможность его образования. Конечно, даже если его появление подтвердится, вряд ли живые ткани станут источником элементного фтора (если речь не идет о фантастических организмах с других планет). Но многие фторорганические соединения применяются в качестве лекарств (довольно токсичных, кстати: введение атома фтора в молекулу увеличивает токсичность последней в среднем в десять раз!). Мы должны разбираться в их фармакокинетике, чтобы оценивать возможные риски для здоровья.
Вот так биодеградация с нашей легкой руки плавно перетекла сначала в химическое производство, потом в фармакологию. Одним словом, мир вокруг нас един, на разные области знания мы его поделили для удобства. Берясь за решение конкретной, узкой научной задачи, не следует об этом забывать.
Литература
- Биодеградация белого фосфора: как яд стал удобрением;
- Миндубаев А.З. (2020) Микробы-санитары. Наука и жизнь. 4, 28-33;
- Marina Fomina, John M. Charnock, Stephen Hillier, Rebeca Alvarez, Francis Livens, Geoffrey M. Gadd. (2008). Role of fungi in the biogeochemical fate of depleted uranium. Current Biology. 18, R375-R377;
- Белов Д.В., Соколова Т.Н., Карташов В.Р., Смирнов В.Ф., Челнокова М.В., Ляпина М.А. (2007). Коррозия алюминия и алюминиевых сплавов под воздействием микроорганизмов. Химия и химическая технология. 50, 60-61;
- Jian Feng Ma, Peter R Ryan, Emmanuel Delhaize. (2001). Aluminium tolerance in plants and the complexing role of organic acids. Trends in Plant Science. 6, 273-278;
- Hang Yu, Jared R. Leadbetter. (2020). Bacterial chemolithoautotrophy via manganese oxidation. Nature. 583, 453-458;
- Белов Д.В., Калинина А.А., Кузина О.В., Карташов В.Р., Соколова Т.Н. (2011) Коррозия цинка и оцинкованных сталей под воздействием бактерий. Коррозия: материалы, защита. 7, 42-47;
- Júlio C.M. Souza, Pierre Ponthiaux, Mariana Henriques, Rosário Oliveira, Wim Teughels, et. al.. (2013). Corrosion behaviour of titanium in the presence of Streptococcus mutans. Journal of Dentistry. 41, 528-534;
- MAGDALENA BARTOSIK, ZOFIA ŻAKOWSKA, KRYSTYNA CEDZIŃSKA, KAZIMIERZ ROŻNIAKOWSKI. (2010). Biodeterioration of Optical Glass Induced by Lubricants Used in Optical Instruments Technology. Pol J Microbiol. 59, 295-300;
- Estokova A., Harbulakova V. O., Luptakova A., Prascakova M., Stevulova N. Sulphur (2011) Oxidizing Bacteria as the Causative Factor of Biocorrosion of Concrete. 10th International Conference on Chemical and Process Engineering. 24, 1-6;
- Биодеградация: что в ней удивительного?;
- Северин Е.С. Биохимия: учебник. 5-е изд., испр. и доп. М.: ГЭОТАР-Медиа, 2013. — 768 с.;
- Matthias Reihmann, Helmut Ritter. (2006). Synthesis of Phenol Polymers Using Peroxidases. Enzyme-Catalyzed Synthesis of Polymers. 1-49;
- Shiro Kobayashi, Hiroshi Uyama, Shunsaku Kimura. (2001). Enzymatic Polymerization. Chem. Rev.. 101, 3793-3818;
- Биодеградация ксенобиотиков как самозащита природы;
- Ole Kirk, Morten Würtz Christensen. (2002). Lipases from Candida antarctica: Unique Biocatalysts from a Unique Origin. Org. Process Res. Dev.. 6, 446-451;
- Shuichi Matsumura. (2005). Enzymatic Synthesis of Polyesters via Ring-Opening Polymerization. Enzyme-Catalyzed Synthesis of Polymers. 95-132;
- Hiroshi Uyama, Shiro Kobayashi. (2006). Enzymatic Synthesis of Polyesters via Polycondensation. Enzyme-Catalyzed Synthesis of Polymers. 133-158;
- Yi Jiang, Katja Loos. (2016). Enzymatic Synthesis of Biobased Polyesters and Polyamides. Polymers. 8, 243;
- L. Perbellini, F. Brugnone. (1980). Lung uptake and metabolism of cyclohexane in shoe factory workers. Int. Arch Occup Environ Heath. 45, 261-269;
- Ajay Kumar, R. A. Gross, D. Jendrossek. (2000). Poly(3-hydroxybutyrate)-depolymerase from Pseudomonas lemoignei: Catalysis of Esterifications in Organic Media. J. Org. Chem.. 65, 7800-7806;
- Luc C. Duchesne, D. W. Larson. (1989). Cellulose and the Evolution of Plant Life. BioScience. 39, 238-241;
- Роль слабых взаимодействий в биополимерах;
- Saxena I.M. and Brown R.M. (1997). Identification of cellulose synthase(s) in higher plants: sequence analysis of processive â-glycosyltransferases with the common motif ‘D, D, D35Q(R,Q)XRW’. Cellulose. 4, 33-49;
- Shiro Kobayashi, Masashi Ohmae. (2006). Enzymatic Polymerization to Polysaccharides. Enzyme-Catalyzed Synthesis of Polymers. 159-210;
- Tao Li, Sudhakar Takkellapati. (2018). The current and emerging sources of technical lignins and their applications. Biofuels, Bioprod. Bioref.. 12, 756-787;
- Раздумья о природной и неприродной химии;
- Amarjit Singh, David L. Kaplan. (2006). In Vitro Enzyme-Induced Vinyl Polymerization. Enzyme-Catalyzed Synthesis of Polymers. 211-224;
- Scott Zavada, Tsatsral Battsengel, Timothy Scott. (2016). Radical-Mediated Enzymatic Polymerizations. IJMS. 17, 195;
- Frank Hollmann, Isabel W. C. E. Arends. (2012). Enzyme Initiated Radical Polymerizations. Polymers. 4, 759-793;
- Bhanu Kalra, Richard A. Gross. (2000). Horseradish Peroxidase Mediated Free Radical Polymerization of Methyl Methacrylate. Biomacromolecules. 1, 501-505;
- Michael S. Machas, Rebekah McKenna, David R. Nielsen. (2017). Expanding Upon Styrene Biosynthesis to Engineer a Novel Route to 2‐Phenylethanol. Biotechnol. J.. 12, 1700310;
- Yusuke Yamaguchi, Hitomi Kumagai. (2019). Characteristics, biosynthesis, decomposition, metabolism and functions of the garlic odour precursor, S‑allyl‑l‑cysteine sulfoxide (Review). Exp Ther Med;
- Michael S. Machas, Rebekah McKenna, David R. Nielsen. (2017). Expanding Upon Styrene Biosynthesis to Engineer a Novel Route to 2‐Phenylethanol. Biotechnol. J.. 12, 1700310;
- Ying Ma, Hernán Biava, Roberto Contestabile, Nediljko Budisa, Martino di Salvo. (2014). Coupling Bioorthogonal Chemistries with Artificial Metabolism: Intracellular Biosynthesis of Azidohomoalanine and Its Incorporation into Recombinant Proteins. Molecules. 19, 1004-1022;
- Ma Y. Metabolic engineering of O-acetyl-L-homoserine sulfhydrylase and Met-biosynthetic pathway in Escherichia coli. Residue-specific chemoselective conjugation on azide functionalized proteins. Doctoral Thesis. — Technische Universität Berlin, 2016. — 88 p.;
- Soujanya D. Yelamanchi, Savita Jayaram, Joji Kurian Thomas, Seetaramanjaneyulu Gundimeda, Aafaque Ahmad Khan, et. al.. (2016). A pathway map of glutamate metabolism. J. Cell Commun. Signal.. 10, 69-75;
- J. Schnyder, M. Rottenberg, K.H. Erismann. (1975). The Synthesis of Threonine and Thiothreonine from o-Phospho-Homoserine by Extracts Prepared from Higher Plants. Biochemie und Physiologie der Pflanzen. 167, 605-608;
- Junichi Miyazaki, Nobuyuki Kobashi, Makoto Nishiyama, Hisakazu Yamane. (2001). Functional and Evolutionary Relationship between Arginine Biosynthesis and Prokaryotic Lysine Biosynthesis through α-Aminoadipate. J Bacteriol. 183, 5067-5073;
- Hongqiao Lin, Bruce S. Levison, Jennifer A. Buffa, Ying Huang, Xiaoming Fu, et. al.. (2017). Myeloperoxidase-mediated protein lysine oxidation generates 2-aminoadipic acid and lysine nitrile in vivo. Free Radical Biology and Medicine. 104, 20-31;
- Jette Thykaer, Jens Nielsen. (2003). Metabolic engineering of β-lactam production. Metabolic Engineering. 5, 56-69;
- Gabriele Netzel, Eddie Tan, Mukan Yin, Cindy Giles, Ken Yong, et. al.. (2019). Bioaccumulation and Distribution of Indospicine and Its Foregut Metabolites in Camels Fed Indigofera spicata. Toxins. 11, 169;
- Shital Kumar Chattopadhyay, Suman Sil, Jyoti Prasad Mukherjee. (2017). Synthesis of 2-aminosuberic acid derivatives as components of some histone deacetylase inhibiting cyclic tetrapeptides. Beilstein J. Org. Chem.. 13, 2153-2156;
- R. Furumai, Y. Komatsu, N. Nishino, S. Khochbin, M. Yoshida, S. Horinouchi. (2001). Potent histone deacetylase inhibitors built from trichostatin A and cyclic tetrapeptide antibiotics including trapoxin. Proceedings of the National Academy of Sciences. 98, 87-92;
- M Kijima, M Yoshida, K Sugita, S Horinouchi, T Beppu. (1993). Trapoxin, an antitumor cyclic tetrapeptide, is an irreversible inhibitor of mammalian histone deacetylase.. Journal of Biological Chemistry. 268, 22429-22435;
- R. F. Carlyle. (1974). The occurrence in and actions of amino acids on isolated supra oral sphincter preparations of the sea anemoneActinia equina. The Journal of Physiology. 236, 635-652;
- Yoshihisa Kudo. (1978). The pharmacology of the amphibian spinal cord. Progress in Neurobiology. 11, 1-76;
- Eva-Maria Niehaus, Slavica Janevska, Katharina W. von Bargen, Christian M. K. Sieber, Henning Harrer, et. al.. (2014). Apicidin F: Characterization and Genetic Manipulation of a New Secondary Metabolite Gene Cluster in the Rice Pathogen Fusarium fujikuroi. PLoS ONE. 9, e103336;
- Zhao G., Liu X., Wu W. (2007) Helicosporous hyphomycetes from China. Fungal Diversity. 26, 313-524;
- Paula Bracco, Hanna Busch, Jan von Langermann, Ulf Hanefeld. (2016). Enantioselective synthesis of cyanohydrins catalysed by hydroxynitrile lyases – a review. Org. Biomol. Chem.. 14, 6375-6389;
- Lance C. Seefeldt, Zhi-Yong Yang, Simon Duval, Dennis R. Dean. (2013). Nitrogenase reduction of carbon-containing compounds. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1827, 1102-1111;
- Marta Pelay-Gimeno, Judit Tulla-Puche, Fernando Albericio. (2013). “Head-to-Side-Chain” Cyclodepsipeptides of Marine Origin. Marine Drugs. 11, 1693-1717;
- Koichiro Kodama, Hiroshi Nakayama, Kensaku Sakamoto, Seketsu Fukuzawa, Takanori Kigawa, et. al.. (2010). Site-specific incorporation of 4-Iodo-l-phenylalanine through opal suppression. The Journal of Biochemistry. 148, 179-187;
- Ичас М. О природе живого: механизмы и смысл. М.: Мир, 1994. — 496 с.;
- Marvin D. Armstrong, Joy D. Lewis. (1951). EFFECT OF PHENYLALANINE ON THE TOXICITY OF 4-FLUOROPHENYLALANINE FOR THE RAT. Journal of Biological Chemistry. 190, 461-466;
- Yifan Wang, Aimin Liu. (2020). Carbon–fluorine bond cleavage mediated by metalloenzymes. Chem. Soc. Rev.. 49, 4906-4925;
- Являются ли ксенобиотики ксенобиотиками? Одна из сторон разнообразия природных соединений;
- Valery M Dembitsky, Reem Smoum, Abed Aziz Al-Quntar, Hijazi Abu Ali, Inna Pergament, Morris Srebnik. (2002). Natural occurrence of boron-containing compounds in plants, algae and microorganisms. Plant Science. 163, 931-942;
- Sarah J Coulthurst, Neil A Whitehead, Martin Welch, George P.C Salmond. (2002). Can boron get bacteria talking?. Trends in Biochemical Sciences. 27, 217-219;
- Dimitra Chormova, David J Messenger, Stephen C Fry. (2014). Rhamnogalacturonan-II cross-linking of plant pectins via boron bridges occurs during polysaccharide synthesis and/or secretion. Plant Signaling & Behavior. 9, e28169;
- Milka Brdar-Jokanović. (2020). Boron Toxicity and Deficiency in Agricultural Plants. IJMS. 21, 1424;
- Tom Willemse, Wim Schepens, Herman Vlijmen, Bert Maes, Steven Ballet. (2017). The Suzuki–Miyaura Cross-Coupling as a Versatile Tool for Peptide Diversification and Cyclization. Catalysts. 7, 74;
- Ana C. Negrete-Raymond, Barbara Weder, Lawrence P. Wackett. (2003). Catabolism of Arylboronic Acids by Arthrobacter nicotinovorans Strain PBA. Appl Environ Microbiol. 69, 4263-4267;
- Gabriele König, Anthony Wright. (1998). An Unprecedented Compound from the Dichloromethane Solubles of the Tropical Marine Sponge Agelas oroides. Planta Med. 64, 88-89;
- Michele Nemecek-Marshall, Cheryl Wojciechowski, William P. Wagner, Ray Fall. (1999). Acetone Formation in the Vibrio Family: a New Pathway for Bacterial Leucine Catabolism. J Bacteriol. 181, 7493-7499;
- Xia Yin, An-An Yang, Jin-Ming Gao. (2019). Mushroom Toxins: Chemistry and Toxicology. J. Agric. Food Chem.. 67, 5053-5071;
- Alasdair H. Neilson. (2003). Biological Effects and Biosynthesis of Brominated Metabolites. The Handbook of Environmental Chemistry. 75-204;
- Jonathan Lombard, Purificación López-García, David Moreira. (2012). The early evolution of lipid membranes and the three domains of life. Nat Rev Microbiol. 10, 507-515;
- Carsten Christophersen, H. Bazin, J. Heikkilä, J. Chattopadhyaya, Gotfryd Kupryszewski, Bo Wigilius. (1985). Secondary Metabolites from Marine Bryozoans. A review.. Acta Chem. Scand.. 39b, 517-529.