Биодеградация: что в ней удивительного?
27 октября 2020
Биодеградация: что в ней удивительного?
- 2017
- 0
- 7
Биосфера защищается от ядовитых веществ при помощи биодеградации. Обязанность человека — не усложнять эту задачу, а помогать природе, задействуя технологии.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В предыдущих статьях, посвященных биодеградации неприродных веществ, я так много рассказал об этом явлении, что возникает закономерный вопрос: может, хватит? Пора остановиться? Однако тема биодеградации (как, впрочем, любая научная тема) неисчерпаема. Интересных примеров, каждый из которых достоин внимания читателя, очень много. Вот таким необычным, даже неожиданным примерам биодеградации посвящается эта статья.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Заводы под микроскопом
В то время, когда я только начинал заниматься микробным обезвреживанием белого фосфора (об этой работе я постарался как можно более увлекательно рассказать в своей статье «Биодеградация белого фосфора: как яд стал удобрением» [1]), я сразу же заинтересовался проблемой биодеградации. Это знаковое для меня событие произошло более одиннадцати лет назад. К тому времени биодеградацию описали для большинства классов веществ, в том числе и для соединений фосфора — хотя то, что микроорганизмы могут разлагать и чистый фосфор (к слову, сильнейший яд!), до наших работ [2], [3] было миру неведомо. И честно признаюсь, я очень рад, что своей работой смог пополнить копилку знаний в этой очень важной для защиты окружающей среды области. За это я выражаю глубокую признательность коллегам, каждый из которых внес свой вклад в это большое общее дело.
Таким образом, с точки зрения практика, биодеградация сегодня стала четко обособленной дисциплиной [4]. Однако с точки зрения фундаментальной науки она гармонично вписывается в классические дисциплины: биохимию, метаболомику, энзимологию, молекулярную биологию, теорию эволюции, наконец. Ее просто невозможно вычленить из постоянно протекающих в биосфере метаболических путей.
Я постарался обрисовать в статье [5], что многие вещества, близкие по строению к созданным человеком ксенобиотикам, а в некоторых случаях даже идентичные им, постоянно присутствуют в окружающей среде. Поэтому не существует каких-то особенных путей метаболизма, характерных только для искусственных веществ.
Высокая эффективность биодеградации связана с тем, что живые клетки представляют собой совершенные «химические заводы», оснащенные тончайшей регуляцией и продвинутыми катализаторами — ферментами. А если речь заходит о клетках микробов, особенно бактерий, то проявляется еще и способность к очень быстрым эволюционным изменениям, позволяющим как осваивать выработку новых веществ, так и адаптироваться к их разложению.
Сладкая жизнь в кислоте
Большинство веществ, которые в обывательском понимании ассоциируются исключительно с неживой природой, на самом деле вырабатываются живыми организмами. Пускай в следовых количествах и при наличии эффективных механизмов обезвреживания. Отличным примером может служить всем известная серная кислота H2SO4 (рис. 1), находящая широкое практическое применение и производимая химической промышленностью крупнотоннажно уже не первое столетие.
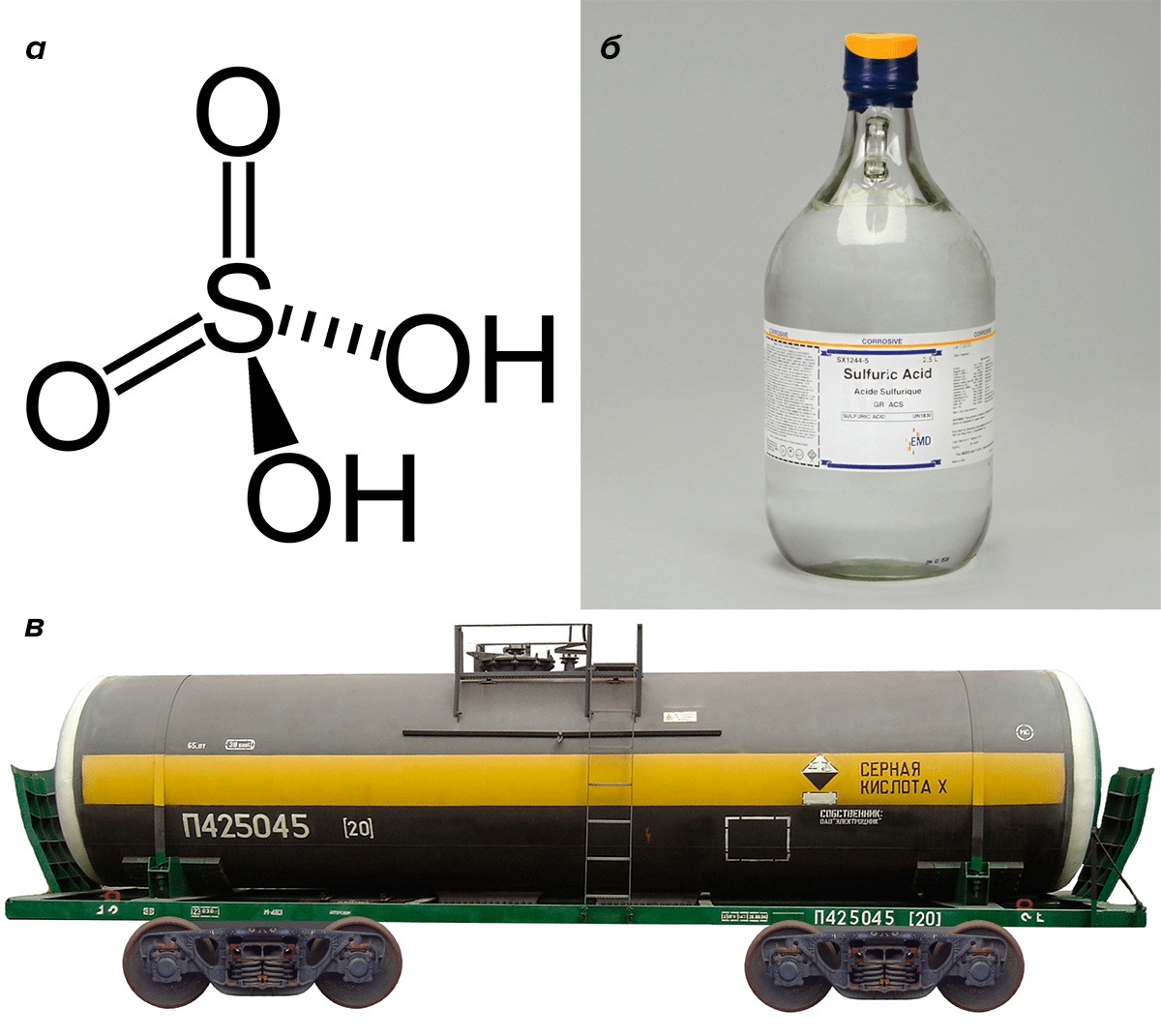
Рисунок 1. Серная кислота — одно из веществ, которые ассоциируются с тленом и разрушением, но не с жизнью. И тем не менее она — метаболит практически всех живых организмов. а — Структурная формула. б — Концентрированная серная кислота в бутылке. в — Серная кислота — крупнотоннажный продукт. Цистерны для ее перевозки имеют специальную, бросающуюся в глаза маркировку.
В то же время, серная кислота опасна. Она — очень сильная (все еще более сильные кислоты называют «сверхкислотами», «суперкислотами»): всё окисляет и разъедает; относится ко второму классу опасности. К сожалению, иногда серная кислота применяется и в криминальных целях, поскольку оставляет тяжелейшие ожоги на коже, уродует человека . Еще недавно экологи били тревогу по поводу кислотных дождей и туманов, образующихся из смога, богатого оксидами серы. Сейчас, когда развитые страны перешли в постиндустриальную фазу развития и принялись заботиться об экологии, проблема стала значительно менее острой.
Опасность серной кислоты усугубляется тем, что ее смешение с водой и диссоциация на ионы представляет собой экзотермическую реакцию, сопровождающуюся сильным нагреванием смеси. Жидкость может закипеть и выплеснуться. Поэтому одним из азов изучения химии является правильная последовательность действий при разбавлении серной кислоты: лить надо кислоту в воду (она тяжелее воды и идет ко дну емкости), но не наоборот!
И тем не менее человеческий организм выделяет с мочой ежедневно около одного грамма кислотных остатков серной кислоты — сульфат-ионов. Серная кислота образуется во всех живых клетках как один из продуктов метаболизма серы — одного из важнейших биогенных элементов [6]. В человеческом организме она мгновенно нейтрализуется многочисленными буферными системами. Более того, метаболическая серная кислота потребляется организмом на сульфирование ксенобиотиков, биосинтез цереброзинсульфата, гепаринсульфата, гликозаминогликанов. А некоторые бактерии, относимые к группе ацидофилов («кислотолюбов»), вольготно себя чувствуют даже при очень низких значениях рН, обусловленных, в первую очередь, серной кислотой [7]. Продуцируемая бактериями серная кислота даже приводит к биокоррозии металлических изделий!
Легче не бывает
Человечество совершает открытия, не подозревая, что задолго до него они уже совершены живой природой в результате бессознательного естественного отбора. Например, когда немецкие химики Отто Дильс и Курт Альдер в 1928 году описали реакцию, обессмертившую их имена (позаботились о защите своих авторских прав!). Реакция Дильса—Альдера (рис. 2) и вправду имеет не только научную, но и практическую ценность, широко применяется как в лабораторном, так и в промышленном органическом синтезе. Должно было пройти шестьдесят с лишним лет, чтобы в 1989 году обнаружили, что эту реакцию могут осуществлять биологические катализаторы: моноклональные антитела и ферменты, названные дильсальдеразами (авторские права были защищены и в этом случае, хотя ферменты, вероятно, делали свое дело задолго до появления первых людей). Эти ферменты участвуют в биосинтезе вторичных метаболитов с высокой молекулярной массой и сложным строением — ряда алкалоидов и терпеноидов [8], отдельные представители которых показали себя в качестве лекарственных препаратов.
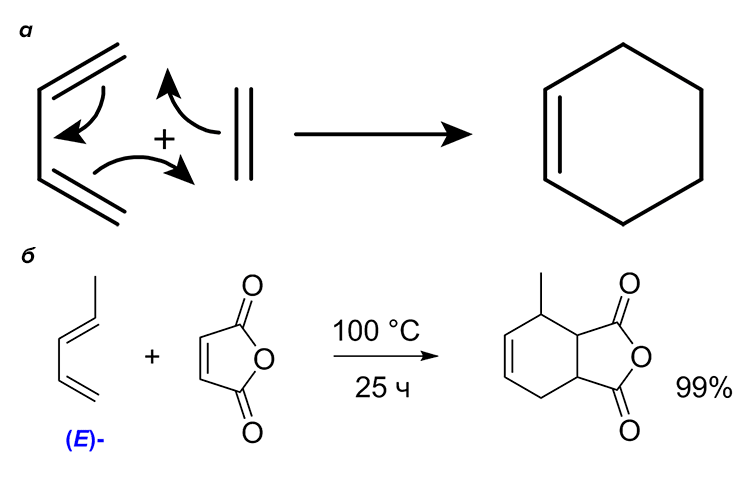
Рисунок 2. Реакция Дильса—Альдера. а — Общая схема. б — Конкретный пример: реакция присоединения Е-пиперилена (пентадиена-1,3) к малеиновому ангидриду.
Спектр природных молекул необычайно широк: от самых простых и легких до массивных и имеющих настолько сложную структуру, что их химический синтез вошел в анналы великих научных достижений. Простейшим метаболитом является молекулярный водород (Н2) — самая маленькая, легкая и просто устроенная из всех существующих молекул (рис. 3а, вверху справа). Это просто два протона, соединенные одинарной ковалентной связью и укутанные облаком из двух электронов. Иногда к протонам добавляются нейтроны — если речь идет о тяжелых изотопах водорода (дейтерии или тритии). Впрочем, понятие «тяжелый» в отношении водорода весьма условное, поскольку это самый легкий элемент в периодической таблице. Молекулярная масса двухатомной молекулы водорода составляет всего два дальтона. Простое вещество водород — газ без цвета, вкуса и запаха, в 14,5 раз легче воздуха. Это самое легкое вещество на свете. Гравитация Земли плохо удерживает водород, и он беспрепятственно улетучивается в открытый космос. Высокое содержание водорода наблюдается в экзосфере — области атмосферы, наиболее удаленной от поверхности нашей планеты.
Получают водород в виде синтез-газа (смеси с угарным газом) реакцией водяного пара и раскаленного кокса, или в чистом виде электролизом воды. Удобным лабораторным методом стало окисление металлического цинка или железа разбавленными кислотами — серной или соляной.
Водород — сильный восстановитель, и в этом качестве широко используется химиками. В промышленности он — сырье в производстве хлористого водорода, аммиака, метилового спирта, анилина, ряда металлов, искусственных пищевых жиров (маргарина). К тому же, водород — самое экологически чистое топливо, поскольку единственным продуктом его сгорания на воздухе является водяной пар (рис. 3а), а энергии выделяется очень много:
2Н2 + О2 → 2Н2О + 285,75 МДж
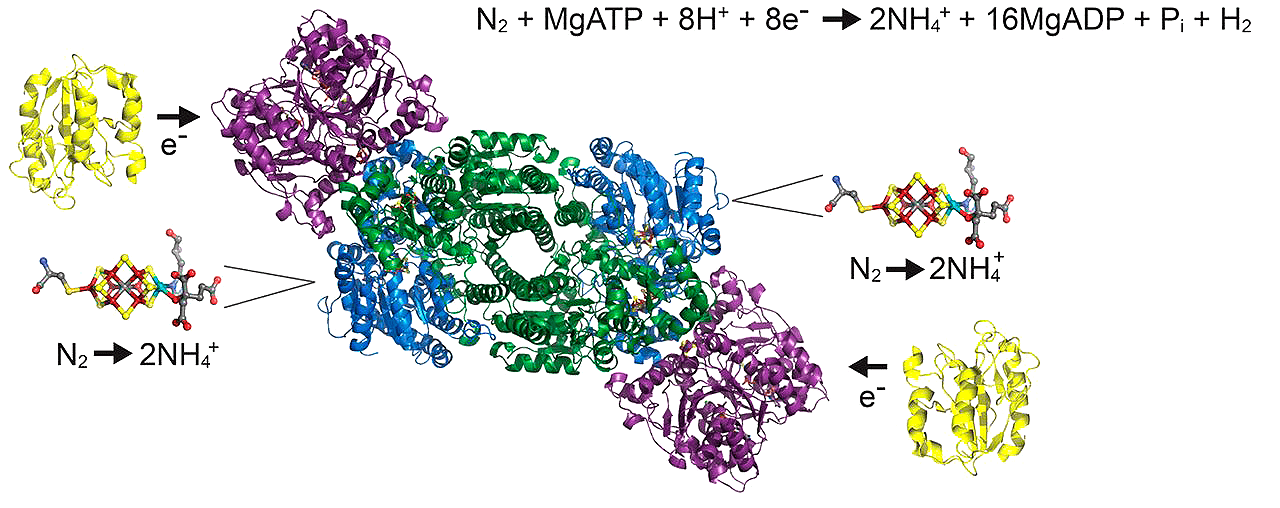
Для нас же главное то, что водород образуется при некоторых процессах метаболизма — брожении и фиксации молекулярного азота [9] ферментом нитрогеназой (рис. 3б), про удивительные особенности строения которой я вкратце рассказывал в статье [5]. То есть молекулярный водород с полным правом можно назвать простейшим биологическим соединением. Вдобавок, есть бактерии, использующие молекулярный водород в качестве источника электронов — так называемые водородокисляющие бактерии [10].
Молекулы-монстры
Если водород бьет все рекорды простоты и легкости, то некоторые биологические молекулы обладают поразительно сложной структурой, на расшифровку которой ушли годы. Здесь, наверно, уместно вспомнить триаду самых сложных природных молекул — кобаламин, майтотоксин и полисахарид клеточных стенок растений рамногалактуронан II [12]. Кобаламин (витамин В12) уже упоминался в статье [5]. Эмпирическая формула майтотоксина выглядит так: C164H256O68Na2S2, а его структурная формула показана на рисунке 23 под названием «Токсины динофлагеллят». Действительно, водоросли динофлагелляты («ужасные жгутиконосцы») (рис. 4) синтезируют целый букет ядов, и это делает их одними из самых опасных живых организмов. Основу коктейля динофлагеллят составляют циклические полиэфиры — яды, хорошо растворимые в липидах (поскольку родственны им), содержащие множество кислородных мостиков и обладающие высочайшей токсичностью. Среди них окадаевая кислота, бреветоксины, сигуатоксины, а также состоящий в отдаленном родстве с ними палитоксин, продуцируемый коралловыми полипами.

Рисунок 4. Красный прилив у побережья острова Сулавеси (Индонезия) — цветение морской воды, связанное со вспышкой численности динофлагеллят. Явление красивое, но исключительно опасное.
Все эти молекулы имеют сложное строение, но майтотоксин, продуцируемый водорослью Gambierdiscus toxicus, безусловно, «король» размеров молекулы и сложности ее строения. Двадцать две метильные и двадцать восемь гидроксильных групп. Тридцать два конденсированных кольца. Девяносто восемь хиральных центров. Молекулярная масса натриевой соли почти 3424 Да, то есть молекула майтотоксина в 1712 раз тяжелее молекулы водорода. Столь массивная молекула разлагается при нагревании, поэтому температур плавления и кипения майтотоксина не существует, даже в вакууме. Конечно, изучать строение такой молекулы, а тем более синтезировать ее, исключительно сложно [13]. К слову, полный синтез майтотоксина не осуществлен до сих пор; остались сомнения и в правильности установленной пространственной структуры этого соединения. Палитоксин, кстати, по уровню сложности, да и по токсичности, его достойный конкурент.
Для чего живым организмам понадобился биосинтез таких «химических монстров»? Дело в том, что они оказались исключительно токсичными веществами. LD50 майтотоксина для мышей составляет 50 нг/кг живого веса, то есть он в 1400 раз токсичнее VX, про который рассказывалось в статье [14], в 175 раз токсичнее «Новичка» А-234 — самого токсичного вещества, созданного человеком [15], и в 74 200 раз превосходит цианид! Механизм действия этого яда основан на активации работы кальциевых каналов и резком увеличении концентрации ионов кальция внутри клеток. В результате возникает мышечный спазм и полный паралич, приводящий к смерти. Это самый сильный природный токсин небелкового происхождения.
Палитоксин чуть менее токсичен: его LD50 составляет 100–200 нг/кг живого веса. Так что с эволюционной точки зрения возникновение способности к синтезу майтотоксина, палитоксина и подобных им веществ было оправданным.
Отведайте этидиумбромида
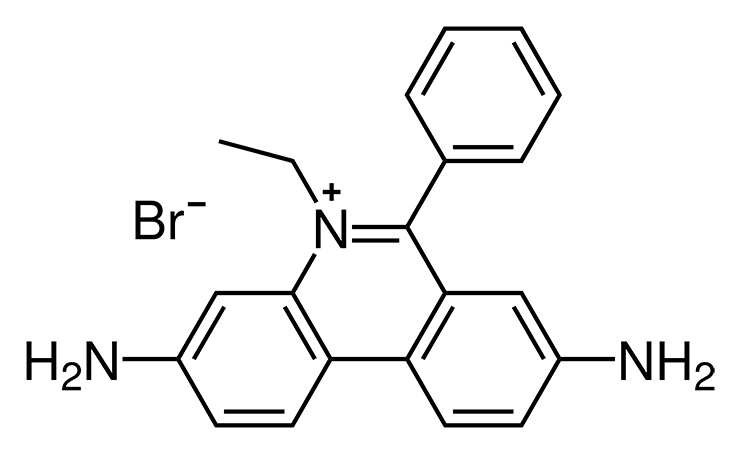
Было бы странно, если бы столь совершенные химические реакторы, коими являются живые клетки, не могли бы справиться с веществами, созданными человеком. Тем не менее некоторые примеры биодеградации вызывают изумление даже у искушенных специалистов. Бромистый этидий (3,8-диамино-5-этил-6-фенилфенантридиум бромид) — вещество, широко известное в узких кругах молекулярных биологов и генетиков (рис. 5). Важнейшая особенность этого соединения — высочайшее сродство к макромолекулам ДНК и способность образовывать с ними прочные комплексы. А поскольку комплексы ДНК с этидиумбромидом обладают способностью флуоресцировать при освещении ультрафиолетовыми лучами, это вещество часто используется для проявки пятен ДНК, разделившихся при электрофорезе в полиакриламидном геле.
В статьях [5], [14], одна из которых посвящена биодеградации неприродных веществ, а другая — необычным и редким природным метаболитам, я уже рассказывал про соединения, подобно бромистому этидию образующие комплексы с ДНК — полиароматические углеводороды и диоксины. Среди веществ с подобными свойствами есть и целый ряд природных антибиотиков — антрациклины, актиномицин D, эхиномицин, — используемых для лечения онкологических заболеваний. Все эти вещества, объединяемые в группу интеркалирующих агентов, очень опасны для живых клеток: это мутагены, канцерогены и тератогены. Блокируя репликацию и транскрипцию ДНК, они останавливают и деление клеток. Бромистый этидий в середине ХХ века использовался в ветеринарии для лечения трипаносомозов у скота. Впоследствии, с ужесточением требований к препаратам, он был исключен из практики. Конечно, непросто представить соединение с таким набором свойств в качестве пищевого субстрата для живых клеток.
Тем не менее бромистый этидий — это типичное органическое вещество, состоящее в основном из биогенных элементов. Да и структура его не представляет собой что-то неординарное. Поэтому нашлись-таки бактерии из рода Lactobacillus, утилизирующие бромистый этидий в качестве источника углерода [16]. Конечно, сам факт того, что биодеградации одного вещества посвящают целые статьи, свидетельствует о сенсационности этого результата. Метаболические способности микроорганизмов явно недооценены!
Бромистый этидий в природе не найден. Вполне возможно, что до человека он никогда и не существовал. Однако в некоторых растениях найдены похожие алкалоиды фенантридинового ряда (рис. 6) [15]. Наверняка они встречаются в природе миллионы лет и, естественно, подвергаются деструкции, в том числе биологической. То есть, метаболические пути разложения производных фенантридина были «заготовлены» в биосфере задолго до первого синтеза бромистого этидия человеком, и были применены для нового вещества.
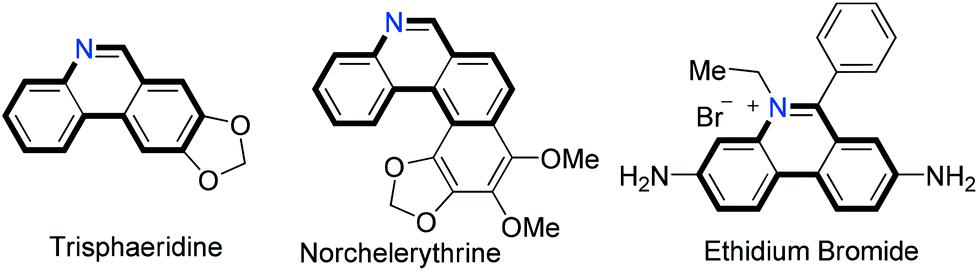
Рисунок 6. Структуры природных фенантридиновых алкалоидов трисферидина (слева) из растений рода Narcissus семейства амариллисовых, норхелеритрина (в центре) из растений рода Zanthoxylum семейства рутовых и синтетического производного фенантридина — бромистого этидия (справа). Жирным выделен общий фрагмент этих трех молекул, простейший член ряда — гетероцикл фенантридин.
Бактерия... кофеман
Если кофе и яд, то очень медленный, потому что я пью его вот уже 80 лет.
Фонтенель
В основе биодеградации лежит удивительная способность микроорганизмов адаптироваться к самым неблагоприятным условиям существования. Причем адаптироваться со сравнительными легкостью и быстротой.
Понятие «биодеградация» ассоциируется с ликвидацией нефтяных загрязнений и сточных вод предприятий [14], [18–22]. Но при помощи этого метода можно избирательно удалять из сложной смеси какое-то одно вещество. Например, интересная и необычная история связана с биодеградацией кофеина.
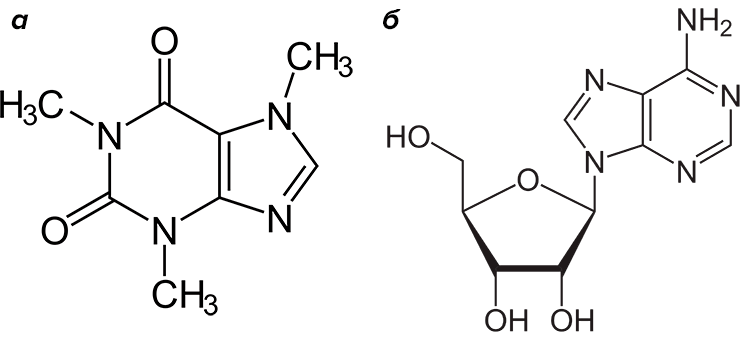
1,3,7-триметил-1H-пурин-2,6(3H,7H)-дион представляет собой алкалоид пуринового (точнее, метилксантинового) ряда и имеет множество тривиальных названий: кофеин, теин, матеин, гуаранин, 1,3,7-триметилксантин. Все названия, кроме последнего, отражают источник, из которого получено вещество — традиционная номенклатура для алкалоидов. Сильнее других закрепилось название «кофеин», данное в 1819 году немецким химиком Фердинандом Рунге, выделившим из зерен кофе бесцветные игольчатые кристаллы нового вещества, горькие на вкус и растворимые в горячей воде. Уже из названий ясно, что этот алкалоид содержится в некоторых растениях — зернах кофе, какао и гуараны, орехах колы, почках и листьях чая, парагвайского падуба, стеблях дамианы (рис. 7б–д). Все перечисленные растения произрастают в тропиках и издревле используются в целях психостимуляции. Из них заваривают бодрящие напитки или готовят изысканные пищевые продукты, например, шоколад. А психоактивным агентом в них оказался, конечно же, кофеин (рис. 7а).
Активность кофеина обусловлена его структурным сходством с нуклеозидом аденозином (рис. 7а) — оба они производные гетероцикла пурина. Аденозин, в свою очередь, это не только структурный фрагмент молекул нуклеиновых кислот, но и нейротрансмиттер. С действием аденозина тесно связаны суточные ритмы (в частности, сон). Связываясь в центральной нервной системе со специфическими аденозиновыми рецепторами, аденозин угнетает ЦНС, понижает кровяное давление и вызывает сонливость. А кофеин действует как классический структурный аналог и антагонист: блокирует рецепторы, не позволяет связаться с ними аденозину и оказывает прямо противоположное действие. То есть возбуждает ЦНС, усиливает сердцебиение и кровяное давление, прогоняет сонливость. Поднимает тонус и настроение, придает сил.
Кофеин представляет собой легкий наркотик и вызывает зависимость, как и любой психоактивный препарат. До сих пор не умолкают споры о том, относится ли кофеин к канцерогенам — структурное сходство с пуриновыми основаниями ДНК позволяет предполагать для него мутагенные и канцерогенные свойства. Впрочем, однозначно не подтвержденные и наверняка очень слабо выраженные. Для многих беспозвоночных, в отличие от человека, кофеин стал сильным ядом. У ряда членистоногих и моллюсков даже в малых концентрациях он вызывает паралич. Возможно, это его свойство и стало причиной эволюционного возникновения растений, продуцирующих и накапливающих кофеин: так они обороняются от насекомых и улиток фитофагов. Хотя... нектар цветков кофе и ряда цитрусовых (апельсин, лимон, грейпфрут, помела) содержит очень низкие концентрации кофеина, но насекомых-опылителей он только привлекает. То есть растения могли начать выделять кофеин и для повышения эффективности опыления. Обо всем этом хорошо повествуется в статье [23].
Кофеин — практически обязательный компонент энергетических напитков, а также он широко применяется в медицине как эффективное средство для снятия головной боли. Разумеется, чайные и кофейные плантации всего мира не могут удовлетворить потребность в этом веществе. Поэтому давно разработаны методы химического синтеза кофеина путем метилирования ксантина или мочевой кислоты.
Но мы, кажется, увлеклись. Статья-то посвящена биодеградации. А про биодеградацию кофеина тоже можно рассказать кое-что интересное. Штамм бактерий Pseudomonas putida CBB5 стал одной из немногих культур микроорганизмов, известных не только узким специалистам, но и (благодаря множеству заметок в интернете) широкой общественности. Он прозван бактерией-кофеманом, и не случайно. Кофеин представляет для штамма единственный источник углерода и азота, и в средах, не содержащих данный алкалоид, эта высокоспециализированная бактерия не растет. Вывел этот удивительный микроорганизм будущий сотрудник Университета Айовы Райан Саммерс — в то время старшекурсник, работающий над дипломным проектом [24]. Вот ради этого и была затеяна работа.
Дикая исходная культура была получена из совершенно тривиального источника — из почвы клумбы студенческого городка, на которую студенты после обеда регулярно выливали остатки кофе. Можно было предположить, что у микробиоты этой клумбы уже выработались адаптации к питанию кофеином. В результате направленной селекции (несколько последовательных пересевов в среду, содержащую кофеин в качестве единственного источника азота и углерода) была получена псевдомонада, растущая только на кофеине.
То, что штамм относится к виду Pseudomonas putida, не случайно. Этот организм даже по меркам бактерий обладает удивительно гибким метаболизмом и очень легко осваивает новые пищевые субстраты. Для биодеградации P. putida применяется, пожалуй, чаще других видов микробов, да и не только — ферменты этой бактерии широко используются в самых разных направлениях биотехнологии [25]. Одним словом, Саммерс защитил дипломную работу, потом написал ряд статей, оформил ряд патентов, посвященных изучению этого уникального микроба. Нашел в его геноме кофеиновый оперон, продукты которого в ряд стадий разлагают кофеин до углекислого газа и аммиака (рис. 8), и создал на его основе вместе с целым коллективом коллег множество других штаммов, способных утилизировать кофеин.
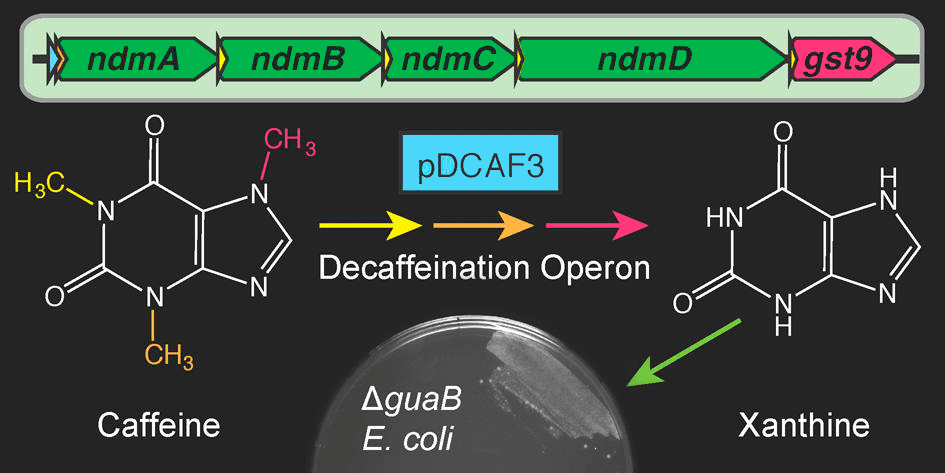
Рисунок 8. Кофеиновый оперон кодирует ряд ферментов, деметилирующих кофеин до ксантина — его основного метаболита. Коллективу авторов удалось перенести его методами генной инженерии в кишечную палочку и «научить» ее перерабатывать кофеин.
Сейчас P. putida CBB5 и другие штаммы с ее кофеиновым опероном находят коммерческое применение в биотехнологии в качестве чувствительного биосенсора на кофеин, позволяющего обнаруживать этот алкалоид в ничтожных концентрациях. Предложены они и как способ получения напитков без кофеина (декофеинизации) [26]. Более того, это первый запатентованный штамм микроорганизмов в истории.
Эта история не только захватывающе интересна. Она еще и поучительна. Саммерс являет собой очень редкий пример человека, который начал работу из чистого любопытства, не имея перед глазами опыта предшественников и не представляя, к чему придет. И довел ее до практического результата — продукта, востребованного на мировом рынке. Добавлю от себя: дорогие читатели, каждый из вас на это способен! Главное — увлеченность, терпение и убежденность в полезности своего дела.
Антибиотик из ксенобиотика
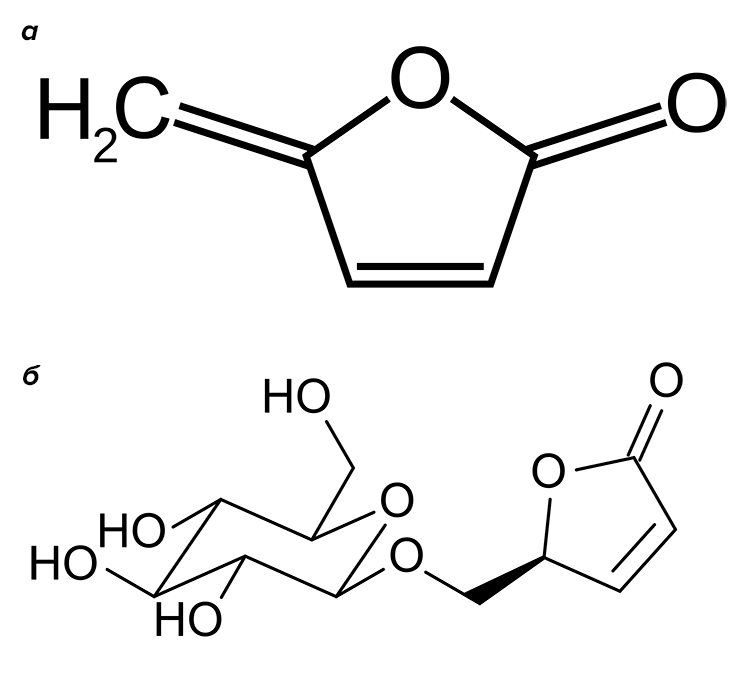
Летом любое русское поле желтеет от лютиков. Не только диких, кстати, — многие представители рода Ranunculus окультурены. Оно и понятно — цветы скромные, но милые. Род велик: только у нас в стране произрастает около 40 видов. Конечно, лютики славятся не только декоративным внешним видом. Растения лекарственные. И сразу предупредим читателей — ядовитые, поскольку содержат целый букет токсичных веществ, разных для каждого вида. Одни богаты алкалоидами, другие содержат сердечные гликозиды, третьи вырабатывают протоанемонин (рис. 9а).
Лютик едкий (рис. 9б) получил свое название не случайно. В соке этого растения содержится протоанемонин — токсичный лактон 4-гидрокси-2,4-пентадиеновой кислоты. Точнее, содержится глюкозид ранункулин, который при повреждении тканей под действием фермента распадается до глюкозы и агликона — собственно протоанемонина. Протоанемонин — сильный ирритант — раздражает кожу и слизистые оболочки, особенно глаза. Кроме того, протоанемонин подавляет рост микроорганизмов (то есть проявляет свойства антибиотика). На воздухе он димеризуется по двойной связи и образует анемонин — вещество, также обладающее биологической активностью, анальгетик и спазмолитик. Вырабатывается многими ядовитыми растениями семейства лютиковых (Ranunculaceae) [27]. Его биохимический предшественник в растениях — 5-гидроксилевулиновая кислота.
Протоанемонин, безусловно, интересное соединение. И тем не менее почему на страницах этой статьи ему уделено столько внимания? Какое вообще отношение он имеет к биодеградации? Оказывается, имеет.
Коллектив из Национального исследовательского биотехнологического центра Германии (Брауншвейг) исследовал аэробную биодеградацию хлорароматических соединений штаммами бактерий. Из предыдущих статей мы уже знаем, что эти вещества образуются как продукты горения полимеров, а некоторые из них еще недавно применялись в качестве пестицидов. Хлорированная ароматика справедливо считается одним из опаснейших загрязнителей окружающей среды. Эти вещества сильно токсичны, канцерогенны и, к сожалению, прекрасно накапливаются в организме.
Ароматические соединения в аэробных условиях метаболизируются по одной схеме: сначала окисляются до катехинов (1,2-дигидроксибензолов), после чего ароматическое кольцо раскрывается, и образуются производные цис,цис-муконовой кислоты. Этот путь обезвреживания ароматических веществ характерен для самых разнообразных форм жизни, от бактерий до млекопитающих. Бактерии разлагают муконаты далее, до полностью безвредного ацетилкоэнзима А.
Метаболизм хлорароматических соединений ничем принципиально не отличается. Образуются хлоркатехины и соответствующие хлор-цис,цис-муконовые кислоты. Известна склонность цис,цис-муконовых кислот образовывать лактоны, напоминающие протоанемонин — муконолактоны. Но герои нашего повествования обнаружили... самый настоящий протоанемонин, образующийся в результате метаболического расщепления 4-хлормуконолактона (рис. 10). Статья с описанием этого факта даже была названа авторами «Из ксенобиотика в антибиотик» [28]. Это очень интересный пример того, как одно и то же соединение образуется совершенно разными путями у совершенно разных живых организмов, связанных очень отдаленным родством — растений семейства лютиковых и бактерий родов Pseudomonas, Sphingomonas, Alcaligenes, Rhodococcus.
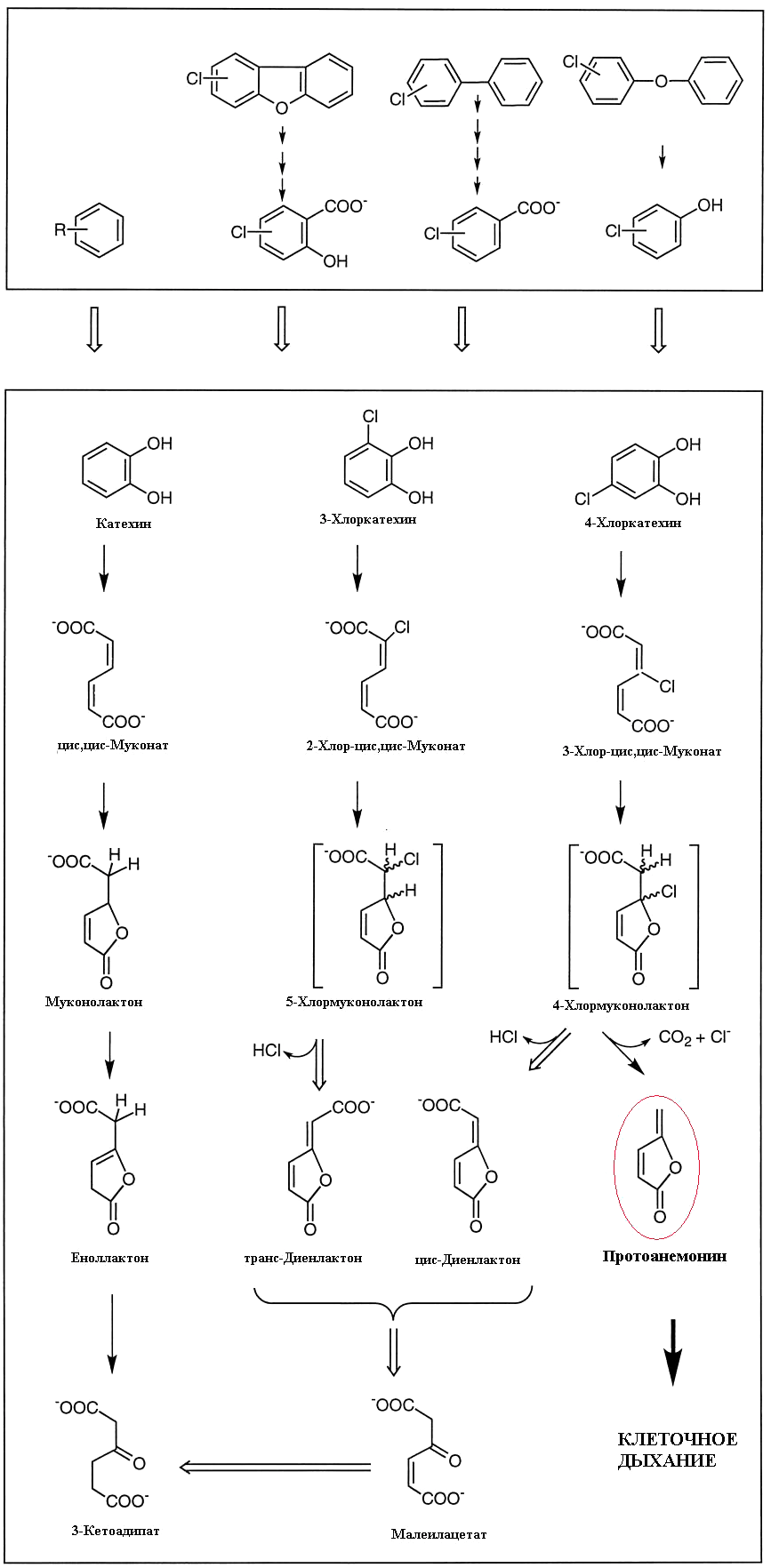
Рисунок 10. Биодеградация хлорароматических веществ с образованием антибиотика протоанемонина (выделен цветом).
[28], рисунок с изменениями
Но и это еще не всё. Как уже говорилось, протоанемонин обладает противомикробным действием. Но это не мешает бактериям разлагать его как промежуточный продукт биодеградации хлорароматики. Pseudomonas sp. B13 при помощи фермента диенлактонгидролазы обезвреживает протоанемонин, раскрывая лактоновый цикл [29].
Запереть джинна
До сих пор мы вели разговор в основном о биологическом обезвреживании химических отходов. Однако сегодня особенно остро стоит проблема захоронения еще более опасных отходов — ядерных. Именно захоронения. Потому что, в отличие от химических отходов, радиоактивные не поддаются полному обезвреживанию. «Влезть» в ядро атома и произвести изменения в нем гораздо труднее, чем в электронных оболочках этого атома. То есть радиоактивные отходы напоминают джинна из восточных сказок — уберечься от них можно, только надежно заперев. Их и запирают в массивных бетонных саркофагах, глубоко под землей или под водой.
Конечно, закономерен вопрос: может ли метод биодеградации помочь в борьбе с радиоактивным загрязнением? И каким образом? Живые организмы в процессе эволюции достигли высочайшего совершенства в химической трансформации веществ. Но атомные ядра для них недоступны. Ни одно живое существо (за исключением человека, да и то с совсем недавних пор) не способно накапливать и высвобождать энергию, достаточную для запуска ядерного синтеза или распада.
Значит, биодеградация бессильна? Нет, не бессильна. Ведь проблему не обязательно решать «в лоб». Большинство атомов, как стабильных, так и нестабильных, вступают в химические реакции. При этом вещество не утрачивает радиоактивность, но его химические свойства могут радикально измениться. Например, если оно становится нелетучим или нерастворимым в воде, угроза радиоактивного загрязнения резко снижается. Вот в этом биодеградация может помочь.
В своей последней статье в «Науке и жизни» [30] я уже рассказывал про то, как некоторые виды грибов обезвреживают обедненный уран, в ряд стадий превращая химически активный (и очень токсичный!) металл в химически инертные и нерастворимые в воде соли — фосфаты уранила, более удобные для захоронения.
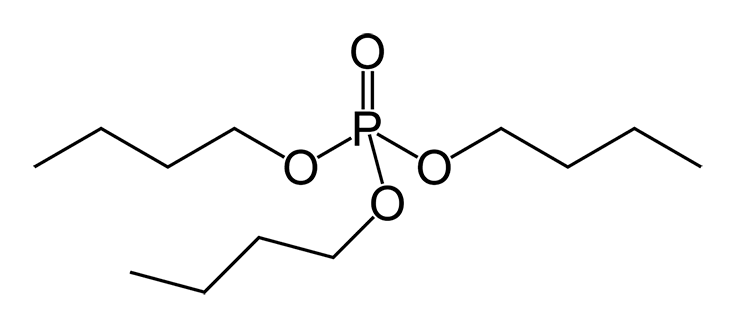
Похожий, хотя, в некотором смысле, даже более элегантный пример применения биодеградации для захоронения радиоактивных отходов описан в работе [31]. Органические фосфаты (сложные эфиры ортофосфорной кислоты и спиртов) широко применяются в промышленности в качестве пластификаторов (добавляются в полимеры для придания им эластичности и пластичности) и полярных растворителей. В частности, трибутилфосфат (рис. 11а) прекрасно сольватирует ионы переходных металлов и применяется для разделения очень близких по свойствам циркония и гафния, в качестве эффективного экстрагента солей железа, цинка, серебра, золота, а в первую очередь актиноидов: тория, урана и плутония. Собственно, промышленная технология обогащения урана основана на экстракции трибутилфосфатом.
То, что бактерии способны использовать трибутилфосфат и другие алкилфосфаты в качестве источника углерода и фосфора, известно давно. Путь катаболизма в данном случае вполне заурядный. Сначала ферменты эстеразы гидролизуют сложный эфир до спирта и кислоты. Далее спирты алканолы окисляются до ацетил-КоА, вступающего в дальнейший метаболизм углерода (этот путь изображен далее, на рисунке 23). А утилизация фосфорной кислоты для микробов вообще не проблема: для них это готовый пищевой продукт, в норме даже дефицитный.
Однако коллектив авторов из Университета Бирмингема (Великобритания) исследовал не просто биодеградацию трибутилфосфата. В культуральную среду был добавлен нитрат уранила UO2(NO2)2 — в виде этой соли экстрагируется уран. В среду посеяли смешанную культуру бактерий Citrobacter sp. и Acinetobacter sp. — их близкие родственники изображены на рисунке 11, внизу. Через определенное время в среде стал выпадать осадок из кристаллов ярко-желтого цвета — полигидрат гидрофосфата уранила. То самое нерастворимое в воде соединение, в виде которого удобно связывать радиоактивный элемент для дальнейшего захоронения! То есть, бактерии «съели» органическую часть растворителя (бутильные радикалы), а образовавшийся незамещенный фосфат связал катионы уранила UO22+. Понятно, что этот метод имеет огромный потенциал практического применения. При помощи микроорганизмов можно обезвреживать стоки с предприятий, производящих ядерное топливо.
Во имя искусства
В своих статьях [5], [14], [30] я уже приводил множество примеров эффективности биодеградации. Собственно говоря, в противном случае этот метод не применялся бы. Но, оказывается, биодеградация — не только эффективный, но и очень тонкий метод очистки, которому порой находят самое неожиданное применение.
Испанский город Валенсия, один из старейших в Европе, — настоящий город-музей с историей, охватывающей более двух тысячелетий. Здесь оставили свой культурный след эллины и карфагеняне, римляне и вестготы, мавры, иезуиты и творцы Нового времени. И среди многочисленных достопримечательностей Валенсии есть церковь Святого Иоанна, возведенная еще в XIV столетии, а в середине XIX века получившая статус Королевского церковного прихода. А если учесть, что церковь строилась на фундаменте старинной маврской мечети, возраст всей постройки уходит еще дальше в прошлое, в конец первого тысячелетия нашей эры.
Стоит ли говорить, что возводили и расписывали церковь признанные мастера. Например, купол на рубеже XVII и XVIII веков расписывал в стиле барокко придворный художник Антонио Паломино, которого называли «испанским Вазари».
Конечно, на протяжении столетий шедевры повидали немало событий и нуждались в реставрации. Особенно повредил их пожар, случившийся в 1936 году, в разгар Гражданской войны в Испании. А реставрация требует порой не меньшего мастерства, чем создание шедевра. Пожалуй, несправедливо, что имена реставраторов известны широкой общественности куда меньше, чем имена художников, скульпторов и зодчих. Команде профессионалов, работавших в 1960-х гг., удалось буквально сотворить чудо и вернуть фрескам первозданный вид.
Но в ходе реставрационных работ были допущены ошибки, последствия которых проявились не сразу. В последующие десятилетия на поверхности слоев краски стали проступать натеки клея и белесые разводы из кристалликов соли. На первый взгляд, удалить их не составляло труда. Но надо помнить, что речь идет о шедеврах мирового значения. Даже малейшие царапины, повреждения поверхности фресок допускать было нельзя. По этой причине как о механической очистке, так и о применении растворителей речь не шла. Таким образом, задача по очередному спасению фресок была многократно усложнена. Вообще, была ли она решаемой? Вот здесь на помощь пришла биодеградация.
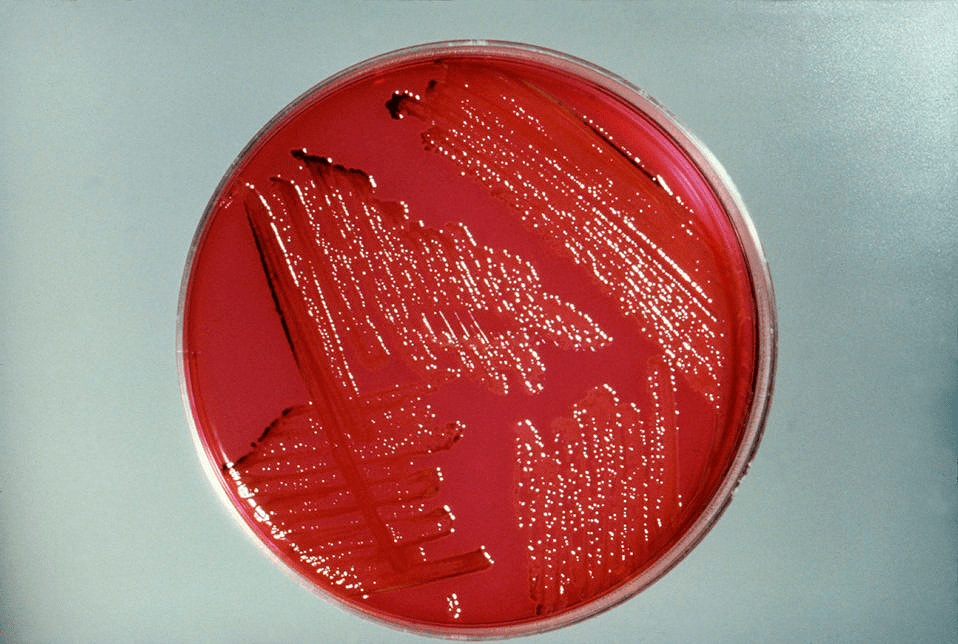
Исследователи из Политехнического университета Валенсии специально для этой цели вывели штаммы Pseudomonas stutzeri (рис. 12). Бактерии поместили в специальный гель, который нанесли на поверхность фресок. А сами штаммы были подобраны так, что разложили весь клей и всю соль, скопившиеся на поверхности, но не тронули краску! После окончания процедуры очистки реставраторы высушили полотно и очистили гель вместе с микробами. Позже они отмечали, что другие методы не позволили бы очистить поверхность картин столь аккуратно [32].
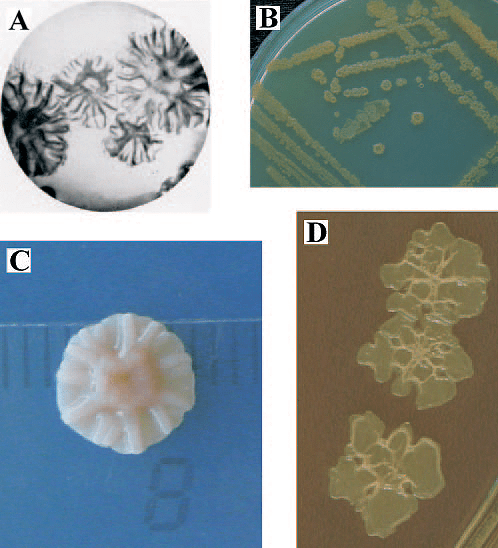
Рисунок 12. Колонии Pseudomonas stutzeri — близкие родственники бактерий, применявшихся для реставрации в Валенсии
Вместе с коллективом из Испании работали итальянские коллеги, которые уже обладали подобным опытом в Пизе. Пиза, конечно же, город-музей не менее древний, чем Валенсия. Знаменита она, в первую очередь, своей Падающей башней, но не только. Одна из главнейших достопримечательностей Пизы — старинное церковное кладбище «Святое поле» (Кампо Санто), возникшее еще в XIII веке (рис. 13а). На протяжении последующих четырех столетий церковь при кладбище расписывали фресками. Изображенные на них сюжеты современному человеку кажутся очень мрачными, но выбор тем был далеко не случаен. Дело в том, что эпидемическая обстановка в четырнадцатом веке была до боли похожа на нынешнюю (с поправкой на уровень медицины, конечно!). Как сегодня на планете свирепствует COVID-19, так в позднем Средневековье целые города вымирали от чумы — «черной смерти» (об этом очень подробно и увлекательно рассказано в монографии моих старых друзей и коллег Тимура Хайдарова и Дмитрия Долбина [34]. Не раз освещала эту тему и «Биомолекула» [35], [36]). Поэтому тема Смерти и Апокалипсиса в искусстве того времени была очень популярна.
Но... труд многих поколений может быть уничтожен в одночасье. Комплекс Кампо Санто сильно пострадал от налетов британских и американских бомбардировщиков летом 1944-го. Фрески именитого итальянского художника начала XIV столетия Буонамико Буффальмакко «Триумф смерти» и «Страшный суд» (рис. 13б) были повреждены взрывом зажигательной бомбы. Вот при их реставрации впервые применили биологический метод [37]. Разумеется, его авторы планируют вести исследования в этой области дальше. Так что в будущем бактерии помогут спасти немало шедевров.
А для нас самым интересным стало то, что в каждом случае подбираются (и даже создаются заново) штаммы бактерий, подходящие для реставрации конкретной картины. Это очень хорошо демонстрирует разнообразие путей микробного метаболизма. В принципе, можно найти бактерии, питающиеся чем угодно и что угодно не использующие в пищу. То есть биодеградация является не только эффективным, но и исключительно тонким, избирательным методом!
Биодеградация? Нет, биосинтез
Многозначное и имеющее в русском языке негативный оттенок слово «деградация» в дословном переводе с латыни означает «упрощение». В профессиональном научном языке негативного оттенка у него, кстати, нет. Соответственно, сложносоставное слово «биодеградация» подразумевает упрощение структуры вещества под влиянием биохимических реакций. И даже у специалистов, работающих в этой области, термин «биодеградация» интуитивно ассоциируется именно с упрощением структуры.
Это соответствует действительности, если речь идет о веществах сложного строения, таких как полимеры. А если биодеградации подвергается вещество простейшей структуры? В таком случае чаще всего, наоборот, происходит усложнение строения. В статье [14] я рассказывал о синильной кислоте и ее солях цианидах — одних из опаснейших ядов. Рассказывал и про то, что в процессе эволюции живые организмы «изобрели» множество приемов обезвреживания этих веществ. Очевидно, что расщепить молекулу, содержащую всего один атом углерода, не удастся — расщеплять попросту нечего. А один из самых эффективных путей обезвреживания синильной кислоты это конденсация с аминокислотой цистеином при помощи фермента цианоаланинсинтазы. При этом отщепляется сероводород и образуется аминокислота β-цианоаланин. А дальше в дело вступает фермент цианоаланингидратаза, который гидролизует β-цианоаланин до аспарагина и аспарагиновой кислоты (рис. 14). Так молекула синильной кислоты включается в состав сразу двух аминокислот, входящих в структуру белков и являющихся предшественниками множества жизненно необходимых метаболитов [38].
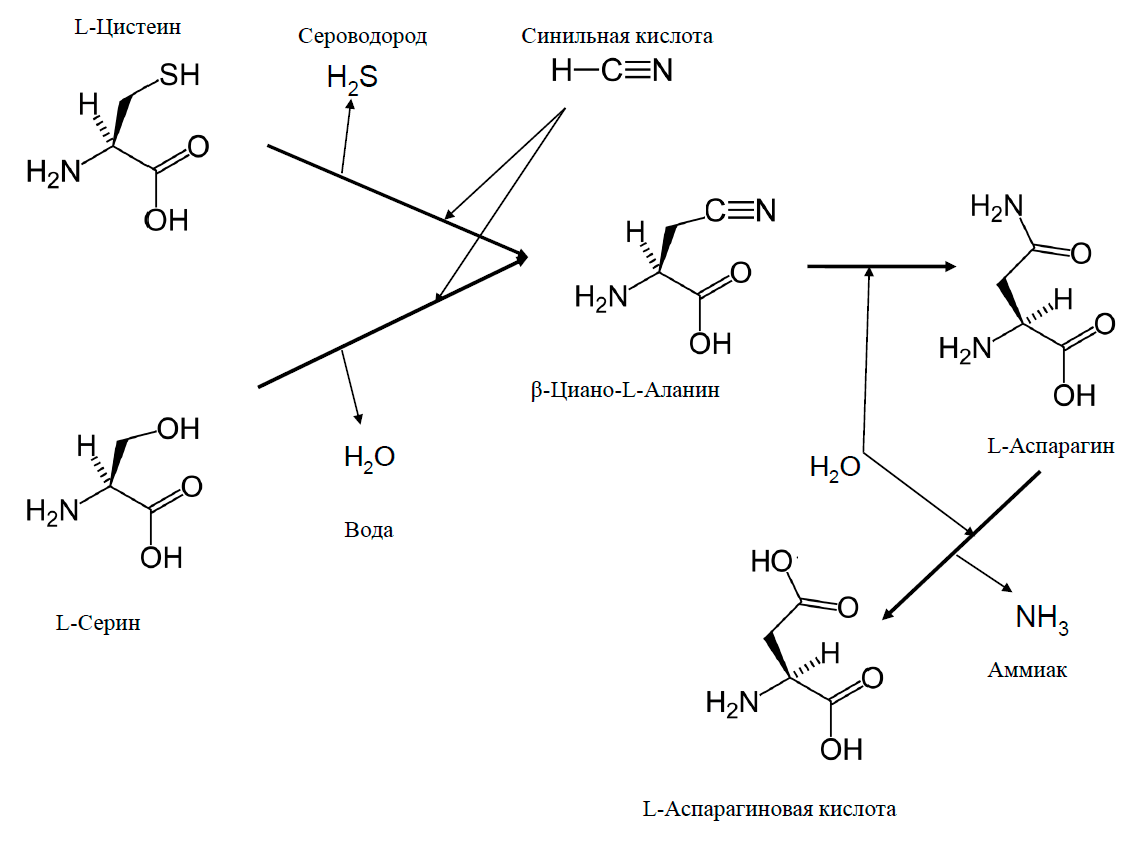
Рисунок 14. Один из самых эффективных метаболических путей обезвреживания цианида при помощи пары ферментов — цианоаланинсинтазы и цианоаланингидратазы
рисунок автора статьи
Этот путь обезвреживания цианидов оказался настолько удачным, что закрепился у самых разнообразных форм жизни — бактерий, зеленых растений (рис. 15), позвоночных и беспозвоночных.
Надо отметить, что цианоаланингидратаза осуществляет еще более интересную реакцию конденсации синильной кислоты с серином. При этом отщепляется не сероводород, а вода, то есть путь совсем уж экологически чистый (рис. 14). Но скорость этой реакции в двадцать раз ниже, чем с цистеином, и в природе она происходит значительно реже [39].
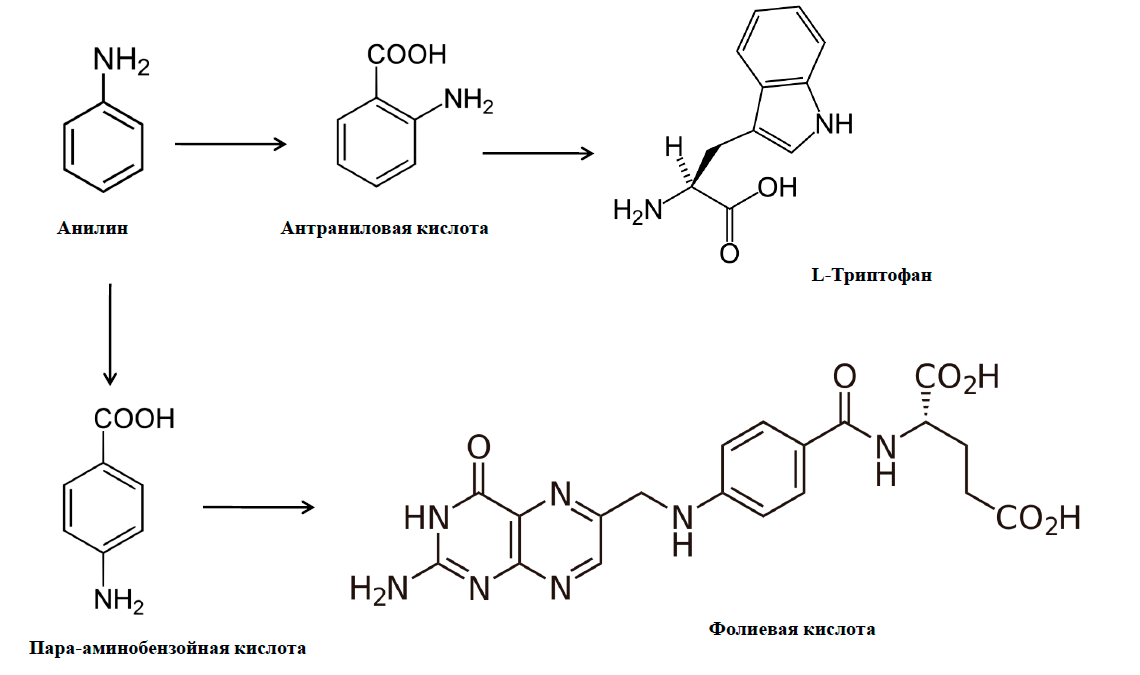
В этом смысле, очень показательны примеры биодеградации анилина. Анилин (фениламин, аминобензол) — крупнотоннажный промышленный продукт. Сырье в производстве красителей и лекарств, имеющее долгую (с позапрошлого века) и славную историю. Связь с органическими красителями запечатлена даже в самом названии вещества: анилин впервые был получен термохимическим разложением индиго (рис. 16а), добываемого из растения Indigofera anil. Позднее его стали производить из более доступного сырья — каменноугольной смолы. А в 1842 году наш великий соотечественник, химик-органик Николай Николаевич Зинин разработал получение анилина восстановлением нитробензола. Этот метод, названный реакцией Зинина, не утратил значения до сих пор. А в последние годы анилин начал интересовать ученых как мономер, полимеризацией которого получают полианилин — уникальный «органический металл» — полимер, проводящий электрический ток. Вещество, вне всякого сомнения, очень полезное. Но... анилин ядовит и представляет собой опасный загрязнитель окружающей среды.
Конечно, микроорганизмы, обезвреживающие анилин, нашлись. Среди них пурпурные (рис. 16б) несерные бактерии родококки, которые способны к фотосинтезу и содержат пигменты бактериохлорофиллы, придающие скоплениям этих бактерий броскую пурпурную окраску. Для этих микроорганизмов давно замечена способность карбоксилировать анилин в орто-положение с образованием антраниловой кислоты — предшественника аминокислоты триптофана (рис. 16в) [40]. То есть токсичное вещество превращается в ценные биологические молекулы, практически не претерпевая структурных изменений! И бензольное кольцо, и атом азота аминогруппы остаются на месте. Напомню, что триптофан для млекопитающих незаменимая кислота. Он входит в состав белков [41] и является биохимическим предшественником гормонов серотонина и мелатонина. Предшественником упоминавшегося выше синего красителя индиго тоже стал триптофан, точнее, его боковой радикал индол. Он-то и образуется из антранилата.
Другая бактерия, Desulfobacterium aniline, для которой термин «анилин» стал видовым названием, карбоксилирует анилин в пара-положение с образованием п-аминобензойной кислоты — предшественника фолиевой кислоты (рис. 16в) [42]. Фолиевая кислота — витамин В9 — вырабатывается кишечной микрофлорой человека и представляет собой ценный метаболит, нехватка которого приводит к анемии. В ряде стран законодательство обязывает обогащать фолатом продукты питания, в частности, мучные изделия.
Следует особо подчеркнуть, что в результате указанных превращений молекула анилина не разлагается. Она входит в состав более сложных биологических молекул целиком!
В связи с этим, следует упомянуть выдающегося американского химика Элиаса Джеймса Кори, создателя ретросинтетического анализа структуры органических молекул и основоположника учения о синтонах. Что же такое синтон? Если объединить определения из «Википедии» и замечательной монографии [43], то получится примерно так:
- Синтон
- реальная или идеализированная структурная единица молекулы, которая может быть введена или создана в результате возможных синтетических приёмов.
Проще говоря, синтоны — это простые детали, из которых можно собирать сложные молекулы. Конечно, говоря о синтонах, Кори и его последователи имели ввиду органический синтез. Однако с полным правом о них может говорить и биохимик. То есть синильная кислота — это синтон для биосинтеза аспарагина, а анилин, соответственно, является синтоном для триптофана и фолиевой кислоты. Подобных примеров можно привести, по меньшей мере, несколько.
Первым пускай будет анилин, раз уж мы начали разговор с него (рис. 17).
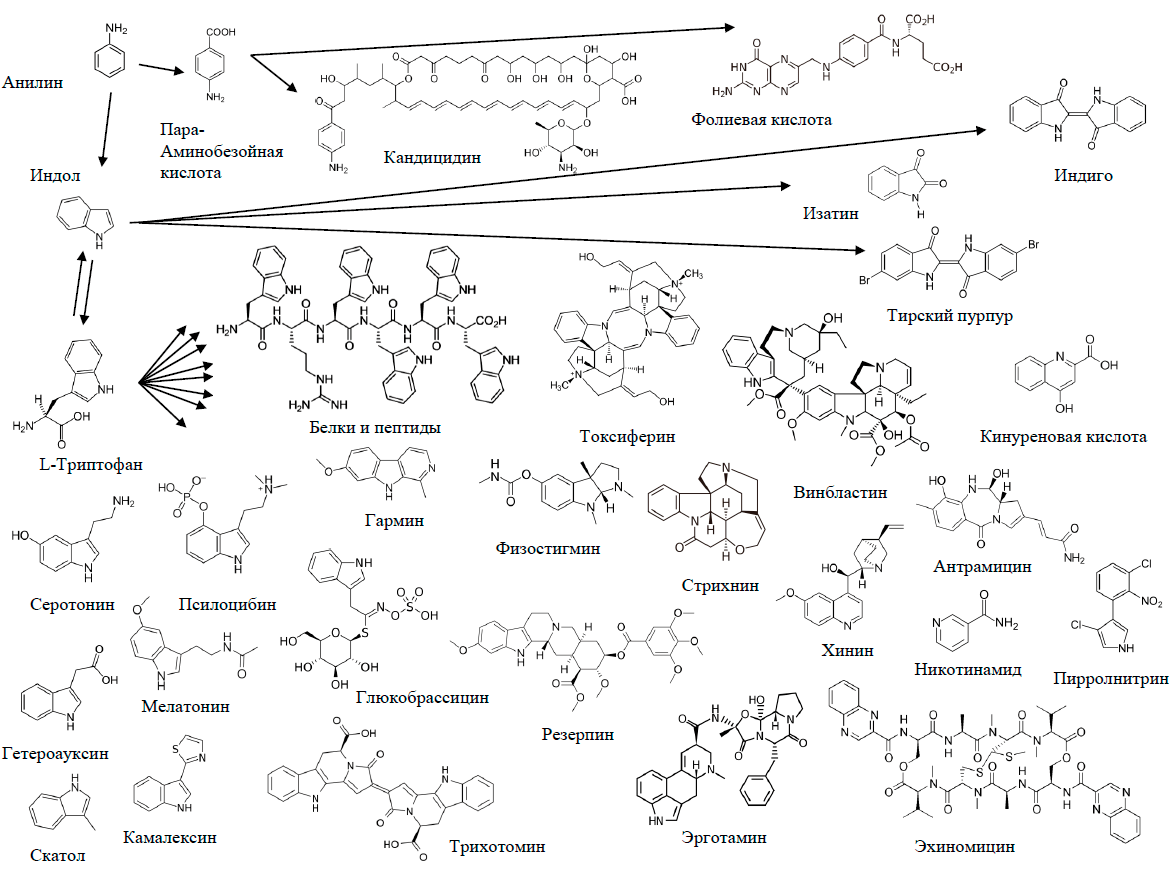
Рисунок 17. Ядовитый продукт химической промышленности анилин в роли синтона природных молекул. Замечательный пример того, как ксенобиотики могут поглощаться биосферой.
рисунок автора статьи
Схема получилась с сильным уклоном в токсикологию: так сложилось эволюционно, что большинство метаболитов, содержащих индольную группу и ее производные, представляют собой токсичные алкалоиды. Но что характерно: при всей непохожести строения и свойств, у абсолютного большинства из них бензольное кольцо сохраняется практически в неизменном виде. Этому эмпирическому факту есть фундаментальное объяснение: шестичленный углеродный ароматический цикл не напряжен и имеет высокую термодинамическую стабильность. Поэтому он не склонен к химическим превращениям.
Хотя в случае никотинамида (витамин В3), который в организме эукариот образуется из триптофана, происходят более глубокие структурные изменения. Бактерии, кстати, синтезируют его из аспарагиновой кислоты, поэтому никотинамид присутствует и на рисунке 24.
Недавние исследования, представленные в замечательном обзоре [44], показали, что анилин может подвергаться целому ряду необыкновенных превращений при помощи ферментов, которые не вошли в схему. Например, полианилин (рис. 18) — тот самый электропроводящий полимер (ссылки по теме — [45–47]), о котором говорилось выше, — можно получать не только чисто химическим путем, но и с использованием пероксидаз из растений! Катализируемая ими реакция приводит к образованию свободных радикалов и радикальной полимеризации анилина.
Очень интересное исследование коллектива из Японии продемонстрировало, что бромпероксидаза из штамма Pseudomonas putida в присутствии бромид-ионов бромирует анилин в орто- и пара-положениях, а в отсутствии солей брома окисляет анилин до красного красителя азобензола, азоксибензола и даже нитробензола (рис. 19) [49]! Соответственно, Salmonella typhimurium при помощи нитроредуктазы осуществляет обратное восстановление нитробензола до азоксибензола и анилина, то есть проводит классическую реакцию Зинина [50]! Перечисленные примеры показывают нам, что возможности биотехнологии гораздо шире привычных рамок, и сегодня мы используем лишь малую их часть.
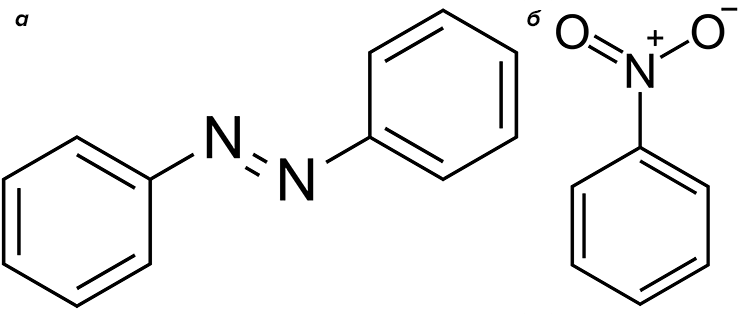
Рисунок 19. Структурные формулы азобензола (дифенилдиазена) (а) и нитробензола (б). Эти соединения, наряду с изомерными броманилинами, образуются при окислении анилина бромпероксидазой Pseudomonas putida.
На рисунке 20 изображен другой пример природного синтона. Метаболизм одноуглеродных фрагментов молекул, простейшей из которых является метан. То есть схему можно представить как метаболические пути превращений метана. Следует сразу оговориться, что (как и в случае анилина!) ни один вид живых организмов не может осуществить все эти превращения: они происходят на уровне биоценозов или всей биосферы. К тому же эта и последующие схемы упрощены, на них нет возможности показать промежуточные продукты превращений.
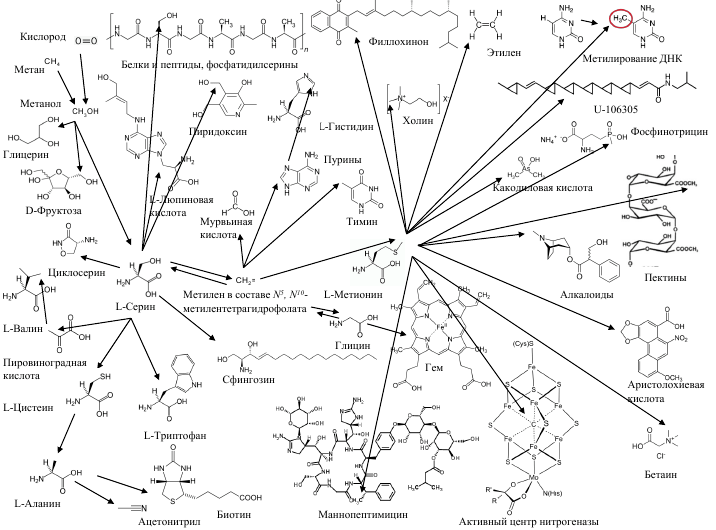
Рисунок 20. Включение метана, метанола и формальдегида в состав биологических молекул. Стрелки указывают на атомы углерода, происходящие из метана.
рисунок автора статьи
Метан образуется на земном шаре как биогенным путем (высокоспециализированными метаногенными архебактериями), так и абиотическим (при пиролизе угля и органических веществ). Метан всегда присутствует в атмосфере в концентрации примерно 175 миллионных долей и является парниковым газом. Он — важная составляющая природного газа, болотного и свалочного газов, биогаза, кишечного газа, в особенности у крупного рогатого скота. Будучи простейшим насыщенным углеводородом, метан лишен функциональных групп, и это делает его химически малоактивным. Усваивать метан могут только бактерии-метанотрофы, которые окисляют его кислородом (значительно реже, другими окислителями, например, нитратом) до метилового спирта. А дальше различные виды микробов, растений и животных производят увлекательные превращения метильной группы, производя большое многообразие первичных и вторичных метаболитов. В своей статье [14] я уже касался биодеградации метанола. Стало быть, такие важнейшие метаболиты, как аминокислоты серин и метионин, а также производное метионина S-аденозилметионин (SAM), главный донор метильных групп в биохимии, можно с полным основанием называть продуктами биодеградации метана, метанола и формальдегида. Кстати, не только их. Формальдегид образуется в качестве промежуточного продукта при биодеградации многих молекул, преимущественно, содержащих одноуглеродные фрагменты: метиламинов, метансульфоновой кислоты, метилмеркаптанов, метилгалогенидов и метиленгалогенидов, ацетона.
Безусловно, очень показательна схема превращений бензольного кольца, представленная на рисунке 21. Простейшее из всех ароматических соединений — бензол С6Н6 — крайне редко встречается в живой природе (один из примеров представлен в статье [5]). Бóльшая часть природного бензола содержится в нефти, а в промышленности его получают тримеризацией ацетилена по Реппе, ароматизацией бензиновых фракций нефти, коксованием угля. Бензол очень токсичен и обладает канцерогенным действием. Самые разнообразные живые организмы, от бактерий до млекопитающих, окисляют этот вредный ксенобиотик до фенола, который тоже очень ядовит [51]. Фенол образуется и в результате метаболизма пластификатора и антипирена трифенилфосфата [52], а также антисептиков парабенов [53]. Про фенол я уже писал в своей работе [14]. Там же я указал на возможность ферментативного превращения фенола в аминокислоту тирозин, описанную в ряде статей [54].
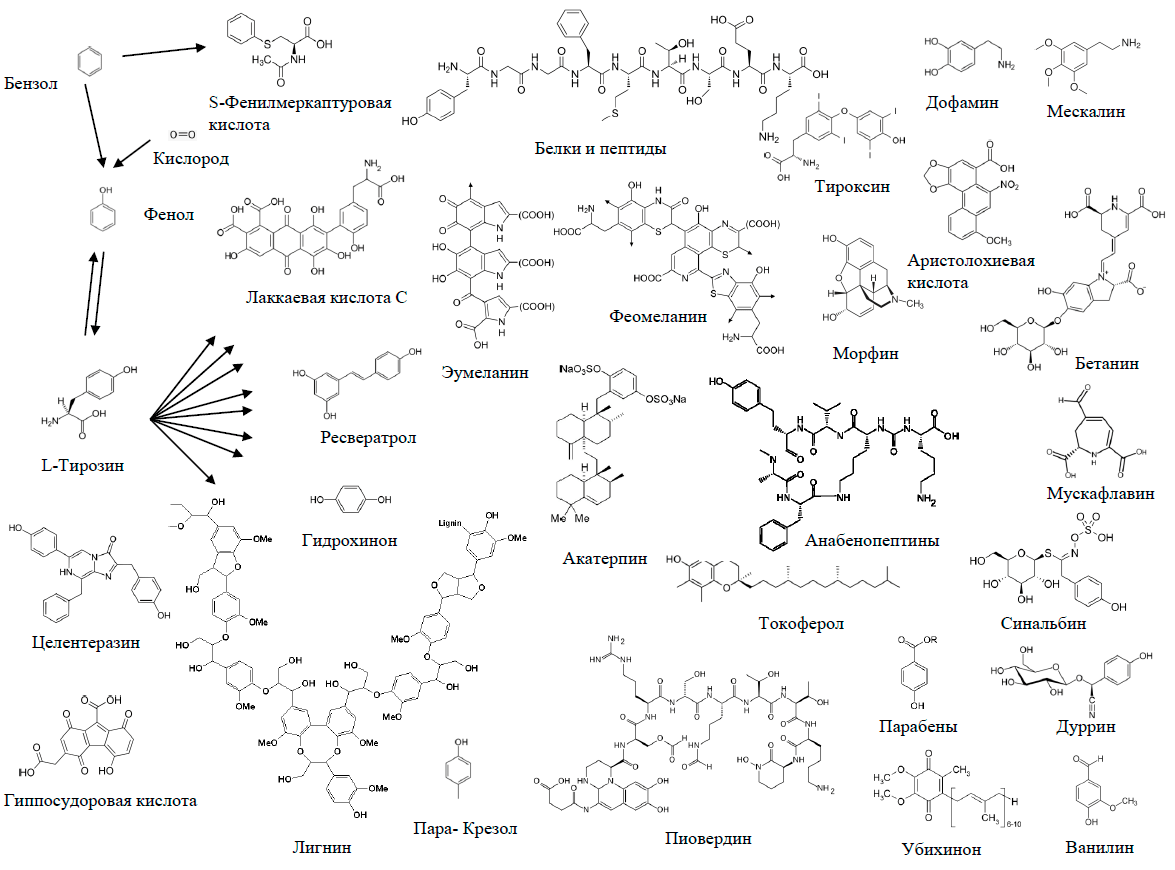
Рисунок 21. Включение бензола и фенола в состав биологических молекул
рисунок автора статьи
Хотя нет указаний на то, что тирозин образуется из фенола в природе: ароматические вещества обезвреживаются, окисляясь до катехинов и муконовых кислот, о чем уже рассказывалось выше. Тем не менее эволюционный отбор вполне может закрепить этот признак — обратную реакцию тирозинфеноллиазы, — и в будущем могут появиться микроорганизмы, превращающие фенол в тирозин. Может быть, они уже существуют, просто еще не попали в руки исследователей — кто знает?
А вот дальнейшие превращения тирозина в природе уже очень разнообразны, на рисунке представлена лишь часть их. Здесь действует то же правило, что и с триптофаном: ароматическое кольцо в большинстве метаболитов сохраняется. Среди представленных на схеме веществ единственное исключение — пигмент грибов мухоморов мускафлавин, в процессе биосинтеза которого бензольное кольцо превращается-таки в семичленный гетероцикл (рис. 22в) [55].
Кстати, на схеме среди метаболитов тирозина представлен лигнин. Вообще-то у большинства растений он синтезируется из другой ароматической кислоты — фенилаланина. От тирозина он отличается отсутствием фенольного гидроксила. Однако недавно стало известно, что именно тирозин — предшественник лигнина у некоторых злаков [63]. В природе тирозин, конечно, образуется не из бензола, а из шикимовой кислоты, про которую я рассказывал в своей прошлогодней статье [64].
Итак, мы рассмотрели два биохимических синтона — ароматическое кольцо и одноуглеродный фрагмент. Но двухуглеродные фрагменты тоже являются синтонами, поскольку чрезвычайно важны для биосинтеза. Схема на рисунке 23 отнюдь не является доказательством пользы пьянства. Тем более что большинство полезных веществ на ней образуется в организме не из этилового спирта. Этанол, а в особенности его токсичный метаболит ацетальдегид, при неумеренном потреблении оказывают на человеческий организм разрушительное действие. Этанол, между прочим, не только природное вещество. Технический спирт в промышленности не всегда получают сбраживанием сахаров. Производят его и химическим путем, из продуктов превращений природного газа и угля. То есть, этиловый спирт тоже подходит под определение «ксенобиотик».
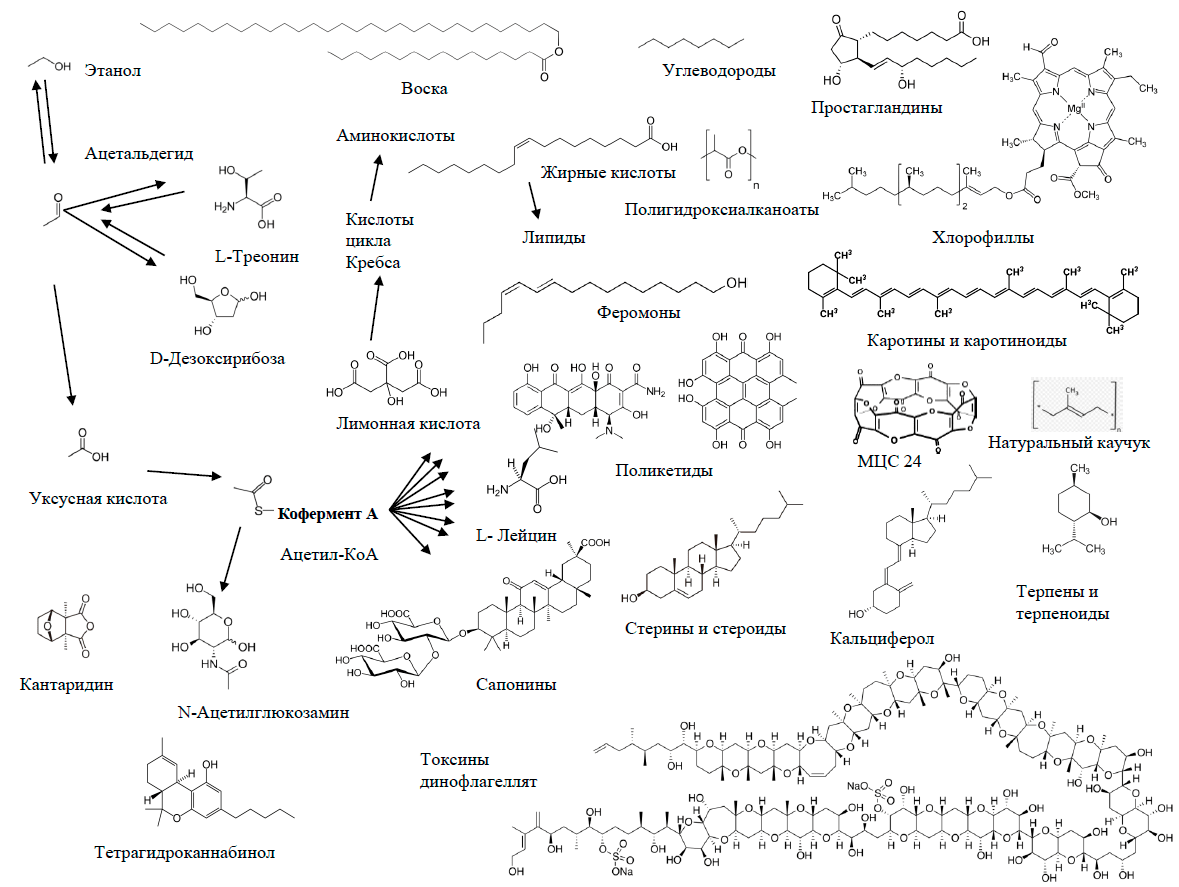
Рисунок 23. Двууглеродные молекулы как природные синтоны
рисунок автора статьи
Главный источник жирных кислот и изопреноидов в природе двухуглеродный синтон — радикал ацетил в составе ацетилкофермента А. А прочие молекулы, в первую очередь двухуглеродные (для млекопитающих это уксусная кислота, для микробов пресловутые этанол и ацетальдегид, этан, хлорэтан, этилен, ацетилен, диэтиловый эфир, этилацетат, а также ацетон и угарный газ, высшие алканы, включая полиэтилен, и многие другие) становятся предшественниками ацетила. Ацетон, кстати — трехуглеродная молекула, в процессе метаболизма распадающаяся на двухуглеродный и одноуглеродный фрагменты [64]. То есть ацетон принимает участие в обеих метаболических схемах, представленных на рисунках 20 и 22.
Любопытно, что некоторые вещества стоят на пересечении метаболических путей. Например, изображенный на схеме 18 α-токоферол, важнейший природный антиоксидант, — наиболее биологически активная форма жирорастворимого витамина Е. Токохроманоловый цикл в его молекуле происходит из тирозина, боковой радикал фитил из ацетилкофермента А, метильные группы при ароматическом кольце из S-аденозилметионина [65]. Поэтому токоферол можно было бы с полным правом разместить на всех трех предыдущих схемах.
Образующиеся из синильной кислоты аспарагин и аспарагиновая кислота оказываются предшественниками огромного количества метаболитов, в первую очередь, аминокислот и их производных (рис. 24).
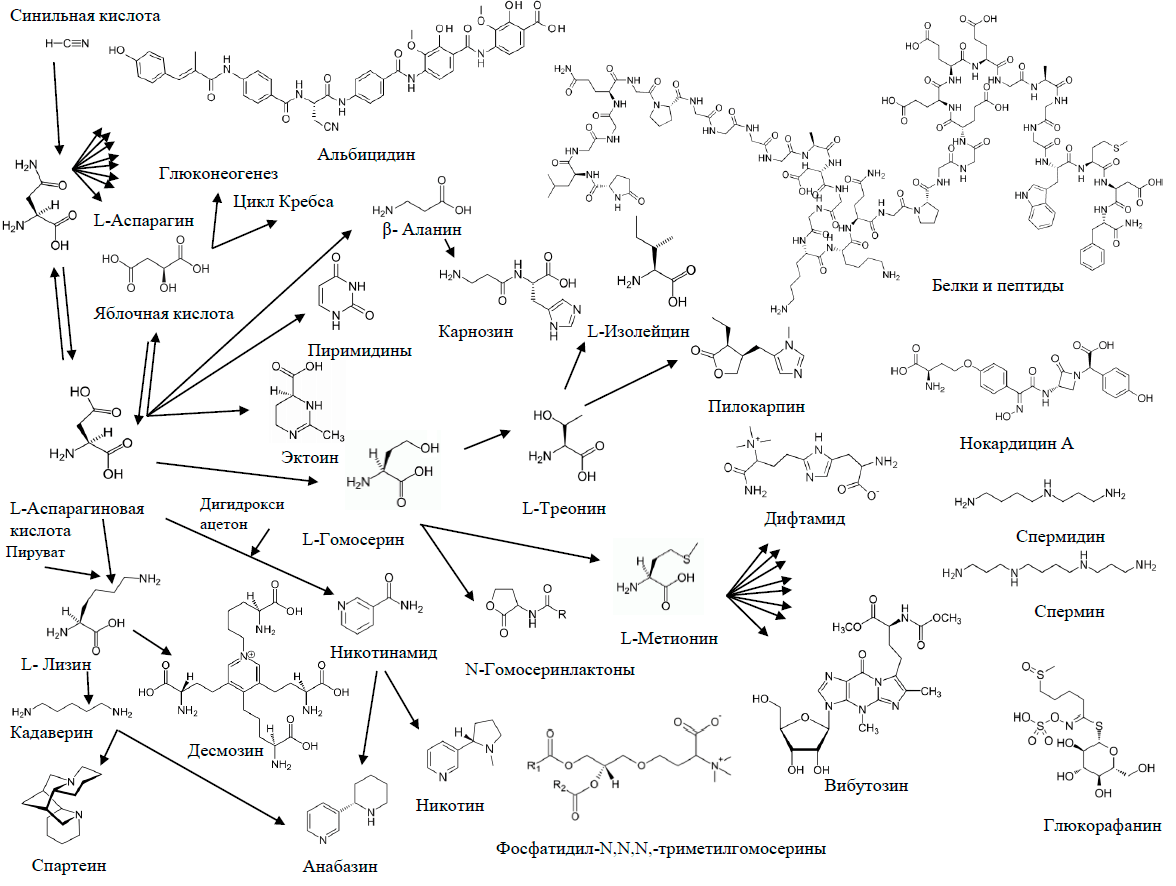
Рисунок 24. Синильная кислота как природный синтон
рисунок автора статьи
Интересно, что в некоторых очень редких метаболитах, таких как продуцируемый фитопатогенной бактерией Xanthomonas albilineans ингибитор ДНК-гиразы альбицидин, остаток аспарагина претерпевает обратное превращение в остаток β-цианоаланина, образуя необычное подобие пептида [66]. Одним из важнейших продуктов превращений аспартата оказывается метионин, с которым мы уже встречались при рассмотрении метаболизма одноуглеродных молекул (рис. 20). Конечно, разнообразие производных метионина (точнее, его активного продукта, SAM) не ограничивается только метильными и метиленовыми группами [67]. Таким образом, мы становимся свидетелями еще одного пересечения метаболических путей.
Любопытно, что аминокислота треонин присутствует и на данной схеме, и на предыдущей. Дело в том, что в природе в большинстве случаев предшественником треонина становится аминокислота гомосерин, которая не входит в состав белков, а образуется из аспарагиновой кислоты. То есть в конечном итоге, треонин становится одним из продуктов превращений синильной кислоты. Однако специфический фермент треонинальдолаза катализирует обратимую реакцию синтеза треонина из глицина и ацетальдегида. Таким образом, треонин можно рассматривать и как метаболит этанола.
Интересуясь необычными путями метаболизма, я, в частности, натолкнулся на патент, который не мог меня оставить равнодушным [68]. Объектом патентования стали метаболические пути, ведущие к ароматическим соединениям, таким как бензол, толуол, стирол и некоторым другим веществам. С авторами патента читатели «Биомолекулы» уже знакомы по моей статье [5], где рассказывалось про создание искусственных метаболических путей, ведущих к неизвестному в природе дивинилу. Согласитесь, интереснейшей тематикой занят этот американский коллектив! На мой взгляд, их работа имеет не только важное прикладное значение — она расширяет представления о возможностях нашей биосферы.
А еще они запатентовали образование бензола из ароматической аминокислоты фенилаланина при помощи некоего фермента фенилаланинбензоллиазы. Фермент, судя по всему, неизвестен — во всяком случае, упоминается исключительно в данном патенте. Возможно, он вообще не встречается в природе, и его планируется создать методами белковой инженерии. Тем не менее его ближайший аналог — β-тирозиназа, производящая фенол из тирозина, — хорошо известен и неоднократно упоминается в моих работах.
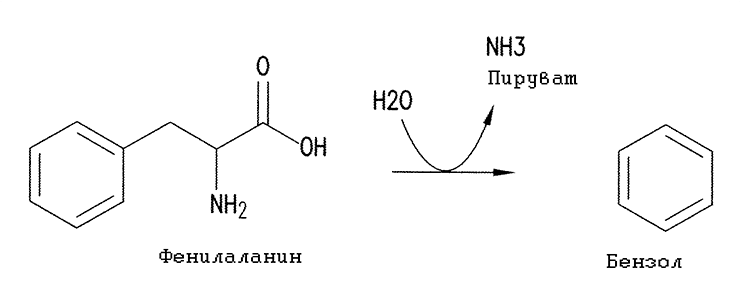
Рисунок 25. Действие гипотетического фермента фенилаланинбензоллиазы (β-фенилаланиназы), приводящее к образованию бензола
[68], с изменениями
Конечно, представленная на рисунке 25 реакция разложения фенилаланина с образованием бензола захватывающе интересна. Однако я хочу акцентировать внимание на моменте, который упустили американцы. А именно, что большинство ферментативных реакций, в том числе и эта, обратимы. То есть тот же самый фермент может катализировать кратчайший путь биодеградации ядовитого бензола, включение его в незаменимую аминокислоту L-фенилаланин путем реакции с пируватом аммония или L-серином. Ее, безусловно, тоже следовало патентовать! Авторы патента, по всей видимости, просто не задумывались над этим.
Конечно, если данный фермент будет создан, это откроет новые пути включения бензола в природные молекулы, которые я попытался представить на рисунке 26.
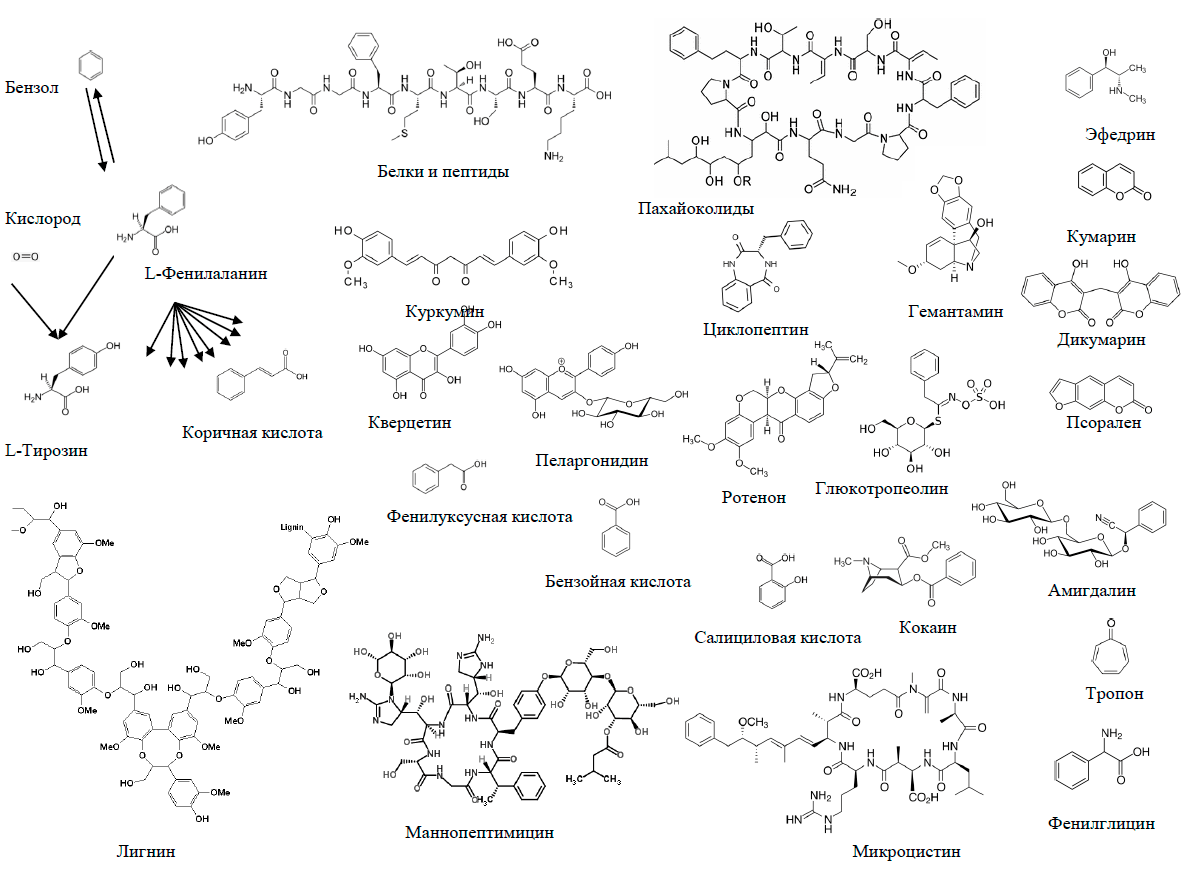
Рисунок 26. Включение бензола в состав биологических молекул при помощи фенилаланинбензоллиазы
рисунок автора статьи
Из всего вышесказанного следует, что биодеградация как явление не представляет собой что-то отдельное, какой-то «довесок» к существующим путям метаболизма. На самом деле, она гармонично в эти пути вписывается, являясь их неотъемлемой частью. Можно сказать больше. Биодеградация — это часть глобальных биогеохимических процессов, меняющих саму биосферу, а на раннем этапе существования нашей планеты даже приведших к возникновению жизни.
Вместо послесловия
Оглядываясь назад, я вспоминаю время, когда мне казались интересными только пути биологического синтеза сложных молекул. Те метаболические пути, которые принято называть анаболизмом. Катаболизм, то есть распад сложных молекул до простых, метаболическое разложение, казалось тогда чем-то заурядным, незатейливым. «Ломать — не строить», гласит пословица. И только всерьез занявшись проблемой биодеградации, я понял, насколько был неправ.
Биологическое расщепление сложных веществ — это целый мир. Здесь мы видим эволюцию в действии, процесс, позволяющий включать в природный круговорот новые вещества, ранее никогда в него не входившие. Соответственно, приводящий к появлению новых ферментов с необычной активностью, кодирующих эти ферменты генов и плазмид. А в перспективе — возникновение новых форм жизни и рост уровня сложности самой биосферы. Но и это не всё! Стало ясно, что между анаболизмом и катаболизмом не существует грани. Опасные для живых организмов вещества, включая даже ряд неприродных, могут служить синтонами, «кирпичиками» для построения классических природных молекул, включая даже самые сложные, например, белки. После этого они поглощаются биосферой без следа. Одним словом, окружающий мир в очередной раз оказывается намного сложнее представлений о нем. А нам, ученым, следует научиться управлять процессом биодеструкции. Тогда, наконец, возникнет кардинальное решение назревшей проблемы загрязнения окружающей среды.
Литература
- Биодеградация белого фосфора: как яд стал удобрением;
- Lawrence P. Wackett. (2013). The Metabolic Pathways of Biodegradation. The Prokaryotes. 383-393;
- Миндубаев А.З., Волошина А.Д., Бабынин Э.В., Бадеева Е.К., Хаяров Х.Р. и др. (2018). Микробиологическая деградация белого фосфора. «Экология и промышленность России». 1, 33–37;
- Миндубаев А.З., Кузнецова С.В., Евтюгин В.Г., Даминова А.Г., Григорьева Т.В. и др. (2020). Влияние белого фосфора на выживаемость, протеом и клеточную морфологию Aspergillus niger. «Прикладная биохимия и микробиология». 2, 156–164;
- Являются ли ксенобиотики ксенобиотиками? Одна из сторон разнообразия природных соединений;
- Paul Anthony Dawson, Scott Petersen, Robyn Rodwell, Phillip Johnson, Kristen Gibbons, et. al.. (2015). Reference intervals for plasma sulfate and urinary sulfate excretion in pregnancy. BMC Pregnancy Childbirth. 15;
- Pabulo Henrique Rampelotto. (2010). Resistance of Microorganisms to Extreme Environmental Conditions and Its Contribution to Astrobiology. Sustainability. 2, 1602-1623;
- Emily M. Stocking, Robert M. Williams. (2003). Chemistry and Biology of Biosynthetic Diels–Alder Reactions. Angew. Chem. Int. Ed.. 42, 3078-3115;
- Одиссея азота;
- Wei Zhang, Fang Zhang, Yun Niu, Yong-Xin Li, Yong Jiang, et. al.. (2020). Power to hydrogen-oxidizing bacteria: Effect of current density on bacterial activity and community spectra. Journal of Cleaner Production. 263, 121596;
- Eric S. Boyd, Amaya M. Garcia Costas, Trinity L. Hamilton, Florence Mus, John W. Peters. (2015). Evolution of Molybdenum Nitrogenase during the Transition from Anaerobic to Aerobic Metabolism. J. Bacteriol.. 197, 1690-1699;
- Sergey A. Nepogodiev, Robert A. Field, Iben Damager. (2010). Approaches to Chemical Synthesis of Pectic Oligosaccharides. Annual Plant Reviews. 65-92;
- K. C. Nicolaou. (2014). Organic synthesis: the art and science of replicating the molecules of living nature and creating others like them in the laboratory. Proc. R. Soc. A.. 470, 20130690;
- Биодеградация ксенобиотиков как самозащита природы;
- Tucker J.B. War of nerves: chemical warfares from World war I to al-Qaeda. New York: Anchor Books, 2006. — 479 p.;
- Anil Kumar, Preeti Swarupa, Vikram Pal Gandhi, Snehal Kumari. (2017). Isolation of Ethidium Bromide Degrading Bacteria from Jharkhand. Int J Appl Sci Biotechnol. 5, 293-301;
- Jumreang Tummatorn, Suppachai Krajangsri, Krissada Norseeda, Charnsak Thongsornkleeb, Somsak Ruchirawat. (2014). ChemInform Abstract: A New Synthetic Approach to 6-Unsubstituted Phenanthridine and Phenanthridine-Like Compounds under Mild and Metal-Free Conditions.. ChemInform. 45, no-no;
- «Зеленые» революционеры;
- Бактерии-нефтедеструкторы для биоремедиации супесчаных почв Воронежской области;
- Пределы биодоступности углеводородов в грунтах;
- Главный «почвенник» медицины: Зельман Ваксман;
- Ты не пройдёшь: техногенные геохимические барьеры на страже окружающей среды;
- Аденозиновые рецепторы: история великого обмана;
- Ryan Michael Summers Metabolism, enzymology, and genetic characterization of caffeine degradation by pseudomonas putida CBB5 — The University of Iowa;
- Lawrence P. Wackett. (2003). Pseudomonas putida—a versatile biocatalyst. Nat Biotechnol. 21, 136-138;
- Erik M. Quandt, Michael J. Hammerling, Ryan M. Summers, Peter B. Otoupal, Ben Slater, et. al.. (2013). Decaffeination and Measurement of Caffeine Content by Addicted Escherichia coli with a Refactored N-Demethylation Operon from Pseudomonas putida CBB5. ACS Synth. Biol.. 2, 301-307;
- Le Coz C.J., Ducombs G., Paulsen E. Plants and plant products. In: Contact dermatitis / ed. by Johansen D., Frosch P.J. Lepoittevin J.-P. Springer, 2011. P. 873–925;
- Rafael Blasco, Rolf-Michael Wittich, Megharaj Mallavarapu, Kenneth N. Timmis, Dietmar H. Pieper. (1995). From Xenobiotic to Antibiotic, Formation of Protoanemonin from 4-Chlorocatechol by Enzymes of the 3-Oxoadipate Pathway. J. Biol. Chem.. 270, 29229-29235;
- Markus Brückmann, Rafael Blasco, Kenneth Nigel Timmis, Dietmar Helmut Pieper. (1998). Detoxification of Protoanemonin by Dienelactone Hydrolase. J. Bacteriol.. 180, 400-402;
- Миндубаев А.З. (2020). Микробы-санитары. «Наука и жизнь». 4, 28–32;
- Russell A. P. Thomas, L. E. Macaskie. (1996). Biodegradation of Tributyl Phosphate by Naturally Occurring Microbial Isolates and Coupling to the Removal of Uranium from Aqueous Solution. Environ. Sci. Technol.. 30, 2371-2375;
- Frédéric Barras. (2018). Art and microbiology: encounters of the third type. Environmental Microbiology Reports;
- Jorge Lalucat, Antoni Bennasar, Rafael Bosch, Elena García-Valdés, Norberto J. Palleroni. (2006). Biology of Pseudomonas stutzeri. MMBR. 70, 510-547;
- Хайдаров Т.Ф. Эпоха «Черной смерти» в Золотой Орде и прилегающих регионах (конец XIII — первая половина XV вв.). Казань: Институт истории им. Марджани АН РТ, 2018. — 304 с.;
- Это чума;
- Смертельный поцелуй чумы;
- G. Ranalli, G. Alfano, C. Belli, G. Lustrato, M.P. Colombini, et. al.. (2005). Biotechnology applied to cultural heritage: biorestoration of frescoes using viable bacterial cells and enzymes. J Appl Microbiol. 98, 73-83;
- R. Jenrich, I. Trompetter, S. Bak, C. E. Olsen, B. L. Moller, M. Piotrowski. (2007). Evolution of heteromeric nitrilase complexes in Poaceae with new functions in nitrile metabolism. Proceedings of the National Academy of Sciences. 104, 18848-18853;
- P. B. Rodgers. (1982). Cyanide Metabolism and -Cyanoalanine Formation by Washed, Non-proliferating Cultures of Chromobacterium violaceum: Studies with Radiolabeled Cyanide. Microbiology. 128, 2983-2989;
- Kenji Aoki, Takashi Uemori, Ryu Shinke, Hiroshi Nishira. (1985). Further Characterization of Bacterial Production of Anthranilic Acid from Aniline. Agricultural and Biological Chemistry. 49, 1151-1158;
- Роль слабых взаимодействий в биополимерах;
- Pankaj K. Arora. (2015). Bacterial degradation of monocyclic aromatic amines. Front. Microbiol.. 6;
- Смит В., Бочков А., Кейпл Р. Органический синтез. Наука и искусство. М.: «Мир», 2001. — 573 с.;
- Shiro Kobayashi, Hiroshi Uyama, Shunsaku Kimura. (2001). Enzymatic Polymerization. Chem. Rev.. 101, 3793-3818;
- Фаговый домик. А в ваши строительные магазины уже завезли фаговые нанопровода?;
- Металлическая проводимость биологических структур;
- Микробиоэлектроника: как подключить к сети компьютер, спроектированный три миллиарда лет назад;
- Peng Kong, Pei Liu, Zhenyu Ge, Hao Tan, Linjuan Pei, et. al.. (2019). Conjugated HCl-doped polyaniline for photocatalytic oxidative coupling of amines under visible light. Catal. Sci. Technol.. 9, 753-761;
- Itoh N., Morinaga N., Kouzai T. (1993). Oxidation of aniline to nitrobenzene by nonheme bromoperoxidase. Biochem Mol Biol Int. 4, 785–791;
- Katharina Durchschein, Mélanie Hall, Kurt Faber. (2013). Unusual reactions mediated by FMN-dependent ene- and nitro-reductases. Green Chem.. 15, 1764;
- R Snyder, C C Hedli. (1996). An overview of benzene metabolism.. Environmental Health Perspectives. 104, 1165-1171;
- Yeowool Choi, Junho Jeon, Younghun Choi, Sang Don Kim. (2020). Characterizing biotransformation products and pathways of the flame retardant triphenyl phosphate in Daphnia magna using non-target screening. Science of The Total Environment. 708, 135106;
- Nelly Valkova, François Lépine, Loredana Valeanu, Maryse Dupont, Louisette Labrie, et. al.. (2001). Hydrolysis of 4-Hydroxybenzoic Acid Esters (Parabens) and Their Aerobic Transformation into Phenol by the Resistant Enterobacter cloacae Strain EM. Appl. Environ. Microbiol.. 67, 2404-2409;
- Timothy K. Lee, Humg-yu Hsiao. (1986). Synthesis of l-tyrosine by a coupled reaction of serine hydroxymethyltransferase and β-tyrosinase. Enzyme and Microbial Technology. 8, 523-526;
- Dieter Strack, Thomas Vogt, Willibald Schliemann. (2003). Recent advances in betalain research. Phytochemistry. 62, 247-269;
- Thomas Vogt. (2010). Phenylpropanoid Biosynthesis. Molecular Plant. 3, 2-20;
- Sonam Chouhan, Kanika Sharma, Jian Zha, Sanjay Guleria, Mattheos A. G. Koffas. (2017). Recent Advances in the Recombinant Biosynthesis of Polyphenols. Front. Microbiol.. 8;
- Davide Liberti, Maria Laura Alfieri, Daria Maria Monti, Lucia Panzella, Alessandra Napolitano. (2020). A Melanin-Related Phenolic Polymer with Potent Photoprotective and Antioxidant Activities for Dermo-Cosmetic Applications. Antioxidants. 9, 270;
- Toshiyuki Wakimoto, Ikuro Abe. (2012). Labile natural products. Med. Chem. Commun.. 3, 866;
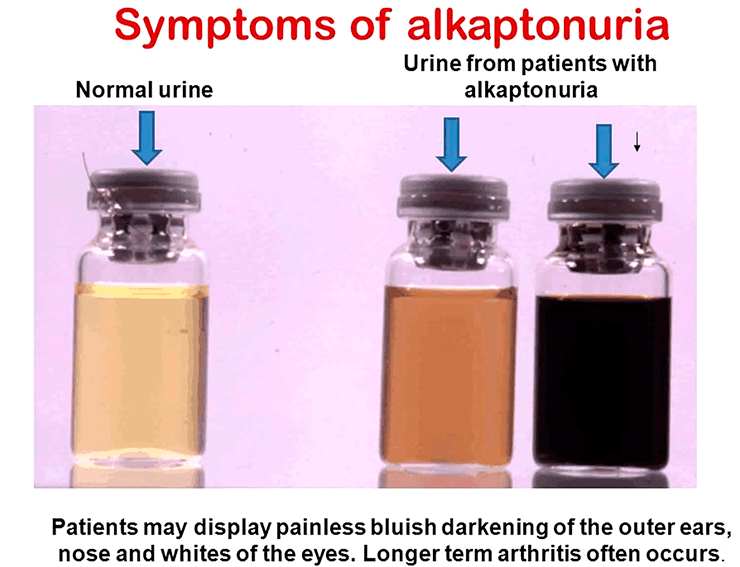
- N. B. Roberts, S. A. Curtis, A. M. Milan, L. R. Ranganath. (2015). The Pigment in Alkaptonuria Relationship to Melanin and Other Coloured Substances: A Review of Metabolism, Composition and Chemical Analysis. JIMD Reports. 51-66;
- Gulsaz SHAMIM, Sanjeev K. RANJAN, Dev M. PANDEY, Ranganathan RAMANI. (2014). Biochemistry and biosynthesis of insect pigments. Eur. J. Entomol.. 111, 149-164;
- Yuichi Oba, Shin-ichi Kato, Makoto Ojika, Satoshi Inouye. (2009). Biosynthesis of coelenterazine in the deep-sea copepod, Metridia pacifica. Biochemical and Biophysical Research Communications. 390, 684-688;
- Hiroshi A. Maeda. (2016). Lignin biosynthesis: Tyrosine shortcut in grasses. Nature Plants. 2;
- Раздумья о природной и неприродной химии;
- Dean DellaPenna, Barry J. Pogson. (2006). VITAMIN SYNTHESIS IN PLANTS: Tocopherols and Carotenoids. Annu. Rev. Plant Biol.. 57, 711-738;
- Stéphane Cociancich, Alexander Pesic, Daniel Petras, Stefanie Uhlmann, Julian Kretz, et. al.. (2015). The gyrase inhibitor albicidin consists of p-aminobenzoic acids and cyanoalanine. Nat Chem Biol. 11, 195-197;
- Hening Lin. (2011). S-Adenosylmethionine-dependent alkylation reactions: When are radical reactions used?. Bioorganic Chemistry. 39, 161-170;
- Osterhout R.E., Burgard A.P., Pharkya P., Burk M.J. (2012). Microorganisms and methods for the biosynthesis of aromatics, 2,4-pentadienoate and 1,3-butadiene. Patent US 2012/0021478 A1.