От эксперимента до индустрии: как органоиды строят мост между наукой и бизнесом
04 марта 2025
От эксперимента до индустрии: как органоиды строят мост между наукой и бизнесом
- 435
- 0
- 3
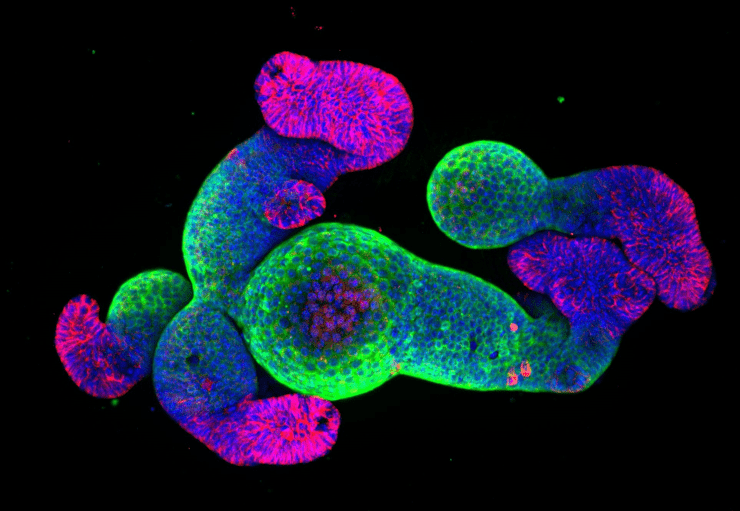
Органоид кишечника, обработанный флуоресцентными красителями: зеленым и красным окрашены структуры, имитирующие ворсинки и крипты, соответственно, а синим — ядра.
Рисунок в полном размере.
-
Автор
-
Редакторы
Темы
Органоиды — трехмерные клеточные структуры, моделирующие функции человеческих органов, стали ключевым прорывом современной биологии и медицины. Эти «мини-органы», созданные из стволовых клеток взрослого человека, предоставляют уникальные возможности во многих областях: от регенеративной медицины и до тестирования лекарств. В этой статье мы разберем историю успеха органоидов и проанализируем, как технологии их создания превратились из исключительно академического инструмента в перспективный рынок.
Конкурс «Био/Мол/Текст»-2024/2025
 Эта работа заняла первое место в номинации «Академия & Бизнес» конкурса «Био/Мол/Текст»-2024/2025.
Эта работа заняла первое место в номинации «Академия & Бизнес» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса и партнер номинации — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Двадцать первый век можно по праву назвать прорывным для биологии: с невероятным развитием технологий перед учеными вновь и вновь возникают новые возможности для их применения в науке. Из новостей мы часто слышим о том, как ученым удалось создать искусственную человеческую кожу, синтезировать участок мышечной ткани животных in vitro и даже орган «на чипе» [2]. Все эти открытия кажутся настолько невероятными, что нам бывает сложно представить встречу с ними в обычной жизни. Задумывались ли вы, насколько технологии 3D-культивирования клеток приблизились к практическому использованию? Сегодня речь пойдет об органоидах — инновационных биологических мини-моделях, способных имитировать работу целого органа, из которого они были получены. Быстро подхватив тренд из науки, биотехнологические компании по всему миру смогли успешно интегрировать данную технологию трехмерного моделирования в индустрию.
Как узнать стволовую клетку?
Органоиды — это искусственно созданные трехмерные клеточные структуры, которые моделируют функции и архитектуру определенных органов или тканей. На сегодняшний день успешно были получены органоиды почти из всех органов человека, таких как кишечник, почки, печень, легкое и даже мозг [3–5]. Говоря об истории развития технологии получения органоидов, сложно не отметить, что огромную роль в ее становлении сыграл голландский ученый Ганс Клеверс (Hans Clevers), известный как пионер в области изучения стволовых клеток взрослого человека. Его научная карьера началась с исследования молекулярных механизмов, лежащих в основе сигнального пути Wnt — ключевого клеточного пути в регуляции процессов эмбрионального развития, клеточной пролиферации и дифференцировки. Во всех обновляемых тканях человека присутствуют стволовые клетки, например, они есть в эпителии кишечника (рис. 1).
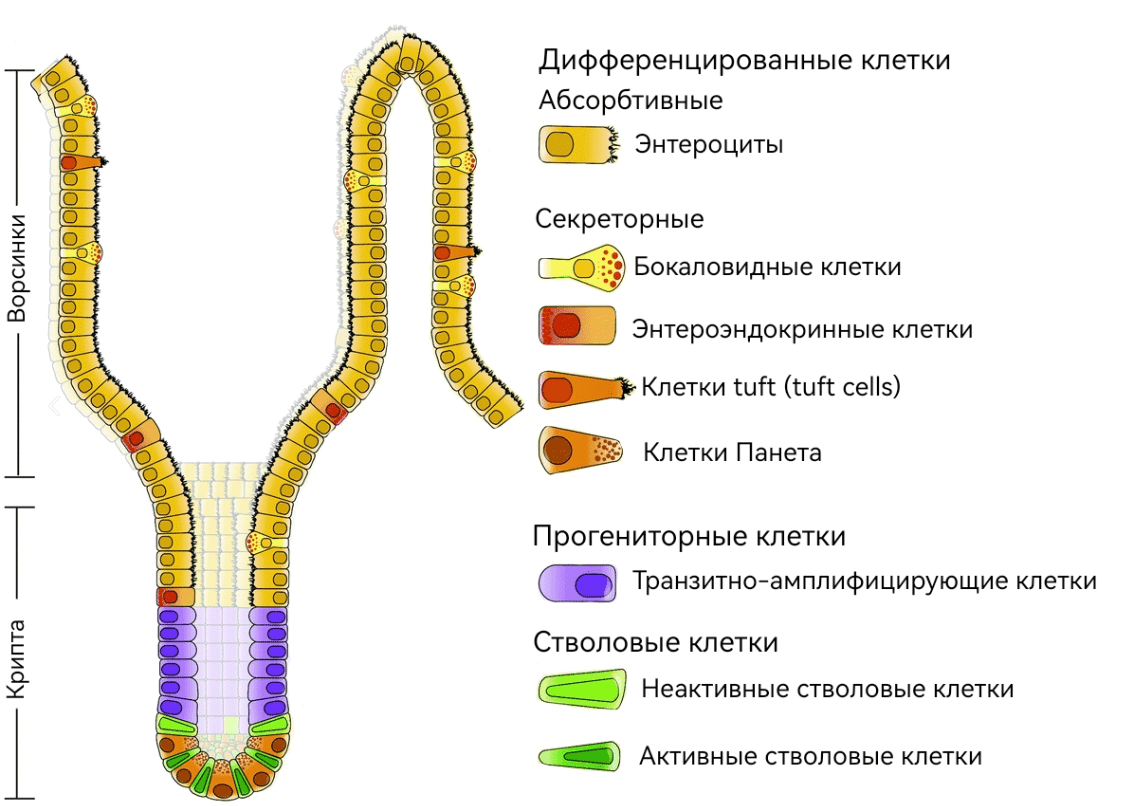
Рисунок 1. Строение крипты кишечника и положение стволовых клеток в них.
[6], рисунок адаптирован
Оказалось, что если заблокировать Wnt-путь в клетках эпителия кишечника, зоны активного деления, заметные в нормальной ткани, полностью исчезают. В результате фактически прекращается процесс обновления эпителия ворсинок. Это наблюдение позволило ученым предположить, что во взрослых стволовых клетках, в частности в эпителии кишечника, ключевую роль в поддержании способности к большому количеству клеточных делений играет Wnt-сигналинг. В 2007 году группе ученых под руководством Клеверса удалось идентифицировать маркер стволовых клеток тонкого и толстого кишечника мыши — то, что принципиально отличает эти клетки от всех остальных клеток и может быть избрано в качестве своего рода «определителя» стволовой клетки [7]. Этим маркером оказался мембранный рецептор LGR5 (leucine-rich repeat-containing G-protein coupled receptor), участвующий, как позже стало ясно, в увеличении продолжительности действия сигнала Wnt (рис. 2).
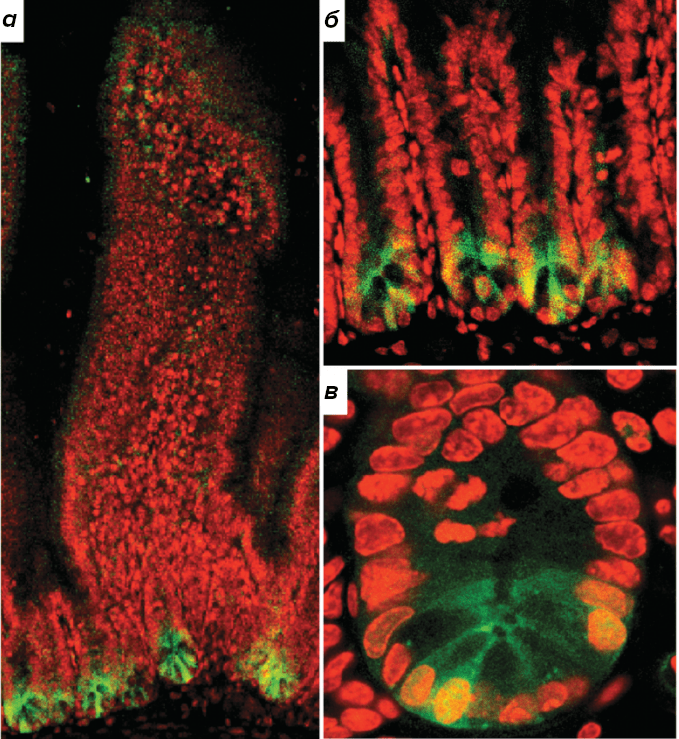
Рисунок 2. Снимок ворсинок тонкого кишечника мыши, полученный с помощью конфокальной микроскопии. Зеленым окрашены клетки, имеющие маркер стволовых клеток LGR5, красным — ДНК в клетках. Заметно, что зеленая окраска точно соответствует расположению стволовых клеток.
Классика науки: ожидали одно, а получили другое
В 2009 году Тоширо Сато (Toshiro Sato), аспирант лаборатории Клеверса, продолжил исследование особенностей стволовых клеток эпителия тонкого кишечника. Обладая высокой пролиферативной способностью, эти клетки, по предположению ученого, могли бы успешно делиться in vitro при правильно подобранных условиях. Известно, что клетки в составе тканей постоянно «общаются» друг с другом: как посредством прямых межклеточных контактов, так и через специальные сигнальные молекулы, выделяемые в межклеточное пространство. Стало ясно, что для максимально точного воссоздания среды требуется трехмерный внеклеточный матрикс, доступным вариантом которого является Matrigel. Однако для пролиферации клеток этого недостаточно: необходимы питательные вещества и ростовые факторы, присутствующие в жидкой среде вокруг желеобразных капель матригеля. Сато подобрал подходящую комбинацию из веществ, действующих как блокаторы дифференцировки, активаторы деления и факторы роста, и обнаружил, что через пару недель одна стволовая клетка превратилась в целую структуру — органоид (рис. 3).
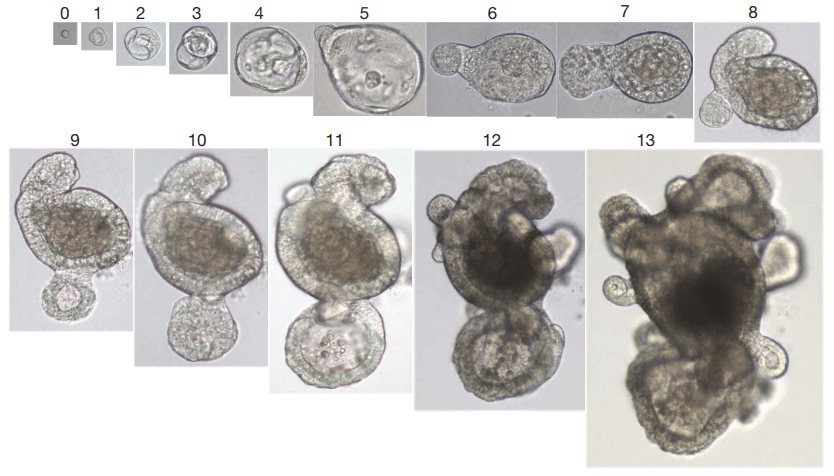
Рисунок 3. Процесс роста органоида тонкого кишечника мыши из стволовой клетки всего за 13 дней.
Ожидая получить одну-две стволовые клетки, ученый смог вырастить биологическую мини-систему, почти в точности структурно повторяющую своего прародителя — тонкий кишечник. Как и в кишечнике, внутри органоида образовалась полость, а также выросты, напоминающие крипты — «впадины» между ворсинками кишечника, где и находятся стволовые клетки. Клеточный состав получившейся структуры тоже соответствовал кишечнику — все типы клеток были представлены и пространственно расположены сходным образом. Впоследствии, улучшая методику, всего через два года ученые научились получать органоиды толстой кишки человека (рис. 4), причем не только из здоровой ткани, но и из опухолевых клеток различного происхождения. Уже в течение следующего десятилетия появились органоиды и из других органов.
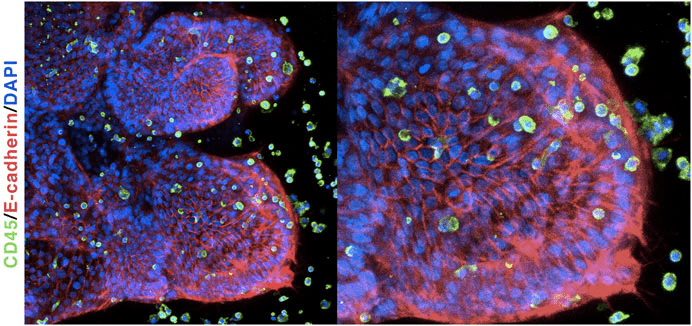
Рисунок 4. Органоид легкого, окрашенный флуоресцентными красителями. Зеленые клетки рядом — моноциты, взаимодействующие со структурой. В органоидах легких также есть ворсинки, как в настоящем органе, на видео можно наблюдать циркуляцию жидкости в полости от их движения!
Из науки в индустрию
Открытие, сделанное в лаборатории Ганса Клеверса, ознаменовало новую эпоху в клеточной биологии, связанную с переходом от 2D-культивирования клеток к более современным трехмерным клеточным структурам, которые лучше воспроизводят физиологические условия. Наличие модели человеческого органа открыло возможность получать более точные результаты без использования животных в клинических испытаниях при создании новых лекарств. Открытие органоидов также привело к бурному росту такой передовой области как регенеративная медицина. Часто в клинической практике время играет решающую роль. Возможность культивировать органоиды, полученные из взрослых стволовых клеток конкретного пациента, открывает перспективу ускоренного заживления пораженных участков. Технология получения органоидов, набирая популярность и имея перспективные клинические применения, привлекла внимание биотехнологических компаний. Они увидели в ней возможность освоить принципиально новую и многообещающую нишу. На 2023 год объем рынка органоидов оценивается в 1178 миллионов долларов в год, и, как обещают эксперты, в течение следующих 10 лет промышленное использование технологии будет стремительно расти [10].
HUB organoids: как из лаборатории дорасти до крупной компании
Говоря о компаниях, использующих технологию создания органоидов в целях бизнеса, невозможно не упомянуть организацию, являющуюся лидером на рынке. HUB Organoids была создана в 2013 году как дочернее предприятие Института Хубрехта (Hubrecht Institute), Королевского Нидерландского Института Искусств и Наук (Royal Netherlands Institute for Arts and Sciences, KNAW) и Университетского Медицинского Центра Утрехта (University Medical Center Utrecht). Компания была основана на оригинальном открытии взрослых стволовых клеток лаборатории Ганса Клеверса и успешно разработала уникальные протоколы для использования органоидов, полученных от пациентов (patient-derived organoids, PDOs), в поиске и создании новых лекарств для лечения онкологических, иммуноонкологических заболеваний, муковисцидоза и других патологий. На своем сайте компания публикует большое количество воркшопов, исследований и кейсов, проливающих свет на области применения органоидов.
В течение прошедших 11 лет организация, начинавшая с довольно скромных результатов, смогла вырасти до крупной компании, успешно осуществляющей свою работу в Америке, Европе и Азии. Одним из направлений развития HUB Organoids является использование органоидов в доклинических испытаниях лекарств. Известно, что создание препаратов — это долгий, дорогостоящий и зачастую малоэффективный процесс. В онкологии только 5% новых соединений на этапе разработки лекарств успешно доходят до клинических испытаний. К тому же для большинства препаратов этот процесс занимает до 9 лет, а в некоторых случаях и до 15 [11]. Консорциум SupressSTEM, в который входит HUB Organoids, работает над созданием новых терапевтических средств, устраняющих механизмы резистентности клеток колоректального рака и предлагающих альтернативу традиционным методам лечения. В исследовании на органоидах от пациентов тестировали инновационные биспецифические антитела, способные «выключать» активные на поверхности раковых клеток рецепторы. Это приводит к тому, что опухолевая клетка перестает формировать метастазы, расти и сигнализировать другим клеткам о необходимости делиться (рисунок 5). Оказалось, что при использовании органоидов вместо привычных животных моделей, таких как мыши, процесс доклинического исследования идет быстро и эффективно, что позволяет сократить эту стадию до 5 лет — при том, что каждый упущенный момент влечет за собой потери человеческих жизней!
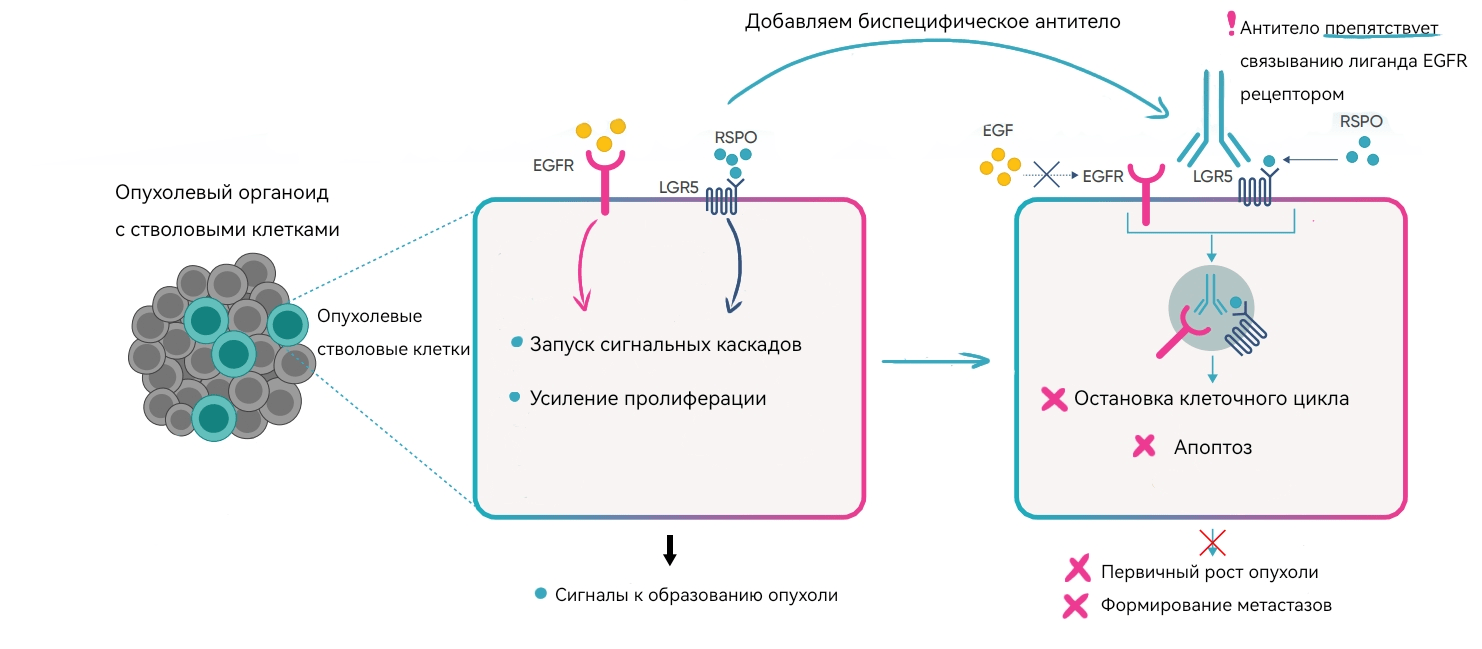
Рисунок 5. Схема действия биспецифического антитела с использованием органоидов в качестве модели.
[12], рисунок адаптирован
Деньги с неба не падают, поэтому для ведения успешного бизнеса необходимо искать возможности сотрудничества с другими компаниями. HUB Organoids успешно работает вместе с такими крупными компаниями как Corning и Yamaha Corporation, что позволяет существенно снизить затраты на оборудование и расходные материалы. С 2023 года компания перешла от работы в рамках фонда к частной корпоративной структуре, что позволило HUB Organoids получать значительные средства от продажи лицензий и предоставления доступа к собственным базам и технологиям. Успешная франшиза позволяет компании направить ресурсы на развитие технологий органоидов и продвижение бизнеса, делая HUB Organoids одной из самых влиятельных компаний на этом рынке.
«Одна из наших задач — внедрить органоидную технологию в промышленность и клиники и сделать ее использование как можно более широким, поскольку мы считаем, что это наиболее подходящая модель для разработки лекарств.» — Главный научный сотрудник HUB Organoids Сильвия Бодж (Sylvia Boj) в интервью BioTechniques [13].
«Своего рода брат или сестра пациента для тестирования»
Персонализированная медицина представляет собой совокупность методов диагностики и лечения, которые основаны на индивидуальных особенностях пациента. Что, если попробовать выращивать органоиды от человека и использовать их для тестирования препаратов? На самом деле, такие случаи уже есть. Один из самых известных — спасение 15-летнего юноши Фабиана из Нидерландов, страдающего редкой генетической вариацией муковисцидоза. Причиной муковисцидоза является одна из многочисленных мутаций в гене белка ионного канала CFTR. «Поломка» этого гена вызывает скопление густой слизи в легких, которая является благоприятной средой для размножения бактерий. Человек с таким заболеванием испытывает серьезные проблемы с дыханием и усвоением легкими кислорода. У многих пациентов с поздней стадией муковисцидоза даже поднятие руки вызывает тяжелую одышку. Помимо поражения легких, у больных также наблюдаются проблемы с работой кишечника, что приводит к диарее, непроходимости кишечника и сниженному набору веса. Диагностируют муковисцидоз довольно часто: в Европе, по оценкам Всемирной Организации Здравоохранения, у одного из 2–3 тысяч новорожденных выявляют это заболевание.
Борьба с муковисцидозом идет уже довольно долго. Препарат, известный как Kalydeco, о процессе создания которого «Биомолекула» рассказывала ранее [14], открывает ионные каналы клетки, облегчая перемещение соли и воды. Несмотря на свою высокую эффективность, Калидеко не является универсальным препаратом — он подходит не каждому пациенту. Существует около 2000 различных генетических дефектов, которые приводят к муковисцидозу, и только для части из них наблюдается положительная реакция пациентов на препарат. Если конкретная мутация пациента не была клинически протестирована против препарата Калидеко (Kalydeco), вероятность успеха считается слишком низкой для назначения препарата. Другая проблема заключается в том, что Kalydeco является чрезвычайно дорогостоящим препаратом: стоимость курса лечения ежегодно составляет сотни тысяч долларов на одного пациента.
В 2012 году к Клеверсу обратился Джеффри Бикман (Jeffrey Beekman), бывший сотрудник его отделения, который к тому времени работал на кафедре детской пульмонологии медицинской школы Утрехтского университета. Руководитель лаборатории муковисцидоза Корс ван дер Энт (Kors van der Ent), который также возглавлял отделение пульмонологии в детской больнице Вильгельмины, потратил много лет на поиск эффективных способов лечения муковисцидоза. Бикман задался вопросом, могут ли кишечные органоиды быть ключом к разгадке. Использование органоидов позволяет быстро и с минимальными затратами протестировать реакцию пациента на Калидеко, даже если его мутация в гене белка CFTR ранее не исследовалась на чувствительность к этому препарату. Подобной редкой мутацией обладал 15-летний Фабиан: такой же дефект в гене, как у него, был только у его тети. У юноши не было надежды пройти лечение, потому что с подобной мутацией получить препарат Калидеко, на который имеется большой спрос, почти невозможно. В таком случае оставалось лишь подавлять симптомы с помощью физиотерапии и антибиотиков, но вернуться к жизни здорового человека не представлялось возможным. Будучи врачом Фабиана, Корс ван дер Энт принял решение взять с помощью биопсии взрослые стволовые клетки эпителия кишечника и вырастить из них органоиды. Далее нужно было провести тестирование — если в ответ на действие препарата органоиды, полученные от Фабиана, разбухнут, это будет означать, что Калидеко восстанавливает ионный обмен (рисунок 6). К счастью, результат оказался положительным, и юноше смогли назначить лечение. Эффект превзошел все ожидания: спустя всего четыре часа легкие Фабиана начали избавляться от застоявшейся слизи!
«Очень приятно, когда ты делаешь открытие, которое приносит реальный результат. Мы опубликовали множество статей в престижных журналах, но это совсем другое. Фабиан действительно первый человек, который непосредственно извлек пользу из всех наших достижений.» — Ганс Клеверс.
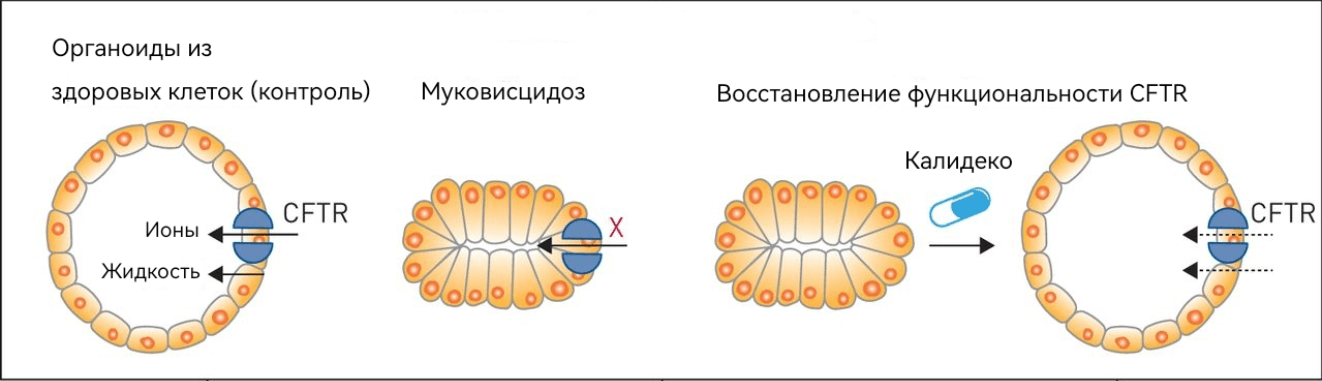
Рисунок 6. Тест на эффективность Калидеко.
[15], рисунок адаптирован
Эта ошеломительная история ознаменовала новую веху в развитии персонализированной медицины — использование органоидов. Американская компания SEngine Precision Medicine, ведущий новатор в области прецизионной онкологии, успешно развивает применение органоидов, подбирая пациентам лекарства на основе образцов их собственных опухолей. Организация разработала собственный уникальный тест PARIS®, цель которого состоит в определении чувствительности к противораковым лекарственным средствам. Получив образцы биопсии опухоли пациента, SEngine в собственных лабораториях выращивают органоиды. Так как каждый случай рака уникален, компания проводит скрининг множества лекарств из собственной библиотеки, состоящей из 240 низкомолекулярных препаратов, и разрабатывает персонализированный отчет, в котором оценивает методы лечения для достижения максимальной эффективности и минимизации токсичности.
В 2023 году SEngine опубликовала один клинический случай, демонстрирующий замечательную реакцию пациента на нестандартную терапию [16]. Несмотря на проведение стандартного курса химиотерапии и нескольких операций, серозный рак яичников низкой степени злокачественности (low-grade serous ovarian cancer, LGSOC) у пациентки прогрессировал, и прогноз был неблагоприятным. После оценки ряда методов лечения на органоидах, выращенных из образца опухоли пациентки, специалисты с помощью SEngine PARIS® теста выявили ибрутиниб в качестве основного кандидата. Этот препарат, ранее одобренный только для лечения некоторых лейкозов и лимфом, не имел предварительных клинических доказательств эффективности при раке яичников. Монотерапия ибрутинибом привела к прекращению принятия обезболивающих препаратов, выписке пациентки из хосписа и 15 месяцам стабильного течения заболевания. С тех пор она продолжила лечение двумя дополнительными препаратами, также выявленными тестом PARIS®, которые были одобрены только для лечения некоторых видов рака легких. Ее индивидуальный курс лечения привел к более чем двухлетнему стабильному течению заболевания, в то время как обычно пациенты с таким диагнозом могут жить около 7 месяцев. В этой истории удивительно то, как быстро удалось с помощью органоидной технологии подобрать лечение, ранее даже не применявшееся для рака яичников. Учитывая потенциал этой технологии, в ближайшие годы подход с использованием полученных от пациентов органоидов в персонализированной медицине должен только набирать популярность.
«Мы были очень рады прогрессу, достигнутому этой пациенткой за более чем два года после прохождения курса лечения, рекомендованного PARIS® тестом. <...> Такой успех наглядно демонстрирует эффективность нашего подхода.» — доктор Карла Грандори (Carla Grandori), генеральный директор SEngine.
Больше, чем лечение
Другое перспективное направление применения органоидов — регенеративная медицина. Вследствие перенесенных инфекций, химических воздействий или аутоиммунных заболеваний ткани человека часто подвергаются разрушению. Для восстановления повреждений организм тратит огромное количество ресурсов, что усложняет и замедляет процесс выздоровления. Медицина XXI века имеет в своем арсенале несколько методик, которые призваны облегчить регенерацию поврежденных тканей: от применения индуцированных плюрипотентных стволовых клеток до препаратов на основе факторов роста и цитокинов. Выращивать здоровые клетки человека in vitro из-за ограниченного числа делений и склонности к старению затруднительно, поэтому одним из самых многообещающих направлений является использование более простых в культивировании органоидов человека. С 2018 года южнокорейская компания Organoid Sciences разрабатывает четыре подобные методики: для восстановления эндометрия матки; для лечения ксеростомии (сухости во рту), вызванной деградацией слюнных желез; для лечения редких генетических заболеваний печени и воспалительных заболеваний кишечника (болезнь Крона и язвенный колит). На последнем остановимся подробнее — согласно отчету компании, методика регенерации ткани кишечника с использованием органоидов уже находится на стадии оформления заявки на начало клинических испытаний с участием человека. Иными словами, уже пройдено больше половины пути к выводу технологии на рынок, и можно ожидать первые результаты ее использования в медицине через 6–8 лет!
Иммуносупрессивные препараты, которые используют для лечения воспалительных заболеваний кишечника — инфликсимаб и адалимумаб — призваны подавить очаги воспаления. Однако если используемые медикаменты лишь временно помогают в борьбе с воспалительными процессами, то поврежденные ткани могут потребовать дальнейшего восстановления. Для этого компания предлагает использовать органоиды, полученные от конкретного пациента. Процедура состоит в следующем (рис. 7): с помощью резекции эндоскопом от человека получают небольшой участок ткани из непораженного участка кишечника, и из него уже с помощью специальных методик отбирают из крипт только клетки с экспрессией LGR5 (маркер стволовых клеток, о котором мы говорили ранее). Органоиды оперативно выращивают в лабораториях, далее с помощью геля, облегчающего адгезию (прикрепление) к пораженным участкам, инъекцией добавляют состав на поврежденный эпителий. Так как органоиды были получены от самого пациента, они легко и довольно быстро приживаются, поэтому на выходе мы получаем ускоренное заживление вызванного заболеванием повреждения!
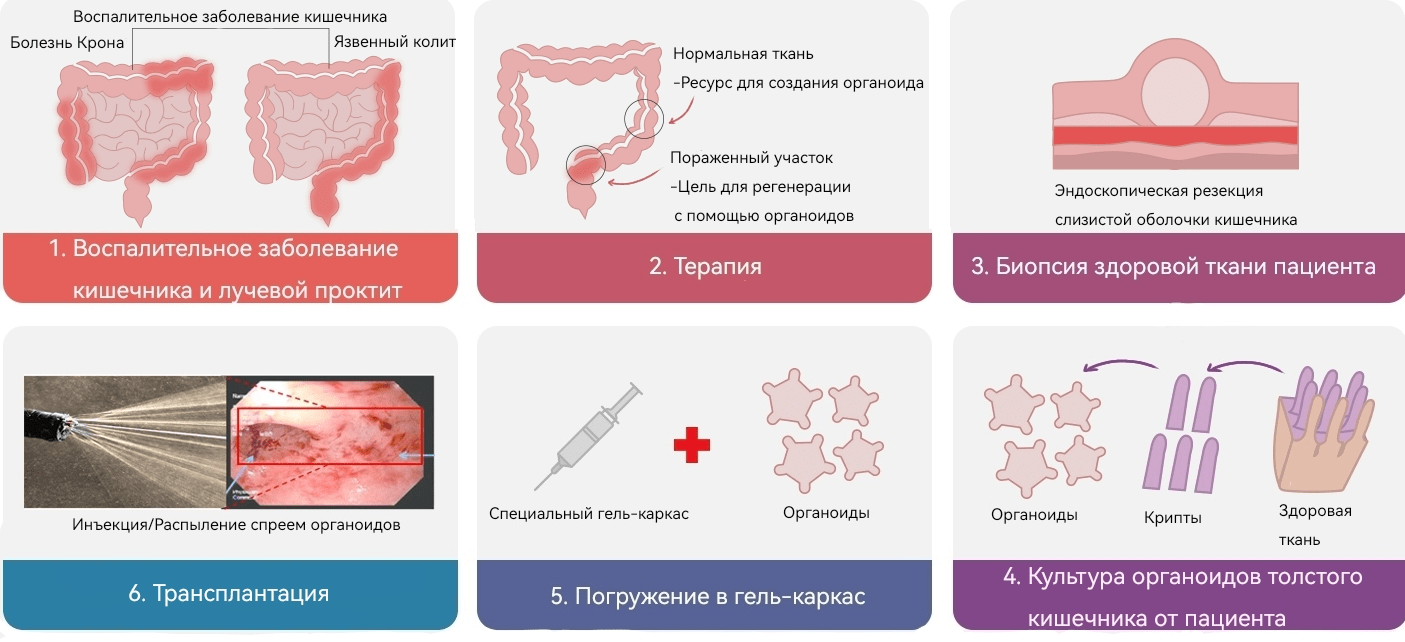
Рисунок 7. Схематическое представление технологии регенерации эпителия кишечника с помощью органоидов.
[17], рисунок адаптирован
Органоиды — ключ к изменениям в медицине и бизнесе
Путь органоидов от научной концепции до целой индустрии — это пример того, как инновации на стыке науки и бизнеса меняют мир. Благодаря кооперации институтов и стартапов, технология уже сейчас преобразует отрасли фармацевтических исследований и регенеративной медицины. Органоиды — не просто научное открытие, а своеобразный катализатор для создания новых рынков и подходов, доказывающий, что синергия академии и бизнеса способна менять будущее медицины и экономики.
Литература
- Yang Q. (2021). Mini-guts reveal crucial forces that shape the intestinal lining. Friedrich Miescher Institute for Biomedical Research;
- Искусственные органы и тканевая инженерия;
- Megan Aurora, Jason R. Spence. (2016). hPSC-derived lung and intestinal organoids as models of human fetal tissue. Developmental Biology. 420, 230-238;
- Fjodor A. Yousef Yengej, Jitske Jansen, Maarten B. Rookmaaker, Marianne C. Verhaar, Hans Clevers. (2020). Kidney Organoids and Tubuloids. Cells. 9, 1326;
- Chun-Ting Lee, Raphael M. Bendriem, Wells W. Wu, Rong-Fong Shen. (2017). 3D brain Organoids derived from pluripotent stem cells: promising experimental models for brain development and neurodegenerative disorders. J Biomed Sci. 24;
- Alexis J. Carulli, Linda C. Samuelson, Santiago Schnell. (2014). Unraveling intestinal stem cell behavior with models of crypt dynamics. Integr. Biol. 6, 243;
- Nick Barker, Johan H. van Es, Jeroen Kuipers, Pekka Kujala, Maaike van den Born, et. al. (2007). Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449, 1003-1007;
- Toshiro Sato, Robert G. Vries, Hugo J. Snippert, Marc van de Wetering, Nick Barker, et. al. (2009). Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265;
- Veronika Bosáková, Marco De Zuani, Lucie Sládková, Zuzana Garlíková, Shyam Sushama Jose, et. al. (2022). Lung Organoids—The Ultimate Tool to Dissect Pulmonary Diseases?. Front. Cell Dev. Biol. 10;
- Ghosh S. (2024). Organoids Market Trends – Demand & Future Outlook 2024-2034. Future Market Insights;
- Путь лекарства;
- Drug discovery to clinical trials in five years. (2022). HUB Organoids;
- Boj S. (2020). Sylvia Boj on gene editing in organoids and their use in drug discovery. BioTechniques;
- Муковисцидоз — первые надежды;
- Organoid Models Of Genetic Diseases. (2023). faCellitate;
- Heidi J. Gray, Payel Chatterjee, Rachele Rosati, Lauren R. Appleyard, Grace J. Durenberger, et. al. (2023). Extraordinary clinical response to ibrutinib in low-grade ovarian cancer guided by organoid drug testing. npj Precis. Onc. 7;
- Regenerative Therapy. (2025). Organoid Sciences.