
От медицины для всех — к медицине для каждого!
12 декабря 2015
От медицины для всех — к медицине для каждого!
- 12486
- 3
- 6
Настоящая медицина — именно такая, персональная.
Рисунок в полном размере.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Преимущества персонализированного подхода к ведению больных очевидны. Более того, философия персонализированной медицины как взаимодействия между двумя людьми — пациентом и доктором — не нова. Именно в этой форме медицина существовала с момента зарождения врачевания как одного из типов деятельности человека. Персонализированная медицина не заменяет собой привычную нам доказательную медицину, а является надстройкой над современным зданием, построенным с помощью совместных усилий ученых и клиницистов, в результате кропотливых исследований достигших понимания функциональной регуляции организма человека и молекулярных основ патогенеза его основных заболеваний. Расскажем об основных принципах 4П-медицины.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Клиническая наука нового поколения — яркие открытия и ежедневные разочарования
В результате двух последних научных прорывов — геномного и постгеномного — сначала была определена полная последовательность генома человека [1], а потом описаны генные варианты, различающиеся по своей частоте у народов мира. Развитие методов секвенирования нового поколения (Next Generation Sequencing — NGS) [2–4] и других постгеномных технологий, в том числе полногеномного исследования ассоциаций (GWAS) [5–7], позволило выявить редкие генные варианты, вносящие значительный вклад в риск развития многих хронических заболеваний человека. Дорогие методы исследования, ранее применявшиеся лишь отдельными коллективами, занимающимися фундаментальной наукой, подешевели и стали доступными для внедрения в клинику. Например, онкологи получили возможность узнать об онкогенных мутациях в опухоли конкретного больного по результатам анализа внеклеточной фракции ДНК, выделенной из плазмы, а врачи-генетики — направить больного на анализ всех кодирующих участков (экзонов) его генома. Казалось, что череда научных прорывов должна привести к немедленному результату, который мы сможем почувствовать, посетив кабинет обычного участкового врача. К сожалению, этого пока не произошло по целому ряду причин, главная из которых — это колоссальный разрыв между наукой и практической медициной.
Разрыв заключается вовсе не в невозможности масштабного применения персонализированных медицинских технологий и не в высокой стоимости сложного оборудования, а в том, что наука и медицина работают в принципиально разных системах координат. Ученые выявляют общие закономерности патогенеза, объединяющие больных со сходными картинами заболевания в одну группу. Практикующий врач работает с индивидуальными случаями этого же заболевания. «Традиционная» логика взаимодействия между врачами и учеными отражена в концепции доказательной медицины, в основе которой лежит оценка эффективности и безопасности методик диагностики, профилактики и лечения в клинических исследованиях [8]. В рамках доказательной медицины качественность доказательности оценивают по достоверности исследования. Относительная силы доказательств убывает в следующем порядке:
- Мета-анализ или систематический обзор рандомизированных клинических испытаний;
- Рандомизированное контролируемое испытание;
- Нерандомизированное испытание с одновременным контролем;
- Нерандомизированное испытание с историческим контролем;
- Когортное исследование;
- Исследование типа «случай-контроль»;
- Перекрестное испытание;
- Результаты наблюдений над когортами больных;
- Описание отдельных случаев.
Восемь наиболее весомых уровней доказательства опираются на одновременную работу с большой, однородной группой больных с одинаковой патологией, что позволяет получить статистически неоспоримые доказательств, что у большинства больных в данной группе определенный способ терапии привел к успеху. Сила данного подхода очевидна — доказательная медицина выявляет наиболее эффективные способы лечения для данной нозологии. В течение последних двадцати лет методы доказательной медицины принесли ощутимые плоды, заметно подняв общий процент успеха в лечении многих острых и хронических патологий человека.
Однако, в основной особенности доказательной медицины — работе с однородными группами больных — кроется ключевое ограничение. Врач, следуя методологии доказательной медицины, по сути занимается лечением среднестатистической популяции и надеется, что случай его пациента окажется типичным. Расчет делается на то, что особенности конкретного больного, подвергающегося лечению, будут иметь меньшее значение, чем общие сходства клинической картины с течением заболевания у пациентов, принимавших участие в том или ином рандомизированном клиническом исследовании. Только принимая эти допущения, можно надеяться, что эффект от назначенного лечения будет сходен с эффектом, отмеченным в ходе клинического испытания. С этих позиций многие эксперты обозначают доказательную медицину как медицину, основанную на надеждах.
Итак, доказательная медицина работает с группами людей, в то время как врачу приходится лечить конкретного больного. Организм человека — это сложная система, состоящая из многих миллионов типов органических молекул, организованных в клеточные структуры с многоуровневым контролем регуляции. Доказательная медицина предполагает наличие достаточно простой типологии этих живых систем, различающихся по типу отклонения системы от ее начального, равновесного (или здорового) состояния. Такая типология известна врачам как систематическое описание нозологий, действительно помогающее ориентироваться в многообразии возможных патологических состояний. Это означает, что система нозологий — это не что иное, как сетка координат. Как один больной отличается от другого с таким же заболеванием, так и здоровые люди несходны между собой. Различия накапливаются из-за разницы в стиле жизни, которая накладывается на большое количество полиморфных вариантов, обусловливающих разнообразие наших геномов. Совокупности молекулярных различий между индивидуумами, хорошо знакомые каждому врачу, учтены в рамках персонализированной медицины. В отличие от медицины доказательной, основанной на надежде, на (математическом) ожидании в как можно более крупных выборках больных, персонализированная медицина основана на доказательствах, полученных в значительно более узких выборках людей — выборках со сходными генотипами, или другими четко определенными критериями включения и исключения.
Таким образом, развитие современной медицины проделало полный круг, подчеркивая значение индивидуальных особенностей конкретного пациента на новом, более высоком уровне. Эти особенности на интуитивном уровне всегда принимались во внимание врачами, относящимися к клинической практике как к «врачебному искусству».
Персонализированная медицина не подменяет собой доказательную медицину путем отказа от объединения пациентов в однородные группы. Персонализированная медицина предполагает дальнейшее дробление (стратификацию) этих групп, а соответственно, и нозологических координат в соответствии с основными особенностями генома, биохимических анализов или образа жизни (биомаркерами). При этом из большого числа возможных особенностей выбирают только те, что имеют прямое, функционально-увязанное отношение к течению патологии или основного лекарственного препарата. Как и в доказательной медицине, в персонализированной медицине решения о применении профилактических, диагностических и лечебных мероприятий принимаются на основе имеющихся доказательств их эффективности и безопасности, но относительный вес этих доказательств рассчитывается для конкретного пациента с учетом совокупности его индивидуальных особенностей. Таким образом, персонализированная медицина не заменяет собой доказательную медицину, а является надстройкой над современным зданием, построенным с помощью совместных усилий ученых и клиницистов, в результате кропотливых исследований достигших понимания функциональной регуляции организма человека и молекулярных основ патогенеза его основных заболеваний.
Плодотворность взаимодействия персонализированной и доказательной медицины
Давайте рассмотрим на нескольких гипотетических примерах, как эффективно работают вместе доказательная и персонализированная медицина.
Первый пример: разработка нового лекарства, излечивающего рак прямой кишки
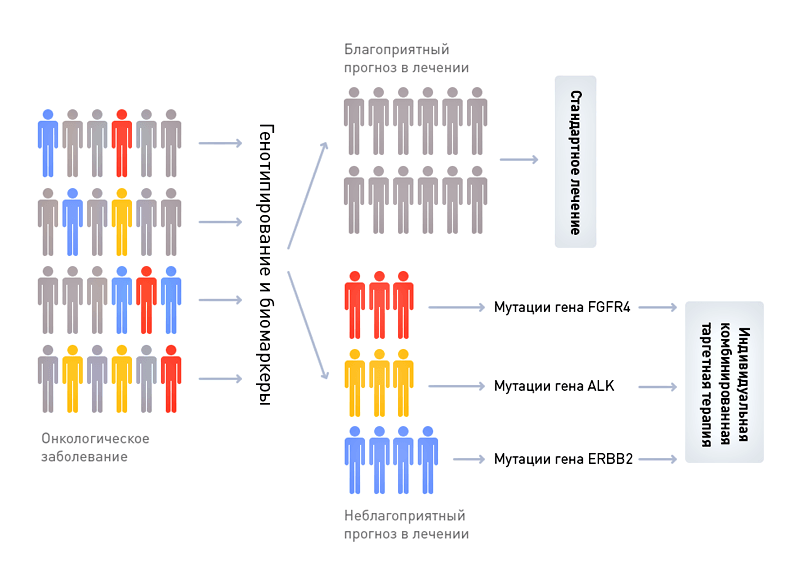
Рисунок 1. Схема персонализации терапии онкологического заболевания (например, рака прямой кишки) на основании данных генотипирования и биомаркерного типирования.
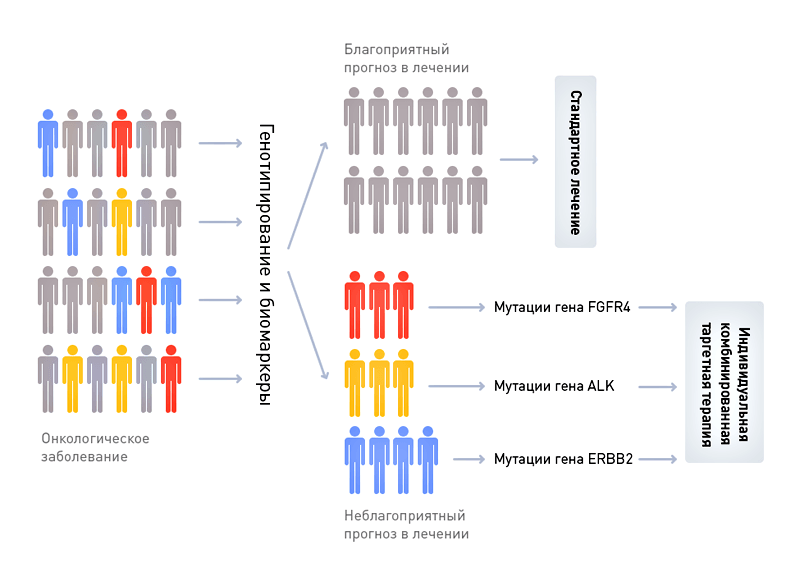
Рисунок 1. Схема персонализации терапии онкологического заболевания (например, рака прямой кишки) на основании данных генотипирования и биомаркерного типирования.
Фармацевтическая компания «Ягодка» в рамках доказательной медицины работает над созданием нового препарата «Мираклин», убивающего клетки рака прямой кишки. Потратив 200 млн долларов (поверьте, это весьма скромная цифра), компания «Ягодка» завершила доклиническую (50 млн долларов) и первую (150 млн долларов) фазы клинических испытаний и доказала относительную безопасность «Мираклина», который не вызвал опасных для жизни осложнений ни у одного из 30 больных с метастазами рака прямой кишки. Потратив еще 200 млн долларов, компания «Ягодка» начала вторую фазу испытаний «Мираклина», призванную доказать его более высокую эффективность по сравнению с общепринятым методом лечения.
В ходе второй фазы препарат был испытан с участием 150 больных метастатическим раком прямой кишки, в то время как другие 150 больных получили стандартное лечение. В результате в группе больных, получивших «Мираклин», средняя продолжительность жизни с начала курса терапии составила 155 ± 89 дней, в то время как в группе, получившей стандартное лечение, средняя продолжительность жизни составила 151±20 дней. Статистически достоверных различий в эффективности «Мираклина» по сравнению со стандартным лечением выявлено не было. Более того, оказалось, что в группе, получившей «Мираклин», восемь больных умерли в первый месяц после начала лечения, в то время как при стандартном лечении в первый месяц погиб только один больной.
Фармацевтическая компания «Буревестник» в рамках персонализированной медицины работает над созданием нового препарата «Милагрол», убивающего клетки рака прямой кишки. Обратите внимание — химическая структура препарата схожа со структурой препарата, который исследовался компанией «Ягодка». Компания «Буревестник» начала с более подробных доклинических исследований метаболизма «Милагрола» и мишени его действия, в том числе влияния вариантов генов, участвующих в метаболизме препарата, на его эффективную дозу, а также подробного ретроспективного анализа активности мишени в 500 образцах карциномы прямой кишки (поэтому доклиническая фаза стоила компании «Буревестник» не 50, а 100 млн долларов). В результате доклинических исследований «Милагрола» стало понятно, что примерно 15% людей обладают так называемым «медленным» вариантом гена фермента, метаболизирующего новое лекарство. Эти люди накапливают «Милагрол» в здоровых тканях, что может привести к развитию токсического действия и к еще большему ослаблению организма, уже страдающего от опухолевой интоксикации. Именно люди с таким генным вариантом, без всякого отбора записанные в исследование «Ягодки» и пострадали от побочных эффектов препарата.
С другой стороны, оказалось, что примерно в 10% опухолей функционирование мишени для «Милагрола» критически необходимо для поддержания жизни злокачественных клеток, в то время как в 90% опухолей того же типа активированы другие, дополнительные сигнальные пути, способные поддержать опухоль в случае отключения мишени «Милагрола». Таким образом, в случае большинства больных карциномой прямой кишки лечение «Милагролом» приведет к примерно такому же терапевтическому эффекту, как и в случае стандартной схемы химиотерапии, а у 10% будет достигнуто полное излечение опухоли.
Поэтому компания «Буревестник» построила первую фазу клинических испытаний следующим образом. По протоколу клинических испытаний первой фазы было проведено генотипирование всех потенциальных участников, и допущены были только обладатели стандартного генотипа, в то время как больные с «медленным» вариантом гена были сразу направлены на стандартную терапию, менее опасную для их здоровья. Как и в случае препарата компании «Ягодка», первая фаза испытаний «Милагрола» не выявила опасных для жизни побочных эффектов. Однако разница все же была. «Мираклин» от «Ягодки» проскочил первый этап клинических испытаний случайно, лишь потому, что группа больных, принимавших препарат, была относительно невелика (30 человек). Другими словами, компании «Ягодка» повезло, что у 4–5 больных с «медленным» вариантом метаболизирующего фермента токсические эффекты препарата не привели к печальному исходу и досрочному прекращению испытаний. «Буревестник» же исключил больных с «медленным» вариантом фермента, метаболизирующего «Милагрол», из группы испытуемых, и поэтому прошел первую фазу испытаний «твердо», без скидки на случай.
В ходе второй фазы «Милагрол» был для начала испытан лишь в специальной группе больных — а именно лишь тех, чьи опухоли критически зависели от мишени для «Милагрола». Да, таких больных было мало — лишь 10% от всех случаев карциномы кишечника, поэтому компания «Буревестник» не могла рассчитывать на сверхприбыли. Однако вторая фаза испытаний оказалась весьма успешной: средняя продолжительность жизни больных, пролеченных «Милагролом», составила 415±57 дней, в то время как в контрольной группе, получавшей стандартную терапию, она составила 162±23 дня. Различия были не просто достоверны статистически, а прямо-таки видны невооруженным глазом, поэтому прохождение препарата через дальнейшие фазы исследования было ускорено — ведь он продлевал жизнь больных с метастазами почти в три раза! Препарат «Милагрол» также успешно преодолел и третью фазу испытаний, а затем был одобрен, но только для весьма специфической группы больных — только для тех, чьи опухоли зависят от функционирования мишени для «Милагрола», а геномы не содержат «медленного» варианта гена, метаболизирующего препарат. Продавая «Милагрол» в течении двух следующих лет, компания «Буревестник» смогла заработать достаточно для проведения еще одной серии испытаний, которая доказала, что добавление «низкой», более безопасной дозировки препарата «Милагрол» к стандартной схеме химиотерапии позволяет достичь продления жизни больных в среднем на 90 дней, что было достаточно для расширения показаний для препарата. Препарат «Милагрол» стал блокбастером, компания «Буревестник» — источником радости для ее акционеров, а главное — путем персонализированной стратификации больных был достигнут значительный успех в терапии метастатической карциномы прямой кишки.
Этот вымышленный пример не так уж далек от истины. Таргетные препараты уже одобрены для лечения многих злокачественных опухолей, в том числе рака молочной железы, кишечника, многих типов лимфом и лейкозов. Однако в своей повседневной практике врач общего профиля практически не сталкивается с таргетными препаратами для терапии опухолей. Работа с данными лекарственными средствами является уделом узких специалистов, наблюдающих только одну группу больных, например, пациентов с карциномой молочной железы. Поэтому мы перейдем к другому примеру, более близкому для практикующего врача.
Второй пример: выбор стратегии для терапии гепатита C
Текущим стандартом лечения гепатита С в России является сочетание пегилированного интерферона и рибавирина. К сожалению, данный вид терапии, сопровождающийся частым развитием неблагоприятных побочных явлений, излечивает лишь примерно 50% больных, зараженных вирусом с генотипом 1, составляющим большинство инфекций в России. На практике это означает, что каждый второй больной проходит длительный курс тяжелой терапии лишь для того, чтобы выяснить, что усилия, время и деньги были потрачены зря.
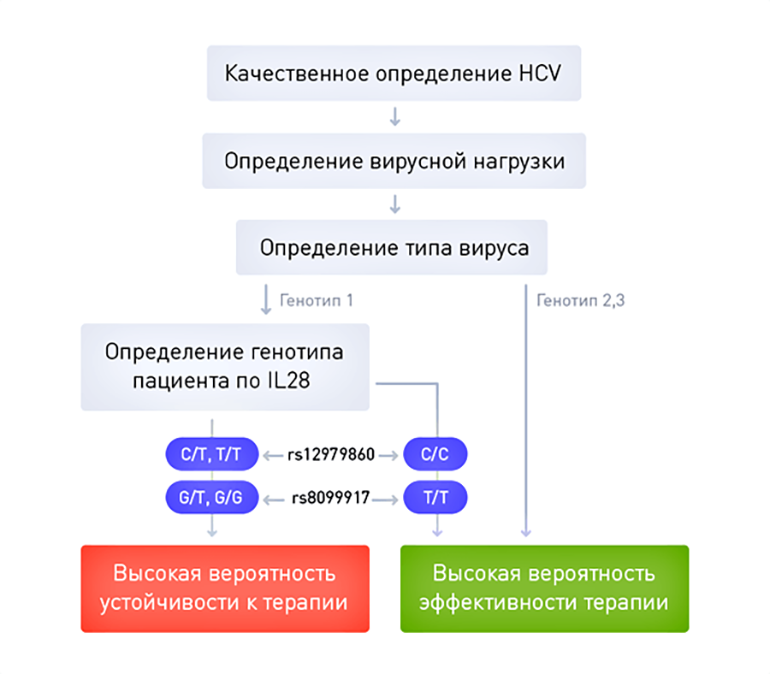
Рисунок 2. Схема оценки прогноза лечения вирусного гепатита C на основании данных генотипирования вируса и пациента.
В рекомендациях есть раздел, посвященный так называемой тройной терапии вирусного гепатита С: пегилированные интерфероны + рибавирин + третий препарат (ингибитор протеазы). Такая комбинация способна помочь примерно 90% больных, зараженных вирусом с генотипом 1, то есть является намного более эффективной. Ингибиторы протеазы — это препараты, напрямую воздействующие на вирус гепатита С. Некоторые из этих препаратов уже зарегистрированы в России, но не входят в «Перечень жизненно необходимых и важнейших лекарственных препаратов» и в «Постановление о финансировании закупок препаратов для лечения ВИЧ и гепатитов B и C». Соответственно, цена на них не регулируется, а их доступность для пациентов крайне ограничена. По данным портала государственных закупок, их стоимость за курс лечения может достигать 2 млн рублей, что недоступно для большинства больных.
К счастью, во многих случаях проблему можно решить с помощью персонализированного подхода. Оказалось, что эффект от лечения «простой» комбинацией пегилированного интерферона и рибавирина зависит от генотипа больного. Успех лечения во многом зависит от генетического полиморфизма в гене IL28B, определяющем активность близлежащего гена, кодирующего интерферон лямбда 4. Пациенты, имеющие обычные аллели гена IL28B, с гораздо большей вероятностью достигают излечения с помощью двухкомпонентной (стандартной) терапии, чем лица с достаточно часто встречающимся активным вариантом этого гена (17% европейской популяции). Таким образом, генотип больного является важнейшим фактором для принятия решения — больные с обычными копиями гена IL28B могут начать с «простой» комбинации лекарственных средств, субсидируемой государством, а пациентам с дополнительной активностью этого генного локуса придется искать средства на оплату дорогого препарата нового поколения. Важно отметить, что определение вариантов гена IL28B проводится в России уже сейчас, стоит в пределах тысячи рублей, а значит, является вполне доступным. Это означает, что применение подходов персонализированной медицины уже сейчас позволяет врачу и больному принять совместное, взвешенное решение о стратегии лечения заболевания.
Концепция медицины будущего — 4П
Разобранный выше пример хорошо иллюстрирует концепцию медицины будущего, в 2008 году предложенную известным ученым, президентом Института системной биологии в Сиэттле Лероем Худом (Leroy Hood). Эта концепция основана на принципах 4П, наиболее ярко отображающих изменения в подходах к ведению пациентов, произошедшие за последние несколько лет.
Заложенные в концепции 4П принципы означают, что медицина должна стать: предиктивной (то есть, предсказательной); профилактической; партисипативной (требующей активного участия пациента), и, наконец персонализированной. Эта концепция уже сейчас претворяется в жизнь, в значительной степени благодаря заметному повышению интереса людей к мониторингу собственного здоровья, которое и является основным движителем постепенного изменения существующей клинической практики.
- Предиктивная (предсказательная) медицина: означает, что врач сможет определить вероятности развития тех или иных заболеваний и грамотно объяснить пациенту, что именно эти вероятности означают для него лично, а также помочь скорректировать его образ жизни, чтобы отложить начало серьезных заболеваний, ослабить их проявления и подобрать оптимальное лечение. В примере с гепатитом C врач предсказывает вероятность успеха применения «стандартной» комбинации пегилированного интерферона и рибавирина у конкретного больного в зависимости от его генотипа.
- Профилактическая медицина: означает, что основной объем действий врача будет направлен не на лечение заболевания, а на предупреждение начала его развития. Очевидно, что данный подход подразумевает, что пациент установит тесный контакт с врачом задолго до начала развития заболевания, а врач разработает персонализированную программу для выявления ранних признаков надвигающихся заболеваний, и, если нужно, к применению соответствующих вмешательств. Стоит отметить, что врач «будет готов» только в том случае, если у него будет возможность провести серию измерений, которая поможет отследить реакцию организма на различные изменения его состояния, происходящие в ходе естественного течения жизни: стрессы, излишества, перегрузки. В этом случае различные стрессовые ситуации служат суррогатом эксперимента, а наблюдения за ответом организма на эти стрессы позволят выявить границы индивидуальной нормы реакции.
- Партисипативная медицина (требующая активного участия пациента): эта особенность медицины будущего подразумевает активное участие пациента в процессе принятия как конкретных медицинских решений, так и в определении общей стратегии мониторинга состояния здоровья. Конечно же, принимаемые решения должны быть информированными, а значит, врачам и ученым нужно вести совместную работу над повышением общего уровня понимания основ работы человеческого организма у неспециалистов.
- Персонализированная медицина (работающая с конкретным пациентом): мы снова вернулись к понятию «персонализированная медицина», в рамках которой учитывается вся совокупность индивидуальных особенностей больного, прежде всего его генотип. Опираясь на базу данных доказательной медицины, подробно описанную в клинических руководствах, протоколах и стандартах, в рамках персонализированной медицины врач также использует базу знаний, в том числе накопленный опыт, описывающий разнообразие форм течения известных заболеваний. База знаний позволяет делить описанные нозологии в соответствии с отличительными особенностями организма больного, таким образом уходя от принципа «одно лекарство для всех». Подбирая индивидуальные схемы лечения, врач способен улучшить результаты лечения, обеспечить его безопасность и рентабельность.
Первые успехи персонализированной медицины: фармакогеномика
Конечно, нельзя ожидать, что вся медицина вдруг станет персонализированной. Однако уже сейчас можно привести ряд успешных примеров, демонстрирующих явную пользу для больных и врачей. Большинство примеров персонализированного подхода, уже воплощенных в клиническую реальность, находятся в области фармакогеномики — науки, исследующей влияние полиморфизмов, редких генных вариантов и других компонентов генетической основы ответа организма на лекарственные препараты.
Эффективность лекарственных средств и неблагоприятные побочные реакции при применении зависят от индивидуальных особенностей фармакокинетики (всасывание, распределение, метаболизм, выведение) и фармакодинамики (чувствительности молекул-мишеней рецепторов, ферментов, ионных каналов и т. д.). Указанные особенности могут меняться в зависимости от клеточной и тканевой физиологии, которая, в свою очередь, определяется сочетанием генных аллелей пациента, то есть его генотипом. Доказательства влияния генов на различные процессы, опосредующие эффекты лекарственных средств, получены почти для всех терапевтических агентов.
Аллельные варианты генов, кодирующих ферменты метаболизма лекарственных веществ, известны давно. Для их выявления не обязательно знание нуклеотидной последовательности генома больного: наличие того или иного генного варианта можно распознать с помощью измерения уровня активной формы лекарственного вещества или его метаболита в крови, то есть лабораторного теста, который проводят после принятия препарата (так называемое «фенотипирование», терапевтический лекарственный мониторинг). При таком подходе персонализация лечения происходит уже после начала лечения. Для больных с аномально высокими или аномально низкими концентрациями мониторируемого в крови лекарственного средства будет проведена корректировка дозировки.
Персонализированная медицина будущего предполагает проведение «упреждающих» фармакогеномных тестов до начала лечения или даже до начала развития заболевания. В идеале такой тест должен быть однократным. Генотипирование позволяет заранее выявить все фармакологически значимые генные варианты, и затем занести их в карту больного — на случай, если потребуется экстренное назначение какого-то лекарственного препарата из фармакогеномного списка.
Классическим примером лекарственных средств с вариабельным ответом, зависящим от генотипа больного, являются непрямые антикоагулянты, снижающие риск тромботических осложнений, в том числе варфарин. Эффективность этих препаратов доказана во множестве клинических исследований и не подлежит сомнению, однако их применение может привести к серьезным осложнениям в виде кровотечений. У носителей аллельных вариантов CYP2C9*2 и CYP2C9*3 и генотипа АА по полиморфному маркеру G3673A в гене VCORC1 антикоагулянтный эффект варфарина нестабилен, а его применение часто сопровождается кровотечениями. Следовательно, выбор антикоагулянтного препарата должен быть персонализирован, то есть должен опираться на результаты фармакогенетического тестирования. Для расчета начальной дозы варфарина можно воспользоваться калькулятором на сайте WarfarinDosing.org. Более того, результаты фармакогенетического тестирования по генам CYP2C9 и VKORC1 помогут также спрогнозировать диапазон колебаний поддерживающей суточной дозы варфарина. Таким образом, персонализированный подбор дозировки варфарина помогает снизить риск кровотечений, а также ускорить время подбора оптимальной дозы препарата. В ряде случаев результаты фармакогенетического тестирования могут стать основанием для назначения альтернативных препаратов — а именно пероральных антикоагулянтов нового поколения, не требующих коагулогического контроля и подбора дозы, например, ингибиторов фактора IIa или Xa.
Другой препарат, требующий персонализированного подхода к его назначению — клопидогрел, антиагрегант из группы блокаторов тромбоцитарных рецепторов P2Y12. Печень больных, являющихся носителями аллельных вариантов CYP2C19*2 и CYP2C19*3, генетически не способна к биотрансформации клопидогрела в его фармакологически-активный метаболит. Другими словами, носители таких генных вариантов резистентны к терапевтическому действию клопидогрела, а значит его назначение бессмысленно. При выявлении носительства CYP2C19*2 или CYP2C19*3 (в гетерозиготном или гомозиготном состоянии) рекомендуется использовать иные терапевтические схемы.
И наконец, антидепрессанты [9], которых в арсенале врача имеется целый набор. Согласно современным клиническим рекомендациям, разработанным в рамках доказательной медицины, выбор того или иного антидепрессанта определяется формой депрессии и наличием сопутствующих заболеваний пациента. Однако, по данным разных авторов, антидепрессанты оказываются неэффективными у 40% больных, причем частота нежелательных лекарственных реакций, в том числе серьезных, может достигать 24%. Очевидно, что оптимальное терапевтическое решение может быть принято лишь с учетом особенностей фармакокинетики антидепрессантов у конкретного пациента. Так, эффективность антидепрессантов из группы трициклических в основном определяется активностью цитохрома CYP2D6. При низкой активности CYP2D6 возможно повышение концентрации антидепрессанта, метаболизирующегося данным изоферментом, и вследствие этого — развитие нежелательных лекарственных реакций. В России число лиц с генотипами «медленного» метаболизма (генные варианты CYP2D6*3–10, CYP2D6*41) достигает 20–25%. При высокой активности CYP2D6 (генные варианты CYP2D6*1 и CYP2D6*2) применение стандартных доз антидепрессанта является малоэффективным из-за быстрой биотрансформации и последующего выведения этих препаратов. Понимая, каким изоферментом цитохрома Р450 метаболизируется тот или иной антидепрессант, а также зная факторы, вызывающие изменение активности того или иного изофермента цитохрома Р450 у конкретного больного, можно осуществить персонализированный выбор препарата, который, как ожидается, будет максимально эффективным и максимально безопасным. Так, при выявлении у пациентов генотипов «медленного» или «быстрого» метаболизма необходимо либо правильно подобрать дозу антидепрессанта с помощью специально разработанного алгоритма, либо выбрать антидепрессант, не метаболизирующийся CYP2D6.
Ключи к внедрению персонализированной медицины
Ключом к внедрению персонализированной медицины в клиническую практику являются информационные технологии, в частности, специально разработанные системы поддержки принятия решений о назначении лекарств. Подобные системы предупреждают врачей о возможных неблагоприятных побочных реакциях у пациентов с определенными особенностями генотипа, указывая на необходимость или, по крайней мере, желательность проведения фармакогеномного теста, а после получения результатов теста — способствуют их адекватной клинической интерпретации. В мире уже проводят масштабные проекты и по «упреждающей» фармакогеномике. Опыт проекта «1200 пациентов» Чикагского университета показал, что внедрение «упреждающих» тестов такого рода вовремя напоминает врачу о необходимости учитывать генные варианты при применении лекарственных средств, тем самым повышая эффективность и безопасность лечения [10].
Партисипативная медицина основывается на желании пациента самостоятельно исследовать информацию о своем заболевании. Современная ИТ-среда предоставляет для этого неограниченные возможности. Форумы, дискуссии, чаты, сети профессионального и тематического общения, мобильные приложения, в том числе электронные дневники самонаблюдения, устройства для лонгитюдной оценки показателей жизнедеятельности, а также «напоминатели» о приеме лекарств — это действующие элементы партисипативной медицины, способствующие повышению общего уровня понимания функционирования организма человека среди врачей и больных, а также оповещению о новых диагностических и терапевтических возможностях, становящихся доступными. Таким образом, как среди врачей, так и среди пациентов будет проходить взаимообогащение знаниями, в данном случае понимаемое как кумулятивный обмен информацией, направленный как от врача к пациенту, так и от пациента к врачу. В перспективе развитие ИТ-технологий в области персонализированной медицины должно привести к постепенному переходу от классического определения времен 17–20 веков, когда врач «пользовалъ пациента», к концепции пациента нового поколения, активно «пользующего» врача.
Партисипативная медицина подразумевает не только новый подход к взаимодействию между пациентом и врачом, но и новую систему отношений между организаторами здравоохранения и врачом, построенную с упором на эффективность внедрения технологий персонализированной медицины в клиническую практику. Широкое внедрение фармакогеномного тестирования должно ускорить наступление эры 4П. Первыми элементами партисипативной медицины станут системы поддержки принятия решений, инкорпорированные в электронные лекарственные назначения и позволяющие «на лету», при прописывании лекарства, информировать больного о возможности пройти фармакогеномный тест (и объясняющих, что именно этот тест покажет) или предупреждать о наличии у пациента тех или иных генетических особенностей, способных повлиять на фармакологический ответ (неблагоприятные реакции, резистентность к лечению), с выдачей рекомендаций по изменению тактики лечения. Подобные информационные технологии будут способствовать не только увеличению частоты обращений за геномными и постгеномными тестами, но и формированию у врачей компетенций по применению достижений персонализированной медицины на «рабочем месте».
Новое понятие нормы
Важнейшая особенность персонализированной медицины — это пересмотр понятия «норма». В настоящее время под физиологической нормой понимается среднее значение какого-либо параметра, например, концентрации глюкозы в крови, собранной от достаточно большой группы условно здоровых людей. Значения каждого из этих параметров связаны со значениями многих других биохимических показателей и постоянно меняются даже на коротких измеряемых отрезках, например, в течение суток. Поэтому вместо одной цифры, означающей точное среднее значение в популяции, врачи-лаборанты используют две: верхнюю и нижнюю границы нормы. Интуитивно понятно, что точное значение каждого биохимического показателя, находящегося «в пределах нормы», имеет значение не меньшее, чем значение показателей, находящегося за ее пределами.
К примеру, верхняя граница нормы содержания глюкозы в крови составляет 5,5 ммоль/литр. Представим себе пациента с показателем ровно по верхней границе нормы — является ли он диабетиком? Вспомним, что показатели каждого параметра постоянно меняются — получается, что один и тот же больной может быть диабетиком сегодня и вернуться в границы нормы завтра? А если он отложит визит к врачу до конца недели, да еще и на всякий случай поголодает перед посещением кабинета, преддиабетическое состояние (нарушенная толерантность к глюкозе, нарушенная гликемия натощак) или сахарный диабет будет пропущены. На этом примере видно, что мониторинг биохимических показателей крови должен проводиться гораздо чаще, чем один раз в год, и по возможности одним и тем же врачом (или врачебной киберсистемой) — только такая стратегия позволит предупредить развитие хронических заболеваний или начать их своевременное лечение.
Биомаркерные тесты как одна из основ персонализированной медицины
Небольшие сдвиги уровня того или иного измеряемого параметра сами по себе не могут служить надёжным основанием для дифференциальной диагностики заболевания. Это особенно хорошо видно на примере онкомаркеров — веществ, обычно белков или их фрагментов, вырабатываемых самой опухолью или организмом человека в ответ на развитие злокачественного процесса [11]. Для многих онкомаркеров «нормальный» уровень экспрессии сильно зависит от конкретных генных вариантов. К примеру, уровень ПСА в сыворотке здоровых людей зависит от A/G–полиморфизма в элементе ARE1 (от англ. androgen responsive element 1) гена KLK3 и/или числе повторов CAG в первом экзоне гена рецептора андрогена (AR) [12, 13]. Более того, уровень ПСА повышается не только при онкологических, но и при доброкачественных воспалительных заболеваниях простаты (ACS 2002), поэтому диагностическим критерием обычно служат концентрация опухолевого маркера, а не простое наличие его молекул в крови. Поскольку воздействие воспалительного фона стимулирует деление покоящихся предраковых клеток, граница между злокачественными и нормальными состояниями ткани оказывается размытой [14] и зависит от общего состояния организма больного, например, от наличия хронических воспалительных заболеваний, таких как плевриты и асциты [15], простатит [16], панкреатит [17], урогенитальные инфекции [18], [19] и даже хронический бронхит [20]. В связи с этим увеличение чувствительности и специфичности опухолевой диагностики за счёт обнаружения отдельного «идеального» маркера или за счёт углубленного понимания биологии уже существующих опухолевых биомаркеров представляется маловероятным. По всей видимости, будущее за диагностическими панелями, включающими десятки и сотни маркерных молекул.
В целом все тесты, количественно измеряющие уровни биологических молекул и по этому уровню позволяющие судить о состоянии организма, называют биомаркерными тестами. По принципу их практического использования биомаркеры подразделяют на антецендентные (определяющие риск развития заболеваний), скрининговые (использующиеся для выявления субклинических стадий заболевания при общем осмотре), диагностические (подтверждающие наличие заболевания), так называемые биомаркеры состояния, характеризующие относительную тяжесть заболевания, и прогностические биомаркеры (отражающие динамику течения заболевания, в том числе позволяющие оценивать эффективность лечения). Биомаркеры можно классифицировать и по-другому, а именно по степени их связи с основным патофизиологическим или терапевтическим процессом. Так называемые биомаркеры типа 0 отражают естественную эволюцию заболевания и напрямую связаны с определенными клиническими характеристиками. Примерами биомаркеров типа 0 являются концентрация альбумина в моче, уровень глюкозы натощак, маркеры дисфункции эндотелия. Биомаркеры типа 1 отражают эффект той или иной терапевтической интервенции, а биомаркеры типа 2 являются суррогатами (surrogat endpoint biomarker) — они отражают вероятность успеха выбранной стратегии лечения или предсказательный потенциал диагностической процедуры на основе экстраполяции доказательств, полученных в ходе клинических исследований, проведенных в небольшой группе пациентов на общую выборку всех больных. В качестве примера суррогатных биомаркеров можно привести активность аспартатаминотрансферазы (АсАТ) и аланинаминотрансферазы (АлАТ) при заболеваниях печени, а также концентрацию глюкозы у пациента с уже диагностированным сахарным диабетом [21].
В рамках так называемого SMART-определения биомеркера каждый внедряемый в клиническую практику биомаркер должен быть:
- S — specific and sensitive — чувствительным и специфичным;
- M — measurable — измеряемым;
- A — available and affordable — доступным и недорогим;
- R — responsive and reproductive — воспроизводимым;
- T — timely — своевременным.
И тестирование биохимических показателей крови, и измерение онкомаркеров является примером использования биомаркеров. Инженеры постоянно совершенствуют чувствительность оборудования для измерения уровня индивидуальных биомаркеров. Ученые и клиницисты работают над выявлением и валидацией новых биомаркерных молекул, для многих из которых связь с патогенезом неочевидна. За последние 15 лет количество зарегистрированных для клинического применения биомаркеров, а также число опубликованных сообщений о нахождении новых биомаркеров росло экспоненциально, что привело к отсутствию практической пользы от постгеномных данных для врача.
Как же разобраться в море биомаркерных тестов и научиться правильно применять эти тесты?
Правильная интерпретация результатов биомаркерного теста возможна при использовании подходов персонализированной медицины, которая в качестве объекта наблюдения рассматривает конкретного человека, не сравнивая его с другими. Персонализированная медицина не отказывается от основного метода доказательной медицины — работы с множеством измерений и наблюдений и достижением информированного вывода путем применения статистических процедур, а развивает этот метод, используя сравнение множества единичных измерений биологических параметров, в том числе биомаркеров, собранных в течение жизни пациента. Заключения о важности измеренного значения уровня того или иного биомаркера принимаются с учетом общей (долгосрочной) динамики молекулярного профиля индивида и статистической значимости выявленных трендов, отражающих постепенное изменение состояния его организма. Такая концепция ведения больного «на плечах» доказательной медицины продвигается еще на шаг вперед, сопоставляя не уровни отдельных биомаркеров в группах больных и здоровых людей, а цельные, непрерывные профили изменений этих уровней с течением времени и в зависимости от событий в жизни человека, то есть выявляет границы ситуационной изменчивости.
В рамках доказательной медицины изменения, связанные с циркадным ритмом, нарушения в образе жизни, диете и среде обитания вследствие возросшей мобильности, взаимодействие человека с быстро эволюционирующей техногенной средой на порядок усложняют задачу поиска надежных молекулярных «предвестников» ранних стадий заболевания. В рамках персонализированной медицины те же самые переменные факторы помогают выявить «ключевые точки» патогенеза. Это произошло в лонгитюдном эксперименте по мониторингу состояния индивида, позволившему «подопытному» ученому Майку Снайдеру «перехватить» начало развития диабета после регистрации неожиданного скачка в уровнях некоторых, ранее никак не связанных с диабетом молекул при постоянном их измерении [22].
В рамках этого весьма дорогостоящего эксперимента, проведенного с помощью постгеномных технологий, профессор Снайдер получил точное описание своего «Интегративного многокомпонентного персонального профиля» (integrative personal omics profile, iPOP), включающего информацию о последовательности генома и результаты многократного количественного измерения стандартных биохимических параметров, уровней всех мРНК, а также белков и многих других биологических молекул на протяжении 14 месяцев эксперимента. За это время каждый анализ был проведен 20 раз, что привело к созданию трех миллиардов индивидуальных записей о результатах индивидуального анализа. Все эти записи подвергались непрерывному анализу, и, когда на 299 день эксперимента профессор Снайдер заболел простудой, а точнее, был инфицирован респираторно-синцитиальным вирусом, его лонгитюдный iPOP-профиль значительно изменился. Примерно 10% от общего числа генов изменили свою активность, что свидетельствовало о серьезности переносимого стресса. Действительно, вскоре после выздоровления, анализ того же iPOP-профиля показал увеличение уровней глюкозы и гликозилированного гемоглобина HbA1c, то есть нарастания толерантности к действию инсулина. Важно отметить, что Снайдер выступал в этот исследовании и как научный монитор своего собственного профиля, и как пациент. Получив биомаркерный сигнал о неблагополучии в своем организме, профессор Снайдер снизил гликемическую составляющую диеты и увеличил физические нагрузки, что позволило вернуть уровень глюкозы к норме [23].
Полномасштабное iPOP-профилирование пока недоступно подавляющему большинству пациентов. Да это и не нужно. Лонгитюдное профилирование представляет важную информацию и в случаях, когда многократно измеряют не сотни тысяч, а всего лишь десятки наиболее информативных молекул. В случае профессора Снайдера диагноз начинающегося диабета можно было поставить по результатам многократного измерения всего лишь трех важных маркерных молекул, находящихся в арсенале любого врача, а именно глюкозы, инсулина и гликированного гемоглобина HbA1c. Тем не менее, значение результатов, полученных в исследовании профессора Снайдера, нельзя переоценить. Его работа проложила путь к новому видению роли врача как активного наблюдателя за состоянием гомеостаза организма — наблюдателя, в случае необходимости готового к терапевтическому вмешательству.
Таким образом, в персонализированной медицине метод пассивного наблюдения, со времен Гиппократа поддерживаемый важнейшим для врача принципом «не навреди», впервые получает возможность приблизиться к значительно более сильному, но невозможному для практикующего врача экспериментальному методу исследования. В качестве суррогата эксперимента выступают надлежащим образом задокументированные и отслеженные с помощью биомаркеров «нагрузочные тесты», неизбежно случающиеся в жизни каждого человека. Типичным примером такого теста может быть смена часовых и климатических поясов при поездке в отпуск или в командировку. Реакция на физические нагрузки (человек занимается триатлоном), на пиковое эмоциональное напряжение документируется; при этом вся совокупность наблюдений формирует лонгитудинальный молекулярный профиль, который, вместе с генетическим паспортом, становится основой для персонализированного лечения.
Конечно, до повсеместного внедрения многоразового профилирования множества биомаркеров у одного и того же пациента пока далеко. Однако уже сейчас можно предсказать, что развитие персонализированной медицины приведет к полному изменению структуры «пирамиды внимания» практикующего врача. В настоящее время чем сложнее и тяжелее болезнь пациента, тем глубже его взаимодействие с врачом — чаще назначаются визиты, расширяется спектр назначаемых инструментальных исследований, в результате множества последовательных измерений уточняются параметры лабораторных тестов. Адекватное выстраивание системы персонализированной медицины подразумевает, что врачи будут контактировать с клинически здоровыми людьми существенно чаще, чем с заболевшими.
В области персонализированной медицины фундаментальные исследовательские вопросы, а также вопросы практической помощи здоровым и заболевшим тесно переплетены с техническими и даже с организационными моментами. Так, проведение долгосрочных исследований требует постоянного мониторинга пациента. Нереалистично предполагать, что здоровые люди будут регулярно наблюдаться в стационаре, где они смогут каждый час ходить в лабораторию и сдавать кровь. Тем более нереалистично, что каждый собранный образец крови или другого биологического материала будет подвергнут детальному анализу в исследовательской лаборатории. Поэтому развитие персонализированной медицины предусматривает усовершенствование методов исследования биологических образцов, а также их удешевление — например, путем перехода от дорогих и «штучных» протеомных исследований к анализу профилей метаболитов. Протеомный анализ требует от 30 до 200 минут на измерение, тогда как метаболомный профиль можно определить за 30 секунд. За счет разработки системно-биологических моделей, которые позволят по метаболомному профилю экстраполировать концентрации диагностически значимых белков, можно будет сократить как время, так и себестоимость анализа.
Контуры будущего
Итак, попробуем набросать контуры будущей эры персонализированной медицины — ведь мы установили, что основы необходимых технологий уже разработаны, осталось лишь масштабировать их практическое использование, сделать их доступными каждому больному. Опыт говорит, что услуги представителей других «персонализированных» профессий, например, телохранителя или личного водителя, являются эксклюзивными, а значит, доступны далеко не каждому. А ведь общение с врачом необходимо каждому человеку. Более того, если какой-либо врач станет лечить одного-единственного пациента и, кроме этого пациента, не будет имеет дополнительной практики, это значительно снизит его квалификацию. В этом случае персонализированное поддержание здоровья одной ВИП-персоны закроет врачу дорогу к лучшему средству повышения квалификации — увеличению личного опыта, который может быть набран только в результате наблюдений за множеством больных. Разница между трудом врача и трудом личного водителя, у которого нет необходимости для расширения круга клиентов с целью повышения профессиональных навыков, — огромна.
Мир, в котором мы живем, представляет собой систему, включающую ограниченное количество очень состоятельных людей, для которых медицина в полной мере персонализирована, значительные слои населения стран, входящие в так называемый «золотой миллиард», и огромные популяции, для которых ограничен полноценный доступ не только к персонализированной, но и к обычной медицине, осуществляемой в соответствии с принятыми стандартами. Распространение методов персонализированной медицины является одним из способов автобалансировки в настоящее время очень неравномерно доступной системы медицинских услуг. Увеличение затрат на диагностику и лечение пациентов из популяций, ранее получавших лишь рудиментарное медицинское обслуживание, напрямую «выгодно» и тем, кто не может пожаловаться на качество базовой врачебной помощи, но желает ее дальнейшей персонализации. Это связано с тем, что работа с огромными массивами индивидуальных случаев, обеспечиваемая накоплением массивов данных в электронных картах, развитием коллекций биологических образцов, проведением эпидемиологических исследований, включающих сотни тысяч наблюдений, является необходимым залогом развития персонализированной медицины, которая невозможна без постоянного расширения базы знаний о полном спектре возможностей человеческого организма и репертуаре его ответов на различные физиологические и патофизиологические факторы. Хорошим примером коллективных общечеловеческих усилий является добровольное внесение индивидуальных траекторий «здоровья», ставшее возможным в связи с развитием информационно-телекоммуникационных технологий (Reality Mining) в общедоступные базы данных. Анализ этих данных способен не только способствует развитию одного из основных направлений персонализированной медицины — лонгитюдного мониторинга — но и существенно расширить наши представления о пределах нормы реакции и механизмах обеспечения гомеостаза.
Поскольку персонализированная медицина опирается на интернет-технологии, она демократична по своей сути. С одной стороны, мы можем представить себе успешного бизнесмена А, готового выделить средства на мониторинг многих миллионов людей в надежде, что полученная сумма знаний или какая-то конкретная траектория окажется полезной для него лично. С другой стороны, ничто не мешает обмену информацией о накопленных траекториях «здоровья» между слесарем Б и учителем В. Заметьте, что случаи Б и В для бизнесмена А полезны лишь в той степени, в какой они являются отдельными страницами энциклопедии, состоящей из миллиона томов. В рамках этой концепции наибольшую «пользу» приносит лишь сравнительный мониторинг здоровья всего населения, а не углубленное изучение одного единственного, пусть даже постгеномного профиля богатого больного.
Развитие постгеномных технологий неразрывно связано с развитием ИТ сферы. Именно ИТ-прорывы делаю возможной работу секвенаторов и масс-спектрометрометров — эти приборы «читают» структуры молекул благодаря возросшей частоте работы кристаллов находящихся в них микросхем и недавно преодоленных порогового объема и скорости записи на различные, в том числе, «облачные» накопители данных. Следует ожидать, что и постгеномная персонализированная медицина будет развиваться по сходному сценарию.
В настоящее время контроль за состоянием здоровья населения осуществляется с помощью механизмов, которые можно сравнить с большими электронно-счетными машинами (БЭСМ), разработанными в СССР в 1950–1970-х годах прошлого века. БЭСМ выпускались ограниченными штучными партиями под жестким контролем использования со стороны государства — что напоминает современную систему стандартов в здравоохранении. Персонализированное использование БЭСМ было невозможно, как невозможна и персонализация врачебной помощи в рамках сегодняшних медицинских стандартов. Однако в конце XX века мир изменился, и вместо БЭСМ мы сегодня имеем персональные устройства (планшеты, смартфоны, ноутбуки, персональные компьютеры), находящиеся в личном распоряжении каждого. Заметьте, что широкое распространение персональных БЭСМ не отменяет существования государственных супер-БЭСМ, в настоящее время реализованных в виде как распределенных, так и централизованных вычислительных мощностей, используемых для мониторинга общего состояния государственной системы.
Исходя из уже реализовавшегося сценария развития вычислительных технологий можно представить себе следующий сценарий развития медицины будущего. В следующем десятилетии постгеномные технологии будут актуальными для персонализированной медицины в той степени, в которой они позволят редуцировать сложный молекулярный анализ до формата еще одного приложения в смартфоне, которое позволит врачу увереннее и быстрее принять клиническое решение для конкретного пациента. Нетрудно представить, что на следующем этапе своего развития приложения для персонализированной медицины с экрана смартфона врача перейдут к пациенту, превратившись в «ответственную» самодиагностику и самолечение. Где пройдут границы такой «ответственности», пока определить невозможно, но, к сожалению, без широкомасштабных законодательных запретов этот шаг неизбежен. По-видимому, обществу придется методом проб и ошибок отыскать оптимальное решение для преодоления этой проблемы. Несомненно одно — даже при полной доступности персонализированных медицинских справочников, центральной фигурой, ответственной за здоровье человека, останется, как и в течение тысяч предыдущих лет, врач.
Заключение
Итак, мы разобрали концепцию персонализированной медицины и значение геномных и постгеномных технологий для ежедневной клинической практики. Вкратце напомним, что постгеномные технологии позволяют, образно говоря, «вглядеться» в организм отдельного человека и увидеть в нем индивидуальные молекулы, то есть составить индивидуальный «молекулярный» портрет. Однако клиническая интерпретация огромных объемов молекулярных данных — это сложнейшая задача, реализация которой запаздывает по сравнению с развитием технологий высокопроизводительного профилирования биологических молекул. Поэтому, за исключением некоторых специальностей, прежде всего онкологии, постгеномные технологии до сих пор остаются невостребованными в клинике. Этим и определяется разрыв между надеждами, возлагавшимися на постгеномные технологии в течение последних 10 лет, и фактическим подспорьем, которые эти технологии предоставляют для практической деятельности врача: оказалось, что широкое использование этих технологий в практической медицине невозможно. На настоящий момент масштабы внедрения постгеномных технологий в клиническую практику невелики, а их применение ограничено рядом конкретных клинических задач.
Преимущества персонализированного подхода к ведению больных очевидны. В онкологической практике персонализированное ведение больных уже внедрено в рамках таргетной терапии, когда те или иные лекарственные препараты назначаются после детального молекулярно-генетического исследования опухоли. Следующим шагом на пути персонализации является молекулярно-генетическое исследование организма пациента, которое по возможности должно быть выполнено на этапе, когда его организм достаточно здоров. Фармакогенетические тесты являются первым серьезным инструментом персонализированной медицины, доступным лечащим врачам неонкологических специальностей.
Философия персонализированной медицины как взаимодействия между двумя людьми — пациентом и доктором — не нова. Именно в этой форме медицина существовала с момента зарождения врачевания как одного из типов деятельности человека. Новые технологии персонализированной медицины, описанные в этой статье, например, индивидуализации применения антитромботических средств и антидепрессантов, являются дополнительным инструментом, позволяющим повысить качество оказания медицинской помощи. Как рандомизированные клинические исследования, так и мета-анализы показывают, что в определенных случаях этот инструмент весьма эффективен, а значит достижения персонализированной медицины высоко оценены и с позиций хорошо зарекомендовавшей себя доказательной медицины. Именно поэтому у многих врачей возникает проблема смыслового наполнения термина «персонализированная медицина»: ведь фактически врач и так работает с каждым пациентом в отдельности, стремясь при этом индивидуализировать свои вмешательства, а следовательно, нам стоит ожидать, что технологии персонализированной медицины будут внедряться естественным образом по мере того, как в рандомизированных исследованиях, проводимых с позиций доказательной медицины, будет наглядно продемонстрирована их польза.
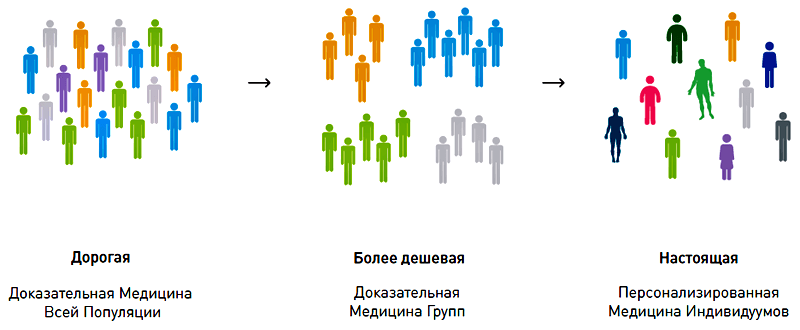
Рисунок 3. Медицина, какой она должна быть.
Статья написана в соавторстве с членами редакции онлайн-журнала AltasMed Дмитрием Сычевым и Марианной Ивановой, а также д.б.н. Андреем Лисицей. Исходная версия называлась «Персонализированная и постгеномная медицина».
Литература
- Геном человека: как это было и как это будет;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Код жизни: прочесть не значит понять;
- Огурцы-убийцы, или Как встретились Джим Уотсон и Гордон Мур;
- Код жизни: прочесть не значит понять;
- Перевалило за тысячу: третья фаза геномики человека;
- Загадочная генетика «загадочной болезни кожи» — витилиго;
- Evidence-Based Medicine Working Group. (1992). Evidence-based medicine. A new approach to teaching the practice of medicine. JAMA. 268, 2420–2425;
- Краткая история антидепрессантов;
- O’Donnell P.H., Danahey K., Jacobs M., Wadhwa N.R., Yuen S., Bush A. et al. (2014). Adoption of a clinical pharmacogenomics implementation program during outpatient care — initial results of the University of Chicago «1,200 Patients Project». Am. J. Med. Genet. C. Semin. Med. Genet. 166C, 68–75;
- Как распознать рак при помощи биомаркеров?;
- Время обезьяньих исследований: расшифрован геном макаки резуса;
- Xu J., Meyers D.A., Sterling D.A., Zheng S.L., Catalona W.J., Cramer S.D. et al. (2002). Association studies of serum prostate-specific antigen levels and the genetic polymorphisms at the androgen receptor and prostate-specific antigen genes. Cancer Epidemiol. Biomarkers Prev. 11, 664–669;
- Okada F. (2002). Inflammation and free radicals in tumor development and progression. Redox Rep. 7, 357–368;
- Kalantri Y., Naik G., Joshi S.P., Jain A., Phatak S., Chavan R. et al. (2007). Role of cancer antigen-125 from pleural & ascitic fluid samples in non malignant conditions. Indian J. Med. Res. 125, 25–30;
- Sandhu J.S. (2009). Management of elevated prostate-specific antigen in men with nonbacterial chronic prostatitis. Curr. Urol. Rep. 10, 302–306;
- Halm U., Rohde N., Klapdor R., Reith H.B., Thiede A., Etzrodt G. et al. (2000). Improved sensitivity of fuzzy logic based tumor marker profiles for diagnosis of pancreatic carcinoma versus benign pancreatic disease. Anticancer Res. 20, 4957–4960;
- Sarandakou A., Phocas I., Sikiotis K., Rizos D., Botsis D., Kalambokis K. et al. (1997). Cytokines in gynecological cancer. Anticancer Res. 17, 3835–3839;
- Konety B.R. and Getzenberg R.H. (2001). Urine based markers of urological malignancy. J. Urol. 165, 600–611;
- Oremek G.M., Sauer-Eppel H., Bruzdziak T.H. (2007). Value of tumour and inflammatory markers in lung cancer. Anticancer Res. 27, 1911–1915;
- Kumar M. and Sarin S.K. (2010). Biomarkers of diseases in medicine. Curr. Trends Sci. 15, 403–417;
- Упреки в нарциссомике;
- Snyder M. (2014). iPOP and its role in participatory medicine. Genome Med. 6, 6..






