Перспективы стандартизации аллергенных экстрактов: современные технологии контроля качества биологических препаратов
12 сентября 2013
Перспективы стандартизации аллергенных экстрактов: современные технологии контроля качества биологических препаратов
- 6091
- 2
- 4
Природные аллергены — сырьевые источники «аллерговакцин»
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Аллергические заболевания распространены среди населения всего мира. Существует целый вагон способов лечения подобных патологий, наиболее эффективным из которых является аллерген-специфическая иммунотерапия (АСИТ). Основным «действующим началом» данного метода лечения являются аллерговакцины или аллергенные экстракты-препараты. Оценка качества данной группы биологических препаратов представляет весьма сложную задачу, решение которой возможно несколькими способами. Каждый из них имеет свои достоинства и недостатки, поэтому интерес представляет каждый из них, начиная от самого начала производства препарата, заканчивая готовым продуктом.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Становление и достижения современной АСИТ
На сегодняшний день в современной медицине сложилось стойкое убеждение, что наиболее эффективным способом лечения аллергических заболеваний является аллерген-специфическая иммунотерапия (АСИТ) [13]. Это подтверждается рядом неопровержимых фактов. История становления АСИТ заняла несколько десятилетий: ещё в 1819 г. английский врач Джон Босток описал «сенную лихорадку»; в 1869 г. уже Дэвид Блекли, пытаясь определить, что являлось причиной обострений сенной лихорадки, поставил на себе кожные пробы (втирая пыльцу в повреждённые участки кожи); в 1902–1905 гг. врачи из Гамбурга, Прауснитц и Дунбар, страдавшие сенной лихорадкой, так же установили, что симптоматика сенной лихорадки вызвана пыльцой растений. Впервые в качестве терапевтического метода АСИТ предложили Леонард Нун и Джон Фримен в 1911 году при лечении поллиноза (сенной лихорадки = аллергического заболевания, вызванного пыльцой растений): публикация в журнале «Ланцет» сообщала сведения об успешном выздоровлении около 20 больных сенной лихорадкой. При лечении астмы иммунотерапия аллерговакцинами с успехом использовалась Кауфилдом в 1921 г. [17], [19].
Особо следует отметить, что в 1907 г. наш соотечественник А.М. Безредка в Париже одним из первых в мире начал работу по созданию аллерговакцины на основе пыльцы. Большая заслуга в становлении и развитии метода АСИТ принадлежит аллергологам бывшего СССР и стран постсоветского пространства. Особенно большой вклад внёс в развитие и становление метода АСИТ основатель современной отечественной аллергологии академик А.Д. Адо. Именно под его чутким руководством было организовано производство терапевтических и диагностических аллергенов в СССР, и метод АСИТ нашел широкое распространение в самых дальних аллергологических кабинетах нашей страны [2]. В настоящий момент прослеживается чёткая тенденция к возрастанию частоты встречаемости аллергических заболеваний, структура которых весьма разнообразна (рис. 1) [23], [24].
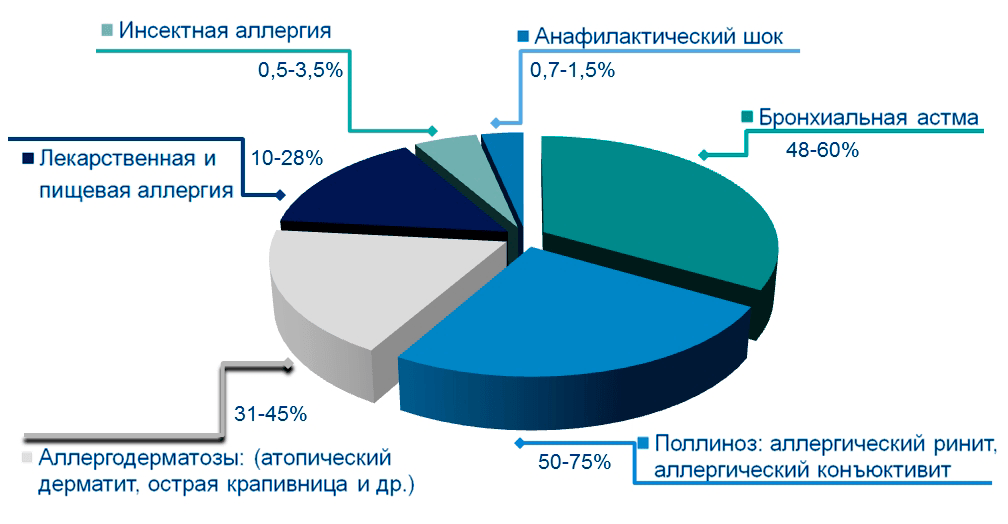
Рисунок 1. Распространённость в структуре аллергических заболеваний
Сегодня АСИТ стала единственным патогенетическим методом лечения, направленным исключительно на составляющие этапов механизма развития аллергических реакций. Данный метод терапии заключается в применении возрастающих доз специальным образом приготовленных водно-солевых аллергенных экстрактов, а также модифицированных или адсорбированных на разных носителях препаратов [4], [8]. Причем подбор аллергена осуществляется с тем расчётом, чтобы именно он вызывал основные симптоматические проявления заболевания у больного с повышенной чувствительностью [18]. Основной задачей терапии является специфическая гипосенсибилизация — постепенное снижение чувствительности пациента вплоть до полной индифферентности к естественной экспозиции этого аллергена (или группы аллергенов) в окружающей среде (рис. 2) [11], [18].
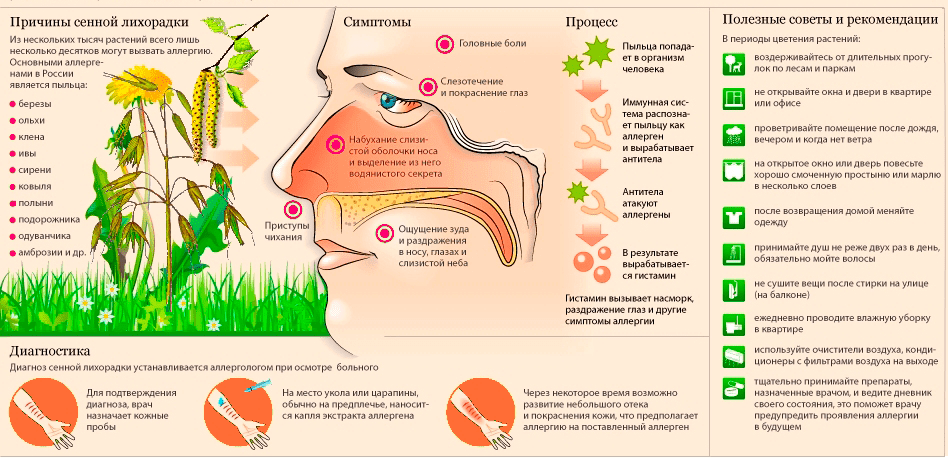
Рисунок 2. Причины, симптомы и профилактика сенной лихорадки
При введении в организм пациента аллергена наблюдается повышение резистентности к его действию на иммунологическом уровне, что имеет некоторые общие черты с процедурой вакцинации. Исходя из этого сегодня возможно использование терминов наряду с «аллергенными экстрактами», так же «аллергенные вакцины». С момента первого использования АСИТ накопилось достаточно клинических данных применения этого метода. Сегодня он широко используется в качестве терапии Ig E-опосредованных типовых аллергических процессов [4], [7], [10].
Аллергенные экстракты: вчера и сегодня
Достижения в области эффективности и безопасности современной АСИТ были бы невозможны без разработки и внедрения стандартизированных экстрактов аллергенов. Сейчас наблюдаются значительные успехи в их изготовлении. В то же время существует ряд проблем, которые связаны со стандартизацией и контролем качества данных препаратов [4], [6], [9], [29]. С применением водно-солевых аллергенных экстрактов пыльцы растений началось широкое распространение лечебных аллергенов в медицинской практике. Например, в Средней полосе России первостепенная роль в этиологии всех поллинозов, вызванных древесными растениями в весенний период, принадлежит берёзе повислой (Betula pendula Roth) (рис. 3.) [5].

Рисунок 3. Береза повислая (Betula pendula Roth). а — мужское соцветие; б — микроснимок ее пыльцевого зерна, полученный при помощи растрового электронного микроскопа (увеличение 1820×).
В настоящий момент выделяют три основные категории аллергенных растений: древесные, сорняки, злаковые и разнотравье. Условно, сезоны заболевания поллинозом можно разделить на три основных пика, связанных с календарём цветения растений в центральной полосе Российской Федерации (рис. 4) [1], [17].
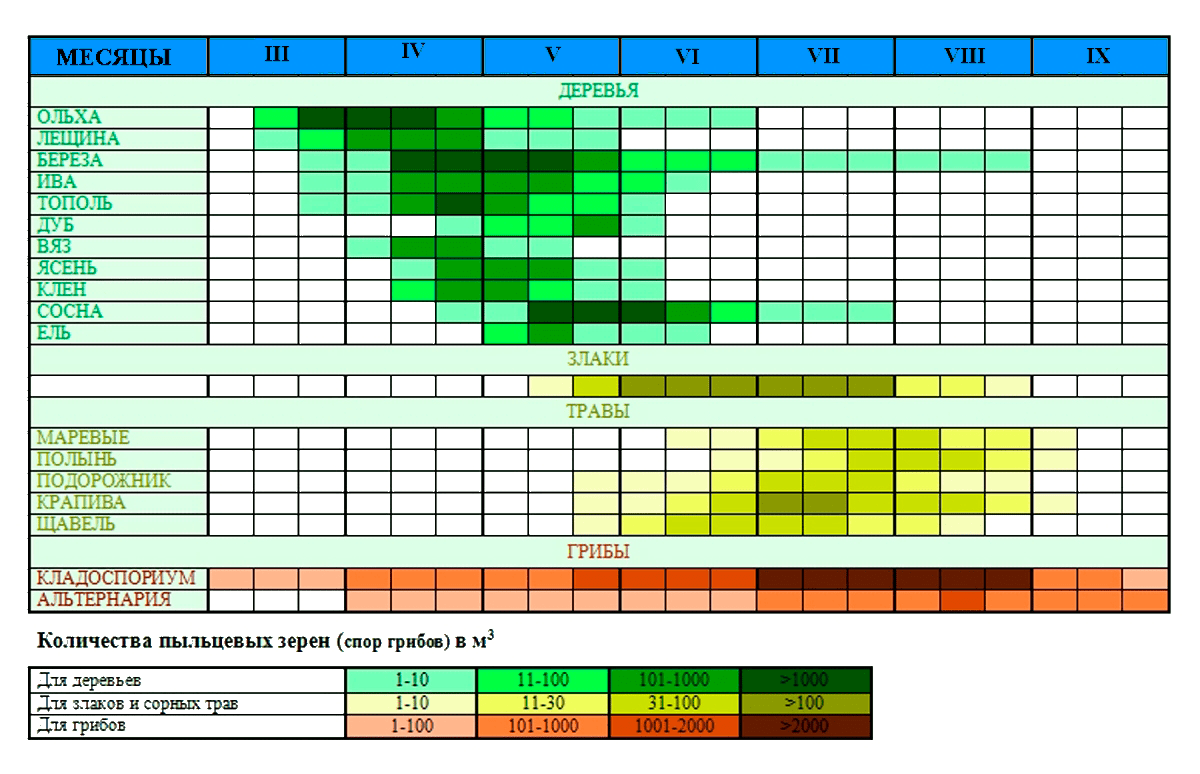
Рисунок 4. Календарь цветения растений в центральной полосе Российской Федерации
В дальнейшем лечебные формы аллергенов совершенствовались с учетом их безопасности при сохранении главного критерия — иммуногенности. Были также предприняты попытки модифицировать аллергены путём их полимеризации (глутаровым альдегидом, формальдегидом), получения сорбированных форм (с гидроксидом алюминия, L-тирозином), разработке пролонгированных форм с применением многочисленных как синтетических, так и природных носителей [23], [24].
Состав и качество аллергенных экстрактов
Состав аллергенных экстрактов чрезвычайно разнообразен: это белки, пептиды, гликопротеиды, полисахариды, производные липидов и т.д. Объясняется это тем, что для получения аллергенных экстрактов используются различные источники сырья, методы изготовления и способы очистки. Из-за этого препараты разных фирм-производителей также отличаются значительной вариабельностью по составу антигенных компонент и биологической активности. Обеспечить одинаковый состав и иммунологическую активность аллергенов (нативных экстрактов) различных производителей и партий препаратов одного конкретного производителя возможно при соблюдении требований к проведению стандартизации, чтобы данные препараты стали полноценными фармакопейными продуктами [3], [20].
Определение специфической активности аллергенных экстрактов является основной, а также наиболее сложной составляющей стандартизации. Проблемы связаны с различными способами получения сырьевого материала, методами его химической и физической модификации, использованием разного рода растворителей, нормативами заполнения тары (флаконов и ампул), способами хранения и транспортировки и т.д. [3], [6], [9]. В процессе изготовления аллергенных экстрактов зачастую приходиться сталкиваться с проблемами, которые связаны с невозможностью выделения из ряда препаратов химически чистых аллергенных компонентов, нестабильностью физико-химических свойств сырьевого материала, неполной корреляцией между биологической активностью отдельных аллергенных компонент и их количественным соотношением.
Так, с финансовой поддержкой Европейского союза был сформирован проект CREATE или «Сертифицированные эталоны (референсы) аллергенов для оценки качества продукции» (Certified References used for Allergen and Test Evalution). Цель проекта — стандартизация аллергенов на уровне фармакопейных препаратов и внесение в соответствующие фармакопейные статьи унифицированных методик и характеристик независимо от конкретной компании-производителя. В основе данного проекта были заложены идеи широкого введения унифицированных стандартизированных методов количественного содержания главных (мажорных) аллергенных компонент с использованием стандартных протоколов [26]. К клинически значимым, мажорным аллергенам относятся те аллергены, которые способны вызывать иммунологический ответ более чем у половины пациентов и связывать более половины IgE-AT у сенсибилизированных к этому аллергену пациентов [3]. Несмотря на всю амбициозность проекта его постиг ряд неудач, связанных прежде всего с трудновыполнимостью поставленных задач. В результате сложной кропотливой работы участников проекта всего лишь две молекулы аллергенных белков — аллерген пыльцы березы (Betv1) и аллерген пыльцы тимофеевки (Phlp5b) (рис. 5) [26] — смогли пройти проверку в лабораториях, чтобы их можно было включить в соответствующие статьи Европейской фармакопеи [28].
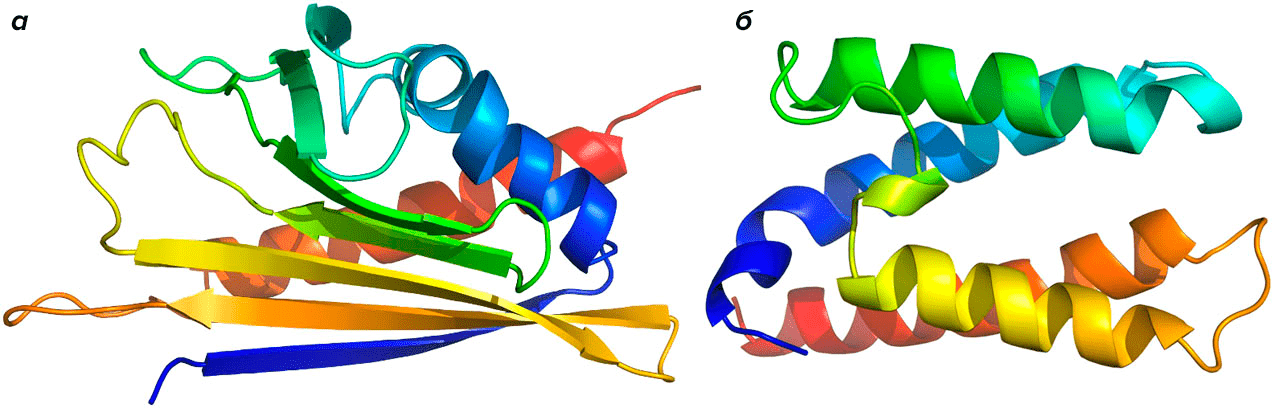
Рисунок 5. Масштабные структуры молекул Betv1 (а) и Phlp5b (б)
Приготовление аллергенных экстратов-препаратов
Самым старым методом изготовления аллергенных экстрактов для лечебных и диагностических целей является экстрагирование необходимых аллергенов из природной матрицы (биообъектов). Выделение аллергенов проводят путём экстрагирования сырьевого материала различными растворителями. Перед экстракцией проводят дезинтеграцию природного сырья путём разрушения природной матрицы; далее полученные таким образом экстракты подвергают различного рода очистке. Итак, приготовление экстрактов аллергенов на основе природного сырья состоит из следующих этапов: измельчения, экстракции, очистки, диализа, стерилизации, пробы на токсичность.
Для обеспечения стандартности продукта предварительно проводят оценку качества самого сырья. Его источником являются организмы-продуценты аллергенов: растения (березовые, злаки), клещи домашней пыли, насекомые, грибы и др. Их культивируют в лабораторных условиях (клещи, микроорганизмы, насекомые) или проводят сбор в естественных условиях обитания (пыльца различных растений). К сырью предъявляется ряд требований: определение видовой принадлежности, регламентирование присутствия посторонних примесей. Так, при проведении визуального и микробиологического анализов возможно присутствие не более 1% любых посторонних примесей в исследуемом образце [27].
В процессе измельчения предварительно отобранного сырья происходит разрушение клеточных мембран, что приводит к значительному увеличению общей поверхности сырьевого материала. Для проведения измельчения используют специальную аппаратуру (лабораторный миксер, ультразвуковые приборы и др.). Больше всего проблем технологического характера возникает при пробоподготовке таких материалов, как перо, шерсть животных, шелк и т.п.
Для экстракции используют слабощелочную среду (pH 7,5–8,5), поскольку в процессе экстрагирования зачастую происходит подкисление раствора. Для обеспечения постоянного рН целесообразно использовать буферные растворы: щелочной раствор Кока (Coca A., 1922) применяется для приготовления экстрактов из грибов, домашней пыли, пыльцы и др.; буферный раствор с NaCl чаще всего используется для экстрактов из овощей, орехов, фруктов, эпидермиса животных и т. д. Обезжиренный материал смешивают с наиболее подходящим раствором, затем проводят экстрагирование при комнатной температуре в тест-системе от 17 до 24 часов при постоянном встряхивании. Согласно технике Frugoni экстракцию проводят 12%-раствором этилового спирта (соотношение материала к экстрагенту 1:9) продолжительностью 48–72 часов в холодильной камере.
Процесс очистки сырьевого материала может включать осаждение, центрифугирование, фильтрацию, либо комплекс этих методов. Получение, по возможности, максимального количества высокоочищенного экстракта аллергена, а так же минимизация потерь при изготовлении являются основными техническими задачами на данном этапе.
После предварительной очистки следует диализ, в процессе которого происходит удаление низкомолекулярных веществ и пигментов, способных вызвать нежелательные побочные реакции (например, раздражения кожи). Использование данного метода необходимо для экстракции некоторых продуктов питания, домашней пыли. Высокомолекулярные примеси можно исключить благодаря применению каскадного способа фильтрации. Не смотря на все меры предосторожности, в готовом экстракте все равно остается некоторое количество сопутствующих компонентов, которые не проявляют иммунологических свойств, что является одним из недостатков данного метода.
Поскольку экстракты аллергенов предназначены по большей части для инъекционного введения, следующим этапом изготовления является стерилизация. Фильтрация через бактериальные фильтры — наиболее приемлемый способ стерилизации, позволяющий сохранить структуру термолабильных веществ. После стерилизации экстракт переносят в стерильную посуду. Также необходим дополнительный контроль на стерильность перед использованием: для этого проводят посев и обнаруживают возможный рост аэробных и анаэробных микроорганизмов.
Испытание на токсичность состоит в определении рН (значение должно быть ≈7.0), обязательном проведении микробиологического и токсикологического контролей. Таким образом, полученный экстракт должен представлять собой высокоочищенный препарат с точным указанием качественного и количественного состава [6], [23].
Получать аллергенные экстракты кроме как из природных источников возможно с помощью биотехнологического производства (высокочистые экстракты, содержащие одну фракцию активного аллергенного белка). Новые технологии получения клонированных молекул белка уже сейчас позволяют использовать большое количество важных аллергенов (аллергены пыльцы растений, эпидермиса животных, постельного клеща, ядов насекомых и др.), представляющих собой индивидуальные рекомбинантные белки, которые обладают иммунологической активностью, сопоставимой с аналогичными белковыми аллергенами, встречающимися в природе [16]. Такая технология облегчает стандартизацию аллергенных препаратов, позволяя с высокой точностью определять содержание главных (мажорных) аллергенов в произведенных сериях лекарственных препаратов. Однако, в любом случае необходима процедура стандартизации аллергенного получаемого экстракта.
Стандартизация аллергенных экстрактов
На данный момент, как уже было отмечено ранее, отсутствуют единые протоколы стандартизации аллергенных экстрактов для всех производителей. Так, в Европе оценкой экстрактов аллергенов на их соответствие всем требованиям, прописанным в Европейской Фармакопее, занимается Европейское агентство по лекарственным средствам (ЕАЛС) — European Medicines Agency (EMEA). В США основной организацией, занимающейся вопросами стандартизации аллергенных экстрактов является Управление по контролю качества продуктов питания и лекарственных средств — Food and Drug Administration (FDA). Суммарная аллергенная активность лекарственного препарата определяется из соотношения проявления кожной реакции на аллерген (прик-тест) к аналогичной кожной реакции, вызываемой гистамином у больных, сенсибилизированых (чувствительных) к данному аллергену [9]. Таким образом, основным методом стандартизации экстрактов аллергенов во всем мире является определение биологической активности препарата посредством способности связывания комплекса АГ—АТ [6].
Что касается природного сырья (нерекомбинантных молекул), состав и иммунологическая активность аллергенных экстрактов имеют довольно значительные расхождения не только у нескольких производителей, но так же и у одного производителя от одной партии препарата к другой. Возникает потребность в проведении сравнительных анализов иммунологической активности производимых экстрактов. При проведении сравнительного анализа необходимо определить метод, стандарт и единицы измерения иммунологической активности препарата.
Оценка биологической активности экстрактов аллергенов возможна несколькими методами. Различают in vitro- и in vivo-диагностику. К методам in vitro относят: вестерн-блоттинг, изоэлектрофокусирование, IgE-иммуноблоттинг, перекрёстный радиоиммуноэлектрофорез, иммуноферментный анализ (ИФА, ELISA), перекрёстный радиоиммуноэлектрофорез, ракетный электрофорез по Лореллу, электрофорез в полиакриламидном геле с додецил-сульфатом натрия, радиоаллергосорбентный тест (PACT) и др. К in vivo-методам относят: кожные пробы — капельные, прик-тесты (тесты уколом), аппликационные (эпикутанный) метод, скарификационные, внутрикожные и др. [3], [6], [9], [11], [23].
Следует отметить, что до сегодняшнего дня специфическая активность и концентрация аллергенов каждым производителем определялась посредством методологических подходов, удобных только для него, то есть с использованием своих внутренних стандартов — In House Reference Standard (IHRS) (рис. 6) [3], [9], [22].
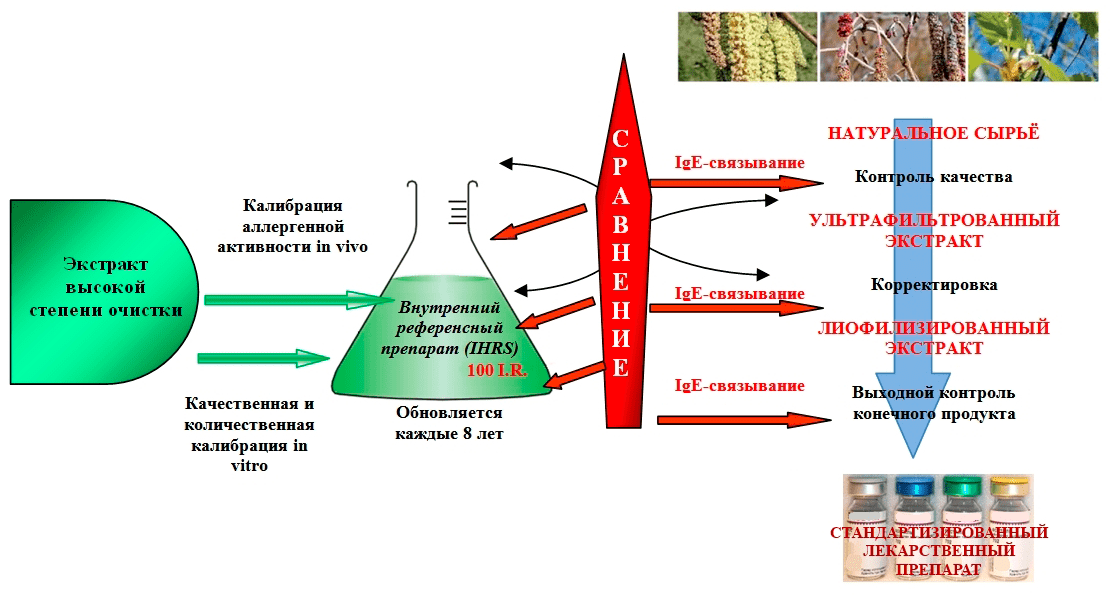
Рисунок 6. Схема стандартизации с использованием IHRS при производстве препарата
Поэтому на рынке появилось великое множество препаратов, имеющих различную маркировку своих коммерческих серий лечебных и диагностических аллергенных экстрактов, характеризующих их иммунологическую активность. Среди них:
- биологическая единица — Biological Unit (BU),
- биологическая аллергенная единица — Biological Allergenic Unit (BAU),
- единица аллергенной активности — Allergen Units (AU),
- единица активности АСИТ — Specific treatment unit (STU),
- индекс реактивности (ИР) — Index of reactivity (IR-Europe),
- единица активности радиоаллергосорбентного теста — Activity Units by RAST (AUR-Europe),
- единица эквивалента гистамина HEP,
- таблетка (T) или единица (U) — вид экстрактов для терапии сенсибилизированных пациентов — Standartisation Quality (SQ-T или SQ-U) [3].
Также встречаются единицы, которые стандартизуются по специфической активности связывания IgG, а не IgE — SU. К ним относятся диагностическая биологическая единица — DBU и лечебная терапевтическая стандартизированная единица TSU.
Данные испытания основываются главным образом на размерах папулы (кожный прик-тест) с концентрацией гистамина 10 мг/мл в качестве эталона-стандарта. Несмотря на это даже в случае применения абсолютно одинаковых методик стандартизации, одна и та же указанная активность, которая будет выражаться в одинаковых единицах на упаковках экстрактов аллергенов, но изготовленных по разным технологическим условиям у разных производителей, в реальности будет вызывать реакцию разной степени выраженности. Данный факт объясняется различной чувствительностью тестируемых больных, а также проведения большинства исследований на недостаточно больших выборках пациентов [7], [10]. Подобное явное непостоянство в оценке активности аллергенов оказывает сильноe влияние на результаты метаанализов, резко снижая их однородность, и как следствие мешает проведению систематических обзоров клинических испытаний по установлению эффективности АСИТ, что в конечном счете мешает разработке новых эффективных и безопасных аллергенных препаратов.
Каково мнение мирового сообщества?
Отсутствие унифицированных методик вынуждает каждого производителя аллергенных экстрактов, опять же, применять собственные протоколы стандартизации, зачастую значительно отличающиеся от аналогичных у других фирм-производителей. На данный момент универсальные эквиваленты выражения иммунологической активности отсутствуют, и у каждого производителя есть свои методы и алгоритмы их интерпретации. Но сегодня, для разных фирм-производителей стало принципиально выполнимым определение содержания в лекарственном препарате главных аллергенных белков, которые преимущественно ответственны за гиперчувствительность организма пациента к многокомпонентному составу аллергенного экстракта. Для этого в распоряжение стран мирового сообщества передаются так называемые международные референс-стандарты, созданные Всемирной организацией здравоохранения (ВОЗ), которые содержат определенное количество соответствующих аллергенных компонент. ВОЗ так же была предложена система международных единиц (International Unit, IU): в данных единицах выражается биологическая активность международных стандартов, разработанных организацией.
В феврале 1981 года на рабочем совещании ВОЗ в Женеве была разработана программа по использованию 15-ти международных стандартов аллергенов, в числе которых были аллергены пыльцы березы и клещей домашней пыли. В 1983–1986 годах благодаря работе Экспертного подкомитета стандартизации аллергенных препаратов при Международном союзе иммунологических обществ (WHO/IUIS) были одобрены следующие международные стандарты аллергенов: тимофеевки (Phleum pratense L.), клещей домашней пыли (Dermatophagoides pteronyssinus, 1897), пыльцы березы (Betula pendula Roth.) и аллергенов собаки (Canis lupus familiaris L.). На этом работа в области стандартизации аллергенных экстрактов не была остановлена: сегодня имеются основные нормативные акты, которые регламентируют национальные и международные стандарты. В европейских странах, несмотря на все достоинства, международные референс-препараты не получили широкого распространения: каждым производителем всё так же используется свой IHRS, и активность данного стандарта по-прежнему выражается в собственных единицах [3], [7], [9].
Неоспоримо, что однотипная, унифицированная стандартизация аллергенных экстрактов, как и всех фармакопейных продуктов, смогла бы оказать существенную помощь в определении оптимальной дозировки для больных, которые подвержены сенсибилизации на конкретный определённый аллерген. Но пока, к сожалению, разработка одной унифицированной единицы, по которой бы проводилась стандартизация у хотя бы подавляющего большинства компаний — производителей диагностических и лечебных аллергенов — практически нерешаемая задача. В сложившихся условиях ВОЗ настоятельно рекомендует использовать именно те аллергены, стандартизация которых осуществлялась в соответствии с текущими европейскими требованиями. К подобным критериям качественной оценки аллергенов относятся: обособленность антигенов (максимальная изоляция от компонентов, которые перекрещивающихся с родственными антигенными детерминантами), специфичность (особое свойство индуцировать аллергическую реакцию исключительно в организме, предварительно сенсибилизированном конкретным аллергеном), антигенная чистота, безвредность, стандартизация биологических и физико-химических свойств, а также рациональный химический состав [3], [8], [15].
Требования к аллергенным экстрактам в Российской Федерации
В настоящий момент в Российской Федерации для комплексной АСИТ применяют ряд водно-солевых экстрактов, представляющих собой смесь из аллергенных и неаллергенных соединений; депонированные, а также подвергнутые модификации лечебные формы аллергенов. Их, как правило, применяют для лечения различного рода аллергических заболеваний (респираторных, анафилактических реакций и др.). Модифицированные и депонированные терапевтические аллергены выгодно отличаются большей иммуногенностью и в то же время меньшей аллергенностью. Благодаря этим свойствам данные группы аллергенов являются более эффективными и вызывают значительно меньше побочных реакций при проведении АСИТ.
В практической медицине широко применяются депонированные аллергены и аллергоиды. Первая группа аллергенов представляют собой суспензионную форму, их адсорбируют на гидроксиде алюминия (Al(OH)3), фосфате кальция (Ca3(PO4)2), или химически модифицируют с помощью глутарового альдегида (C5H8O2). Вторую группу получают посредством полимеризации молекул аллергена с формальдегидом (CH2O). ГНЦ Институтом иммунологии ФМБА проводятся исследования, в которых при помощи направленной модификации структур белковых молекул создаются новые конъюгированные формы аллергенов на основе полиоксидония (иммуномодулятора) — аллерготропинов. В ходе клинических исследований новой группы препаратов была установлена их высокая эффективность и, что немало важно, безопасность использования для АСИТ. Исходя из этого, можно судить о перспективности дальнейшей разработки данной группы лекарственных средств [3], [14], [24].
В Российской Федерации достаточно широко применяются лечебные аллергены на основе водно-солевых экстрактов клещей домашней пыли рода Dermatophagoides, пыльцы злаковых и сорных трав, деревьев, а так же их смеси. Лечебные аллергены, которые разрешенны к использованию в РФ, производятся компаниями ФГУП НПО «Микроген» (Ставрополь), «Севафарма» (Чехия), «Биомед» (ФГБУ «НИИВС им. И. И. Мечникова» РАМН) стандартизуются преимущественно при помощи уже устаревших технологических приёмов, а именно посредством единиц азотного белка (protein nitrogen units — PNU). Другие формы лечебных аллергенов в РФ не прошли регистрацию или находятся пока на ранней стадии внедрения, поэтому их использование в широкой медицинской практике на данный момент не может осуществляться в полном объеме.
Контроль за качественным и количественным составом, чистотой, соответствие стандартам лечебных и диагностических аллергенов в России производится на базе Государственного научно-исследовательского института стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича. Стандартизация терапевтических и диагностических аллергенных препаратов, которые на сегодняшний момент выпускаются отечественными производителями, по прежнему, к сожалению, проводится по параметру количественного содержания в экстракте аллергена единиц белкового азота — Protein nitrogen units. Определение аллергенной активности готовых препаратов возможно также по результатам кожных тестов на пациентах, которые чувствительны к данному аллергену. К сожалению, количественная оценка в испытаниях in vitro и in vivo не проводится [3].
Основные протоколы стандартизации аллергенных экстрактов
Суммарная активность, определяемая по азотистым основаниям (PNU), зачастую не совсем эквивалентна таковой биологической активности аллергенного экстракта ввиду достаточно большой разницы в содержании в самом продукте мажорных и сопутствующих аллергенов. При всём этом, на российском фармацевтическом рынке в последние время стали появляться стандартизированные в ИР препараты, которые зарегистрированы и могут применяться в медицинской практике.
Подобная система стандартизации применяется французской компанией Stallergènes при изготовлении препаратов
- Phostal® — «Аллерген пыльцы деревьев» (аллергенный экстракт, представляющий собой смесь пыльцы древесных растений — березы, граба, ольхи, орешника, используемого для подкожной АСИТ),
- Staloral® — «Аллерген пыльцы березы» (аллергенный экстракт, представляющий собой извлечение из пыльцы березы для сублингвальной АСИТ),
- Staloral® — «Аллерген клещей» (аллергенный экстракт, представляющий собой смесь нескольких видов клещей домашней пыли Dermatophagoides farinae, Dermatophagoides pteronyssinus в пропорции 1:1 для сублингвальной АСИТ) [22], [31].
Преимуществами препаратов Phostal® и Staloral® является то, что ВОЗ, а также группой международных экспертов из ARIA рекомендуется использование подобных стандартизированных аллергенов. Препаратами Phostal® и Staloral® подобная стандартизацию пройдена, и поэтому иммунологическая активность данных аллергенных экстрактов может гарантироваться, что, в свою очередь, дает лечащему врачу надлежащую уверенность в отсутствии побочных реакций у пациента и эффективности АСИТ.
Отечественные препараты, к большому сожалению, не могут порадовать подобной стабильностью, и при покупке аллергенных препаратов с таким же наименованием и той же фирмы-производителя не всегда можно быть уверенным в протекании реакций и исхода терапии в целом. Справочно, аллергенный экстракт с 100 ИР/мл эквивалентен величине кожной реакции в среднем около 7 мм в диаметре на кожной пробе методом уколов (прик-тест) у выборки, составляющей 30 пациентов, которые имеют доказанную реактивность к используемым аллергенам. В каждой партии реактогенность всегда сопоставляется с эталоным препаратом, а именно внутренним референсным продуктом (IHRS). Подобный подход к стандартизации значительно повышает показатели специфичности, эффективности и безопасности терапии, но, к сожалению, в то же время повышает и стоимость курса лечения [3], [9].
Протоколы стандартизации, включающие определение иммунологической активности, на данный момент становятся одними из главных направлений развития современных технологий, благодаря которым стал возможен переход от подкожного введения самостоятельно приготовленных разведений нативных аллергенных экстрактов к обоснованному научно высокотехнологичному стандартизированному продукту.
Инновационные методы стандартизации аллергенных экстрактов
Способ стандартизации аллергенных вакцин по биологической активности остается неинформативным в отношении содержания мажорных аллергенов, а именно благодаря их присутствию обеспечивается эффективность АСИТ у преобладающего числа пациентов. Установлено, что оптимальная концентрация главных аллергенов в большинстве различных аллергенных вакцин лежит в интервале 5–20 мкг в одной инъекции. По этой причине лечащему врачу необходимо точно знать концентрацию мажорных аллергенов в используемом для АСИТ препарате [25]. Поскольку единицы биологической активности трудно сопоставляются среди разных производителей, активность препарата может быть выражена в концентрациях мажорных аллергенов (мкг/мл), определение которой возможно по методу жидкостной хроматографии с хроматомасс-спектрометрическим детектированием (ЖХ—МС) (Liquid chromatography—mass spectrometry, LC—MS) (рис. 7) [30].

Рисунок 7. Жидкостной хромато-масс-спектрометр Shimadzu LCMS 2020
В настоящий момент данное направление является приоритетным в области стандартизации аллергенных экстрактов. Таким образом, производство препаратов для проведения АСИТ стало выходить на более высокий, современный, качественный уровень. Однако все же остается ряд текущих проблем, в первую очередь связанных со стандартизацией как процессов получения препарата, так и готового продукта.
Стандартизация аллергенных экстрактов по методу ЖХ—МС
Выпускаемые в настоящий момент немногочисленными отечественными производителями лечебные и диагностические аллергены по-прежнему стандартизуются по количественному содержанию в биологическом препарате единиц белкового азота, в то же время их аллергенная активность устанавливается по результатам кожного тестирования (прик-тестов) на сенсибилизированных к этим аллергенам пациентах, но количественная оценка не проводится ни в испытаниях in vitro, ни in vivo. Совершенно ясно, что необходимо как можно раньше привести отечественную технологию получения и стандартизации аллергеных экстрактов в полное соответствие с современным мировым уровнем. Выход из сложившейся ситуации может быть найден посредством применения современных физико-химических методов анализа. Таким на данный момент является вышеупомянутый метод ЖХ—МС [5], [12], [30].
Масс-спектрометрический (МС) анализ является одним из высокотехнологичных методов, который позволяет определять качественный и количественный состав многокомпонентных белково-пептидных смесей, обладающих различными физико-химическими свойствами. Данный вид анализа заключается в ионизации молекул в исследуемом образце с последующим разделением и регистрацией образующихся ионов. С введением такого метода как ионизация электрораспылением (ИЭР) и метода матрично-активированной лазерной десорбции/ионизации (МАЛДИ) стало возможным анализировать крупные биоорганические молекулы, в том числе молекулы аллергенных белков. Наиболее перспективные исследования связаны именно с анализом белковых молекул.
Поскольку масс-спектрометрия обладает целым рядом преимуществ, среди которых высокая чувствительность, экспрессность, информативность, возможность работы с многокомпонентными смесями, её использование для анализа белковых молекул стало одним из важнейших этапов в их исследовании. С открытием ряда методик переведения биологических молекул из раствора в газообразное состояние с использованием МАЛДИ и ИЭР неизбежно привело к прорыву во всей биологической масс-спектрометрии. Развитию этих методов способствовали характерные для них уникальные аналитические параметры. Благодаря их внедрению стало возможным проводить измерение молекулярных масс с очень высокой точностью. Большие молекулы белков-аллергенов фрагментируются в масс-спектрометрах за довольно короткие промежутки времени, что исключительно необходимо для их оперативного анализа. Скорость анализа, несравненно более высокие чувствительность и разрешение по массе являются ключевыми факторами, сделавшими масс-спектрометрию лидирующим методом среди всех нынешних аналитических способов анализа, которые используются для исследования и идентификации биомолекул [12].
В области LC-MS компанией Shimadzu представлен целый набор инновационных систем, каждая из которых максимально учитывает предъявляемые требования для решения конкретных задач в области стандартизации аллергенных экстрактов. Для определения сверхмалых количеств известных компонентов, например молекул аллергенов в таких сложных объектах, как аллергенные экстракты, Shimadzu предлагается новейший тандемный масс-спектрометрический детектор типа «тройной квадруполь». Благодаря поддержке режимов регистрации выбранных ионных переходов достигается высочайшая чувствительность детектирования известных компонентов. Режимы анализа нейтральных потерь, сканирования ионов-предшественников и ионов-продуктов позволяют расшифровывать структуры неизвестных веществ с самой высокой степенью достоверности. Все системы для хромато-масс-спектрометрии внесены или проходят процедуру внесения в Государственный реестр средств измерения РФ, имеют Государственный Метрологический Сертификат РФ. Хромато-масс-спектрометры Shimadzu активно эксплуатируются в ведущих научных и учебных центрах России [5], [21].
Исследования на кафедре фармацевтической химии Первого Московского государственного медицинского университета имени И.М. Сеченова
В настоящее время нами на кафедре фармацевтической химии Первого Московского государственного медицинского университета имени И.М. Сеченова проводится ряд исследований относительно стандартизации аллергенных экстрактов методом ЖХ—МС. Например, были определены оптимальные параметры, относительно которых будет проводиться стандартизация аллергенного экстракта пыльцы берёзы (белок Betv1), что невозможно без изучения химического состава, а также разработана и валидирована методика стандартизации данного экстракта по выбранному компоненту с использованием указанного метода.
Основной сложностью при разработке методики является подбор колонки с наполнителем и состава жидкой фазы, то есть оптимальных условий хроматографирования. После разделения компонентов экстракта в хроматографе происходит их последовательная ионизация и количественное определение интересующего мажорного белка.
Данная методика количественного определения белка Betv1 (характеристическое отношение при ионизации m/z = 876,1) может быть с успехом использоваться для стандартизации экстрактов пыльцы берёзы, применяемых при проведении АСИТ [5].
Таким образом, можно сделать вывод о том, что в области стандартизации аллергенных экстрактов прослеживается ряд положительных изменений, благодаря которым станет возможным производство качественных лечебных и диагностических аллергенов в Российской Федерации.
Литература
- Северова Е.Э. Аллергия на пыльцу растений. «Медицинская иммунология»;
- Из истории аллергологии. «Асоціація алергологів України»;
- Астафьева Н.Г., Гамова И.В., Удовиченко Е.Н. и др. (2013). Место аллергенспецифической иммунотерапии в лечении атопии. Consilium medicum. 3, 55–61;
- Как победить аллергию за четыре инъекции?;
- Боков Д.О. (2013). Разработка подходов к стандартизации и методов контроля качества аллергенных экстрактов, применяемых при проведении аллерген-специфической иммунотерапии (АСИТ). «Медицинская весна: сборник материалов итоговой всероссийской студенческой научной конференции с международным участием (25-26 апреля 2013 г.)». 214–216;
- Воробьева О.В. (2011). Современное состояние проблемы стандартизации аллергенов при аллерген-специфической иммунотерапии. «Российский аллергологический журнал». 4, 76–77;
- Воробьева О.В. Сравнительный и исторический анализ методического прогресса в аллергологии: аллерген-специфическая иммунотерапия: автореф. дис. ... канд. мед. наук. — Москва, 2012. — 24 с.;
- Гущин И.С. (2001). Аллерген-специфическая иммунотерапия (гипосенсибилизация). «Лечащий врач». 3, 10–27;
- Желтикова Т.М. (2012). Аллергены для аллерген-специфической иммунотерапии: достижения и проблемы. Consilium medicum (Педиатрия). 1, 29–31;
- Курбачёва О.М. Клинические, патогенетические и экономические аспекты применения аллерген-специфической иммунотерапии: автореф. дис. ... док. мед. наук. — М., 2007. — 47 с.;
- Курбачева О.М. и Павлова К.С. (2010). Аллерген-специфическая иммунотерапия. «Доктор.ру». 3, 16–19;
- Ласкин Дж. и Лифшиц Х. Принципы масспектрометрии в приложении к биомолекулам. М.: «Техносфера», 2012. — 608 с.;
- Маслова Л.В. (2013). Поллиноз: методы контроля заболевания. «Рецепт». 3, 118–127;
- Мокроносова М.А. и Коровкина Е.С. (2010). Аллергенспецифическая иммунотерапия аллергенным экстрактом пыльцы деревьев, адсорбированным на суспензии кальция фосфата. «Российский аллергологический журнал». 4, 79–84;
- Никонова М.Ф., Донецкова А.М., Андреев И.В. и др. (2012). Биологическое действие препаратов аллергенов из пыльцы растений в культуре лимфоцитов человека. «Иммунология». 2, 86–89;
- Павлов А.Е. Сейлиева Н.А., Мухортых О.Ю. и др. (2012). Получение и оценка свойств рекомбинантного аналога мажорного аллергена пыльцы березы Bet v1. «Российский аллергологический журнал». 3, 7–13;
- Передкова Е.В. (2009). Пыльцевая аллергия. Consilium medicum. 3, 63–66;
- Причины и лечение сенной лихорадки. (2010). «РИА Новости»;
- Пухлик Б.М. (2012). Метод, проверенный столетием. «Новости медицины и фармации: всеукр. спец. мед.-фармац. изд.». 1/2, 3–4;
- Пухлик Б.М. и Кязимова А.Т. (2010). Роль специфической иммунотерапии в лечении аллергических заболеваний и успехи перорального метода. «Клиническая иммунология. Аллергология. Инфектология». 7, 38–43;
- Родин И.А. и Варламов В.В. (2012). Инновационные хромато-масс-спектрометры Shimadzu в лабораторной практике 21 века. «Аналитика. Оборудование и материалы». 1, 6–10;
- Справочник Видаль. Лекарственные препараты в России: Справочник. М.: «АстраФармСервис», 2013. — 1640 с.;
- Хаитов Р.М. и Ильина Н.И. Аллергология и иммунология: Национальное руководство. М.: «Гэотар-Медиа», 2009. — 649 с.;
- Хаитов Р.М., Федосеева В.Н., Ильина Н.И. и др. (2002). Применение для специфической аллергенной иммунотерапии конъюгированных аллергенполимерных вакцин (пыльцевых аллерготропинов новой генерации). «Терапевтический архив». 10, 37–40;
- Promoting the development, implementation and interoperability of Immunization Information Systems. American Immunization Registry Association;
- Astral Sequences & Subsets. SCOP;
- Code of Federal Regulations Food and Drug Administration (21 680.1). Allergenic Products. 7, 133–136;
- European pharmacopoeia (7th Edition suppl. 7.0). Strasbourg: European Department for the Quality of Medicines, 2010. — 1207 p.;
- Zakzuk J., Kilimajer J., Fernández-Caldas E., Lockey F.R. (2019). Allergen Standardization and Characterization. World Allergy Organization;
- LC/MS Information: Technology Reviews. Chem-Space Associates;
- Our commitment to AIT. Stallergenes Greer.