
Пластиковые антитела
01 июля 2010
Пластиковые антитела
- 900
- 1
- 4
Мечта о создании молекул, способных заменить природные, а ещё лучше — превзойти их, преследует учёных, наверное, с тех самых пор, когда стало известно про само существование молекул. «Скульптура» антитела: Джулиан Восс-Андре.
-
Автор
-
Редакторы
Антителá, служащие одним из главных «посланников» иммунитета, отличаются высочайшей избирательностью и эффективностью действия, прицельно синтезируясь в организме в ответ на появление потенциально опасных антигенов практически любой химической или биологической природы. Фантастическая гибкость антител давно используется человеком в своих целях, однако их стабильность вне организма оставляет желать много лучшего, а значит, и для хранения они пригодны плохо; кроме того, антитела дóроги. Современная синтетическая химия на стыке с науками о материалах изобрела молекулярный импринтинг, позволяющий полимеризовать довольно простую органику в «умные» полимеры, «натасканные» на определённые молекулы. Теперь же показано, что внутри организма наночастицы из такого «пластика» могут работать подобно настоящим антителам.
— Еда есть?
— Каша...
— Какая?
— Пластиковая...
Сцена из к/ф «Кин-дза-дза!»
Согласно клональной теории специфического иммунитета, лимфоциты синтезируют астрономическое количество антител (каждый — своё!), различающихся своей вариабельной частью. При первом контакте с антигеном лимфоцит, содержащий «подходящее» антитело, пролиферирует, давая начало клону плазматических клеток, вырабатывающих нужное антитело в количестве, необходимом для эффективного иммунного ответа.
Люди до какой-то степени научились использовать антитела в своих целях, разработав технологию гибридóм для получения моноклональных антител (за это в 1984 году была вручена Нобелевская премия по биологии), однако этот способ дорог и не очень эффективен из-за низкой стабильности антител вне организма. В этой связи антитела сложно хранить и дорого производить, — что хорошо заметно по лекарствам, название которых заканчивается на -маб (от mab — monoclonal antibody), — в основном, против от разных форм рака и аутоиммунных заболеваний.
Учитывая то, что специфичность действия антител определяется пространственной и физико-химической комплементарностью молекул антитела и антигена, теоретически ничто не мешает создавать синтетические аналоги антител, не прибегая к помощи лимфоцитов. В современной синтетической химии на стыке с науками о материалах и нанотехнологическими дисциплинами известен метод молекулярного импринтинга (или метод молекулярных отпечатков), когда полимеризация на основе простых органических мономеров происходит в присутствии молекул-«шаблонов», оставляющих свои «отпечатки» в итоговом полимере. Если потом «шаблон» отмыть от полимера, «импринтированное» вещество практически ничем не будет отличаться от «смолы», заполимеризовавшейся без «шаблона». За одним важным исключением: импринтированный полимер становится «натасканным» на специфическое распознавание молекулы-«шаблона», и впоследствии он может связывать её аналогично антителам. (Правда, антитела — это отдельные молекулы, а импринтированные полимеры обычно — что-то вроде смолы, резины или пластика.)
Японские учёные (некоторые из которых работают в США) предприняли попытку создать искусственное антитело на основе импринтированных полимеров и заставить его работать внутри живого организма [1]. Для введения в кровь был разработан подходящий «форм-фактор» — импринтированные наночастицы. Эти наночастицы «натренировали» на распознавание небольшого пептида мелиттина — основного компонента пчелиного яда, имеющего цитолитическую активность и вызывающего в достаточной концентрации смерть у небольших животных. Схема процедуры молекулярного импринтинга, включавшего несколько «поколений» наночастиц с постепенно улучшаемыми параметрами, показана на рисунке 1.
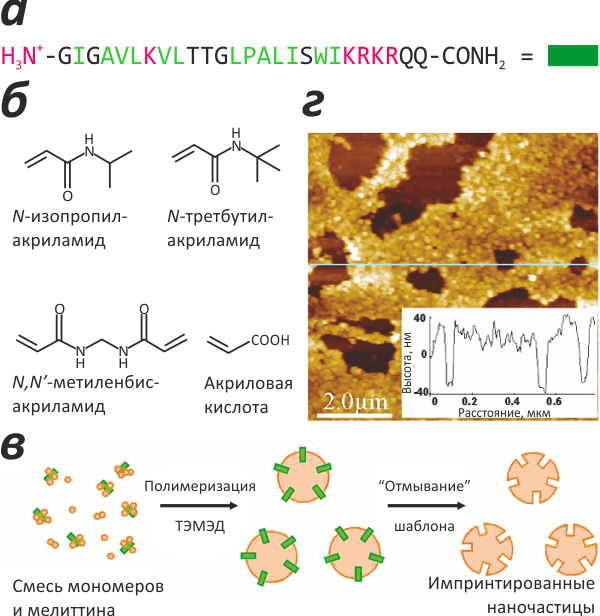
Рисунок 1. Импринтированные полимерные наночастицы («пластиковые антитела»). а — Аминокислотная последовательность пептида-«шаблона» — мелиттина (основного компонента пчелиного яда). б — Мономеры, использованные для полимеризации. в — Схема создания импринтированных наночастиц: присутствующий во время полимеризации мелиттин «запечатывается» в наночастицы; после «отмывания» шаблона эти частицы содержат полости, по форме и физико-химическим свойствам комплементарные целевой молекуле («молекулярные отпечатки»). г — Атомная силовая микроскопия импринтированных наночастиц. На врезке показан высотный профиль вдоль голубой линии.
Полученные «пластиковые» антитела исследовали на предмет токсичности, и не обнаружили следов наличия таковой. А по специфичности и аффинности действия они оказались не хуже естественных антител. Однако прежде чем окончательно делать такие выводы, необходимо было проверить всё на животных, поскольку наночастицы в крови могут существенно менять свои свойства, покрываясь «короной» из белков плазмы крови [2], или вообще разрушаться клетками специфического иммунитета.
Подопытным мышам вводили смертельную дозу мелиттина (после инъекции 4,5 мг/кг веса 100% животных погибало менее чем через час) — это была «контрольная» группа. Другой группе сразу после инъекции пчелиного токсина вводили «пластиковую сыворотку» — импринтированные антитела, «настроенные» на меллитин. Ещё одной группе мышей делали инъекции аналогичных по размеру и составу наночастиц, но не прошедших стадию молекулярного импринтинга. «Пластиковые» антитела существенно увеличили выживаемость — более 50% животных выжило. (Не погибла часть мышей и в группе, обработанной не импринтированными наночастицами, однако эффект был много ниже уровня статистической значимости.)
Все результаты говорят в пользу того, что искусственные «пластиковые» антитела действуют подобно настоящим, а их накопление и разрушение вместе с захваченным антигеном происходит в печени. Пока что это первая такая работа, но не за горами, видимо, и более прогрессивные приложения метода молекулярного импринтинга, направленные против более опасных токсинов, неиллюзорно угрожающих здоровью людей.
«Никогда ранее синтетические антитела ещё не доказывали свою эффективность прямо в кровяном русле живых животных. Биологические жидкости кишат конкурирующими молекулами — такими как белки и пептиды, — осложняющими дизайн наночастиц, — сказал Кеннет Ши (Kenneth Shea), ведущий автор исследования. — Однако успех этого эксперимента однозначно говорит о том, что эти трудности вполне можно преодолеть, и что продемонстрированная нами технология может использоваться для создания „пластиковых антител“ на основе наночастиц, пригодных для борьбы с опасными токсинами и патогенами» [3].
Литература
- Yu Hoshino, Hiroyuki Koide, Takeo Urakami, Hiroaki Kanazawa, Takashi Kodama, et. al.. (2010). Recognition, Neutralization, and Clearance of Target Peptides in the Bloodstream of Living Mice by Molecularly Imprinted Polymer Nanoparticles: A Plastic Antibody. J. Am. Chem. Soc.. 132, 6644-6645;
- Невидимая граница: где сталкиваются «нано» и «био»;
- World’s first plastic antibodies in live organisms: stop spread of bee venom in mice. (2010). ScienceDaily.





