Плазмиды, от которых так просто не избавиться
25 мая 2021
Плазмиды, от которых так просто не избавиться
- 1550
- 0
- 7
Как недавно показали ученые из группы Константина Северинова, система CRISPR-Cas не всегда до конца «добивает» свою мишень. В популяции бактерий с активной системой CRISPR-Cas может долгое время существовать небольшая доля клеток, несущих плазмиду, которая является мишенью CRISPR-Cas, однако может давать клеткам преимущества в определенных условиях.
-
Автор
-
Редактор
Бесконечная гонка вооружений между прокариотическими системами CRISPR-Cas и мобильными генетическими элементами часто приводит к тому, что последние либо обзаводятся специальными механизмами, позволяющими им нейтрализовать действие CRISPR-Cas, либо приобретают мутации, благодаря которым они уклоняются от действия защитных систем. Однако, как недавно показала группа ученых во главе с Константином Севериновым, в бактериальных популяциях сохраняется небольшое количество копий плазмид, которые являются прямыми мишенями систем CRISPR-Cas клеток-хозяев и, более того, при этом не приобретают защитных мутаций. Как же этим плазмидам удается сохраняться в бактериальной популяции и зачем это может быть полезно бактериям? Давайте разбираться.
Системы CRISPR-Cas часто называют «противовирусным иммунитетом» бактерий (подробнее о том, что такое CRISPR-Cas и как эта система работает, можно прочитать, например, здесь — «Просто о сложном: CRISPR/ Cas» [1]). Бактерии постоянно обновляют свои локусы CRISPR, вставляя в них спейсеры, соответствующие новым мобильным генетическим элементам, но и последние в долгу не остаются. Фаги часто приобретают мутации, благодаря которым бактериальные crРНК (молекулы, содержащие один спейсер и кусочки окружающих его повторов) перестают их распознавать. Некоторые фаги пошли еще дальше и обзавелись специальными системами анти-CRISPR, которые подавляют работу CRISPR-Cas (о системах анти-CRISPR читайте в нашей статье «Анти-CRISPR: ответ вирусов» [2]).
Однако мишенями систем CRISPR-Cas могут быть не только вирусы, но и плазмиды. Оно и понятно: тащить за собой целый вагон ненужного генетического груза в виде многочисленных плазмид клетке невыгодно. Кроме того, если CRISPR-Cas нацелить на плазмиды, несущие гены устойчивости к антибиотикам, то природный механизм уничтожения мобильных генетических элементов может сослужить хорошую службу человеку, помогая в борьбе с антибиотикорезистентностью (о проблеме антибиотикорезистентности читайте в нашем спецпроекте).
Исследователи из группы Константина Северинова изучали, как система CRISPR-Cas типа I-E кишечной палочки Escherichia coli взаимодействует с плазмидами, в составе которых есть протоспейсеры, соответствующие спейсерам в бактериальных локусах CRISPR [3]. Казалось бы, что тут может быть неожиданного? CRISPR-Cas быстро расправится с плазмидами-мишенями, и дело с концом. В действительности же все оказалось гораздо хитрее...
Авторы исследования работали с клетками E. coli, у которых гены cas находятся под индуцибельным промотором, а в локусе CRISPR есть единственный спейсер g8, который соответствует плазмиде pG8, несущей гены устойчивости к антибиотику ампициллину. Клетки трансформировали плазмидой и после этого высевали на среду, содержащюю ампициллин, но не содержащюю индуктора генов cas (такие клетки назвали клетками CRISPR-OFF). Как и следовало ожидать, в результате ученые получили множество колоний, содержащих pG8. Часть трансформированных клеток они высеяли на среду, содержащюю и антибиотик, и индуктор генов cas (клетки CRISPR-ON) (рис. 1). Можно было бы предположить, что в этом случае исследователи получили бы совершенно пустые чашки: система CRISPR-Cas просто уничтожила бы спасительную плазмиду, несущую гены устойчивости к ампициллину, и тем самым подписала бы бактериальным клеткам смертный приговор. Тем не менее некоторое количество колоний в этих условиях все-таки выросло, хотя их численность и была почти в 200 раз меньше, чем в CRISPR-OFF-условиях. Схожие результаты были получены с плазмидой pRSFG8, несущей гены устойчивости к канамицину.
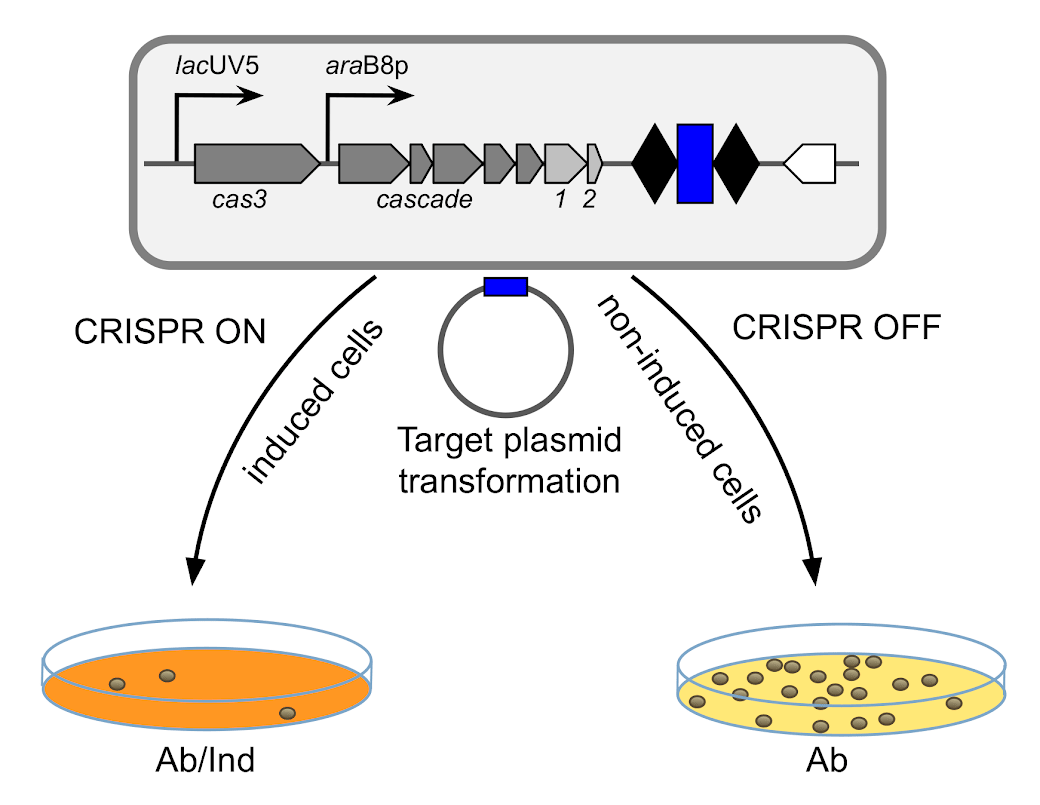
Рисунок 1. Клетки E. coli с системой CRISPR-Cas, в которой гены cas находятся под индуцибельным промотором, трансформировали плазмидой, кодирующей устойчивость к антибиотику и являющейся мишенью CRISPR-Cas. Далее клетки высеяли на среду, содержащую только антибиотик (справа), и получили множество колоний клеток с плазмидой, и на среду, содержащую антибиотик и индуктор экспрессии генов cas (слева), в результате чего выросло лишь несколько колоний.
Может быть, выжили и образовали колонии те немногие клетки, в которых плазмиды получили мутации, делающие их неуязвимыми для системы CRISPR-Cas? Однако секвенирование показало, что плазмиды в клетках, выживших в среде с антибиотиком при включенной системе CRISPR-Cas, не отличались от тех, которыми они были трансформированы изначально.
А может быть, такие клетки в действительности имели неработающие CRISPR-Cas? Чтобы проверить эту гипотезу, исследователи получили компетентные (то есть пригодные для трансформации) клетки из тех самых немногочисленных выживших CRISPR-ON-клеток и заново трансформировали их плазмидой, которая содержала тот же самый протоспейсер g8, однако обеспечивала резистентность к другому антибиотику. После посева на среду с ампициллином оказалось, что эти клетки уничтожили вторую подсаженную плазмиду так же эффективно, как и контрольные клетки с активной системой CRISPR-Cas. Следовательно, в CRISPR-ON-клетках, которые почему-то не уничтожили первую плазмиду с протоспейсером, соответствующим спейсеру в их локусах CRISPR, система CRISPR-Cas была полностью функциональна.
Далее ученые сравнили количество копий плазмиды pG8 в клетках CRISPR-ON и CRISPR-OFF с помощью количественной ПЦР. Оказалось, что среднее число копий плазмиды на колонию CRISPR-ON оказалось ниже единицы. Стало быть, не все клетки в этой колонии имеют плазмиду, защищающую их от действия антибиотика. Чтобы определить количество клеток CRISPR-ON, несущих плазмиду, ученые пересеяли колонии бактерий CRISPR-ON и CRISPR-OFF на чашки с ампициллином и без ампициллина. В случае клеток CRISPR-OFF на чашках с антибиотиком и без антибиотика выросло примерно равное количество колоний, а вот в случае CRISPR-ON только единицы из нескольких тысяч пересеянных клеток смогли образовать колонии на среде с ампициллином. По-видимому, по мере роста колоний система CRISPR-Cas продолжает уничтожать плазмиды в клетках CRISPR-ON, изначально успешно трансформированных плазмидой. Об этом свидетельствует еще и то обстоятельство, что при повторном пересеве на среду с индуктором генов cas и антибиотиком доля клеток CRISPR-ON, несущих плазмиду, уменьшилась.
Чтобы визуализировать клетки, несущие плазмиду, и с помощью микроскопии отследить процесс ее утраты, авторы работы повторили трансформацию со специально созданной плазмидой pG8-GFP, которая дополнительно кодирует зеленый флуоресцентный белок (рис. 2). Благодаря этому клетки, несущие плазмиды, стало возможным отличить по зеленой флуоресценции (подробнее о видах микроскопии читайте в нашей статье [4]). Оказалось, что все колонии CRISPR-OFF ярко светились при выращивании на среде с антибиотиком, а в случае клеток CRISPR-ON светились лишь 1–3% колоний. Более того, дальнейшее наблюдение показало, что большинство клеток из этой малой доли со временем утрачивало плазмиду.
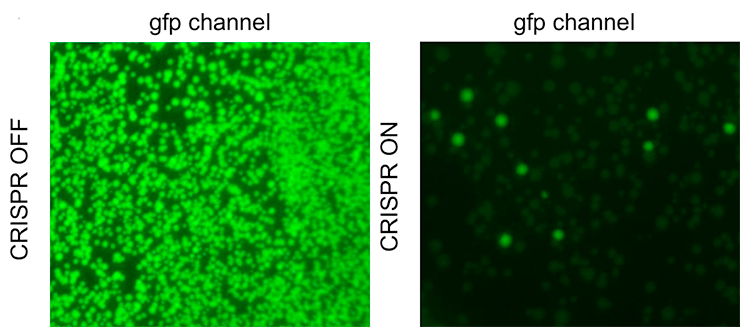
Рисунок 2. Если в плазмиду поместить ген, кодирующий GFP, то содержащие плазмиду клетки можно визуализировать с помощью флуоресцентной микроскопии. Как видно, в случае клеток CRISPR-OFF светится множество колоний, а в случае CRISPR-ON — лишь единичные колонии.
Итак, небольшая доля клеток все же сохраняет плазмиду при выращивании на среде с антибиотиком и индуктором генов cas. Со временем количество этих клеток уменьшается, однако полностью из популяции они не исчезают и продолжают передавать плазмиду из поколения в поколение. Почему же система CRISPR-Cas не уничтожает все копии плазмиды до конца?
Не стоит забывать, что в живой клетке плазмиды удваиваются, и их репликация противодействует активности системы CRISPR-Cas. Если, допустим, скорость репликации всегда ниже, чем скорость действия CRISPR-Cas, то плазмида полностью исчезнет из бактериальной популяции. Возможен и другой сценарий: скорость репликации плазмиды превышает скорость действия CRISPR-Cas, но до некоторого порогового значения копийности плазмиды. В этом случае количество копий плазмид остановится на некотором равновесном значении, которое будет ниже копийности плазмиды в клетках с неактивной CRISPR-Cas. Наконец, могут существовать определенные значения количества копий плазмиды, при которых их совокупная скорость репликации будет превышать скорость работы CRISPR-Cas. В этом случае в популяции будет малая доля клеток, которая, несмотря на действие CRISPR-Cas, будет сохранять плазмиду и передавать ее дочерним клеткам при делении в ряду поколений.
Авторы работы провели математический анализ последнего сценария сохранения плазмиды в популяции бактерий. В результате они смогли заключить, что под действием системы CRISPR-Cas изначально гомогенная популяция трансформированных клеток, имеющих плазмиду, становится бимодальной: часть клеток сохраняет плазмиду, часть — нет. Доля клеток, сохранивших плазмиду, определяется тем, сколько клеток и в каком количестве успеют захватить плазмиду, прежде чем на нее начнет действовать CRISPR-Cas. В то же время распределение плазмиды по клеткам после действия CRISPR-Cas зависит не от ее первоначального распределения, а от особенностей самой плазмиды и системы CRISPR-Cas. Не следует также забывать, что судьба плазмиды в отдельно взятой клетке может определяться уровнем синтеза белков Cas и ферментов, реплицирующих плазмиду.
Как мы видим, действие системы CRISPR-Cas в некоторых случаях ограничено, и в этом есть определенный эволюционный смысл. Чрезмерная активность CRISPR-Cas не только убыточна для клетки с точки зрения энергии (как-никак, синтез белков Cas — энергозатратное дело), но и может привести к побочной активности вне последовательности-мишени. Это, в свою очередь, может навредить как самой геномной ДНК бактерии, так и помешать приобрести полезную в данных условиях плазмиду извне — например, плазмиду, дающую устойчивость к антибиотикам. Именно поэтому бактериальной популяции выгодно иметь «про запас» небольшую долю клеток, несущих плазмиду, обеспечивающую устойчивость к антибиотикам — если вдруг настанут тяжелые времена и бактерии попадут в среду с антибиотиком, эти «запасные» клетки обеспечат выживание популяции.
«Наши результаты, в общем, ожидаемы, — рассказывает руководитель исследования Константин Северинов. — Понятно, что в эволюционной гонке бактерий и их генетических паразитов, например, вирусов, не может быть ни полных побед, ни безоговорочных капитуляций. Независимо от смертоносности атакующего вируса и эффективности защиты клетки всегда остается место для обоих. С одной стороны, это тривиальное следствие огромных размеров популяций бактерий и их вирусов. С другой стороны, как следует из нашей работы, это может быть следствием стохастических эффектов, в результате которых мобильные генетические элементы поддерживаются в популяции, несмотря на противодействие систем CRISPR-Cas. В результате возникает разнообразие, которое при изменении условий внешней среды может оказаться полезным обоим участникам гонки».
Литература
- Просто о сложном: CRISPR/Cas;
- Анти-CRISPR: ответ вирусов;
- Mamontov V., Martynov A., Morozova N., Bukatin A., Staroverov D.B., Lukyanov K.A. et al. (2021). Long-term persistence of plasmids targeted by CRISPR interference in bacterial populations. bioRxiv;
- 12 методов в картинках: микроскопия.